3.2 原子结构 第2课时 原子核外电子的排布 离子 分层练习(含答案) 2025-2026学年化学人教版(2024)九年级上册
文档属性
| 名称 | 3.2 原子结构 第2课时 原子核外电子的排布 离子 分层练习(含答案) 2025-2026学年化学人教版(2024)九年级上册 |  | |
| 格式 | docx | ||
| 文件大小 | 218.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-31 22:37:05 | ||
图片预览


文档简介
第2课时 原子核外电子的排布 离子
原子核外电子的排布
1.(教材变式)如图为原子核外电子分层排布示意图,下列说法错误的是 ( )
A.相对来说,原子核外有很大的空间,电子绕原子核做高速运动
B.核外电子是分层运动的
C.离核最近的电子层为第一层,最远的叫最外层
D.离核近的电子能量高,离核越远,能量越低
2.与金属、非金属的化学性质关系最密切的是其原子的 ( )
A.核内质子数 B.核内中子数
C.最外层电子数 D.核外电子数
3.如图为铝原子结构示意图。下列有关铝原子的说法正确的是 ( )
A.图中“+”表示铝原子带正电
B.铝原子的质量主要集中在核外13个电子上
C.铝原子在化学反应中易得到电子
D.铝原子核外有3个电子层
4.硫原子的结构示意图为。
(1)“+16”表示 。
(2)弧线表示 。
(3)弧线上的数字表示 。
5.某原子的结构示意图为,该原子的核电荷数为 ,质子数为 ,核外有
个电子层,第二层上有 个电子,最外层上有 个电子。在化学反应中该原子容易 电子,形成相对稳定结构。从分类上看,该原子属于 原子。
离子
6.下列物质中由离子直接构成的是 ( )
A.氯化氢 B.氯化钠
C.氢气 D.汞
7.原子变成离子,一定发生改变的是 ( )
A.核外电子层数
B.核电荷数
C.核外电子数
D.相对原子质量
8.梦天实验舱搭载的世界首套冷原子钟组中含有“锶”,如图是锶(Sr)的某种粒子结构示意图,该粒子的符号是 ( )
A.Sr B.Sr2- C.Sr2+ D.Sr2
9.在如图所示的粒子结构示意图中,属于原子的有 (填序号,下同),属于阴离子的有 ,离子符号为 ;属于阳离子的有 ,离子符号为 。
通过上图可以总结出,原子和离子的区别在于:(1) ;
(2) 。
10.(名师原创)写出化学符号“2Al3+”中数字的意义:
“2”表示 ;
“3”表示 。
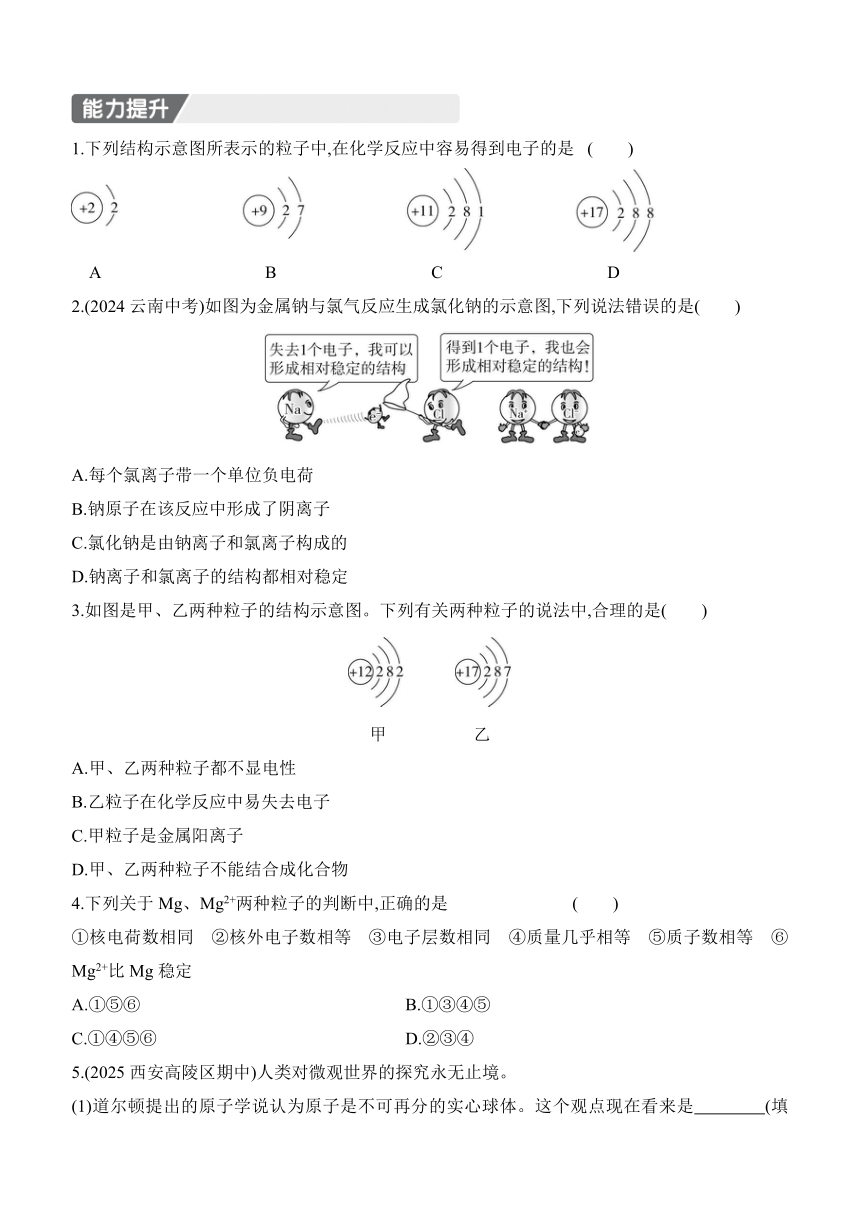
1.下列结构示意图所表示的粒子中,在化学反应中容易得到电子的是 ( )
A B C D
2.(2024云南中考)如图为金属钠与氯气反应生成氯化钠的示意图,下列说法错误的是( )
A.每个氯离子带一个单位负电荷
B.钠原子在该反应中形成了阴离子
C.氯化钠是由钠离子和氯离子构成的
D.钠离子和氯离子的结构都相对稳定
3.如图是甲、乙两种粒子的结构示意图。下列有关两种粒子的说法中,合理的是( )
甲 乙
A.甲、乙两种粒子都不显电性
B.乙粒子在化学反应中易失去电子
C.甲粒子是金属阳离子
D.甲、乙两种粒子不能结合成化合物
4.下列关于Mg、Mg2+两种粒子的判断中,正确的是 ( )
①核电荷数相同 ②核外电子数相等 ③电子层数相同 ④质量几乎相等 ⑤质子数相等 ⑥Mg2+比Mg稳定
A.①⑤⑥ B.①③④⑤
C.①④⑤⑥ D.②③④
5.(2025西安高陵区期中)人类对微观世界的探究永无止境。
(1)道尔顿提出的原子学说认为原子是不可再分的实心球体。这个观点现在看来是 (填“正确”或“错误”)的。
(2)卢瑟福提出有核原子模型(如图),认为原子是由原子核和核外电子构成的。现代科学知道:原子核带 电荷。
(3)海水中含有大量的氯化钠、氯化镁等,几种原子的结构示意图如图:
①钠原子的核内质子数为 ,钠原子转变为钠离子时,发生变化的是 (填“质子数”或“电子数”)。
②x的数值为 。
③镁原子在化学反应中容易 (填“得到”或“失去”)电子。
6.(2025合肥蜀山区月考)在宏观、微观和符号之间建立联系是化学学科的重要思维方式。根据下列粒子结构示意图,回答问题:
(1)上述粒子示意图中,它们之间的本质区别是 不同。
(2)A、B、C、E中属于阴离子的是 (填离子符号)。
(3)若D表示某元素的原子,则m= ,该粒子在化学变化中容易 (填“得到”或“失去”)电子。
(4)若D为离子,则m= 。
7.(科学思维)推理是学习化学的一种重要方法。下列推理合理的是 ( )
A.离子是带电的粒子,所以带电的粒子一定是离子
B.分子能直接构成物质,所以质子也能直接构成物质
C.最外层电子数为8的是相对稳定结构,所以有稳定结构的最外层电子数一定为8
D.原子不显电性,所以原子构成的分子也不显电性
【详解答案】
基础达标
1.D 2.C 3.D
4.(1)原子核带正电荷且核电荷数(或质子数)为16 (2)电子层 (3)该电子层上的电子数
5.12 12 3 8 2 失去(2个) 金属
6.B 7.C 8.C
9.①④⑥ ② F- ③⑤ Mg2+、Al3+
(1)原子中质子数(核电荷数)等于核外电子数,而离子中不相等
(2)原子不显电性,离子显电性
10.2个铝离子 1个铝离子带有3个单位的正电荷
能力提升
1.B 解析:A项,第一层只能容纳2个电子,已经稳定,选项不符合题意;B项,第二层最多容纳8个电子,该原子容易得到1个电子变成稳定结构,符合题意;C项,要变成8电子稳定结构,容易失去最外层的1个电子,选项不符合题意;D项,已经成为8电子稳定结构,选项不符合题意。
2.B 解析:A项,氯离子是氯原子得到1个电子后形成的,故每个氯离子带一个单位的负电荷,不符合题意;B项,在该反应中,钠原子失去电子形成阳离子,符合题意;C项,氯化钠是由金属元素和非金属元素组成的化合物,由钠离子和氯离子构成,不符合题意;D项,钠离子和氯离子的最外层电子数均是8,均达到了相对稳定结构,不符合题意。
3.A 解析:甲、乙粒子中质子数=核外电子数,属于原子,原子不显电性,故A正确、C错误;乙粒子的最外层电子数为7,大于4,容易得电子,故B错误;甲是镁原子,镁原子的最外层电子数是2,易失去最外层的2个电子,而形成带2个单位正电荷的阳离子,乙是氯原子,氯原子最外层电子数是7,易得到1个电子而形成带1个单位负电荷的阴离子,所以镁原子和氯原子可以形成氯化镁,故D错误。故选A。
4.C 解析:镁原子失去最外层的两个电子形成了带两个单位正电荷的镁离子,由此可知:①Mg、Mg2+两种粒子的核电荷数相同,故正确;②Mg、Mg2+两种粒子的核外电子数不相等,故错误;③Mg、Mg2+两种粒子的电子层数不相同,故错误;④由于电子的质量与质子和中子相比较很小,可以忽略不计,所以Mg、Mg2+两种粒子的质量几乎相等,故正确;⑤Mg、Mg2+两种粒子的质子数相等,故正确;⑥镁原子失去2个电子后形成镁离子,镁离子最外层电子数为8,所以Mg2+比Mg稳定,故正确。
5.(1)错误 (2)正
(3)①11 电子数 ②8 ③失去
解析:(1)道尔顿提出的原子学说认为原子是不可再分的实心球体。这个观点现在看来是错误的,原子中存在着很大的空间。 (2)原子核带正电荷。(3)现代科学知道:①由钠原子结构示意图可知,钠原子的质子数为11,其最外层有1个电子,少于4个,在化学反应中易失去最外层的1个电子,发生改变的是电子数,而质子数没有改变。②在原子中,质子数=电子数,则x=17-2-7=8。③由镁原子结构示意图可知,镁原子的最外层有2个电子,少于4个,在化学反应中易失去电子。
6.(1)质子数 (2)S2- (3)7 得到
(4)8
解析:(1)题述粒子示意图中,它们之间的本质区别是质子数不同。(2)E中,质子数为16,核外有18个电子,是带有两个单位负电荷的硫离子,属于阴离子,其符号为S2-。(3)在原子中,质子数=电子数,因此m=17-2-8=7;该原子的最外层有7个电子,多于4个,在化学反应中易得到电子。(4)离子是由原子得失电子后形成的,D的质子数为17,若D为离子,则m=8。
7.D 解析:A项,离子是带电的粒子,但带电的粒子不一定是离子,例如质子带正电,电子带负电,故选项推理错误;B项,分子、原子、离子是构成物质的三种基本粒子,质子不能直接构成物质,故选项推理错误;C项,最外层电子数为8的是相对稳定结构,但稳定结构的最外层电子数不一定为8,如氦为2个,故选项推理错误;D项,原子不显电性,所以原子构成的分子也不显电性,故选项推理正确。
原子核外电子的排布
1.(教材变式)如图为原子核外电子分层排布示意图,下列说法错误的是 ( )
A.相对来说,原子核外有很大的空间,电子绕原子核做高速运动
B.核外电子是分层运动的
C.离核最近的电子层为第一层,最远的叫最外层
D.离核近的电子能量高,离核越远,能量越低
2.与金属、非金属的化学性质关系最密切的是其原子的 ( )
A.核内质子数 B.核内中子数
C.最外层电子数 D.核外电子数
3.如图为铝原子结构示意图。下列有关铝原子的说法正确的是 ( )
A.图中“+”表示铝原子带正电
B.铝原子的质量主要集中在核外13个电子上
C.铝原子在化学反应中易得到电子
D.铝原子核外有3个电子层
4.硫原子的结构示意图为。
(1)“+16”表示 。
(2)弧线表示 。
(3)弧线上的数字表示 。
5.某原子的结构示意图为,该原子的核电荷数为 ,质子数为 ,核外有
个电子层,第二层上有 个电子,最外层上有 个电子。在化学反应中该原子容易 电子,形成相对稳定结构。从分类上看,该原子属于 原子。
离子
6.下列物质中由离子直接构成的是 ( )
A.氯化氢 B.氯化钠
C.氢气 D.汞
7.原子变成离子,一定发生改变的是 ( )
A.核外电子层数
B.核电荷数
C.核外电子数
D.相对原子质量
8.梦天实验舱搭载的世界首套冷原子钟组中含有“锶”,如图是锶(Sr)的某种粒子结构示意图,该粒子的符号是 ( )
A.Sr B.Sr2- C.Sr2+ D.Sr2
9.在如图所示的粒子结构示意图中,属于原子的有 (填序号,下同),属于阴离子的有 ,离子符号为 ;属于阳离子的有 ,离子符号为 。
通过上图可以总结出,原子和离子的区别在于:(1) ;
(2) 。
10.(名师原创)写出化学符号“2Al3+”中数字的意义:
“2”表示 ;
“3”表示 。
1.下列结构示意图所表示的粒子中,在化学反应中容易得到电子的是 ( )
A B C D
2.(2024云南中考)如图为金属钠与氯气反应生成氯化钠的示意图,下列说法错误的是( )
A.每个氯离子带一个单位负电荷
B.钠原子在该反应中形成了阴离子
C.氯化钠是由钠离子和氯离子构成的
D.钠离子和氯离子的结构都相对稳定
3.如图是甲、乙两种粒子的结构示意图。下列有关两种粒子的说法中,合理的是( )
甲 乙
A.甲、乙两种粒子都不显电性
B.乙粒子在化学反应中易失去电子
C.甲粒子是金属阳离子
D.甲、乙两种粒子不能结合成化合物
4.下列关于Mg、Mg2+两种粒子的判断中,正确的是 ( )
①核电荷数相同 ②核外电子数相等 ③电子层数相同 ④质量几乎相等 ⑤质子数相等 ⑥Mg2+比Mg稳定
A.①⑤⑥ B.①③④⑤
C.①④⑤⑥ D.②③④
5.(2025西安高陵区期中)人类对微观世界的探究永无止境。
(1)道尔顿提出的原子学说认为原子是不可再分的实心球体。这个观点现在看来是 (填“正确”或“错误”)的。
(2)卢瑟福提出有核原子模型(如图),认为原子是由原子核和核外电子构成的。现代科学知道:原子核带 电荷。
(3)海水中含有大量的氯化钠、氯化镁等,几种原子的结构示意图如图:
①钠原子的核内质子数为 ,钠原子转变为钠离子时,发生变化的是 (填“质子数”或“电子数”)。
②x的数值为 。
③镁原子在化学反应中容易 (填“得到”或“失去”)电子。
6.(2025合肥蜀山区月考)在宏观、微观和符号之间建立联系是化学学科的重要思维方式。根据下列粒子结构示意图,回答问题:
(1)上述粒子示意图中,它们之间的本质区别是 不同。
(2)A、B、C、E中属于阴离子的是 (填离子符号)。
(3)若D表示某元素的原子,则m= ,该粒子在化学变化中容易 (填“得到”或“失去”)电子。
(4)若D为离子,则m= 。
7.(科学思维)推理是学习化学的一种重要方法。下列推理合理的是 ( )
A.离子是带电的粒子,所以带电的粒子一定是离子
B.分子能直接构成物质,所以质子也能直接构成物质
C.最外层电子数为8的是相对稳定结构,所以有稳定结构的最外层电子数一定为8
D.原子不显电性,所以原子构成的分子也不显电性
【详解答案】
基础达标
1.D 2.C 3.D
4.(1)原子核带正电荷且核电荷数(或质子数)为16 (2)电子层 (3)该电子层上的电子数
5.12 12 3 8 2 失去(2个) 金属
6.B 7.C 8.C
9.①④⑥ ② F- ③⑤ Mg2+、Al3+
(1)原子中质子数(核电荷数)等于核外电子数,而离子中不相等
(2)原子不显电性,离子显电性
10.2个铝离子 1个铝离子带有3个单位的正电荷
能力提升
1.B 解析:A项,第一层只能容纳2个电子,已经稳定,选项不符合题意;B项,第二层最多容纳8个电子,该原子容易得到1个电子变成稳定结构,符合题意;C项,要变成8电子稳定结构,容易失去最外层的1个电子,选项不符合题意;D项,已经成为8电子稳定结构,选项不符合题意。
2.B 解析:A项,氯离子是氯原子得到1个电子后形成的,故每个氯离子带一个单位的负电荷,不符合题意;B项,在该反应中,钠原子失去电子形成阳离子,符合题意;C项,氯化钠是由金属元素和非金属元素组成的化合物,由钠离子和氯离子构成,不符合题意;D项,钠离子和氯离子的最外层电子数均是8,均达到了相对稳定结构,不符合题意。
3.A 解析:甲、乙粒子中质子数=核外电子数,属于原子,原子不显电性,故A正确、C错误;乙粒子的最外层电子数为7,大于4,容易得电子,故B错误;甲是镁原子,镁原子的最外层电子数是2,易失去最外层的2个电子,而形成带2个单位正电荷的阳离子,乙是氯原子,氯原子最外层电子数是7,易得到1个电子而形成带1个单位负电荷的阴离子,所以镁原子和氯原子可以形成氯化镁,故D错误。故选A。
4.C 解析:镁原子失去最外层的两个电子形成了带两个单位正电荷的镁离子,由此可知:①Mg、Mg2+两种粒子的核电荷数相同,故正确;②Mg、Mg2+两种粒子的核外电子数不相等,故错误;③Mg、Mg2+两种粒子的电子层数不相同,故错误;④由于电子的质量与质子和中子相比较很小,可以忽略不计,所以Mg、Mg2+两种粒子的质量几乎相等,故正确;⑤Mg、Mg2+两种粒子的质子数相等,故正确;⑥镁原子失去2个电子后形成镁离子,镁离子最外层电子数为8,所以Mg2+比Mg稳定,故正确。
5.(1)错误 (2)正
(3)①11 电子数 ②8 ③失去
解析:(1)道尔顿提出的原子学说认为原子是不可再分的实心球体。这个观点现在看来是错误的,原子中存在着很大的空间。 (2)原子核带正电荷。(3)现代科学知道:①由钠原子结构示意图可知,钠原子的质子数为11,其最外层有1个电子,少于4个,在化学反应中易失去最外层的1个电子,发生改变的是电子数,而质子数没有改变。②在原子中,质子数=电子数,则x=17-2-7=8。③由镁原子结构示意图可知,镁原子的最外层有2个电子,少于4个,在化学反应中易失去电子。
6.(1)质子数 (2)S2- (3)7 得到
(4)8
解析:(1)题述粒子示意图中,它们之间的本质区别是质子数不同。(2)E中,质子数为16,核外有18个电子,是带有两个单位负电荷的硫离子,属于阴离子,其符号为S2-。(3)在原子中,质子数=电子数,因此m=17-2-8=7;该原子的最外层有7个电子,多于4个,在化学反应中易得到电子。(4)离子是由原子得失电子后形成的,D的质子数为17,若D为离子,则m=8。
7.D 解析:A项,离子是带电的粒子,但带电的粒子不一定是离子,例如质子带正电,电子带负电,故选项推理错误;B项,分子、原子、离子是构成物质的三种基本粒子,质子不能直接构成物质,故选项推理错误;C项,最外层电子数为8的是相对稳定结构,但稳定结构的最外层电子数不一定为8,如氦为2个,故选项推理错误;D项,原子不显电性,所以原子构成的分子也不显电性,故选项推理正确。
同课章节目录
