第五单元 化学反应的定量关系 专题训练七 质量守恒定律的应用 分层练习(含答案) 2025-2026学年化学人教版(2024)九年级上册
文档属性
| 名称 | 第五单元 化学反应的定量关系 专题训练七 质量守恒定律的应用 分层练习(含答案) 2025-2026学年化学人教版(2024)九年级上册 |  | |
| 格式 | docx | ||
| 文件大小 | 171.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-31 23:05:04 | ||
图片预览


文档简介
专题训练七 质量守恒定律的应用
推断化学式或元素组成
1.为了减轻大气污染,在汽车尾气排放装置上加装“催化净化器”,可将尾气中的NO、CO转化为参与大气循环的无毒的混合气体,该混合气体是 ( )
A.CO2、NH3 B.O2、CO2
C.N2、CO2 D.NO2、CO2
2.ClO2是一种高效的水处理剂。其制备反应为2NaClO3+SO2+H2SO42ClO2+2X,下列说法正确的是 ( )
A.ClO2由一个氯原子和一个氧分子构成
B.SO2的名称为氧化硫
C.反应前后硫元素的化合价没变
D.X的化学式是NaHSO4
3.已知23 g纯净物X在足量的氧气中充分燃烧,生成44 g二氧化碳和27 g水。下列说法中错误的是 ( )
A.X中一定含有C、H两种元素
B.该反应消耗氧气的质量为48 g
C.X中C、H两种元素的质量比为4∶1
D.X的化学式可能是C2H6
密闭容器中反应数据的分析
4.一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前质量/g 1 30 17 2
反应后质量/g M 31 0 18
关于此反应,下列认识不正确的是 ( )
A.该反应是分解反应
B.该反应中乙和丁的质量比为31∶18
C.表中M为1
D.甲可能是催化剂
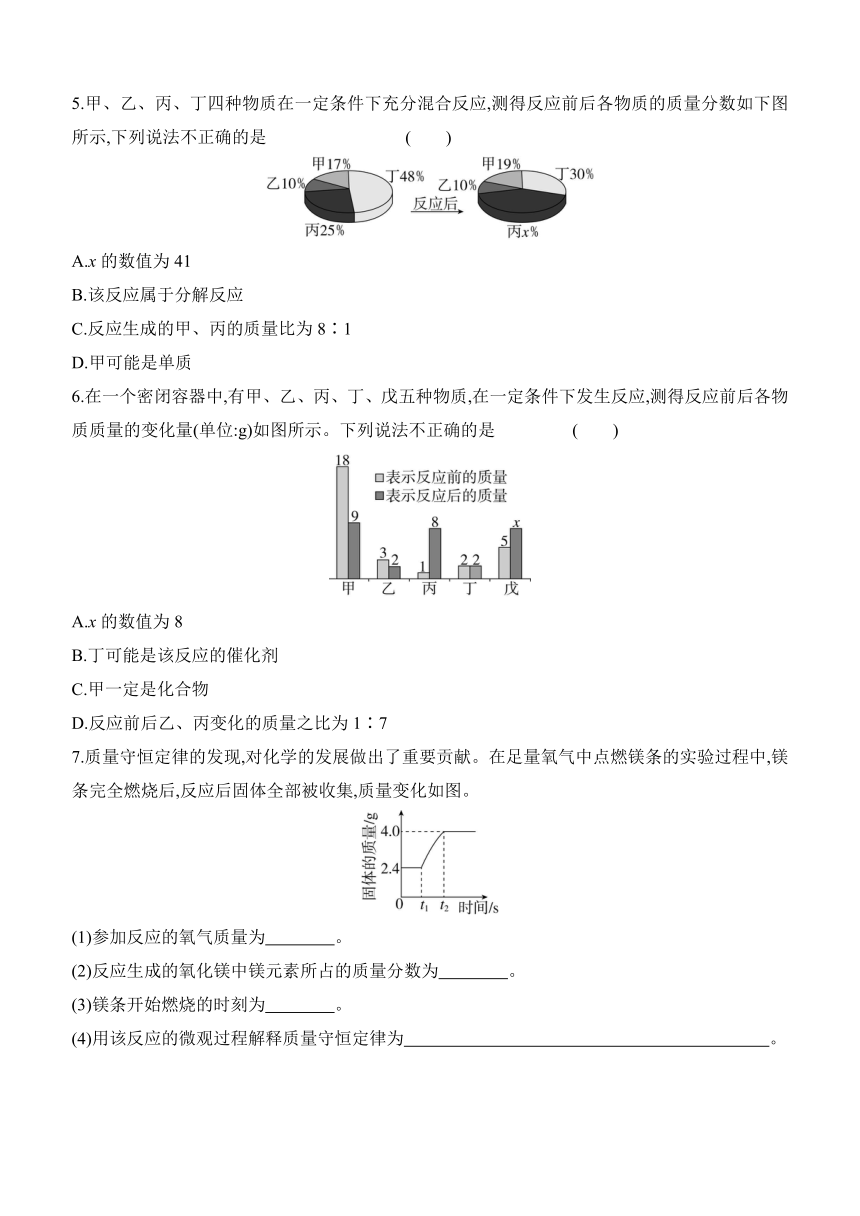
5.甲、乙、丙、丁四种物质在一定条件下充分混合反应,测得反应前后各物质的质量分数如下图所示,下列说法不正确的是 ( )
A.x的数值为41
B.该反应属于分解反应
C.反应生成的甲、丙的质量比为8∶1
D.甲可能是单质
6.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质质量的变化量(单位:g)如图所示。下列说法不正确的是 ( )
A.x的数值为8
B.丁可能是该反应的催化剂
C.甲一定是化合物
D.反应前后乙、丙变化的质量之比为1∶7
7.质量守恒定律的发现,对化学的发展做出了重要贡献。在足量氧气中点燃镁条的实验过程中,镁条完全燃烧后,反应后固体全部被收集,质量变化如图。
(1)参加反应的氧气质量为 。
(2)反应生成的氧化镁中镁元素所占的质量分数为 。
(3)镁条开始燃烧的时刻为 。
(4)用该反应的微观过程解释质量守恒定律为 。
化学方程式的计算
8.在反应2A+B3C+D中,A和B的相对分子质量之比为5∶1,已知20克A与一定量B恰好完全反应,生成5克D,则在此反应中B和C的质量比是 ( )
A.4∶9 B.3∶5
C.1∶3 D.2∶17
9.在反应X+2Y2Q+R中,1.6 g X与足量的Y完全反应,生成4.4 g R,则a∶b等于 ( )
物质 X Y Q R
相对分子质量 18 44
参加反应或生成的 物质的质量(g) 1.6 a b 4.4
A.23∶9 B.46∶9
C.32∶9 D.16∶9
10.碳化铝(Al4C3)可用作甲烷(CH4)发生剂,其在冷水中反应的化学方程式为Al4C3+12H2O4Al(OH)3+3CH4↑。现有36 t碳化铝,可制得甲烷的质量是多少
11.实验室用68 g过氧化氢溶液和2 g二氧化锰制取氧气,实验的相关数据如图。请回答:
(1)反应中二氧化锰的作用是 ,在化学反应前后本身的 都没有发生变化。
(2)反应生成氧气的质量为 g。
(3)计算过氧化氢制取氧气的反应中生成水的质量。
12.某兴趣小组为测定高锰酸钾样品的纯度,进行了实验探究,某次实验中固体的质量变化如图:
(1)反应结束后,剩余固体中一定含有 (填物质名称)。
(2)计算样品中参加反应的高锰酸钾的质量分数是多少 (写出计算过程,精确到0.1%)
13.鸡蛋壳中的主要成分是碳酸钙,小华为检测鸡蛋壳中碳酸钙的含量,进行的实验及实验数据如图所示。请回答下列问题。(信息:鸡蛋壳中其他成分与稀盐酸接触不产生气体,该反应的化学方程式为CaCO3+2HClCaCl2+H2O+CO2↑)
(1)完全反应生成气体的质量为 。
(2)计算鸡蛋壳中碳酸钙的质量分数。(写出计算过程,精确到0.1%)
【详解答案】
1.C 解析:A项,NO、CO中没有氢原子,违背质量守恒定律,故选项错误;B项,NO、CO中有氮原子,而O2、CO2中没有氮原子,违背质量守恒定律,故选项错误;C项,根据反应前后元素的种类不变,可以推断转化为参与大气循环的无毒的混合气体是氮气和二氧化碳,故选项正确;D项,二氧化氮也是空气污染物,故选项错误。
2.D 解析:根据质量守恒定律,化学反应前后原子的数目不变。2NaClO3+SO2+H2SO42ClO2+2X,反应前有2个Na、2个Cl、12个O、2个S、2个H;反应后有2个Cl、4个O,则2X中含有2个Na、8个O、2个S、2个H,故X的化学式为NaHSO4。A项,一个ClO2分子由一个氯原子和两个氧原子构成,该选项不正确。B项,化学式从右往左读作某化某,SO2的名称为二氧化硫,该选项不正确;C项,反应前SO2中硫元素的化合价为+4,H2SO4中硫元素的化合价为+6,由分析可知生成物NaHSO4中硫元素的化合价为+6,故硫元素化合价发生变化,该选项不正确;D项,由分析可知,X的化学式是NaHSO4,该选项正确。
3.D 解析:44 g CO2中含有碳元素的质量为44 g××100%=12 g,27 g水中含有氢元素的质量为27 g× ×100%=3 g,44 g二氧化碳和27 g水中所含碳、氢元素的质量和=12 g+3 g=15 g,15 g<23 g,该物质中含氧元素的质量为23 g-15 g=8 g,则X中一定含有碳、氢、氧三种元素。A项,由上述分析,X中一定含有C、H两种元素,故选项说法正确。B项,由质量守恒定律,该反应消耗氧气的质量为44 g+27 g-23 g=48 g,故选项说法正确。C项,X中C、H两种元素的质量比为12 g∶3 g=4∶1,故选项说法正确;D项,X中一定含有碳、氢、氧三种元素,其化学式不可能为C2H6,故选项说法错误。
4.B 解析:化学反应前后各物质质量总和相等,所以1 g+30 g+17 g+2 g=M g+31 g+18 g,所以M=1。甲质量不变,乙的质量增加了1 g,作生成物,丙的质量减小了17 g,作反应物,丁的质量增加了16 g,作生成物,所以反应表达式为丙乙+丁。A.该反应由一种物质反应生成两种物质,是分解反应,正确;B.该反应中乙和丁的质量比为1∶16,错误;C.表中M为1,正确;D.甲质量不变,可能是催化剂,正确。故选B。
5.C 解析:由题图知,反应后甲的质量分数增加19%-17%=2%,甲是生成物,乙的质量分数不变,可能是催化剂,也可能不参加反应,丁的质量分数减少48%-30%=18%,丁是反应物,反应后丙的质量分数为100%-19%-10%-30%=41%,丙的质量分数增加41%-25%=16%,则丙是生成物。由分析知,x的数值为41,故A不符合题意;由分析知,丁是反应物,甲、丙是生成物,乙可能是催化剂,所以该反应属于分解反应,故B不符合题意;由分析知,反应生成的甲、丙的质量比为2%∶16%=1∶8,故C符合题意;由分析知,丁发生分解反应生成甲和丙,则甲可能是单质,故D不符合题意。故选C。
6.C 解析:A.x=18+3+1+2+5-9-2-8-2=8,故选项正确。B.丁反应前后质量不变,可能是催化剂,故选项正确。C.甲和乙反应后质量减小,都是反应物,因此甲可能是单质,也可能是化合物,故选项不正确。D.反应前后乙、丙变化的质量之比为(3-2)∶(8-1)=1∶7,故选项正确。故选C。
7.(1)1.6 g (2)60% (3)t1
(4)反应前后镁原子、氧原子种类不变,个数不变,质量不变
解析:(1)参加反应的氧气质量为4.0 g-2.4 g=1.6 g。(2)反应生成的氧化镁中镁元素所占的质量分数是×100%=60%。(3)镁燃烧后固体质量增大,镁条开始燃烧的时刻为t1。(4)用该反应的微观过程解释质量守恒定律为反应前后镁原子、氧原子种类不变,个数不变,质量不变。
8.D 解析:根据“反应2A+B=3C+D中,已知A和B的相对分子质量之比为5∶1”,则可假设A和B的相对分子质量分别为5a、a,又因为20 g A与一定量B恰好完全反应,设参加反应的B的质量为x,则
2A + B3C+D
5a×2 a
20 g x
x=2 g,即B=2 g;根据质量守恒定律:20 g+2 g=m(C的质量)+5 g,故m=17 g。则B、C的质量比为2 g∶17 g=2∶17。
9.D 解析:由化学方程式可得
X+2Y2Q+R
36 44
b 4.4 g
=,b=3.6 g,根据质量守恒定律可得,a=4.4 g+3.6 g-1.6 g=6.4 g,则a∶b=6.4 g∶3.6 g=16∶9,故选D。
10.解:设可制得甲烷的质量是x。
Al4C3+12H2O4Al(OH)3+3CH4↑
144 48
36 t x
= x=12 t
答:可制得甲烷的质量是12 t。
11.解:(1)催化作用 质量和化学性质
(2)3.2
(3)设生成水的质量为x。
2H2O22H2O+O2↑
36 32
x 3.2 g
= x=3.6 g
答:过氧化氢制取氧气的反应中生成水的质量是3.6 g。
12.解:(1)锰酸钾、二氧化锰
(2)设样品中参加反应的高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 21 g-19.4 g=1.6 g
=
x=15.8 g
×100%≈75.2%
答:样品中参加反应的高锰酸钾的质量分数是75.2%。
13.解:(1)4.4 g
(2)设鸡蛋壳中碳酸钙的质量分数是x。
CaCO3+2HClCaCl2+CO2↑+H2O
100 44
12 g×x 4.4 g
=
x≈83.3%
答:鸡蛋壳中碳酸钙的质量分数是83.3%。
推断化学式或元素组成
1.为了减轻大气污染,在汽车尾气排放装置上加装“催化净化器”,可将尾气中的NO、CO转化为参与大气循环的无毒的混合气体,该混合气体是 ( )
A.CO2、NH3 B.O2、CO2
C.N2、CO2 D.NO2、CO2
2.ClO2是一种高效的水处理剂。其制备反应为2NaClO3+SO2+H2SO42ClO2+2X,下列说法正确的是 ( )
A.ClO2由一个氯原子和一个氧分子构成
B.SO2的名称为氧化硫
C.反应前后硫元素的化合价没变
D.X的化学式是NaHSO4
3.已知23 g纯净物X在足量的氧气中充分燃烧,生成44 g二氧化碳和27 g水。下列说法中错误的是 ( )
A.X中一定含有C、H两种元素
B.该反应消耗氧气的质量为48 g
C.X中C、H两种元素的质量比为4∶1
D.X的化学式可能是C2H6
密闭容器中反应数据的分析
4.一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前质量/g 1 30 17 2
反应后质量/g M 31 0 18
关于此反应,下列认识不正确的是 ( )
A.该反应是分解反应
B.该反应中乙和丁的质量比为31∶18
C.表中M为1
D.甲可能是催化剂
5.甲、乙、丙、丁四种物质在一定条件下充分混合反应,测得反应前后各物质的质量分数如下图所示,下列说法不正确的是 ( )
A.x的数值为41
B.该反应属于分解反应
C.反应生成的甲、丙的质量比为8∶1
D.甲可能是单质
6.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质质量的变化量(单位:g)如图所示。下列说法不正确的是 ( )
A.x的数值为8
B.丁可能是该反应的催化剂
C.甲一定是化合物
D.反应前后乙、丙变化的质量之比为1∶7
7.质量守恒定律的发现,对化学的发展做出了重要贡献。在足量氧气中点燃镁条的实验过程中,镁条完全燃烧后,反应后固体全部被收集,质量变化如图。
(1)参加反应的氧气质量为 。
(2)反应生成的氧化镁中镁元素所占的质量分数为 。
(3)镁条开始燃烧的时刻为 。
(4)用该反应的微观过程解释质量守恒定律为 。
化学方程式的计算
8.在反应2A+B3C+D中,A和B的相对分子质量之比为5∶1,已知20克A与一定量B恰好完全反应,生成5克D,则在此反应中B和C的质量比是 ( )
A.4∶9 B.3∶5
C.1∶3 D.2∶17
9.在反应X+2Y2Q+R中,1.6 g X与足量的Y完全反应,生成4.4 g R,则a∶b等于 ( )
物质 X Y Q R
相对分子质量 18 44
参加反应或生成的 物质的质量(g) 1.6 a b 4.4
A.23∶9 B.46∶9
C.32∶9 D.16∶9
10.碳化铝(Al4C3)可用作甲烷(CH4)发生剂,其在冷水中反应的化学方程式为Al4C3+12H2O4Al(OH)3+3CH4↑。现有36 t碳化铝,可制得甲烷的质量是多少
11.实验室用68 g过氧化氢溶液和2 g二氧化锰制取氧气,实验的相关数据如图。请回答:
(1)反应中二氧化锰的作用是 ,在化学反应前后本身的 都没有发生变化。
(2)反应生成氧气的质量为 g。
(3)计算过氧化氢制取氧气的反应中生成水的质量。
12.某兴趣小组为测定高锰酸钾样品的纯度,进行了实验探究,某次实验中固体的质量变化如图:
(1)反应结束后,剩余固体中一定含有 (填物质名称)。
(2)计算样品中参加反应的高锰酸钾的质量分数是多少 (写出计算过程,精确到0.1%)
13.鸡蛋壳中的主要成分是碳酸钙,小华为检测鸡蛋壳中碳酸钙的含量,进行的实验及实验数据如图所示。请回答下列问题。(信息:鸡蛋壳中其他成分与稀盐酸接触不产生气体,该反应的化学方程式为CaCO3+2HClCaCl2+H2O+CO2↑)
(1)完全反应生成气体的质量为 。
(2)计算鸡蛋壳中碳酸钙的质量分数。(写出计算过程,精确到0.1%)
【详解答案】
1.C 解析:A项,NO、CO中没有氢原子,违背质量守恒定律,故选项错误;B项,NO、CO中有氮原子,而O2、CO2中没有氮原子,违背质量守恒定律,故选项错误;C项,根据反应前后元素的种类不变,可以推断转化为参与大气循环的无毒的混合气体是氮气和二氧化碳,故选项正确;D项,二氧化氮也是空气污染物,故选项错误。
2.D 解析:根据质量守恒定律,化学反应前后原子的数目不变。2NaClO3+SO2+H2SO42ClO2+2X,反应前有2个Na、2个Cl、12个O、2个S、2个H;反应后有2个Cl、4个O,则2X中含有2个Na、8个O、2个S、2个H,故X的化学式为NaHSO4。A项,一个ClO2分子由一个氯原子和两个氧原子构成,该选项不正确。B项,化学式从右往左读作某化某,SO2的名称为二氧化硫,该选项不正确;C项,反应前SO2中硫元素的化合价为+4,H2SO4中硫元素的化合价为+6,由分析可知生成物NaHSO4中硫元素的化合价为+6,故硫元素化合价发生变化,该选项不正确;D项,由分析可知,X的化学式是NaHSO4,该选项正确。
3.D 解析:44 g CO2中含有碳元素的质量为44 g××100%=12 g,27 g水中含有氢元素的质量为27 g× ×100%=3 g,44 g二氧化碳和27 g水中所含碳、氢元素的质量和=12 g+3 g=15 g,15 g<23 g,该物质中含氧元素的质量为23 g-15 g=8 g,则X中一定含有碳、氢、氧三种元素。A项,由上述分析,X中一定含有C、H两种元素,故选项说法正确。B项,由质量守恒定律,该反应消耗氧气的质量为44 g+27 g-23 g=48 g,故选项说法正确。C项,X中C、H两种元素的质量比为12 g∶3 g=4∶1,故选项说法正确;D项,X中一定含有碳、氢、氧三种元素,其化学式不可能为C2H6,故选项说法错误。
4.B 解析:化学反应前后各物质质量总和相等,所以1 g+30 g+17 g+2 g=M g+31 g+18 g,所以M=1。甲质量不变,乙的质量增加了1 g,作生成物,丙的质量减小了17 g,作反应物,丁的质量增加了16 g,作生成物,所以反应表达式为丙乙+丁。A.该反应由一种物质反应生成两种物质,是分解反应,正确;B.该反应中乙和丁的质量比为1∶16,错误;C.表中M为1,正确;D.甲质量不变,可能是催化剂,正确。故选B。
5.C 解析:由题图知,反应后甲的质量分数增加19%-17%=2%,甲是生成物,乙的质量分数不变,可能是催化剂,也可能不参加反应,丁的质量分数减少48%-30%=18%,丁是反应物,反应后丙的质量分数为100%-19%-10%-30%=41%,丙的质量分数增加41%-25%=16%,则丙是生成物。由分析知,x的数值为41,故A不符合题意;由分析知,丁是反应物,甲、丙是生成物,乙可能是催化剂,所以该反应属于分解反应,故B不符合题意;由分析知,反应生成的甲、丙的质量比为2%∶16%=1∶8,故C符合题意;由分析知,丁发生分解反应生成甲和丙,则甲可能是单质,故D不符合题意。故选C。
6.C 解析:A.x=18+3+1+2+5-9-2-8-2=8,故选项正确。B.丁反应前后质量不变,可能是催化剂,故选项正确。C.甲和乙反应后质量减小,都是反应物,因此甲可能是单质,也可能是化合物,故选项不正确。D.反应前后乙、丙变化的质量之比为(3-2)∶(8-1)=1∶7,故选项正确。故选C。
7.(1)1.6 g (2)60% (3)t1
(4)反应前后镁原子、氧原子种类不变,个数不变,质量不变
解析:(1)参加反应的氧气质量为4.0 g-2.4 g=1.6 g。(2)反应生成的氧化镁中镁元素所占的质量分数是×100%=60%。(3)镁燃烧后固体质量增大,镁条开始燃烧的时刻为t1。(4)用该反应的微观过程解释质量守恒定律为反应前后镁原子、氧原子种类不变,个数不变,质量不变。
8.D 解析:根据“反应2A+B=3C+D中,已知A和B的相对分子质量之比为5∶1”,则可假设A和B的相对分子质量分别为5a、a,又因为20 g A与一定量B恰好完全反应,设参加反应的B的质量为x,则
2A + B3C+D
5a×2 a
20 g x
x=2 g,即B=2 g;根据质量守恒定律:20 g+2 g=m(C的质量)+5 g,故m=17 g。则B、C的质量比为2 g∶17 g=2∶17。
9.D 解析:由化学方程式可得
X+2Y2Q+R
36 44
b 4.4 g
=,b=3.6 g,根据质量守恒定律可得,a=4.4 g+3.6 g-1.6 g=6.4 g,则a∶b=6.4 g∶3.6 g=16∶9,故选D。
10.解:设可制得甲烷的质量是x。
Al4C3+12H2O4Al(OH)3+3CH4↑
144 48
36 t x
= x=12 t
答:可制得甲烷的质量是12 t。
11.解:(1)催化作用 质量和化学性质
(2)3.2
(3)设生成水的质量为x。
2H2O22H2O+O2↑
36 32
x 3.2 g
= x=3.6 g
答:过氧化氢制取氧气的反应中生成水的质量是3.6 g。
12.解:(1)锰酸钾、二氧化锰
(2)设样品中参加反应的高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 21 g-19.4 g=1.6 g
=
x=15.8 g
×100%≈75.2%
答:样品中参加反应的高锰酸钾的质量分数是75.2%。
13.解:(1)4.4 g
(2)设鸡蛋壳中碳酸钙的质量分数是x。
CaCO3+2HClCaCl2+CO2↑+H2O
100 44
12 g×x 4.4 g
=
x≈83.3%
答:鸡蛋壳中碳酸钙的质量分数是83.3%。
同课章节目录
