人教版高中化学必修二 基于化学动力学的速率与机理(22张)
文档属性
| 名称 | 人教版高中化学必修二 基于化学动力学的速率与机理(22张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-02 08:43:26 | ||
图片预览




文档简介
(共22张PPT)
基于化学动力学的速率与机理
学习目标
基于化学动力学的视角,优化反应条件,丰富研究化学反应的视角,进一步体会反应的可调可控性,完善学科观念的建构体系。
提升学生从动力学和热力学两个角度出发,解决实际生活、生产和科学研究中真实问题的能力,发展学生的变化观念与平衡思想、科学态度与社会责任素养。
环戊烯ROMP聚合的调控
化学反应
方向
依据:ΔH-TΔS
判断反应在一定条件下能否发生
限度
定性规律:勒夏特列原理
定量描述:平衡常数K
调节平衡朝所需要的方向移动
影响因素:T 、c 、P
速率
影响因素:T 、c 、P
和催化剂
控制反应以预期的速率进行
证据推理与模型认知素养
可能性要强
原料利用率要高
单位时间内产率要高
多快好省
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
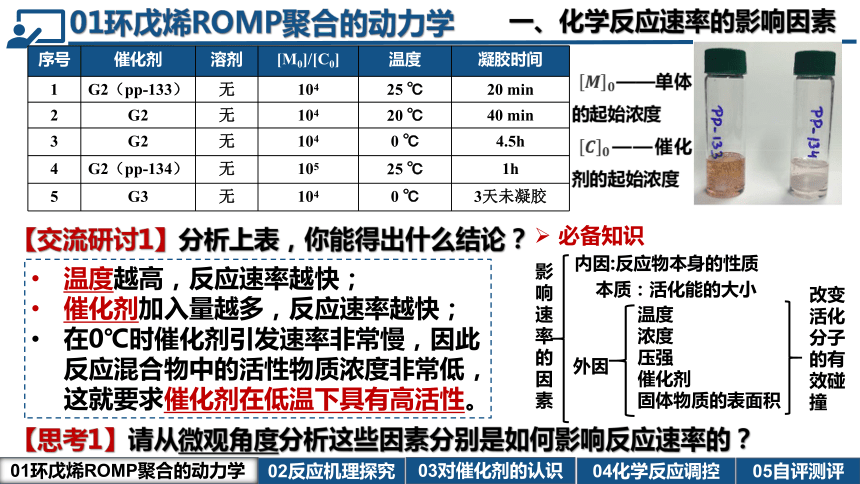
序号 催化剂 溶剂 [M0]/[C0] 温度 凝胶时间
1 G2(pp-133) 无 104 25 ℃ 20 min
2 G2 无 104 20 ℃ 40 min
3 G2 无 104 0 ℃ 4.5h
4 G2(pp-134) 无 105 25 ℃ 1h
5 G3 无 104 0 ℃ 3天未凝胶
温度越高,反应速率越快;
催化剂加入量越多,反应速率越快;
在0℃时催化剂引发速率非常慢,因此反应混合物中的活性物质浓度非常低,这就要求催化剂在低温下具有高活性。
01环戊烯ROMP聚合的动力学
【交流研讨1】分析上表,你能得出什么结论?
影响速率的因素
内因:反应物本身的性质
本质:活化能的大小
外因
温度
浓度
压强
催化剂
固体物质的表面积
改变活化分子的有效碰撞
必备知识
——单体的起始浓度
——催化剂的起始浓度
一、化学反应速率的影响因素
【思考1】请从微观角度分析这些因素分别是如何影响反应速率的?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
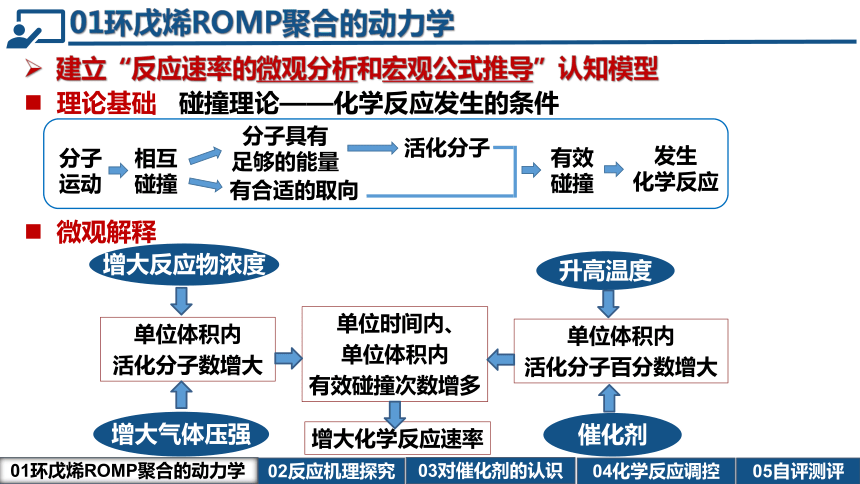
理论基础 碰撞理论——化学反应发生的条件
分子运动
相互碰撞
分子具有
足够的能量
有合适的取向
活化分子
有效碰撞
发生
化学反应
微观解释
单位时间内、
单位体积内
有效碰撞次数增多
增大化学反应速率
升高温度
催化剂
增大反应物浓度
增大气体压强
单位体积内
活化分子百分数增大
单位体积内
活化分子数增大
建立“反应速率的微观分析和宏观公式推导”认知模型
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
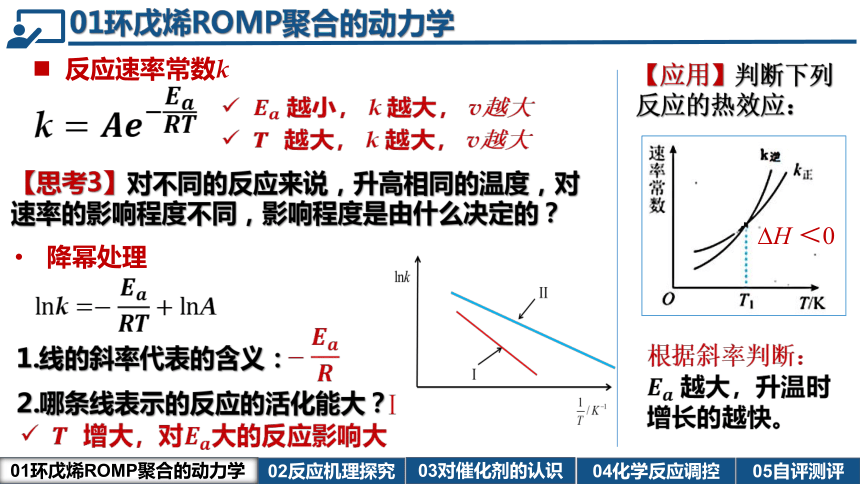
反应速率常数k
对于反应:aA(g)+bB(g)=cC(g)+dD(g)
复杂反应
v=k
k的意义:
速率方程是由实验数据测定的结果,与化学方程式无确定的关系。
k的影响因素:
建立“反应速率的微观分析和宏观公式推导”认知模型
基元反应
v=k
它的大小直接反映速率的快慢,k值越大,说明反应速率越快。
与浓度无关,但受温度、溶剂 、催化剂、固体表面性质等因素的影响。
【思考2】请依据宏观公式推导各因素对反应速率的影响。
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
反应速率常数k
越小, 越大, v越大
越大, 越大, v越大
【思考3】对不同的反应来说,升高相同的温度,对速率的影响程度不同,影响程度是由什么决定的?
降幂处理
增大,对大的反应影响大
1.线的斜率代表的含义:
2.哪条线表示的反应的活化能大?
【应用】判断下列反应的热效应:
根据斜率判断: 越大,升温时增长的越快。
H <0
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
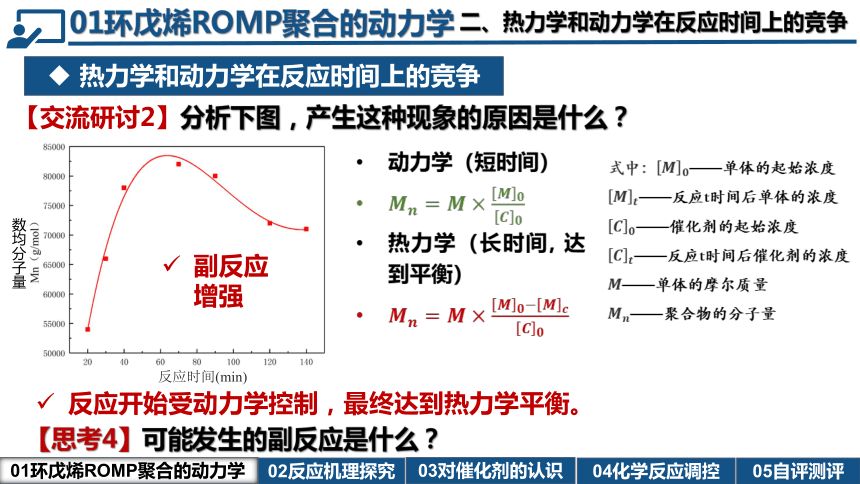
动力学(短时间)
热力学(长时间, 达到平衡)
反应时间(min)
热力学和动力学在反应时间上的竞争
反应开始受动力学控制,最终达到热力学平衡。
式中:——单体的起始浓度
——反应t时间后单体的浓度
——催化剂的起始浓度
——反应t时间后催化剂的浓度
——单体的摩尔质量
——聚合物的分子量
【交流研讨2】分析下图,产生这种现象的原因是什么?
二、热力学和动力学在反应时间上的竞争
副反应增强
【思考4】可能发生的副反应是什么?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
数均分子量
01环戊烯ROMP聚合的动力学
短链烯烃
链间转移
链内回咬
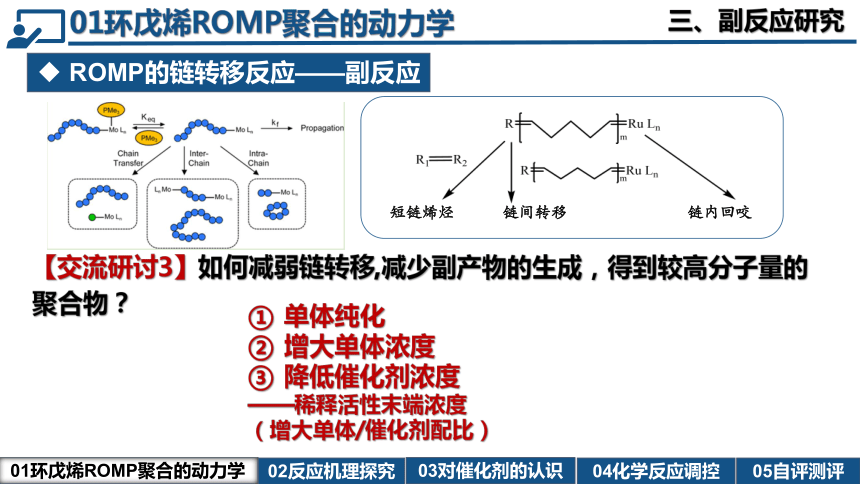
ROMP的链转移反应——副反应
单体纯化
增大单体浓度
降低催化剂浓度
——稀释活性末端浓度
(增大单体/催化剂配比)
【交流研讨3】如何减弱链转移,减少副产物的生成,得到较高分子量的聚合物?
三、副反应研究
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
环戊烯ROMP聚合的热力学和动力学
单体浓度
单体/催化剂配比
单体/催化剂配比
Mn (g/mol)
140000
120000
100000
80000
60000
40000
20000
0 5000 10000 15000 20000 25000 30000
单体浓度(M)
Mn (g/mol)
140000
130000
120000
110000
100000
90000
2 4 6 8 10 12
反应条件控制
平衡单体浓度
热力学(达到平衡)
【思考5】分析右图,你能发现什么?
公式推导
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
02反应机理探究
烯烃复分解反应机理
催化剂
中间产物
反应物
反应物
生成物A
生成物B
中间产物
中间产物
反应物平均能量
生成物平均能量
活化分子平均能量
E
活化能=活化分子平均能量-普通分子平均能量
图1
图2
【思考6】
根据图1分析该反应的催化剂和中间产物。
根据图2分析该反应的决速步是?
催化剂的配体解离需要较大的活化能!
四、反应机理探究
3. 速率快需要什么温度
整个过程都需要较高温度吗?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
02反应机理探究
变温 ROMP
William J. Neary . Macromolecules 2017, 50, 4935 4941
Kennemur等人发现当使用Grubbs催化剂时链引发速率远小于链增长速率,他们进一步提出“变温ROMP”的概念,即在相对较高的温度下快速引发反应,随即在较低的温度下进行链增长,从而实现在高转化率的前提下对聚环戊烯的分子量和分布进行精确调控。
【交流研讨4】在热力学上由于开环易位聚合是熵不利过程,因此较低的反应温度可以在热力学上驱使该类聚合反应。然而,低温条件在动力学上却不利于催化剂的配体解离,即预催化剂的引发。反应过程中应如何控温?
高温引发 低温聚合
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
03环戊烯ROMP聚合的催化剂
拓展视野——环戊烯ROMP聚合的催化剂
Z- vs. E-selectivity
Grubbs, R H.* Chem.Soc.Rev., 2018, 47, 4510--4544
顺-反式选择性是由催化剂两个顶端配体的大小不同引起的
不同的催化剂制得的聚合物的顺反含量(cis/trans)是有差别的,这是由催化剂的活性中心的立体选择性决定的。
五、对催化剂的认识
序号 催化剂 溶剂 温度 顺/反比率 平衡单体浓度
1 Schrock-type 甲苯 0℃ 26/74 0.5M
2 G2 甲苯 0℃ 17/83 0.4M
催化剂不同,顺反式含量不同;
反式含量多,平衡单体转化率高。
反式结构更加稳定, G值更低
【思考7】观察下表你能发现什么?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
03环戊烯ROMP聚合的催化剂
拓展视野——环戊烯ROMP聚合的催化剂
聚合用催化剂:
Mo-based Schrock-type
Ru- based Grubbs-type
W-based catalysts
V-based catalysts
最典型的是基于钼的Schrock催化剂和基于钌的Grubbs催化剂。Schrock催化剂具有很高的活性和立体选择性,但对水、氧和官能团的耐受性较差,由于其不稳定性,对使用时的操作要求较高,需要确保反应体系无水无氧。相对而言,Grubbs催化剂具有较高的催化活性,并且耐水、耐氧、耐官能团、操作条件温和,因而可以用于合成含有不同官能团和丰富性质的聚合物。
五、对催化剂的认识
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
03环戊烯ROMP聚合的催化剂
trans-α
cis-α
β
α
β
α
α
β
α
Trans-polypentenamer
Cis-polypentenamer
在聚环戊烯的1H NMR谱图中,聚环戊烯顺、反异构体双键上的氢(Hα)完全重合,无法进行归属,因此无法通过氢谱积分,快速、简单地确定所合成的聚环戊烯中顺、反异构体的含量。聚环戊烯中顺、反异构体的含量,可以根据对聚环戊烯13C NMR谱图中特征峰的归属和积分确定。
不同反应条件下的顺反式含量分析
六、分子结构的测定
【思考8】如何对分子结构进行测定?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
03环戊烯ROMP聚合的催化剂
分子结构测定——仪器(波谱)分析
常用的测定分子结构的方法有红外光谱(IR)、核磁共振(NMR)、紫外和可见光谱(UV)、质谱(MS),其原理是通过样品对特殊电磁波等作用产生相应的信号(图谱),提供分子结构的信息,用于表征有机化合物的分子结构。
仪器(波谱)分析法 主要功能
获得分子中含有何种化学键或官能团的信息
核磁共振(碳谱、氢谱) 获取基团及基团连接关系信息
紫外和可见光谱 判断有机化合物分子结构中共扼程度的大小
获得有机化合物的相对分子质量
对物质进行内部原子在空间分布状况的结构分析
表1 仪器(波谱)分析法的主要功能
红外光谱
质谱/凝胶渗透色谱仪(GPC)
X射线衍射分析
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
六、分子结构的测定
04化学反应的调控
温度对化学反应体系的影响
解决动力学和热力学上的矛盾:高温引发,低温聚合
动力学
反应速率
催化剂活性
物质性质
熔、沸点等
热力学
化学反应的方向
化学平衡及其移动
副反应趋势
温度对化学反应体系的影响
七、化学反应的调控
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
04化学反应的调控
判断反应的自发性
= <0
化学平衡移动
降低温度,平衡正向移动
( <0)
化学反应速率
升高温度
H<0 , S<0
低温自发
提高单体浓度
增大浓度(单体浓度&催化剂浓度)
选择合适的催化剂
增大体系压强( )
综合视角下的条件选择结果
增加单体浓度:速率加快,副反应减弱,转化率增大
增加催化剂浓度:速率加快,副反应增强——矛盾:合适催化剂加入量,依分子量调控
升高反应温度:速率加快,副反应增强,转化率减小——矛盾:高温引发,低温聚合
七、化学反应的调控
在解决问题的过程中:运用了必备知识,提升了分析与推测能力,发展了变化观念与平衡思想、科学态度与社会责任素养。
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
04化学反应的调控
化学反应的分析模型
判断反应的自发性
=
化学平衡移动
热力学角度
温度
关注焓变
浓度
关注状态
压强
关注系数
平衡转化率
动力学角度
化学反应速率
温度
压强
浓度
催化剂
单位时间内转化率
条件优化模型
多、快、好、省
产量
七、化学反应的调控
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
05学习自评
评价内容
1.能基于化学动力学的视角,优化反应条件,丰富研究化学反应的视角,进一步体会反应的可调可控性,完善学科观念的建构体系。
2.能从动力学和热力学两个角度出发,解决实际生活、生产和科学研究中真实问题,发展了变化观念与平衡思想、科学态度与社会责任素养。
3.能根据化学反应的机理和反应规律对化学反应进行调控。
4.能认识到化学反应的发生是有条件的,条件是可调可控的。
5.能通过图像等信息讨论化学反应条件的选择和优化。
对照本节课的学习内容,自我评价掌握程度,查缺补漏。
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
06 当堂评价
1.环戊二烯( )容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
CD
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
06当堂评价
2.热催化合成氨面临的两难问题是:釆用高温增大反应速率的同时会因平衡限制导致NH3 产率降低。我国科研人员研制了 Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100°C)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
A.①为氮氮三键的断裂过程
B.①②③在高温区发生,④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
BC
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
基于化学动力学的速率与机理
学习目标
基于化学动力学的视角,优化反应条件,丰富研究化学反应的视角,进一步体会反应的可调可控性,完善学科观念的建构体系。
提升学生从动力学和热力学两个角度出发,解决实际生活、生产和科学研究中真实问题的能力,发展学生的变化观念与平衡思想、科学态度与社会责任素养。
环戊烯ROMP聚合的调控
化学反应
方向
依据:ΔH-TΔS
判断反应在一定条件下能否发生
限度
定性规律:勒夏特列原理
定量描述:平衡常数K
调节平衡朝所需要的方向移动
影响因素:T 、c 、P
速率
影响因素:T 、c 、P
和催化剂
控制反应以预期的速率进行
证据推理与模型认知素养
可能性要强
原料利用率要高
单位时间内产率要高
多快好省
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
序号 催化剂 溶剂 [M0]/[C0] 温度 凝胶时间
1 G2(pp-133) 无 104 25 ℃ 20 min
2 G2 无 104 20 ℃ 40 min
3 G2 无 104 0 ℃ 4.5h
4 G2(pp-134) 无 105 25 ℃ 1h
5 G3 无 104 0 ℃ 3天未凝胶
温度越高,反应速率越快;
催化剂加入量越多,反应速率越快;
在0℃时催化剂引发速率非常慢,因此反应混合物中的活性物质浓度非常低,这就要求催化剂在低温下具有高活性。
01环戊烯ROMP聚合的动力学
【交流研讨1】分析上表,你能得出什么结论?
影响速率的因素
内因:反应物本身的性质
本质:活化能的大小
外因
温度
浓度
压强
催化剂
固体物质的表面积
改变活化分子的有效碰撞
必备知识
——单体的起始浓度
——催化剂的起始浓度
一、化学反应速率的影响因素
【思考1】请从微观角度分析这些因素分别是如何影响反应速率的?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
理论基础 碰撞理论——化学反应发生的条件
分子运动
相互碰撞
分子具有
足够的能量
有合适的取向
活化分子
有效碰撞
发生
化学反应
微观解释
单位时间内、
单位体积内
有效碰撞次数增多
增大化学反应速率
升高温度
催化剂
增大反应物浓度
增大气体压强
单位体积内
活化分子百分数增大
单位体积内
活化分子数增大
建立“反应速率的微观分析和宏观公式推导”认知模型
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
反应速率常数k
对于反应:aA(g)+bB(g)=cC(g)+dD(g)
复杂反应
v=k
k的意义:
速率方程是由实验数据测定的结果,与化学方程式无确定的关系。
k的影响因素:
建立“反应速率的微观分析和宏观公式推导”认知模型
基元反应
v=k
它的大小直接反映速率的快慢,k值越大,说明反应速率越快。
与浓度无关,但受温度、溶剂 、催化剂、固体表面性质等因素的影响。
【思考2】请依据宏观公式推导各因素对反应速率的影响。
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
反应速率常数k
越小, 越大, v越大
越大, 越大, v越大
【思考3】对不同的反应来说,升高相同的温度,对速率的影响程度不同,影响程度是由什么决定的?
降幂处理
增大,对大的反应影响大
1.线的斜率代表的含义:
2.哪条线表示的反应的活化能大?
【应用】判断下列反应的热效应:
根据斜率判断: 越大,升温时增长的越快。
H <0
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
动力学(短时间)
热力学(长时间, 达到平衡)
反应时间(min)
热力学和动力学在反应时间上的竞争
反应开始受动力学控制,最终达到热力学平衡。
式中:——单体的起始浓度
——反应t时间后单体的浓度
——催化剂的起始浓度
——反应t时间后催化剂的浓度
——单体的摩尔质量
——聚合物的分子量
【交流研讨2】分析下图,产生这种现象的原因是什么?
二、热力学和动力学在反应时间上的竞争
副反应增强
【思考4】可能发生的副反应是什么?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
数均分子量
01环戊烯ROMP聚合的动力学
短链烯烃
链间转移
链内回咬
ROMP的链转移反应——副反应
单体纯化
增大单体浓度
降低催化剂浓度
——稀释活性末端浓度
(增大单体/催化剂配比)
【交流研讨3】如何减弱链转移,减少副产物的生成,得到较高分子量的聚合物?
三、副反应研究
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
01环戊烯ROMP聚合的动力学
环戊烯ROMP聚合的热力学和动力学
单体浓度
单体/催化剂配比
单体/催化剂配比
Mn (g/mol)
140000
120000
100000
80000
60000
40000
20000
0 5000 10000 15000 20000 25000 30000
单体浓度(M)
Mn (g/mol)
140000
130000
120000
110000
100000
90000
2 4 6 8 10 12
反应条件控制
平衡单体浓度
热力学(达到平衡)
【思考5】分析右图,你能发现什么?
公式推导
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
02反应机理探究
烯烃复分解反应机理
催化剂
中间产物
反应物
反应物
生成物A
生成物B
中间产物
中间产物
反应物平均能量
生成物平均能量
活化分子平均能量
E
活化能=活化分子平均能量-普通分子平均能量
图1
图2
【思考6】
根据图1分析该反应的催化剂和中间产物。
根据图2分析该反应的决速步是?
催化剂的配体解离需要较大的活化能!
四、反应机理探究
3. 速率快需要什么温度
整个过程都需要较高温度吗?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
02反应机理探究
变温 ROMP
William J. Neary . Macromolecules 2017, 50, 4935 4941
Kennemur等人发现当使用Grubbs催化剂时链引发速率远小于链增长速率,他们进一步提出“变温ROMP”的概念,即在相对较高的温度下快速引发反应,随即在较低的温度下进行链增长,从而实现在高转化率的前提下对聚环戊烯的分子量和分布进行精确调控。
【交流研讨4】在热力学上由于开环易位聚合是熵不利过程,因此较低的反应温度可以在热力学上驱使该类聚合反应。然而,低温条件在动力学上却不利于催化剂的配体解离,即预催化剂的引发。反应过程中应如何控温?
高温引发 低温聚合
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
03环戊烯ROMP聚合的催化剂
拓展视野——环戊烯ROMP聚合的催化剂
Z- vs. E-selectivity
Grubbs, R H.* Chem.Soc.Rev., 2018, 47, 4510--4544
顺-反式选择性是由催化剂两个顶端配体的大小不同引起的
不同的催化剂制得的聚合物的顺反含量(cis/trans)是有差别的,这是由催化剂的活性中心的立体选择性决定的。
五、对催化剂的认识
序号 催化剂 溶剂 温度 顺/反比率 平衡单体浓度
1 Schrock-type 甲苯 0℃ 26/74 0.5M
2 G2 甲苯 0℃ 17/83 0.4M
催化剂不同,顺反式含量不同;
反式含量多,平衡单体转化率高。
反式结构更加稳定, G值更低
【思考7】观察下表你能发现什么?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
03环戊烯ROMP聚合的催化剂
拓展视野——环戊烯ROMP聚合的催化剂
聚合用催化剂:
Mo-based Schrock-type
Ru- based Grubbs-type
W-based catalysts
V-based catalysts
最典型的是基于钼的Schrock催化剂和基于钌的Grubbs催化剂。Schrock催化剂具有很高的活性和立体选择性,但对水、氧和官能团的耐受性较差,由于其不稳定性,对使用时的操作要求较高,需要确保反应体系无水无氧。相对而言,Grubbs催化剂具有较高的催化活性,并且耐水、耐氧、耐官能团、操作条件温和,因而可以用于合成含有不同官能团和丰富性质的聚合物。
五、对催化剂的认识
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
03环戊烯ROMP聚合的催化剂
trans-α
cis-α
β
α
β
α
α
β
α
Trans-polypentenamer
Cis-polypentenamer
在聚环戊烯的1H NMR谱图中,聚环戊烯顺、反异构体双键上的氢(Hα)完全重合,无法进行归属,因此无法通过氢谱积分,快速、简单地确定所合成的聚环戊烯中顺、反异构体的含量。聚环戊烯中顺、反异构体的含量,可以根据对聚环戊烯13C NMR谱图中特征峰的归属和积分确定。
不同反应条件下的顺反式含量分析
六、分子结构的测定
【思考8】如何对分子结构进行测定?
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
03环戊烯ROMP聚合的催化剂
分子结构测定——仪器(波谱)分析
常用的测定分子结构的方法有红外光谱(IR)、核磁共振(NMR)、紫外和可见光谱(UV)、质谱(MS),其原理是通过样品对特殊电磁波等作用产生相应的信号(图谱),提供分子结构的信息,用于表征有机化合物的分子结构。
仪器(波谱)分析法 主要功能
获得分子中含有何种化学键或官能团的信息
核磁共振(碳谱、氢谱) 获取基团及基团连接关系信息
紫外和可见光谱 判断有机化合物分子结构中共扼程度的大小
获得有机化合物的相对分子质量
对物质进行内部原子在空间分布状况的结构分析
表1 仪器(波谱)分析法的主要功能
红外光谱
质谱/凝胶渗透色谱仪(GPC)
X射线衍射分析
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
六、分子结构的测定
04化学反应的调控
温度对化学反应体系的影响
解决动力学和热力学上的矛盾:高温引发,低温聚合
动力学
反应速率
催化剂活性
物质性质
熔、沸点等
热力学
化学反应的方向
化学平衡及其移动
副反应趋势
温度对化学反应体系的影响
七、化学反应的调控
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
04化学反应的调控
判断反应的自发性
= <0
化学平衡移动
降低温度,平衡正向移动
( <0)
化学反应速率
升高温度
H<0 , S<0
低温自发
提高单体浓度
增大浓度(单体浓度&催化剂浓度)
选择合适的催化剂
增大体系压强( )
综合视角下的条件选择结果
增加单体浓度:速率加快,副反应减弱,转化率增大
增加催化剂浓度:速率加快,副反应增强——矛盾:合适催化剂加入量,依分子量调控
升高反应温度:速率加快,副反应增强,转化率减小——矛盾:高温引发,低温聚合
七、化学反应的调控
在解决问题的过程中:运用了必备知识,提升了分析与推测能力,发展了变化观念与平衡思想、科学态度与社会责任素养。
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
04化学反应的调控
化学反应的分析模型
判断反应的自发性
=
化学平衡移动
热力学角度
温度
关注焓变
浓度
关注状态
压强
关注系数
平衡转化率
动力学角度
化学反应速率
温度
压强
浓度
催化剂
单位时间内转化率
条件优化模型
多、快、好、省
产量
七、化学反应的调控
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
05学习自评
评价内容
1.能基于化学动力学的视角,优化反应条件,丰富研究化学反应的视角,进一步体会反应的可调可控性,完善学科观念的建构体系。
2.能从动力学和热力学两个角度出发,解决实际生活、生产和科学研究中真实问题,发展了变化观念与平衡思想、科学态度与社会责任素养。
3.能根据化学反应的机理和反应规律对化学反应进行调控。
4.能认识到化学反应的发生是有条件的,条件是可调可控的。
5.能通过图像等信息讨论化学反应条件的选择和优化。
对照本节课的学习内容,自我评价掌握程度,查缺补漏。
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
06 当堂评价
1.环戊二烯( )容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
CD
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
06当堂评价
2.热催化合成氨面临的两难问题是:釆用高温增大反应速率的同时会因平衡限制导致NH3 产率降低。我国科研人员研制了 Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100°C)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
A.①为氮氮三键的断裂过程
B.①②③在高温区发生,④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
BC
05自评测评
01环戊烯ROMP聚合的动力学
02反应机理探究
03对催化剂的认识
04化学反应调控
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
