3.1.3 氧化还原反应 课件 (共32张PPT)_高中化学苏教版(2019)必修一
文档属性
| 名称 | 3.1.3 氧化还原反应 课件 (共32张PPT)_高中化学苏教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 18:40:00 | ||
图片预览







文档简介
(共32张PPT)
3.1.3 氧化还原反应
素养目标
宏观辨识与微观探析
能从宏观层面观察氯气与金属钠反应的实验现象,辨识反应前后元素化合价的变化;从微观角度探析钠原子与氯原子间电子转移的过程,理解化合价变化与电子转移的内在关联,精准把握氧化还原反应的本质 。
科学态度与社会责任
认识到氧化还原反应在生产、生活、环境保护和生命活动等方面的广泛应用,树立科学利用化学知识为社会发展服务的化学观念。
变化观念与平衡思想
形成对氧化还原反应的动态变化观念,认识到在化学反应中元素化合价改变、电子转移是氧化还原反应的核心特征;理解氧化还原反应中存在电子转移的平衡,明确氧化还原反应在物质转化、能量转化中的重要作用。
教学重难点
重点:
1. 氧化还原反应的判断依据(元素化合价是否变化 )
2. 氧化还原反应的本质(电子转移,包括电子的得失或偏移 )
3. 氧化剂、还原剂、氧化反应、还原反应等核心概念的界定与辨析
难点:
1. 从微观电子转移角度,解释化合价变化与氧化还原反应的因果关系
2. 熟练运用双线桥法表示电子转移的方向和数目,准确判断复杂氧化还
原反应中的氧化剂、还原剂 。
新知导入
早上切的苹果,现在变成褐色了; 铁制水龙头,没用几年就生锈。这些生活里常见的 “变色”“生锈” 现象,背后都藏着同一类反应 —— 氧化还原反应。今天,咱们就从氯气和钠的反应入手,揭开氧化还原反应的神秘面纱 !
1
氧化剂、还原剂
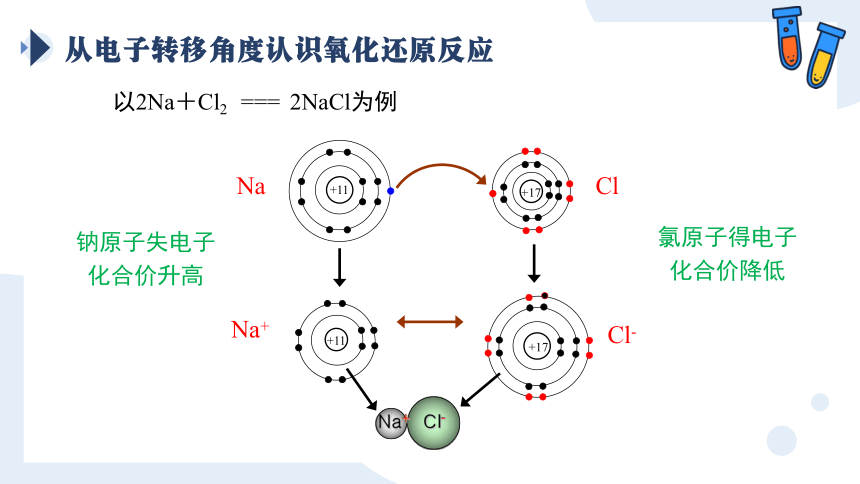
从电子转移角度认识氧化还原反应
以2Na+Cl2 === 2NaCl为例
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
钠原子失电子化合价升高
氯原子得电子化合价降低
氧化还原反应的本质和特征
(1)定义:有电子转移(电子得失或共用电子对偏移)的化学反应。
(2)本质(微观):反应过程中有电子转移。
(3)特征(宏观):元素化合价发生变化(升高和降低)
氧化剂与还原剂
(1)氧化剂:在氧化还原反应中得到电子(或电子对偏向)的反应物,所含元素化合价降低。
(2)还原剂:在氧化还原反应中失去电子(或电子对偏离)的反应物,所含元素化合价升高。
tips:氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
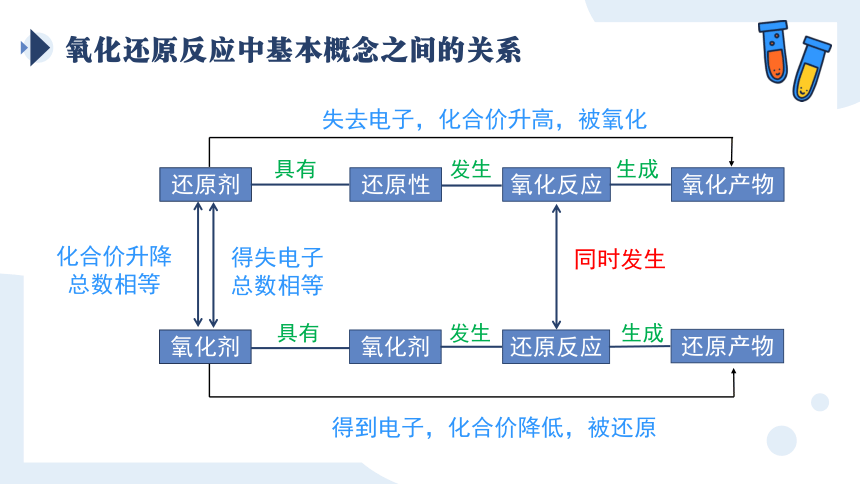
氧化还原反应中基本概念之间的关系
还原剂
还原性
氧化反应
氧化产物
氧化剂
氧化剂
还原反应
还原产物
具有
发生
生成
发生
生成
具有
失去电子,化合价升高,被氧化
得到电子,化合价降低,被还原
化合价升降总数相等
得失电子
总数相等
同时发生
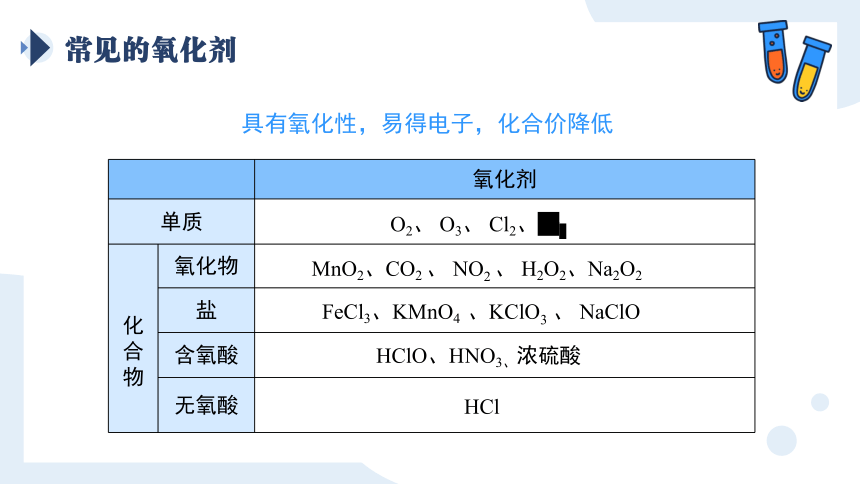
常见的氧化剂
具有氧化性,易得电子,化合价降低
氧化剂
单质
化合物 氧化物
盐
含氧酸
无氧酸
O2、 O3、 Cl2、Br2
MnO2、CO2 、 NO2 、 H2O2、Na2O2
FeCl3、KMnO4 、KClO3 、 NaClO
HClO、HNO3、浓硫酸
HCl
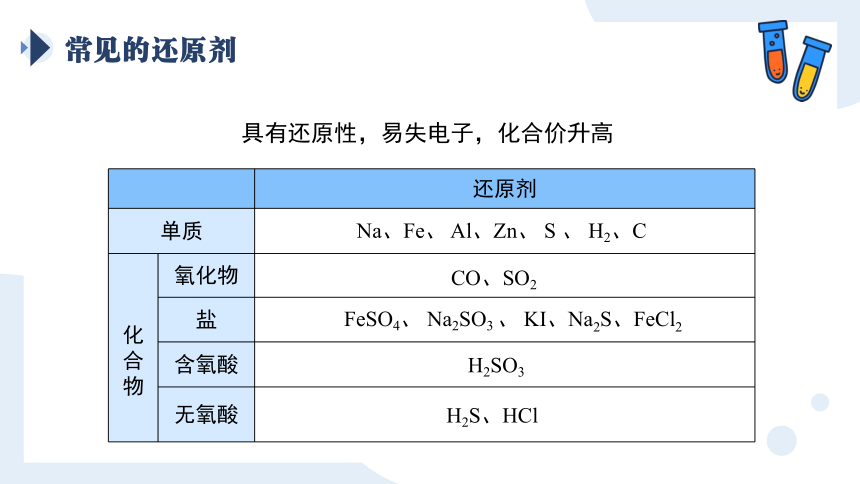
常见的还原剂
具有还原性,易失电子,化合价升高
还原剂
单质
化合物 氧化物
盐
含氧酸
无氧酸
Na、Fe、 Al、Zn、 S 、 H2、C
CO、SO2
FeSO4、 Na2SO3 、 KI、Na2S、FeCl2
H2SO3
H2S、HCl
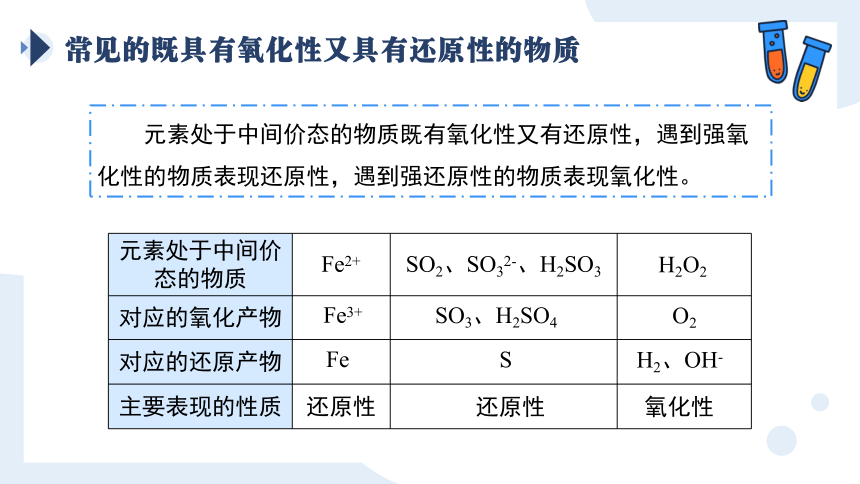
常见的既具有氧化性又具有还原性的物质
元素处于中间价态的物质既有氧化性又有还原性,遇到强氧化性的物质表现还原性,遇到强还原性的物质表现氧化性。
元素处于中间价态的物质
对应的氧化产物
对应的还原产物
主要表现的性质
Fe2+
Fe3+
Fe
SO2、SO32-、H2SO3
SO3、H2SO4
S
H2O2
O2
H2、OH-
还原性
还原性
氧化性
2
电子转移的方向和数目的表示方法
双线桥法
表示意义:反应前后同一元素原子或离子间的电子转移情况。
2Na+Cl2 2NaCl
得到2×e-,化合价降低,被还原
失去2×e-,化合价升高,被氧化
0
0
+1
-1
氧化剂+还原剂=== 还原产物+氧化产物
得到a×be-
失去c×de-
双线桥法的基本书写步骤
标价态
正确标明反应前后各元素的化合价
明确发生化合价变化的元素的化合价升降关系
连双线
一条线
另一条线
由氧化剂中化合价降低的元素指向还原
产物中的相应元素
由还原剂中化合价升高的元素指向氧化
产物中的相应元素
连双线
必须标出“得到”或“失去”电子的总数
即学即练
根据双线桥法的一般步骤,你能用双线桥表示以下反应的电子转移情况吗?
Fe2O3 + 3CO 2Fe + 3CO2
高温
0
+2
+4
+3
得2×3e-
失3×2e-
Zn + H2SO4 ZnSO4 + H2↑
+2
+1
0
0
失1×2e-
得2×e-
tips:箭头、箭尾必须对应化合价变化的同种元素的原子。
单线桥法
表示意义:反应前后不同元素原子或离子间的电子转移情况。
Fe+2HCl===FeCl2+H2↑
2 e-
2Na+Cl2 2NaCl
2 e-
还原剂 + 氧化剂 === 还原产物 + 氧化产物
n e-
单线桥法的基本书写步骤
标价态
正确标明反应前后各元素的化合价
明确发生化合价变化的元素的化合价升降关系
连单线
连双线
标出转移电子的总数
箭头指向氧化剂中化合价降低的元素,箭尾连接还原剂中化合价升高的元素
3
物质的氧化性、还原性强弱的判断
根据氧化还原反应方程式判断
氧化剂 + 还原剂 = 还原产物 + 氧化产物
失去电子,化合价升高,被氧化
得到电子,化合价降低,被还原
氧化性:氧化剂(反应物)>氧化产物(产物)
还原性:还原剂(反应物)>还原产物(产物)
剂强物弱
根据金属活动性顺序判断
(单质的还原性逐渐减弱)
K
K+
Ca
Ca2+
Na
Na+
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
Mg2+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+
(H+)
Cu2+
Hg2+
Ag+
(阳离子的氧化性逐渐增强)
单质易失电子,对应阳离子不易得电子(易失不易得)
tips:元素的化合价处于最高价态时具有氧化性,但不一定具有强氧化性,如Na+。
根据非金属活动性顺序判断
单质易得电子,对应阴离子不易失电子(易得不易失)
(单质的氧化性逐渐减弱)
(阴离子的还原性逐渐增强)
F2
F-
Cl2
Br2
I2
S
Cl-
Br-
I-
S2-
tips:元素的化合价处于最低价态时具有还原性,但不一定具有强还原性,如F-。
根据反应条件判断
当不同的氧化剂(或还原剂)与相同还原剂(或氧化剂)反应时
若氧化产物(或还原产物)中元素价态相同,则反应条件要求越低,氧化剂(或还原剂)的氧化性(或还原性)越强。
F2+H2 2HF
暗处
Cl2+H2 2HCl
点燃
氧化性:F2>Cl2
根据元素的价态判断
(1)不同种氧化剂将同种还原剂中相同元素氧化时,得到的对应氧化产物中相同元素的价态越高,氧化剂的氧化性越强。
2Fe+3Cl2 2FeCl3
点燃
Fe+S FeS
△
氧化性:Cl2>S
根据元素的价态判断
(2)一般地,对于同种元素,价态越高,其氧化性越强;价态越低其还原性越强。
S -2 0 +4 +6
从低价到高价,氧化性渐增,还原性渐减
从高价到低价,氧化性渐减,还原性渐增
4
随堂练习
1. 已知:
①
②
③
请依据上述反应判断还原性由强到弱的顺序是( )
A. B.
C. D.
A
2. 下列有关氧化还原反应的叙述正确的是( )
A. 元素化合价升高的反应是还原反应
B. 物质在变化中失去了电子,此物质中的某一元素化合价降低
C. 有电子转移的反应就是氧化还原反应
D. 有化合价升降的反应,不一定是氧化还原反应
C
3. 下列化学反应中电子转移的表示方法正确的是( )
B
4. 下列物质按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的是( )
A. O2、K、Cl2 B. Cl2、Al、H2
C. NO2、SO2、H2O D. HNO3、HCl、Fe2+
A
5. 已知:在同一反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。在一定条件下KClO3与I2按下式反应:2KClO3+I2===2KIO3+Cl2,下列判断不正确的是( )
A.该反应属于置换反应
B.还原剂为KClO3,氧化剂为I2
C.还原性:I2>Cl2
D.氧化性:KClO3>KIO3
B
感谢您的观看
“THANK YOU”
3.1.3 氧化还原反应
素养目标
宏观辨识与微观探析
能从宏观层面观察氯气与金属钠反应的实验现象,辨识反应前后元素化合价的变化;从微观角度探析钠原子与氯原子间电子转移的过程,理解化合价变化与电子转移的内在关联,精准把握氧化还原反应的本质 。
科学态度与社会责任
认识到氧化还原反应在生产、生活、环境保护和生命活动等方面的广泛应用,树立科学利用化学知识为社会发展服务的化学观念。
变化观念与平衡思想
形成对氧化还原反应的动态变化观念,认识到在化学反应中元素化合价改变、电子转移是氧化还原反应的核心特征;理解氧化还原反应中存在电子转移的平衡,明确氧化还原反应在物质转化、能量转化中的重要作用。
教学重难点
重点:
1. 氧化还原反应的判断依据(元素化合价是否变化 )
2. 氧化还原反应的本质(电子转移,包括电子的得失或偏移 )
3. 氧化剂、还原剂、氧化反应、还原反应等核心概念的界定与辨析
难点:
1. 从微观电子转移角度,解释化合价变化与氧化还原反应的因果关系
2. 熟练运用双线桥法表示电子转移的方向和数目,准确判断复杂氧化还
原反应中的氧化剂、还原剂 。
新知导入
早上切的苹果,现在变成褐色了; 铁制水龙头,没用几年就生锈。这些生活里常见的 “变色”“生锈” 现象,背后都藏着同一类反应 —— 氧化还原反应。今天,咱们就从氯气和钠的反应入手,揭开氧化还原反应的神秘面纱 !
1
氧化剂、还原剂
从电子转移角度认识氧化还原反应
以2Na+Cl2 === 2NaCl为例
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
钠原子失电子化合价升高
氯原子得电子化合价降低
氧化还原反应的本质和特征
(1)定义:有电子转移(电子得失或共用电子对偏移)的化学反应。
(2)本质(微观):反应过程中有电子转移。
(3)特征(宏观):元素化合价发生变化(升高和降低)
氧化剂与还原剂
(1)氧化剂:在氧化还原反应中得到电子(或电子对偏向)的反应物,所含元素化合价降低。
(2)还原剂:在氧化还原反应中失去电子(或电子对偏离)的反应物,所含元素化合价升高。
tips:氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
氧化还原反应中基本概念之间的关系
还原剂
还原性
氧化反应
氧化产物
氧化剂
氧化剂
还原反应
还原产物
具有
发生
生成
发生
生成
具有
失去电子,化合价升高,被氧化
得到电子,化合价降低,被还原
化合价升降总数相等
得失电子
总数相等
同时发生
常见的氧化剂
具有氧化性,易得电子,化合价降低
氧化剂
单质
化合物 氧化物
盐
含氧酸
无氧酸
O2、 O3、 Cl2、Br2
MnO2、CO2 、 NO2 、 H2O2、Na2O2
FeCl3、KMnO4 、KClO3 、 NaClO
HClO、HNO3、浓硫酸
HCl
常见的还原剂
具有还原性,易失电子,化合价升高
还原剂
单质
化合物 氧化物
盐
含氧酸
无氧酸
Na、Fe、 Al、Zn、 S 、 H2、C
CO、SO2
FeSO4、 Na2SO3 、 KI、Na2S、FeCl2
H2SO3
H2S、HCl
常见的既具有氧化性又具有还原性的物质
元素处于中间价态的物质既有氧化性又有还原性,遇到强氧化性的物质表现还原性,遇到强还原性的物质表现氧化性。
元素处于中间价态的物质
对应的氧化产物
对应的还原产物
主要表现的性质
Fe2+
Fe3+
Fe
SO2、SO32-、H2SO3
SO3、H2SO4
S
H2O2
O2
H2、OH-
还原性
还原性
氧化性
2
电子转移的方向和数目的表示方法
双线桥法
表示意义:反应前后同一元素原子或离子间的电子转移情况。
2Na+Cl2 2NaCl
得到2×e-,化合价降低,被还原
失去2×e-,化合价升高,被氧化
0
0
+1
-1
氧化剂+还原剂=== 还原产物+氧化产物
得到a×be-
失去c×de-
双线桥法的基本书写步骤
标价态
正确标明反应前后各元素的化合价
明确发生化合价变化的元素的化合价升降关系
连双线
一条线
另一条线
由氧化剂中化合价降低的元素指向还原
产物中的相应元素
由还原剂中化合价升高的元素指向氧化
产物中的相应元素
连双线
必须标出“得到”或“失去”电子的总数
即学即练
根据双线桥法的一般步骤,你能用双线桥表示以下反应的电子转移情况吗?
Fe2O3 + 3CO 2Fe + 3CO2
高温
0
+2
+4
+3
得2×3e-
失3×2e-
Zn + H2SO4 ZnSO4 + H2↑
+2
+1
0
0
失1×2e-
得2×e-
tips:箭头、箭尾必须对应化合价变化的同种元素的原子。
单线桥法
表示意义:反应前后不同元素原子或离子间的电子转移情况。
Fe+2HCl===FeCl2+H2↑
2 e-
2Na+Cl2 2NaCl
2 e-
还原剂 + 氧化剂 === 还原产物 + 氧化产物
n e-
单线桥法的基本书写步骤
标价态
正确标明反应前后各元素的化合价
明确发生化合价变化的元素的化合价升降关系
连单线
连双线
标出转移电子的总数
箭头指向氧化剂中化合价降低的元素,箭尾连接还原剂中化合价升高的元素
3
物质的氧化性、还原性强弱的判断
根据氧化还原反应方程式判断
氧化剂 + 还原剂 = 还原产物 + 氧化产物
失去电子,化合价升高,被氧化
得到电子,化合价降低,被还原
氧化性:氧化剂(反应物)>氧化产物(产物)
还原性:还原剂(反应物)>还原产物(产物)
剂强物弱
根据金属活动性顺序判断
(单质的还原性逐渐减弱)
K
K+
Ca
Ca2+
Na
Na+
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
Mg2+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+
(H+)
Cu2+
Hg2+
Ag+
(阳离子的氧化性逐渐增强)
单质易失电子,对应阳离子不易得电子(易失不易得)
tips:元素的化合价处于最高价态时具有氧化性,但不一定具有强氧化性,如Na+。
根据非金属活动性顺序判断
单质易得电子,对应阴离子不易失电子(易得不易失)
(单质的氧化性逐渐减弱)
(阴离子的还原性逐渐增强)
F2
F-
Cl2
Br2
I2
S
Cl-
Br-
I-
S2-
tips:元素的化合价处于最低价态时具有还原性,但不一定具有强还原性,如F-。
根据反应条件判断
当不同的氧化剂(或还原剂)与相同还原剂(或氧化剂)反应时
若氧化产物(或还原产物)中元素价态相同,则反应条件要求越低,氧化剂(或还原剂)的氧化性(或还原性)越强。
F2+H2 2HF
暗处
Cl2+H2 2HCl
点燃
氧化性:F2>Cl2
根据元素的价态判断
(1)不同种氧化剂将同种还原剂中相同元素氧化时,得到的对应氧化产物中相同元素的价态越高,氧化剂的氧化性越强。
2Fe+3Cl2 2FeCl3
点燃
Fe+S FeS
△
氧化性:Cl2>S
根据元素的价态判断
(2)一般地,对于同种元素,价态越高,其氧化性越强;价态越低其还原性越强。
S -2 0 +4 +6
从低价到高价,氧化性渐增,还原性渐减
从高价到低价,氧化性渐减,还原性渐增
4
随堂练习
1. 已知:
①
②
③
请依据上述反应判断还原性由强到弱的顺序是( )
A. B.
C. D.
A
2. 下列有关氧化还原反应的叙述正确的是( )
A. 元素化合价升高的反应是还原反应
B. 物质在变化中失去了电子,此物质中的某一元素化合价降低
C. 有电子转移的反应就是氧化还原反应
D. 有化合价升降的反应,不一定是氧化还原反应
C
3. 下列化学反应中电子转移的表示方法正确的是( )
B
4. 下列物质按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的是( )
A. O2、K、Cl2 B. Cl2、Al、H2
C. NO2、SO2、H2O D. HNO3、HCl、Fe2+
A
5. 已知:在同一反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。在一定条件下KClO3与I2按下式反应:2KClO3+I2===2KIO3+Cl2,下列判断不正确的是( )
A.该反应属于置换反应
B.还原剂为KClO3,氧化剂为I2
C.还原性:I2>Cl2
D.氧化性:KClO3>KIO3
B
感谢您的观看
“THANK YOU”
