3.4.4离子反应的应用(三)(共24张PPT)_高中化学鲁科版(2019)选择性必修一
文档属性
| 名称 | 3.4.4离子反应的应用(三)(共24张PPT)_高中化学鲁科版(2019)选择性必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 863.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 18:48:05 | ||
图片预览






文档简介
(共24张PPT)
物质在水溶液中的行为
第三章
3.4.4 离子反应的应用(三)
核心素养目标
1. 宏观辨识与微观探析
能通过分析物质制备、纯化及生活中离子反应的宏观过程和现象,辨识离子反应的应用场景;从微观角度理解离子反应在物质制备、纯化中粒子的转化及对物质组成的影响,明确宏观应用与微观离子行为的联系。
2. 变化观念与平衡思想
认识离子反应在物质制备、纯化及生活应用中的动态变化;能运用平衡移动原理分析离子反应的条件控制,理解离子反应的调控对物质制备和纯化的重要性,形成变化观念,掌握利用离子反应解决实际问题的方法。
3. 科学态度与社会责任
通过探究离子反应在物质制备、纯化及生活中的应用,养成严谨求实、基于证据推理的科学态度。
学习重难点
重点:
1.离子反应在物质制备、纯化中的应用原理及相关离子方程式书写;
2.生活中离子反应的分析,理解其对物质组成和性质的改变。
难点:
1.复杂工业流程(如海水提二氧化碳 )中离子反应的分析及电极反应、离子方程式的推导;
2.离子反应在物质制备和纯化中条件优化(如离子交换膜选择、除杂顺序 )的理解,构建离子反应与实际应用深度融合的知识体系。
课前导入
工业上大量的烧碱是怎么生产出来的? 这背后涉及怎样的化学反应?
硬水为什么会产生水垢? 怎样通过化学反应软化硬水?
物质的制备与纯化
PART 01
物质的制备
离子反应可以用于制备物质。氯碱工业通过电解饱和食盐水生产烧碱和氯气,利用的就是在通电条件下食盐水中发生的离子反应。
2Cl-+2H2O===Cl2↑+H2↑+2OH-
电解
离子反应还可以制备其他的的酸、碱、盐等。如:
(1)制Cu(OH)2:
Cu2+ + 2OH- === Cu(OH)2↓
(2)制CO2:
CaCO3 + 2H+ === Ca2+ + H2O + CO2↑
物质的纯化
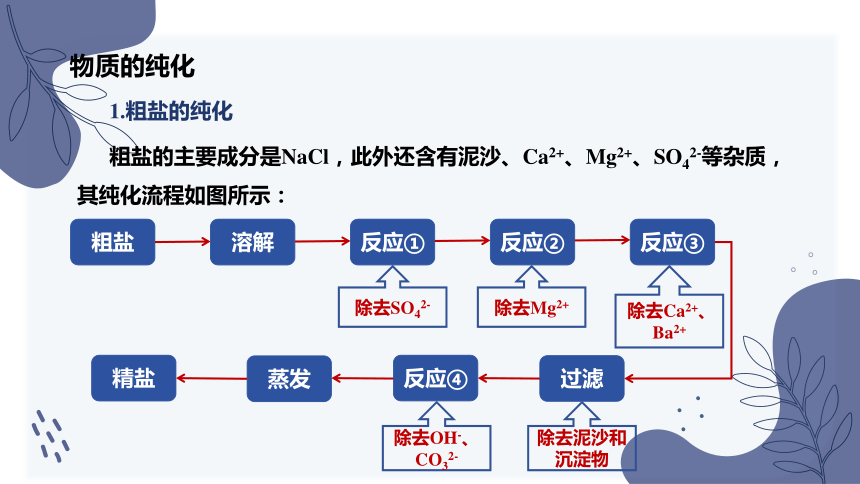
1.粗盐的纯化
粗盐的主要成分是NaCl,此外还含有泥沙、Ca2+、Mg2+、SO42-等杂质,其纯化流程如图所示:
粗盐
溶解
反应①
反应②
反应③
过滤
反应④
蒸发
精盐
除去SO42-
除去Mg2+
除去Ca2+、Ba2+
除去OH-、CO32-
除去泥沙和沉淀物
物质的纯化
反应① :过量BaCl2溶液除去SO42-
Ba2+ + SO42- === BaSO4 ↓
反应② :过量NaOH溶液除去Mg2+
Mg2+ + 2OH- === Mg(OH)2↓
反应③ :过量Na2CO3溶液除去Ca2+、Ba2+
Ba2+ + Ca2+ + 2CO32- === CaCO3↓ + BaCO3↓
反应④ :过量盐酸除去OH-、CO32-
H+ + OH- === H2O
CO32- + 2H+ === H2O + CO2↑
物质的纯化
2.除去污水中的重金属离子
可利用沉淀剂通过离子反应使污水中的重金属离子生成沉淀,再进行过滤,以达到净水的目的。
【交流·研讨】
海水中含有 HCO3- 等离子,呈弱碱性。海洋表层水的 pH 曾为 8.3,当空气中过量的二氧化碳进入海洋中时,海水就会酸化。
研究表明,由于人类活动的影响,过量的二氧化碳排放已将海洋表层水的 pH 降低了 0.2。海水酸性的增强将使多种海洋生物乃至生态系统面临巨大威胁,因而引起了全世界相关领域研究人员的高度重视。
物质的纯化
有研究者提出,用如图所示方法从海水中提取二氧化碳,可以降低环境中温室气体二氧化碳的含量。
从海水中提取二氧化碳装置示意图
物质的纯化
(1)请分析用上述方法从海水中提取二氧化碳的原理,写出相关的电极反应和离子方程式。
反应室 电极反应式或离子方程式
a室(阳极室)
c室(阴极室)
b室(提取CO2)
2H2O - 4e- === O2 ↑+ 4H+
2H2O + 2e- === H2 ↑+ 2OH-
a室产生的H+向b室移动发生反应:
HCO3- + H+ === H2O + CO2↑
物质的纯化
(2) 若用图所示装置产生的物质处理 b 室排出的海水,可获得可排回大海的合格海水,请分析采用的是什么处理方法。
b室中的Na+向c室移动,c室中c(NaOH)增大,用c室产生的NaOH溶液调节b室排出的海水,即可获得可排回大海的合格海水。
Na+→
NaOH
生活中常见的离子反应
PART 02
生活中常见的离子反应
1.“胃舒平”
主要成分为Al(OH)3,治疗胃酸过多。
Al(OH)3 + 3H+ === Al3+ + 3H2O
生活中常见的离子反应
2.硬水的形成
含Ca2+、Mg2+较多的水
CaCO3 + CO2 + H2O === Ca2+ + 2HCO3-
MgCO3 + CO2 + H2O === Mg2+ + 2HCO3-
生活中常见的离子反应
3.硬水的软化
降低硬水的Ca2+、Mg2+的浓度
(1)加热法
Ca2+ + 2HCO3- === CaCO3 ↓+ CO2 ↑+ H2O
△
Mg2+ + 2HCO3- === MgCO3 ↓+ CO2 ↑+ H2O
△
生活中常见的离子反应
(2)石灰—纯碱法
硬水
溶解
足量Ca(OH)2
足量Na2CO3
加盐酸调节至pH=7
过滤
Ca2+ + OH- + HCO3- === CaCO3↓ + H2O
2Ca2+ + Mg2+ + 4OH- + 2HCO3- === 2CaCO3↓ + Mg(OH)2↓ + 2H2O
Ca2+ + CO32- === CaCO3↓
H+ + OH- === H2O
CO32- + 2H+ === H2O + CO2↑
归纳总结
物质的制备
物质的纯化
离
子
反
应
的
应
用
生活中的应用
将离子转化为目标物质进行物质的制备
利用离子反应将离子转化为沉淀或气体除去
用离子反应揭示变化的本质
随堂测试
1.下列离子方程式与所给事实不相符的是( )
A.Cl2制备84消毒液(主要成分是NaClO):Cl2+2OH-===Cl-+ClO-+H2O
B.食醋去除水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
C.利用覆铜板制作印刷电路板:2Fe3++Cu===2Fe2++Cu2+
D.Na2S去除废水中的Hg2+:Hg2++S2-===HgS↓
B
随堂测试
2.下列过程中的化学反应,相应的离子方程式正确的是( )
C.硫酸铝溶液中滴加少量氢氧化钾溶液:Al3++4OH-===[Al(OH)4]-
D.氯化铜溶液中通入硫化氢:Cu2++ S2-===CuS↓
A
随堂测试
3.下列反应的离子方程式正确的是( )
D
随堂测试
4.下列过程中的化学反应,相应的离子方程式不正确的是( )
A.“84消毒液”与洁厕灵(主要成分为浓盐酸)混用:ClO-+Cl-+2H+
===Cl2↑+H2O
D.将闪锌矿浸没在足量的蓝矾溶液:ZnS+Cu2+===CuS+Zn2+
B
随堂测试
5.下列有关电极方程式或离子方程式错误的是( )
A.碱性锌锰电池的正极反应:MnO2+H2O+e-===MnO(OH)+OH-
B.铅蓄电池充电时的阳极反应:Pb2++2H2O-2e-===PbO2+4H+
C.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-===
KFe[Fe(CN)6]↓
D.TiCl4加入水中:TiCl4+(x+2)H2O===TiO2·xH2O↓+4H++4Cl-
B
谢谢观看
物质在水溶液中的行为
第三章
3.4.4 离子反应的应用(三)
核心素养目标
1. 宏观辨识与微观探析
能通过分析物质制备、纯化及生活中离子反应的宏观过程和现象,辨识离子反应的应用场景;从微观角度理解离子反应在物质制备、纯化中粒子的转化及对物质组成的影响,明确宏观应用与微观离子行为的联系。
2. 变化观念与平衡思想
认识离子反应在物质制备、纯化及生活应用中的动态变化;能运用平衡移动原理分析离子反应的条件控制,理解离子反应的调控对物质制备和纯化的重要性,形成变化观念,掌握利用离子反应解决实际问题的方法。
3. 科学态度与社会责任
通过探究离子反应在物质制备、纯化及生活中的应用,养成严谨求实、基于证据推理的科学态度。
学习重难点
重点:
1.离子反应在物质制备、纯化中的应用原理及相关离子方程式书写;
2.生活中离子反应的分析,理解其对物质组成和性质的改变。
难点:
1.复杂工业流程(如海水提二氧化碳 )中离子反应的分析及电极反应、离子方程式的推导;
2.离子反应在物质制备和纯化中条件优化(如离子交换膜选择、除杂顺序 )的理解,构建离子反应与实际应用深度融合的知识体系。
课前导入
工业上大量的烧碱是怎么生产出来的? 这背后涉及怎样的化学反应?
硬水为什么会产生水垢? 怎样通过化学反应软化硬水?
物质的制备与纯化
PART 01
物质的制备
离子反应可以用于制备物质。氯碱工业通过电解饱和食盐水生产烧碱和氯气,利用的就是在通电条件下食盐水中发生的离子反应。
2Cl-+2H2O===Cl2↑+H2↑+2OH-
电解
离子反应还可以制备其他的的酸、碱、盐等。如:
(1)制Cu(OH)2:
Cu2+ + 2OH- === Cu(OH)2↓
(2)制CO2:
CaCO3 + 2H+ === Ca2+ + H2O + CO2↑
物质的纯化
1.粗盐的纯化
粗盐的主要成分是NaCl,此外还含有泥沙、Ca2+、Mg2+、SO42-等杂质,其纯化流程如图所示:
粗盐
溶解
反应①
反应②
反应③
过滤
反应④
蒸发
精盐
除去SO42-
除去Mg2+
除去Ca2+、Ba2+
除去OH-、CO32-
除去泥沙和沉淀物
物质的纯化
反应① :过量BaCl2溶液除去SO42-
Ba2+ + SO42- === BaSO4 ↓
反应② :过量NaOH溶液除去Mg2+
Mg2+ + 2OH- === Mg(OH)2↓
反应③ :过量Na2CO3溶液除去Ca2+、Ba2+
Ba2+ + Ca2+ + 2CO32- === CaCO3↓ + BaCO3↓
反应④ :过量盐酸除去OH-、CO32-
H+ + OH- === H2O
CO32- + 2H+ === H2O + CO2↑
物质的纯化
2.除去污水中的重金属离子
可利用沉淀剂通过离子反应使污水中的重金属离子生成沉淀,再进行过滤,以达到净水的目的。
【交流·研讨】
海水中含有 HCO3- 等离子,呈弱碱性。海洋表层水的 pH 曾为 8.3,当空气中过量的二氧化碳进入海洋中时,海水就会酸化。
研究表明,由于人类活动的影响,过量的二氧化碳排放已将海洋表层水的 pH 降低了 0.2。海水酸性的增强将使多种海洋生物乃至生态系统面临巨大威胁,因而引起了全世界相关领域研究人员的高度重视。
物质的纯化
有研究者提出,用如图所示方法从海水中提取二氧化碳,可以降低环境中温室气体二氧化碳的含量。
从海水中提取二氧化碳装置示意图
物质的纯化
(1)请分析用上述方法从海水中提取二氧化碳的原理,写出相关的电极反应和离子方程式。
反应室 电极反应式或离子方程式
a室(阳极室)
c室(阴极室)
b室(提取CO2)
2H2O - 4e- === O2 ↑+ 4H+
2H2O + 2e- === H2 ↑+ 2OH-
a室产生的H+向b室移动发生反应:
HCO3- + H+ === H2O + CO2↑
物质的纯化
(2) 若用图所示装置产生的物质处理 b 室排出的海水,可获得可排回大海的合格海水,请分析采用的是什么处理方法。
b室中的Na+向c室移动,c室中c(NaOH)增大,用c室产生的NaOH溶液调节b室排出的海水,即可获得可排回大海的合格海水。
Na+→
NaOH
生活中常见的离子反应
PART 02
生活中常见的离子反应
1.“胃舒平”
主要成分为Al(OH)3,治疗胃酸过多。
Al(OH)3 + 3H+ === Al3+ + 3H2O
生活中常见的离子反应
2.硬水的形成
含Ca2+、Mg2+较多的水
CaCO3 + CO2 + H2O === Ca2+ + 2HCO3-
MgCO3 + CO2 + H2O === Mg2+ + 2HCO3-
生活中常见的离子反应
3.硬水的软化
降低硬水的Ca2+、Mg2+的浓度
(1)加热法
Ca2+ + 2HCO3- === CaCO3 ↓+ CO2 ↑+ H2O
△
Mg2+ + 2HCO3- === MgCO3 ↓+ CO2 ↑+ H2O
△
生活中常见的离子反应
(2)石灰—纯碱法
硬水
溶解
足量Ca(OH)2
足量Na2CO3
加盐酸调节至pH=7
过滤
Ca2+ + OH- + HCO3- === CaCO3↓ + H2O
2Ca2+ + Mg2+ + 4OH- + 2HCO3- === 2CaCO3↓ + Mg(OH)2↓ + 2H2O
Ca2+ + CO32- === CaCO3↓
H+ + OH- === H2O
CO32- + 2H+ === H2O + CO2↑
归纳总结
物质的制备
物质的纯化
离
子
反
应
的
应
用
生活中的应用
将离子转化为目标物质进行物质的制备
利用离子反应将离子转化为沉淀或气体除去
用离子反应揭示变化的本质
随堂测试
1.下列离子方程式与所给事实不相符的是( )
A.Cl2制备84消毒液(主要成分是NaClO):Cl2+2OH-===Cl-+ClO-+H2O
B.食醋去除水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
C.利用覆铜板制作印刷电路板:2Fe3++Cu===2Fe2++Cu2+
D.Na2S去除废水中的Hg2+:Hg2++S2-===HgS↓
B
随堂测试
2.下列过程中的化学反应,相应的离子方程式正确的是( )
C.硫酸铝溶液中滴加少量氢氧化钾溶液:Al3++4OH-===[Al(OH)4]-
D.氯化铜溶液中通入硫化氢:Cu2++ S2-===CuS↓
A
随堂测试
3.下列反应的离子方程式正确的是( )
D
随堂测试
4.下列过程中的化学反应,相应的离子方程式不正确的是( )
A.“84消毒液”与洁厕灵(主要成分为浓盐酸)混用:ClO-+Cl-+2H+
===Cl2↑+H2O
D.将闪锌矿浸没在足量的蓝矾溶液:ZnS+Cu2+===CuS+Zn2+
B
随堂测试
5.下列有关电极方程式或离子方程式错误的是( )
A.碱性锌锰电池的正极反应:MnO2+H2O+e-===MnO(OH)+OH-
B.铅蓄电池充电时的阳极反应:Pb2++2H2O-2e-===PbO2+4H+
C.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-===
KFe[Fe(CN)6]↓
D.TiCl4加入水中:TiCl4+(x+2)H2O===TiO2·xH2O↓+4H++4Cl-
B
谢谢观看
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
