3.1.2水溶液的酸碱性与pH 课件 (共32张PPT)_高中化学鲁科版(2019)选择性必修一
文档属性
| 名称 | 3.1.2水溶液的酸碱性与pH 课件 (共32张PPT)_高中化学鲁科版(2019)选择性必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 18:49:39 | ||
图片预览









文档简介
(共32张PPT)
物质在水溶液中的行为
第三章
3.1.2 水溶液的酸碱性与pH
核心素养目标
1. 宏观辨识与微观探析
能通过溶液酸碱性的宏观表现,辨识溶液酸碱性与 c平(H+)、c平(OH-)微观浓度关系,理解pH与微观粒子浓度的关联,从微观角度解释溶液酸碱性本质。
2. 证据推理与模型认知
认识水的电离平衡受条件影响,理解溶液酸碱性、pH 与电离平衡移动的关系,能用变化观念和平衡思想分析溶液中粒子浓度变化、pH计算等问题。
3. 科学探究与创新意识
通过探究溶液酸碱性及pH相关知识,养成严谨求实的科学态度;认识溶液酸碱性知识在生活、生产、健康等方面的应用价值,增强社会责任意识。
学习重难点
重点:
1.水的离子积Kw应用,溶液酸碱性与c平(H+)、c平(OH-)及pH的关系,pH的简单计算。
难点:
1.理解溶液酸碱性本质是c平(H+)和c平(OH-)相对大小,灵活运用Kw进行pH相关计算,把握外界条件对溶液酸碱性、pH影响的平衡移动分析。
课前导入
很多矿泉水瓶上都会标注 “弱碱性”,那大家有没有想过,同样是水,为什么会呈现弱碱性呢?这个 “弱碱性” 又该如何用科学的方式去衡量?
其实,这背后的奥秘就藏在我们今天要学习的溶液的酸碱性与 pH 知识中。
马赛克
马赛克
溶液的pH
PART 01
溶液的酸碱性c(H+)和c(OH-)的相对大小的关系
由于水的电离,在水溶液中始终存在着 H+ 和 OH-,而且稀水溶液中 c平(H+) 和 c平(OH-)的乘积也等于水的离子积。那么,水溶液中 H+、OH- 的浓度与溶液的酸碱性有什么关系呢?水溶液的酸碱度又如何量度呢?
利用水的离子积可以计算溶液中 H+ 或 OH- 的浓度。
例如,室温下测得某酸溶液中的c平(H+) 为 1.0×10-5 mol·L-1,根据
Kw =
c平(H+)·c平(OH-)
=1×10-14 mol2·L-2
可得该酸溶液中的 c平(OH-) 为:
c平(OH-)= = =1.0×10-9 mol·L-1
c平(H+)
Kw
1.0×10-5 mol·L-1
1.0×10-14 mol2·L-2
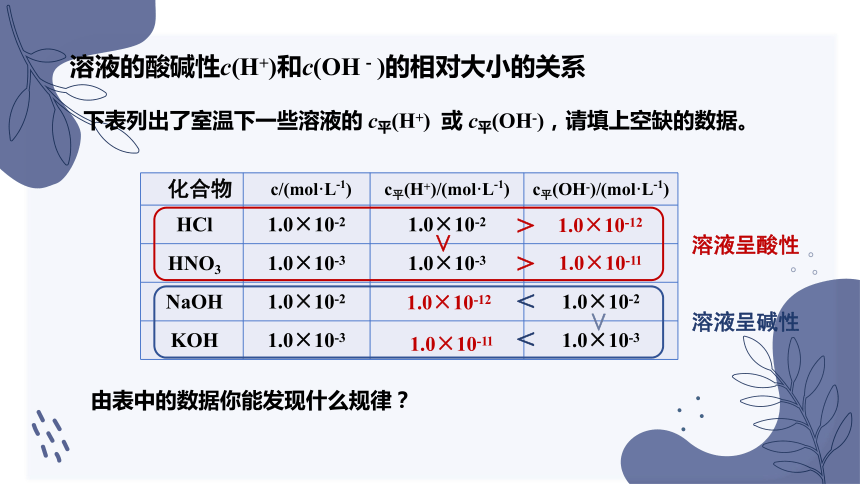
下表列出了室温下一些溶液的 c平(H+) 或 c平(OH-),请填上空缺的数据。
化合物 c/(mol·L-1) c平(H+)/(mol·L-1) c平(OH-)/(mol·L-1)
HCl 1.0×10-2 1.0×10-2
HNO3 1.0×10-3 1.0×10-3
NaOH 1.0×10-2 1.0×10-2
KOH 1.0×10-3 1.0×10-3
1.0×10-12
1.0×10-11
1.0×10-12
1.0×10-11
>
由表中的数据你能发现什么规律?
>
<
溶液呈酸性
<
溶液呈碱性
>
<
溶液的酸碱性c(H+)和c(OH-)的相对大小的关系
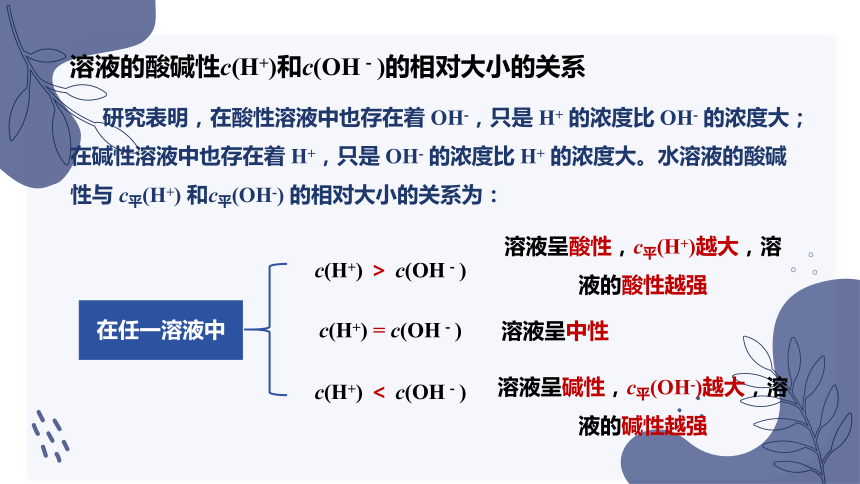
研究表明,在酸性溶液中也存在着 OH-,只是 H+ 的浓度比 OH- 的浓度大;在碱性溶液中也存在着 H+,只是 OH- 的浓度比 H+ 的浓度大。水溶液的酸碱性与 c平(H+) 和c平(OH-) 的相对大小的关系为:
溶液的酸碱性c(H+)和c(OH-)的相对大小的关系
在任一溶液中
c(H+) > c(OH-)
c(H+) = c(OH-)
c(H+) < c(OH-)
溶液呈酸性,c平(H+)越大,溶液的酸性越强
溶液呈中性
溶液呈碱性,c平(OH-)越大,溶液的碱性越强
概念:pH是水溶液中氢离子浓度的负对数。
溶液的pH
表达式:
pH= -lg c平(H+)
适用范围:
用pH表示溶液的酸碱度时,pH的范围一般在0~14之间,即适用于1×10-14 mol/L≤c平(H+)或c平(OH-)≤1 mol/L的电解质稀溶液。
对于c平(H+)>1 mol/L的酸性溶液或c平(OH-)>1 mol/L的碱性溶液,直接用c平(H+)或c平(OH-)表示溶液的酸碱度。
溶液的pH
c(H+)、pH与溶液酸碱性的关系(25℃):
酸性增强
碱性增强
中性
溶液的pH与溶液酸碱性的对应关系
规律:pH越小,c平(H+)越大,溶液的酸性越强;pH越大,c平(OH-)越大,溶液的碱性越强。
溶液酸碱性判断的注意事项
1.任何情况下,均可根据溶液中c平(H+)和c平(OH-)的相对大小来判断溶液的酸碱性,不受温度影响。
2.在分析 pH、c平(H+)与溶液的酸碱性的关系时,要注意溶液的温度是否为常温。只有25 ℃时才能利用pH与7的大小关系或c平(H+)与1×10-7mol/L的相对大小来判断溶液的酸碱性。如pH=7的溶液不一定是中性溶液,只有在常温下,pH=7的溶液才是中性溶液。
3.常温下,pH=0的溶液不是酸性最强的溶液,pH=14的溶液也不是碱性最强的溶液。
溶液pH的计算
PART 02
溶液pH的计算
(2)酸性溶液,先算c平(H+),pH= - lgc(H+),
碱性溶液,先算c平(OH-), pOH= - lgc(OH-), pH= 14 – pOH(常温)
(3)在加法运算中,相差100倍以上(含100)可忽略小的数!
(4) lg2≈0.3;lg3≈0.5;lg5≈0.7。
1.pH计算的解题思路
(1)pH=﹣lgc(H+), c平(H+)·c平(OH-) = Kw
溶液pH的计算
例:室温下,测得NaOH溶液的浓度为1.0×10-3mol·L-1,计算该溶液的pH。
解:
NaOH Na+ + OH-
c/(mol·L-1) 1.0×10-3 1.0×10-3
因为 KW = c平(H+)·c平(OH-)
所以 c平(H+)=
pH = -lgc平(H+)= -lg = -lg
= 11.0
c平(OH-)
KW
c平(OH-)
KW
1.0×10-14
1.0×10-3
溶液pH的计算
2.单一溶液pH的计算
(2)若为碱性,先求c平(OH-) 后,由Kw求c平(H+),再求pH
(1)若为酸性,先求出c平(H+)后,由pH =-lg c(H+)求pH
例如:强酸(HnA)溶液的浓度为c mol/L,则c平(H+)=nc mol/L,pH=
-lg c(H+)=-lg (nc)。
例如:25 ℃,强碱[B(OH)n]溶液的浓度为c mol/L,c平(OH-)=nc mol/L,则 c平(H+)=10-14/nc mol/L,pH=-lg c(H+)=14+lg (nc)。
溶液pH的计算
3.混合溶液pH的计算
(1)两种强酸混合:直接求出c混(H+),再据此求pH。
关键:
1、抓住氢离子进行计算!
2、当相加、减的两个量相差100倍以上时,小的可忽略
例1:计算pH=3的盐酸与pH=5的硫酸等体积混合后的pH。
c平(H+) = mol/L =5×10-4 mol/L
V10-3+V10-5
2V
pH=-lgc(H+)=-lg(5×10-4)=3.3
【结论】两种pH不同的强酸等体积混合时ΔpH≥2时,pH混=pH小+0.3
溶液pH的计算
(2)两种强碱混合:先求出c混(OH-),再据Kw求出c混(H+),最后求pH。
关键:抓住OH- 进行计算!再转化为H+
例2:计算pH=10与pH=12的NaOH溶液等体积混合后的pH。
c平(OH-) = mol/L =5×10-3 mol/L
10-4 V+10-2V
2V
pH=-lgc(H+) =- lg(2×10-12)=11.7
【结论】两种pH不同的强碱等体积混合时ΔpH≥2 时,pH混=pH大- 0.3
溶液pH的计算
(3)强酸强碱混合:“谁过量先求谁”
pH=7(常温)
① 当n(H+)=n(OH-)时,恰好中和
② 当n(H+)>n(OH-)时,酸过量
③ 当n(H+)<n(OH-)时,碱过量
溶液pH的计算
4.强酸、强碱溶液等体积混合后,pH的变化规律
(1) pH1+pH2 = 14
(2) pH1+pH2 > 14
(3) pH1+pH2 < 14
混合后为中性 pH=7
混合后为碱性 pH>7
混合后为酸性 pH<7
5.一强一弱等体积混合且pH之和等于14
(1)若为强酸、弱碱溶液,则混合后溶液显 性。
(2)若为弱酸、强碱溶液,则混合后溶液显 性。
碱
酸
溶液pH的计算
(1) 若为一元强酸(a mol·L-1)、一元强碱(b mol·L-1)溶液等体积混合后呈中性,则混合前a = b。
(2) 若为一元强酸(a mol·L-1)、一元弱碱(b mol·L-1)溶液等体积混合后呈中性,则混合前a < b。
(3)若为一元弱酸(a mol·L-1)、一元强碱(b mol·L-1)溶液等体积混合后呈中性,则混合前a > b。
6.一元酸和一元碱溶液混合呈中性
规律:谁弱谁过量,谁弱显谁性。
原因:酸和碱已电离出的H+与OH-恰好中和,谁弱谁的H+或OH-有储备(即物质过量),还能继续电离。
溶液pH的测定方法
PART 02
酸碱指示剂法
该方法只能确定pH的范围。常用的酸碱指示剂有甲基橙、石蕊和酚酞。
几种常用指示剂的变色范围和颜色变化如图所示:
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
pH试纸法
1.pH试纸的种类
广泛pH试纸:其pH范围是 (最常用),可以识别的pH差约为 。
精密pH试纸:可判别0.2或0.3的pH差值。
专用pH试纸:用于酸性、中性或碱性溶液。
1~14
1
2.pH试纸的使用方法:
取一小块试纸放在干净的玻璃板上,用干净的玻璃棒蘸取溶液点在试纸的中央,待显色后,与标准的比色卡对比,得出溶液的pH。
3. 使用pH试纸的注意事项:
不能用湿的玻璃棒蘸取待测液,也不能将 pH 试纸先用水润湿,否则会将待测液稀释,可能导致所测定的pH 不准确,使测定的酸性溶液的 pH 变大,碱性溶液的 pH 变小,但中性溶液不受影响;
pH试纸法
pH 试纸不能直接伸入待测液中,否则会污染待测液;具有漂白性或强氧化性的溶液不能用酸碱指示剂检验其酸碱性,也不能用 pH 试纸测定其 pH。
pH试纸法
酸度计法
酸度计,又叫pH计,可用来精密测量溶液的pH,其量程为0~14。
人们根据生产与生活的需要,研制了多种类型的pH计,广泛应用于工业、农业、科研和环保等领域
pH计
随堂测试
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)升高温度,水的电离平衡向电离方向移动,c(H+)增大,溶液呈酸性。( )
(2)任何温度下,利用溶液中c平(H+)和c平(OH-)的相对大小判断溶液的酸碱性。( )
(3)25 ℃时pH的范围通常是0~14。( )
(4)4 ℃时,纯水的pH=7。( )
(5)1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0。( )
(6)100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性。( )
(7)pH=4.5的番茄汁中c平(H+)是pH=6.5的牛奶中c平(H+)的100倍。( )
随堂测试
2.下列溶液一定显酸性的是( )
A.溶液中c平(OH-)>c平(H+)
B.滴加紫色石蕊溶液后变红色的溶液
C.溶液中c平(H+)=10-6 mol·L-1
D.溶液中水电离的c水(H+)=10-9 mol·L-1
B
随堂测试
3.关于溶液的酸性及酸性强弱的说法正确的是( )
A.只要溶液中有H+,溶液就显酸性
B.H+浓度大于OH-浓度,溶液一定显酸性
C.H+浓度增大,溶液的酸性一定增强
D.强酸溶液的酸性一定比弱酸溶液的酸性强
B
随堂测试
4.在室温下,由水电离产生的H+浓度为1×10-13 mol·L-1的溶液中,一定能大量共存的离子组是( )
A.③⑤ B.①③ C.③④ D.②⑤
A
随堂测试
5.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断正确的是( )
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
B
谢谢观看
物质在水溶液中的行为
第三章
3.1.2 水溶液的酸碱性与pH
核心素养目标
1. 宏观辨识与微观探析
能通过溶液酸碱性的宏观表现,辨识溶液酸碱性与 c平(H+)、c平(OH-)微观浓度关系,理解pH与微观粒子浓度的关联,从微观角度解释溶液酸碱性本质。
2. 证据推理与模型认知
认识水的电离平衡受条件影响,理解溶液酸碱性、pH 与电离平衡移动的关系,能用变化观念和平衡思想分析溶液中粒子浓度变化、pH计算等问题。
3. 科学探究与创新意识
通过探究溶液酸碱性及pH相关知识,养成严谨求实的科学态度;认识溶液酸碱性知识在生活、生产、健康等方面的应用价值,增强社会责任意识。
学习重难点
重点:
1.水的离子积Kw应用,溶液酸碱性与c平(H+)、c平(OH-)及pH的关系,pH的简单计算。
难点:
1.理解溶液酸碱性本质是c平(H+)和c平(OH-)相对大小,灵活运用Kw进行pH相关计算,把握外界条件对溶液酸碱性、pH影响的平衡移动分析。
课前导入
很多矿泉水瓶上都会标注 “弱碱性”,那大家有没有想过,同样是水,为什么会呈现弱碱性呢?这个 “弱碱性” 又该如何用科学的方式去衡量?
其实,这背后的奥秘就藏在我们今天要学习的溶液的酸碱性与 pH 知识中。
马赛克
马赛克
溶液的pH
PART 01
溶液的酸碱性c(H+)和c(OH-)的相对大小的关系
由于水的电离,在水溶液中始终存在着 H+ 和 OH-,而且稀水溶液中 c平(H+) 和 c平(OH-)的乘积也等于水的离子积。那么,水溶液中 H+、OH- 的浓度与溶液的酸碱性有什么关系呢?水溶液的酸碱度又如何量度呢?
利用水的离子积可以计算溶液中 H+ 或 OH- 的浓度。
例如,室温下测得某酸溶液中的c平(H+) 为 1.0×10-5 mol·L-1,根据
Kw =
c平(H+)·c平(OH-)
=1×10-14 mol2·L-2
可得该酸溶液中的 c平(OH-) 为:
c平(OH-)= = =1.0×10-9 mol·L-1
c平(H+)
Kw
1.0×10-5 mol·L-1
1.0×10-14 mol2·L-2
下表列出了室温下一些溶液的 c平(H+) 或 c平(OH-),请填上空缺的数据。
化合物 c/(mol·L-1) c平(H+)/(mol·L-1) c平(OH-)/(mol·L-1)
HCl 1.0×10-2 1.0×10-2
HNO3 1.0×10-3 1.0×10-3
NaOH 1.0×10-2 1.0×10-2
KOH 1.0×10-3 1.0×10-3
1.0×10-12
1.0×10-11
1.0×10-12
1.0×10-11
>
由表中的数据你能发现什么规律?
>
<
溶液呈酸性
<
溶液呈碱性
>
<
溶液的酸碱性c(H+)和c(OH-)的相对大小的关系
研究表明,在酸性溶液中也存在着 OH-,只是 H+ 的浓度比 OH- 的浓度大;在碱性溶液中也存在着 H+,只是 OH- 的浓度比 H+ 的浓度大。水溶液的酸碱性与 c平(H+) 和c平(OH-) 的相对大小的关系为:
溶液的酸碱性c(H+)和c(OH-)的相对大小的关系
在任一溶液中
c(H+) > c(OH-)
c(H+) = c(OH-)
c(H+) < c(OH-)
溶液呈酸性,c平(H+)越大,溶液的酸性越强
溶液呈中性
溶液呈碱性,c平(OH-)越大,溶液的碱性越强
概念:pH是水溶液中氢离子浓度的负对数。
溶液的pH
表达式:
pH= -lg c平(H+)
适用范围:
用pH表示溶液的酸碱度时,pH的范围一般在0~14之间,即适用于1×10-14 mol/L≤c平(H+)或c平(OH-)≤1 mol/L的电解质稀溶液。
对于c平(H+)>1 mol/L的酸性溶液或c平(OH-)>1 mol/L的碱性溶液,直接用c平(H+)或c平(OH-)表示溶液的酸碱度。
溶液的pH
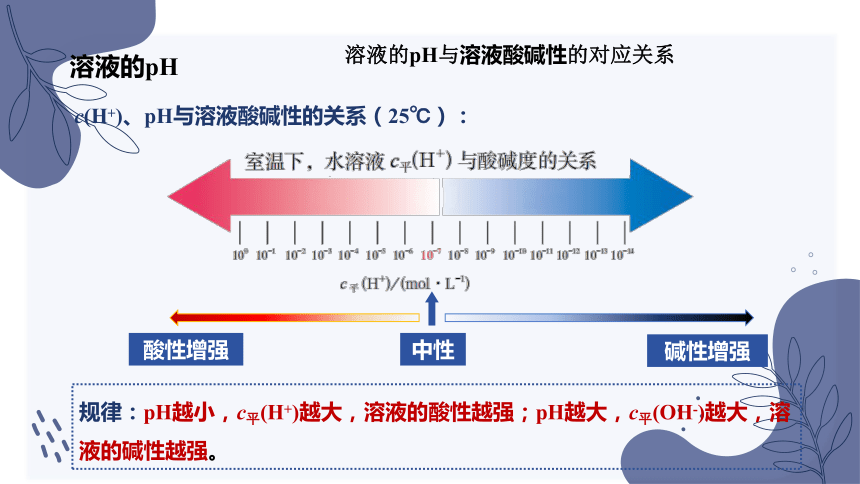
c(H+)、pH与溶液酸碱性的关系(25℃):
酸性增强
碱性增强
中性
溶液的pH与溶液酸碱性的对应关系
规律:pH越小,c平(H+)越大,溶液的酸性越强;pH越大,c平(OH-)越大,溶液的碱性越强。
溶液酸碱性判断的注意事项
1.任何情况下,均可根据溶液中c平(H+)和c平(OH-)的相对大小来判断溶液的酸碱性,不受温度影响。
2.在分析 pH、c平(H+)与溶液的酸碱性的关系时,要注意溶液的温度是否为常温。只有25 ℃时才能利用pH与7的大小关系或c平(H+)与1×10-7mol/L的相对大小来判断溶液的酸碱性。如pH=7的溶液不一定是中性溶液,只有在常温下,pH=7的溶液才是中性溶液。
3.常温下,pH=0的溶液不是酸性最强的溶液,pH=14的溶液也不是碱性最强的溶液。
溶液pH的计算
PART 02
溶液pH的计算
(2)酸性溶液,先算c平(H+),pH= - lgc(H+),
碱性溶液,先算c平(OH-), pOH= - lgc(OH-), pH= 14 – pOH(常温)
(3)在加法运算中,相差100倍以上(含100)可忽略小的数!
(4) lg2≈0.3;lg3≈0.5;lg5≈0.7。
1.pH计算的解题思路
(1)pH=﹣lgc(H+), c平(H+)·c平(OH-) = Kw
溶液pH的计算
例:室温下,测得NaOH溶液的浓度为1.0×10-3mol·L-1,计算该溶液的pH。
解:
NaOH Na+ + OH-
c/(mol·L-1) 1.0×10-3 1.0×10-3
因为 KW = c平(H+)·c平(OH-)
所以 c平(H+)=
pH = -lgc平(H+)= -lg = -lg
= 11.0
c平(OH-)
KW
c平(OH-)
KW
1.0×10-14
1.0×10-3
溶液pH的计算
2.单一溶液pH的计算
(2)若为碱性,先求c平(OH-) 后,由Kw求c平(H+),再求pH
(1)若为酸性,先求出c平(H+)后,由pH =-lg c(H+)求pH
例如:强酸(HnA)溶液的浓度为c mol/L,则c平(H+)=nc mol/L,pH=
-lg c(H+)=-lg (nc)。
例如:25 ℃,强碱[B(OH)n]溶液的浓度为c mol/L,c平(OH-)=nc mol/L,则 c平(H+)=10-14/nc mol/L,pH=-lg c(H+)=14+lg (nc)。
溶液pH的计算
3.混合溶液pH的计算
(1)两种强酸混合:直接求出c混(H+),再据此求pH。
关键:
1、抓住氢离子进行计算!
2、当相加、减的两个量相差100倍以上时,小的可忽略
例1:计算pH=3的盐酸与pH=5的硫酸等体积混合后的pH。
c平(H+) = mol/L =5×10-4 mol/L
V10-3+V10-5
2V
pH=-lgc(H+)=-lg(5×10-4)=3.3
【结论】两种pH不同的强酸等体积混合时ΔpH≥2时,pH混=pH小+0.3
溶液pH的计算
(2)两种强碱混合:先求出c混(OH-),再据Kw求出c混(H+),最后求pH。
关键:抓住OH- 进行计算!再转化为H+
例2:计算pH=10与pH=12的NaOH溶液等体积混合后的pH。
c平(OH-) = mol/L =5×10-3 mol/L
10-4 V+10-2V
2V
pH=-lgc(H+) =- lg(2×10-12)=11.7
【结论】两种pH不同的强碱等体积混合时ΔpH≥2 时,pH混=pH大- 0.3
溶液pH的计算
(3)强酸强碱混合:“谁过量先求谁”
pH=7(常温)
① 当n(H+)=n(OH-)时,恰好中和
② 当n(H+)>n(OH-)时,酸过量
③ 当n(H+)<n(OH-)时,碱过量
溶液pH的计算
4.强酸、强碱溶液等体积混合后,pH的变化规律
(1) pH1+pH2 = 14
(2) pH1+pH2 > 14
(3) pH1+pH2 < 14
混合后为中性 pH=7
混合后为碱性 pH>7
混合后为酸性 pH<7
5.一强一弱等体积混合且pH之和等于14
(1)若为强酸、弱碱溶液,则混合后溶液显 性。
(2)若为弱酸、强碱溶液,则混合后溶液显 性。
碱
酸
溶液pH的计算
(1) 若为一元强酸(a mol·L-1)、一元强碱(b mol·L-1)溶液等体积混合后呈中性,则混合前a = b。
(2) 若为一元强酸(a mol·L-1)、一元弱碱(b mol·L-1)溶液等体积混合后呈中性,则混合前a < b。
(3)若为一元弱酸(a mol·L-1)、一元强碱(b mol·L-1)溶液等体积混合后呈中性,则混合前a > b。
6.一元酸和一元碱溶液混合呈中性
规律:谁弱谁过量,谁弱显谁性。
原因:酸和碱已电离出的H+与OH-恰好中和,谁弱谁的H+或OH-有储备(即物质过量),还能继续电离。
溶液pH的测定方法
PART 02
酸碱指示剂法
该方法只能确定pH的范围。常用的酸碱指示剂有甲基橙、石蕊和酚酞。
几种常用指示剂的变色范围和颜色变化如图所示:
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
pH试纸法
1.pH试纸的种类
广泛pH试纸:其pH范围是 (最常用),可以识别的pH差约为 。
精密pH试纸:可判别0.2或0.3的pH差值。
专用pH试纸:用于酸性、中性或碱性溶液。
1~14
1
2.pH试纸的使用方法:
取一小块试纸放在干净的玻璃板上,用干净的玻璃棒蘸取溶液点在试纸的中央,待显色后,与标准的比色卡对比,得出溶液的pH。
3. 使用pH试纸的注意事项:
不能用湿的玻璃棒蘸取待测液,也不能将 pH 试纸先用水润湿,否则会将待测液稀释,可能导致所测定的pH 不准确,使测定的酸性溶液的 pH 变大,碱性溶液的 pH 变小,但中性溶液不受影响;
pH试纸法
pH 试纸不能直接伸入待测液中,否则会污染待测液;具有漂白性或强氧化性的溶液不能用酸碱指示剂检验其酸碱性,也不能用 pH 试纸测定其 pH。
pH试纸法
酸度计法
酸度计,又叫pH计,可用来精密测量溶液的pH,其量程为0~14。
人们根据生产与生活的需要,研制了多种类型的pH计,广泛应用于工业、农业、科研和环保等领域
pH计
随堂测试
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)升高温度,水的电离平衡向电离方向移动,c(H+)增大,溶液呈酸性。( )
(2)任何温度下,利用溶液中c平(H+)和c平(OH-)的相对大小判断溶液的酸碱性。( )
(3)25 ℃时pH的范围通常是0~14。( )
(4)4 ℃时,纯水的pH=7。( )
(5)1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0。( )
(6)100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性。( )
(7)pH=4.5的番茄汁中c平(H+)是pH=6.5的牛奶中c平(H+)的100倍。( )
随堂测试
2.下列溶液一定显酸性的是( )
A.溶液中c平(OH-)>c平(H+)
B.滴加紫色石蕊溶液后变红色的溶液
C.溶液中c平(H+)=10-6 mol·L-1
D.溶液中水电离的c水(H+)=10-9 mol·L-1
B
随堂测试
3.关于溶液的酸性及酸性强弱的说法正确的是( )
A.只要溶液中有H+,溶液就显酸性
B.H+浓度大于OH-浓度,溶液一定显酸性
C.H+浓度增大,溶液的酸性一定增强
D.强酸溶液的酸性一定比弱酸溶液的酸性强
B
随堂测试
4.在室温下,由水电离产生的H+浓度为1×10-13 mol·L-1的溶液中,一定能大量共存的离子组是( )
A.③⑤ B.①③ C.③④ D.②⑤
A
随堂测试
5.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断正确的是( )
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
B
谢谢观看
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
