3.4.2离子反应的应用(一)(教学课件)(共24张PPT)_高中化学鲁科版(2019)选择性必修一
文档属性
| 名称 | 3.4.2离子反应的应用(一)(教学课件)(共24张PPT)_高中化学鲁科版(2019)选择性必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 18:54:48 | ||
图片预览






文档简介
(共24张PPT)
物质在水溶液中的行为
第三章
3.4.2 离子反应的应用(一)
核心素养目标
1. 宏观辨识与微观探析
能通过物质检验的宏观现象,辨识离子的存在;从微观角度理解离子特征反应的本质,以及中和滴定中离子浓度变化与酸碱反应的关系,明确宏观实验现象与微观离子行为的关联。
2. 变化观念与平衡思想
认识物质检验和含量测定中离子反应的动态过程;能运用平衡思想分析滴定过程中溶液pH变化、粒子种类和数量变化,理解离子反应的定量关系,形成变化观念,掌握定量分析的方法逻辑。
3. 科学态度与社会责任
通过物质检验和中和滴定的实验探究,养成严谨求实、规范操作、尊重数据的科学态度。
学习重难点
重点:
1.常见离子的特征反应及检验方法;
2.酸碱中和滴定的原理、操作步骤(滴定管使用、指示剂选择 )及数据处理,能准确进行浓度计算。
难点:
1.复杂体系中离子检验的干扰分析(如多种离子共存时的检验顺序 );
2.中和滴定过程中pH变化曲线的理解,以及滴定终点判断、误差分析(如操作不当对结果的影响 ),构建定量分析中离子反应与平衡移动融合的知识体系。
课前导入
水质检测中要确定是否含有Cl-、SO42-等离子,怎么检验呢? 工业生产中烧碱产品的纯度又如何准确测定?
物质检测
PART 01
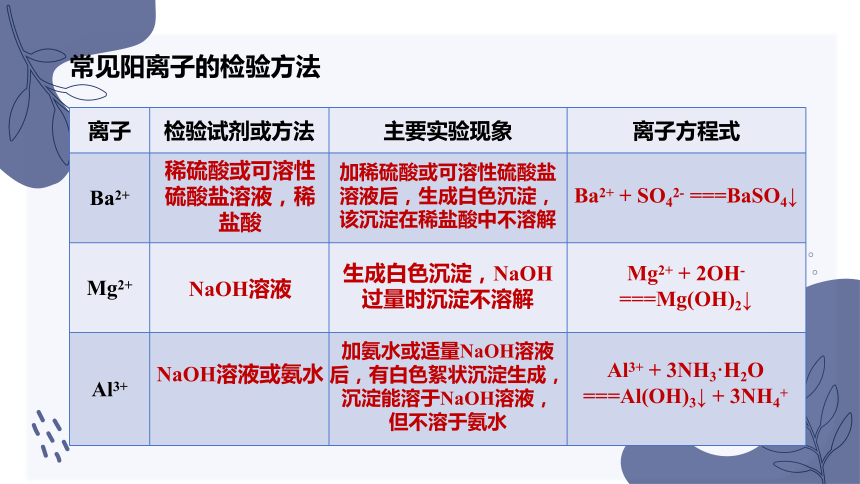
常见阳离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Ba2+
Mg2+
Al3+
稀硫酸或可溶性硫酸盐溶液,稀盐酸
NaOH溶液
NaOH溶液或氨水
加稀硫酸或可溶性硫酸盐溶液后,生成白色沉淀,该沉淀在稀盐酸中不溶解
生成白色沉淀,NaOH过量时沉淀不溶解
加氨水或适量NaOH溶液后,有白色絮状沉淀生成,沉淀能溶于NaOH溶液,但不溶于氨水
Ba2+ + SO42- ===BaSO4↓
Mg2+ + 2OH- ===Mg(OH)2↓
Al3+ + 3NH3·H2O ===Al(OH)3↓ + 3NH4+
常见阳离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Fe3+ (黄色)
NaOH溶液
生成红褐色沉淀
Fe3+ + 3OH- ===Fe(OH)3↓
KSCN溶液
溶液变为血红色
Fe3+ + nSCN- [Fe(SCN)n]3-n(n=1~6)
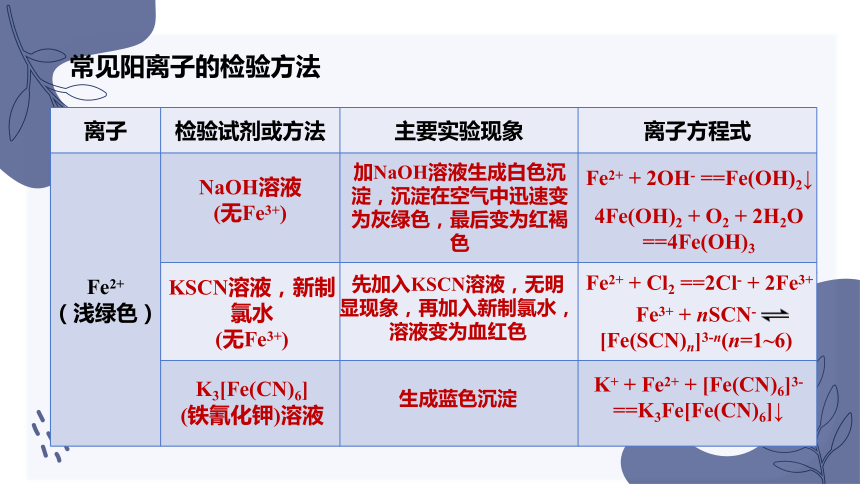
常见阳离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Fe2+ (浅绿色)
加NaOH溶液生成白色沉淀,沉淀在空气中迅速变为灰绿色,最后变为红褐色
Fe2+ + 2OH- ==Fe(OH)2↓
NaOH溶液
(无Fe3+)
KSCN溶液,新制氯水
(无Fe3+)
K3[Fe(CN)6]
(铁氰化钾)溶液
4Fe(OH)2 + O2 + 2H2O ==4Fe(OH)3
先加入KSCN溶液,无明显现象,再加入新制氯水,溶液变为血红色
Fe2+ + Cl2 ==2Cl- + 2Fe3+
Fe3+ + nSCN- [Fe(SCN)n]3-n(n=1~6)
生成蓝色沉淀
K+ + Fe2+ + [Fe(CN)6]3- ==K3Fe[Fe(CN)6]↓
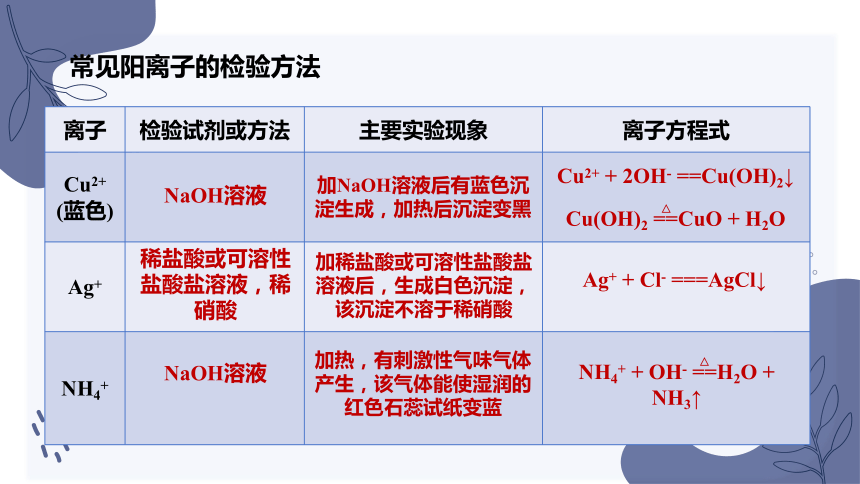
常见阳离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Cu2+ (蓝色)
Ag+
NH4+
稀盐酸或可溶性盐酸盐溶液,稀硝酸
NaOH溶液
NaOH溶液
加NaOH溶液后有蓝色沉淀生成,加热后沉淀变黑
加稀盐酸或可溶性盐酸盐溶液后,生成白色沉淀,该沉淀不溶于稀硝酸
加热,有刺激性气味气体产生,该气体能使湿润的红色石蕊试纸变蓝
Cu2+ + 2OH- ==Cu(OH)2↓
Ag+ + Cl- ===AgCl↓
NH4+ + OH- ==H2O + NH3↑
Cu(OH)2 ==CuO + H2O
△
△
常见阴离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Cl-
Br-
AgNO3溶液,稀硝酸
加AgNO3溶液后,生成白色沉淀,该沉淀不溶于稀硝酸
加AgNO3溶液后,生成淡黄色沉淀,该沉淀不溶于稀硝酸
Ag+ + Cl- ===AgCl↓
Ag+ + Br- ===AgBr↓
常见阴离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
I-
AgNO3溶液,稀硝酸
淀粉,新制氯水
CCl4,新制氯水
加AgNO3溶液后,生成黄色沉淀,该沉淀不溶于稀硝酸
Ag+ + I- ===AgI↓
先加入淀粉无明显现象,再加入新制氯水,溶液变为蓝色
Cl2 + I- ===2Cl- + I2
下层(CCl4层)呈紫色
Cl2 + I- ===2Cl- + I2
常见阴离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
SO42-
SO32-
BaCl2溶液,稀盐酸
先加稀盐酸,无明显现象,再加BaCl2溶液,生成白色沉淀
Ba2+ + SO42- ===BaSO4↓
BaCl2溶液,稀盐酸
先加BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀溶解并放出无色、有刺激性气味的气体
Ba2+ + SO32- ===BaSO3↓
BaSO3 + 2H+ ===Ba2+ + H2O + SO2↑
常见阴离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
CO32-
BaCl2溶液,稀盐酸
先加BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀溶解并放出无色无味的气体
Ca2+ + CO32- ===CaCO3↓
BaCO3 + 2H+ ===Ba2+ + H2O + CO2↑
CaCl2溶液,稀盐酸,澄清石灰水
先加CaCl2溶液,生成白色沉淀,再加入稀盐酸,产生能使澄清石灰水变浑浊的气体
Ca2+ + CO32- ===CaCO3↓
CO32- + 2H+ === H2O + CO2↑
Ca2+ + 2OH- + CO2
=== CaCO3↓ + H2O
含量测定
PART 02
【活动·探究】强酸与强碱的中和滴定及其应用
酸碱中和滴定
实验目的:
通过已知浓度的强酸、强碱溶液,确定待测强碱、强酸溶液的浓度。
实验用品:
浓度未知的盐酸,0.1000 mol·L-1 NaOH 溶液,酚酞溶液,甲基橙溶液;
酸式滴定管,碱式滴定管,锥形瓶,滴定管架(铁架台和蝴蝶夹),胶头滴管等。
滴定原理:
酸碱中和反应的实质为H+ + OH- === H2O,恰好反应时酸提供的H+与碱提供的OH-的物质的量相等,即:
酸碱中和滴定
n酸(H+)= n碱(OH-)
则有:
计算待测液的浓度.
c标V标
V测
=
c测
c(H+)·V酸=c(OH-)·V碱
酸碱中和滴定的仪器
酸式滴定管、碱式滴定管、滴定管夹、铁架台、锥形瓶等。
碱式滴定管
酸式滴定管
规格、温度
“0”刻度
最大刻度
玻璃活塞
尖嘴玻璃管
区分酸式和碱式滴定管的关键部位
乳胶管(内含玻璃球)
酸碱中和滴定的仪器与操作
使用滴定管的注意事项
(1)酸式滴定管下端的玻璃活塞能耐酸和强氧化剂的腐蚀,故其可用于盛装酸性或强氧化性溶液,但不能盛装碱性溶液;
(2)碱式滴定管下端的乳胶管易被酸性或强氧化性溶液腐蚀,所以碱式滴定管一般盛装碱性溶液;
(3)滴定管的“0”刻度在上面,越往下数值越大。因为滴定管下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。放液时,液面不能低于最大刻度。
滴定管读数时要估读到0.01mL。
酸碱中和滴定的仪器与操作
(4)滴定管使用前必须检漏,方法如下:
酸式滴定管:
先关闭活塞,装入一定量水,直立约2分钟,仔细观察有无水珠滴下,然后将活塞转动 180°,再直立约2分钟,观察有无水珠滴下,若均无水珠滴下,则不漏水。
碱式滴定管:装水后直立约2分钟,观察是否漏水即可。
(5)滴定管在加入标准液或待测液前要用所盛装的标准液或待测液润洗2~3次,否则滴定管内壁附着的蒸馏水会将反应液稀释,影响测定结果。
随堂测试
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)检验某溶液是否含有时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸。( )
(2)某溶液中加入CCl4,振荡、静置,分层后CCl4层显紫色,证明原溶液中存在I-。( )
(3)向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无。( )
(4)确定NaCl溶液中是否混有Na2CO3,取少量溶液滴加CaCl2溶液,观察是否出现白色沉淀。( )
随堂测试
2.对某溶液中部分离子的定性检测流程如图。下列相关分析正确的是( )
A.步骤①所加试剂可以是浓KOH溶液
B.步骤①发生反应Al3++4NH3·H2O===
[Al(OH)4]-+
C.可以用湿润的蓝色石蕊试纸检验生成的无色气体
D.步骤②发生反应Al3++ ===Al(OH)3↓+3CO2↑
A
随堂测试
3.某学生欲确定某盐的成分,将其配成溶液甲,鉴定流程如图所示:
下列说法正确的是( )
A.如果甲中含有S2-,则乙是
硫黄沉淀
B.丙中肯定含有Fe3+,所以甲是FeBr2溶液
C.甲中含有铁元素,可能显+2价或+3价
D.若甲溶液滴加酸性KMnO4溶液,溶液变为黄色,则甲中一定含有Fe2+
C
随堂测试
4.某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:
①溶于水,得到无色透明溶液;②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离;③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是( )
A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3
C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
A
谢谢观看
物质在水溶液中的行为
第三章
3.4.2 离子反应的应用(一)
核心素养目标
1. 宏观辨识与微观探析
能通过物质检验的宏观现象,辨识离子的存在;从微观角度理解离子特征反应的本质,以及中和滴定中离子浓度变化与酸碱反应的关系,明确宏观实验现象与微观离子行为的关联。
2. 变化观念与平衡思想
认识物质检验和含量测定中离子反应的动态过程;能运用平衡思想分析滴定过程中溶液pH变化、粒子种类和数量变化,理解离子反应的定量关系,形成变化观念,掌握定量分析的方法逻辑。
3. 科学态度与社会责任
通过物质检验和中和滴定的实验探究,养成严谨求实、规范操作、尊重数据的科学态度。
学习重难点
重点:
1.常见离子的特征反应及检验方法;
2.酸碱中和滴定的原理、操作步骤(滴定管使用、指示剂选择 )及数据处理,能准确进行浓度计算。
难点:
1.复杂体系中离子检验的干扰分析(如多种离子共存时的检验顺序 );
2.中和滴定过程中pH变化曲线的理解,以及滴定终点判断、误差分析(如操作不当对结果的影响 ),构建定量分析中离子反应与平衡移动融合的知识体系。
课前导入
水质检测中要确定是否含有Cl-、SO42-等离子,怎么检验呢? 工业生产中烧碱产品的纯度又如何准确测定?
物质检测
PART 01
常见阳离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Ba2+
Mg2+
Al3+
稀硫酸或可溶性硫酸盐溶液,稀盐酸
NaOH溶液
NaOH溶液或氨水
加稀硫酸或可溶性硫酸盐溶液后,生成白色沉淀,该沉淀在稀盐酸中不溶解
生成白色沉淀,NaOH过量时沉淀不溶解
加氨水或适量NaOH溶液后,有白色絮状沉淀生成,沉淀能溶于NaOH溶液,但不溶于氨水
Ba2+ + SO42- ===BaSO4↓
Mg2+ + 2OH- ===Mg(OH)2↓
Al3+ + 3NH3·H2O ===Al(OH)3↓ + 3NH4+
常见阳离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Fe3+ (黄色)
NaOH溶液
生成红褐色沉淀
Fe3+ + 3OH- ===Fe(OH)3↓
KSCN溶液
溶液变为血红色
Fe3+ + nSCN- [Fe(SCN)n]3-n(n=1~6)
常见阳离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Fe2+ (浅绿色)
加NaOH溶液生成白色沉淀,沉淀在空气中迅速变为灰绿色,最后变为红褐色
Fe2+ + 2OH- ==Fe(OH)2↓
NaOH溶液
(无Fe3+)
KSCN溶液,新制氯水
(无Fe3+)
K3[Fe(CN)6]
(铁氰化钾)溶液
4Fe(OH)2 + O2 + 2H2O ==4Fe(OH)3
先加入KSCN溶液,无明显现象,再加入新制氯水,溶液变为血红色
Fe2+ + Cl2 ==2Cl- + 2Fe3+
Fe3+ + nSCN- [Fe(SCN)n]3-n(n=1~6)
生成蓝色沉淀
K+ + Fe2+ + [Fe(CN)6]3- ==K3Fe[Fe(CN)6]↓
常见阳离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Cu2+ (蓝色)
Ag+
NH4+
稀盐酸或可溶性盐酸盐溶液,稀硝酸
NaOH溶液
NaOH溶液
加NaOH溶液后有蓝色沉淀生成,加热后沉淀变黑
加稀盐酸或可溶性盐酸盐溶液后,生成白色沉淀,该沉淀不溶于稀硝酸
加热,有刺激性气味气体产生,该气体能使湿润的红色石蕊试纸变蓝
Cu2+ + 2OH- ==Cu(OH)2↓
Ag+ + Cl- ===AgCl↓
NH4+ + OH- ==H2O + NH3↑
Cu(OH)2 ==CuO + H2O
△
△
常见阴离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
Cl-
Br-
AgNO3溶液,稀硝酸
加AgNO3溶液后,生成白色沉淀,该沉淀不溶于稀硝酸
加AgNO3溶液后,生成淡黄色沉淀,该沉淀不溶于稀硝酸
Ag+ + Cl- ===AgCl↓
Ag+ + Br- ===AgBr↓
常见阴离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
I-
AgNO3溶液,稀硝酸
淀粉,新制氯水
CCl4,新制氯水
加AgNO3溶液后,生成黄色沉淀,该沉淀不溶于稀硝酸
Ag+ + I- ===AgI↓
先加入淀粉无明显现象,再加入新制氯水,溶液变为蓝色
Cl2 + I- ===2Cl- + I2
下层(CCl4层)呈紫色
Cl2 + I- ===2Cl- + I2
常见阴离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
SO42-
SO32-
BaCl2溶液,稀盐酸
先加稀盐酸,无明显现象,再加BaCl2溶液,生成白色沉淀
Ba2+ + SO42- ===BaSO4↓
BaCl2溶液,稀盐酸
先加BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀溶解并放出无色、有刺激性气味的气体
Ba2+ + SO32- ===BaSO3↓
BaSO3 + 2H+ ===Ba2+ + H2O + SO2↑
常见阴离子的检验方法
离子 检验试剂或方法 主要实验现象 离子方程式
CO32-
BaCl2溶液,稀盐酸
先加BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀溶解并放出无色无味的气体
Ca2+ + CO32- ===CaCO3↓
BaCO3 + 2H+ ===Ba2+ + H2O + CO2↑
CaCl2溶液,稀盐酸,澄清石灰水
先加CaCl2溶液,生成白色沉淀,再加入稀盐酸,产生能使澄清石灰水变浑浊的气体
Ca2+ + CO32- ===CaCO3↓
CO32- + 2H+ === H2O + CO2↑
Ca2+ + 2OH- + CO2
=== CaCO3↓ + H2O
含量测定
PART 02
【活动·探究】强酸与强碱的中和滴定及其应用
酸碱中和滴定
实验目的:
通过已知浓度的强酸、强碱溶液,确定待测强碱、强酸溶液的浓度。
实验用品:
浓度未知的盐酸,0.1000 mol·L-1 NaOH 溶液,酚酞溶液,甲基橙溶液;
酸式滴定管,碱式滴定管,锥形瓶,滴定管架(铁架台和蝴蝶夹),胶头滴管等。
滴定原理:
酸碱中和反应的实质为H+ + OH- === H2O,恰好反应时酸提供的H+与碱提供的OH-的物质的量相等,即:
酸碱中和滴定
n酸(H+)= n碱(OH-)
则有:
计算待测液的浓度.
c标V标
V测
=
c测
c(H+)·V酸=c(OH-)·V碱
酸碱中和滴定的仪器
酸式滴定管、碱式滴定管、滴定管夹、铁架台、锥形瓶等。
碱式滴定管
酸式滴定管
规格、温度
“0”刻度
最大刻度
玻璃活塞
尖嘴玻璃管
区分酸式和碱式滴定管的关键部位
乳胶管(内含玻璃球)
酸碱中和滴定的仪器与操作
使用滴定管的注意事项
(1)酸式滴定管下端的玻璃活塞能耐酸和强氧化剂的腐蚀,故其可用于盛装酸性或强氧化性溶液,但不能盛装碱性溶液;
(2)碱式滴定管下端的乳胶管易被酸性或强氧化性溶液腐蚀,所以碱式滴定管一般盛装碱性溶液;
(3)滴定管的“0”刻度在上面,越往下数值越大。因为滴定管下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。放液时,液面不能低于最大刻度。
滴定管读数时要估读到0.01mL。
酸碱中和滴定的仪器与操作
(4)滴定管使用前必须检漏,方法如下:
酸式滴定管:
先关闭活塞,装入一定量水,直立约2分钟,仔细观察有无水珠滴下,然后将活塞转动 180°,再直立约2分钟,观察有无水珠滴下,若均无水珠滴下,则不漏水。
碱式滴定管:装水后直立约2分钟,观察是否漏水即可。
(5)滴定管在加入标准液或待测液前要用所盛装的标准液或待测液润洗2~3次,否则滴定管内壁附着的蒸馏水会将反应液稀释,影响测定结果。
随堂测试
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)检验某溶液是否含有时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸。( )
(2)某溶液中加入CCl4,振荡、静置,分层后CCl4层显紫色,证明原溶液中存在I-。( )
(3)向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无。( )
(4)确定NaCl溶液中是否混有Na2CO3,取少量溶液滴加CaCl2溶液,观察是否出现白色沉淀。( )
随堂测试
2.对某溶液中部分离子的定性检测流程如图。下列相关分析正确的是( )
A.步骤①所加试剂可以是浓KOH溶液
B.步骤①发生反应Al3++4NH3·H2O===
[Al(OH)4]-+
C.可以用湿润的蓝色石蕊试纸检验生成的无色气体
D.步骤②发生反应Al3++ ===Al(OH)3↓+3CO2↑
A
随堂测试
3.某学生欲确定某盐的成分,将其配成溶液甲,鉴定流程如图所示:
下列说法正确的是( )
A.如果甲中含有S2-,则乙是
硫黄沉淀
B.丙中肯定含有Fe3+,所以甲是FeBr2溶液
C.甲中含有铁元素,可能显+2价或+3价
D.若甲溶液滴加酸性KMnO4溶液,溶液变为黄色,则甲中一定含有Fe2+
C
随堂测试
4.某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:
①溶于水,得到无色透明溶液;②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离;③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是( )
A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3
C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
A
谢谢观看
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
