2.3.3氧化还原反应的配平 课件 (共28张PPT) 高中化学鲁科版(2019)必修一
文档属性
| 名称 | 2.3.3氧化还原反应的配平 课件 (共28张PPT) 高中化学鲁科版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 64.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 19:14:37 | ||
图片预览






文档简介
(共28张PPT)
氧化还原反应的配平
与应用
核心素养目标
1.理解氧化还原反应中得失电子守恒、元素质量守恒等规律,形成利用守恒思想配平氧化还原方程式的思维方法。
2.通过探究氧化还原方程式的配平方法,培养严谨认真、实事求是的科学态度。
一.氧化还原反应方程式的配平
01
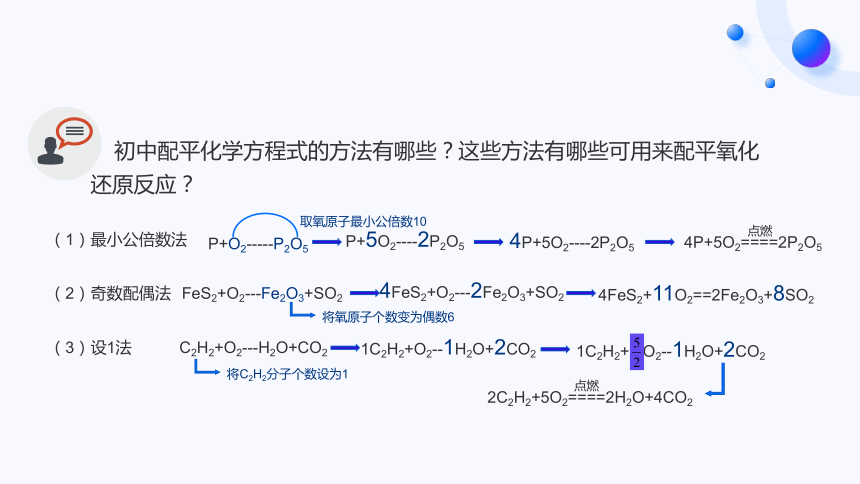
初中配平化学方程式的方法有哪些?这些方法有哪些可用来配平氧化还原反应?
(1)最小公倍数法
(2)奇数配偶法
(3)设1法
P+O2-----P2O5
P+5O2----2P2O5
4P+5O2----2P2O5
4P+5O2====2P2O5
点燃
FeS2+O2---Fe2O3+SO2
4FeS2+O2---2Fe2O3+SO2
4FeS2+11O2==2Fe2O3+8SO2
C2H2+O2---H2O+CO2
取氧原子最小公倍数10
将氧原子个数变为偶数6
将C2H2分子个数设为1
1C2H2+O2--1H2O+2CO2
1C2H2+ O2--1H2O+2CO2
2C2H2+5O2====2H2O+4CO2
点燃
配平下列化学方程式
H2S+FeCl3==HCl+FeCl2+S↓
S+KOH==K2S+K2SO3+H2O
3S+6KOH==2K2S+K2SO3+3H2O
H2S+2FeCl3==2HCl+2FeCl2+S↓
你的答案是否正确?
氧化还原反应方程式的配平
依据:
电子守恒:氧化剂和还原剂的电子得失总数相等
化合价升高总数=化合价降低总数
原子守恒:反应前后原子的种类和个数不变
电荷守恒:离子反应前后阴、阳离子所带电荷总数相等
步骤:
1.标变价——标出变化元素的化合价
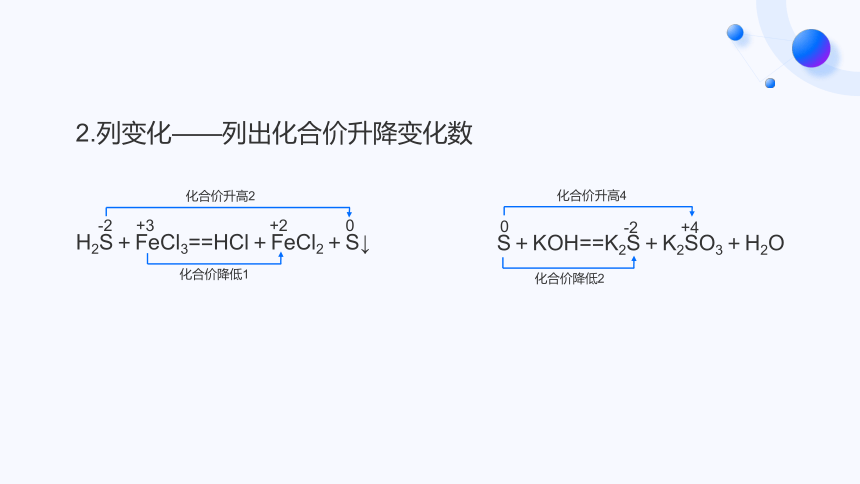
2.列变化——列出化合价升降变化数
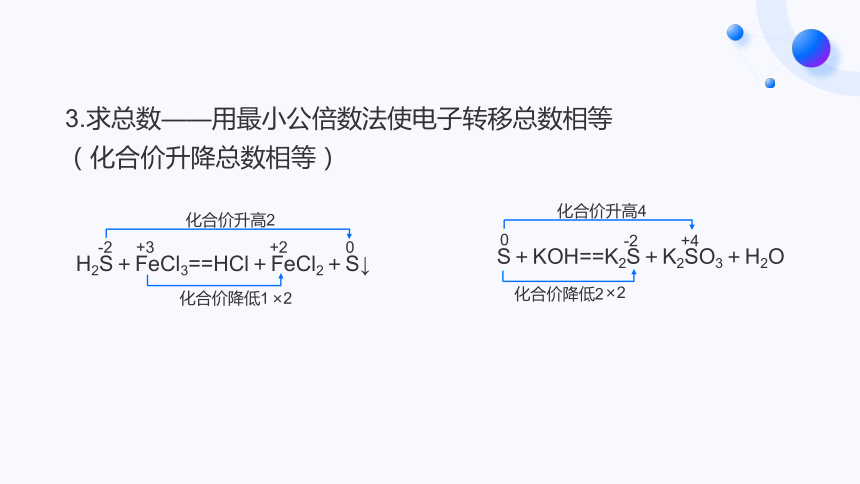
3.求总数——用最小公倍数法使电子转移总数相等(化合价升降总数相等)
4.配系数——先配平变价物质的系数,再用观察法配平其他物质的系数
5.查守恒——检查电荷是否守恒,原子个数是否守恒
H2S+FeCl3==HCl+FeCl2+S↓
S+KOH==K2S+K2SO3+H2O
1.标变价——标出变化元素的化合价
-2
+3
+2
0
0
-2
+4
2.列变化——列出化合价升降变化数
H2S+FeCl3==HCl+FeCl2+S↓
-2
+3
+2
0
化合价升高2
化合价降低1
S+KOH==K2S+K2SO3+H2O
0
-2
+4
化合价降低2
化合价升高4
3.求总数——用最小公倍数法使电子转移总数相等(化合价升降总数相等)
H2S+FeCl3==HCl+FeCl2+S↓
-2
+3
+2
0
化合价升高2
化合价降低1
S+KOH==K2S+K2SO3+H2O
0
-2
+4
化合价降低2
化合价升高4
×2
×2
4.配系数——先配平变价物质的系数,再用观察法配平其他物质的系数
H2S+ FeCl3== HCl+ FeCl2+ S↓
-2
+3
+2
0
化合价升高2
化合价降低1
×2
S+ KOH== K2S+ K2SO3+ H2O
0
-2
+4
化合价降低2
化合价升高4
×2
2
2
2
2
3
6
3
5.查守恒——检查电荷是否守恒,原子个数是否守恒
对于一些氧化还原反应的离子方程式而言,给出了反应物可能不完整,要根据实际情况在反应物中补充H+或OH-
反应物
酸性条件:加H+
碱性条件:加OH-
生成物补H2O
生成物补H2O
MnO4- + H2C2O4 + CO2 ↑ + Mn2+
2
5
H+
10
2
+ H2O
+7 +3 +4 +2
化合价降低5
化合价升高1×2
×2
×5
对比反应物和生成物,
MnO4-在酸性环境下才有氧化性
6
8
Cr2O72- + Fe2+ + ( ) Cr3+ + Fe3+ + H2O
1
6
H+
2
6
7
ClO-+ Fe(OH)3+( ) Cl-+ FeO42- + H2O
3
2
OH-
3
2
5
在酸性环境中稳定存在
在碱性环境中稳定存在
14
4
配平下面两个反应
二.氧化还原反应的应用
02
氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。
化学变化在生产和生活中可能同时具有正、负两方面的影响。
正面作用
金属的冶炼
电镀
燃料的燃烧
绿色植物的光合作用
负面作用
易燃物的自燃
食物的腐败
钢铁的锈蚀
氧化还原反应与金属的冶炼
热还原法、金属置换法、电解法等都是常见的金属冶炼方法,发生的都是氧化还原反应。
热还原法是以碳、一氧化碳等物质作为还原剂,在加热条件下将金属氧化物还原为金属单质,如用一氧化碳还原铁的氧化物得到金属铁。
金属置换法是利用置换反应,以活泼金属为还原剂,将目标金属从其盐溶液中还原出来,如用铁从 CuSO4 溶液中置换出铜。
电解法则是利用外加电源提供电子,使金属元素的化合价降低,
从而获得金属单质,如电解氧化铝制备金属铝。
汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
+2 +2 +4 0
2CO + 2NO=== 2CO2 + N2
高温
催化剂
化合价升高, 失2e-×2, 被氧化
化合价降低, 得2e-×2电子, 被还原
三.实验室制取氯气
03
MnO2+4H+
反应原理
化学方程式:
离子方程式:
MnO2与稀盐酸不反应,与浓盐酸不加热时也不反应
课本实验
视频实验装置
视频中饱和食盐水的作用是什么?
实验中氢氧化钠溶液的作用是什么?
降低氯气的溶解度
吸收尾气,防止氯气污染空气
再改进装置
除去H2O
利用高锰酸钾与浓盐酸在常温下反应制取氯气,请预测反应产物,写出该反应的化学方程式。
2KMnO4+16HCl(浓) = 2MnCl2+2KCl+5Cl2↑+8H2O
①制取的Cl2有毒,且在加热时容易逸出,所以应选用分液漏斗,而不用长颈漏斗
②不能用澄清石灰水吸收氯气,因为澄清石灰水中的Ca(OH)2含量少,吸收不完全;可以使用石灰乳吸收。
③实验结束后,先使反应停止并排出装置中残留的氯气,再拆卸装置,避免污染空气。
制取氯气的注意事项
已知反应:6HCl(浓)+KClO3===KCl+3Cl2 ↑+3H2O。
下列说法正确的是( )
A.浓盐酸只作还原剂
B.生成3分子Cl2有6个电子转移
C.被氧化和被还原的氯元素的质量比为6∶1
D.氯气既是氧化产物又是还原产物
随课练习
北宋王安石在《元日》中描述迎新春的“爆竹声中一岁除”,涉及的化学反应为S+2KNO3+3C===K2S+N2↑+3CO2↑。
下列叙述错误的是( )
A.S发生还原反应
B.只有K2S为还原产物
C.该反应中氧化性:KNO3>CO2
D.依据不同的分类标准,可将KNO3分类为钾盐、硝酸盐、
含氧酸盐等
随课练习
通常将氯气通入消石灰中,在低温条件下反应制备漂白粉,若温度控制不当易产生Ca(ClO3)2,若测得反应后的混合溶液中ClO-与ClO3-的个数比为5∶2,则被还原的氯原子和被氧化的氯原子的个数比为( )
A.5∶2 B.2∶5
C.7∶15 D.15∶7
随课练习
THANK YOU
氧化还原反应的配平
与应用
核心素养目标
1.理解氧化还原反应中得失电子守恒、元素质量守恒等规律,形成利用守恒思想配平氧化还原方程式的思维方法。
2.通过探究氧化还原方程式的配平方法,培养严谨认真、实事求是的科学态度。
一.氧化还原反应方程式的配平
01
初中配平化学方程式的方法有哪些?这些方法有哪些可用来配平氧化还原反应?
(1)最小公倍数法
(2)奇数配偶法
(3)设1法
P+O2-----P2O5
P+5O2----2P2O5
4P+5O2----2P2O5
4P+5O2====2P2O5
点燃
FeS2+O2---Fe2O3+SO2
4FeS2+O2---2Fe2O3+SO2
4FeS2+11O2==2Fe2O3+8SO2
C2H2+O2---H2O+CO2
取氧原子最小公倍数10
将氧原子个数变为偶数6
将C2H2分子个数设为1
1C2H2+O2--1H2O+2CO2
1C2H2+ O2--1H2O+2CO2
2C2H2+5O2====2H2O+4CO2
点燃
配平下列化学方程式
H2S+FeCl3==HCl+FeCl2+S↓
S+KOH==K2S+K2SO3+H2O
3S+6KOH==2K2S+K2SO3+3H2O
H2S+2FeCl3==2HCl+2FeCl2+S↓
你的答案是否正确?
氧化还原反应方程式的配平
依据:
电子守恒:氧化剂和还原剂的电子得失总数相等
化合价升高总数=化合价降低总数
原子守恒:反应前后原子的种类和个数不变
电荷守恒:离子反应前后阴、阳离子所带电荷总数相等
步骤:
1.标变价——标出变化元素的化合价
2.列变化——列出化合价升降变化数
3.求总数——用最小公倍数法使电子转移总数相等(化合价升降总数相等)
4.配系数——先配平变价物质的系数,再用观察法配平其他物质的系数
5.查守恒——检查电荷是否守恒,原子个数是否守恒
H2S+FeCl3==HCl+FeCl2+S↓
S+KOH==K2S+K2SO3+H2O
1.标变价——标出变化元素的化合价
-2
+3
+2
0
0
-2
+4
2.列变化——列出化合价升降变化数
H2S+FeCl3==HCl+FeCl2+S↓
-2
+3
+2
0
化合价升高2
化合价降低1
S+KOH==K2S+K2SO3+H2O
0
-2
+4
化合价降低2
化合价升高4
3.求总数——用最小公倍数法使电子转移总数相等(化合价升降总数相等)
H2S+FeCl3==HCl+FeCl2+S↓
-2
+3
+2
0
化合价升高2
化合价降低1
S+KOH==K2S+K2SO3+H2O
0
-2
+4
化合价降低2
化合价升高4
×2
×2
4.配系数——先配平变价物质的系数,再用观察法配平其他物质的系数
H2S+ FeCl3== HCl+ FeCl2+ S↓
-2
+3
+2
0
化合价升高2
化合价降低1
×2
S+ KOH== K2S+ K2SO3+ H2O
0
-2
+4
化合价降低2
化合价升高4
×2
2
2
2
2
3
6
3
5.查守恒——检查电荷是否守恒,原子个数是否守恒
对于一些氧化还原反应的离子方程式而言,给出了反应物可能不完整,要根据实际情况在反应物中补充H+或OH-
反应物
酸性条件:加H+
碱性条件:加OH-
生成物补H2O
生成物补H2O
MnO4- + H2C2O4 + CO2 ↑ + Mn2+
2
5
H+
10
2
+ H2O
+7 +3 +4 +2
化合价降低5
化合价升高1×2
×2
×5
对比反应物和生成物,
MnO4-在酸性环境下才有氧化性
6
8
Cr2O72- + Fe2+ + ( ) Cr3+ + Fe3+ + H2O
1
6
H+
2
6
7
ClO-+ Fe(OH)3+( ) Cl-+ FeO42- + H2O
3
2
OH-
3
2
5
在酸性环境中稳定存在
在碱性环境中稳定存在
14
4
配平下面两个反应
二.氧化还原反应的应用
02
氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。
化学变化在生产和生活中可能同时具有正、负两方面的影响。
正面作用
金属的冶炼
电镀
燃料的燃烧
绿色植物的光合作用
负面作用
易燃物的自燃
食物的腐败
钢铁的锈蚀
氧化还原反应与金属的冶炼
热还原法、金属置换法、电解法等都是常见的金属冶炼方法,发生的都是氧化还原反应。
热还原法是以碳、一氧化碳等物质作为还原剂,在加热条件下将金属氧化物还原为金属单质,如用一氧化碳还原铁的氧化物得到金属铁。
金属置换法是利用置换反应,以活泼金属为还原剂,将目标金属从其盐溶液中还原出来,如用铁从 CuSO4 溶液中置换出铜。
电解法则是利用外加电源提供电子,使金属元素的化合价降低,
从而获得金属单质,如电解氧化铝制备金属铝。
汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
+2 +2 +4 0
2CO + 2NO=== 2CO2 + N2
高温
催化剂
化合价升高, 失2e-×2, 被氧化
化合价降低, 得2e-×2电子, 被还原
三.实验室制取氯气
03
MnO2+4H+
反应原理
化学方程式:
离子方程式:
MnO2与稀盐酸不反应,与浓盐酸不加热时也不反应
课本实验
视频实验装置
视频中饱和食盐水的作用是什么?
实验中氢氧化钠溶液的作用是什么?
降低氯气的溶解度
吸收尾气,防止氯气污染空气
再改进装置
除去H2O
利用高锰酸钾与浓盐酸在常温下反应制取氯气,请预测反应产物,写出该反应的化学方程式。
2KMnO4+16HCl(浓) = 2MnCl2+2KCl+5Cl2↑+8H2O
①制取的Cl2有毒,且在加热时容易逸出,所以应选用分液漏斗,而不用长颈漏斗
②不能用澄清石灰水吸收氯气,因为澄清石灰水中的Ca(OH)2含量少,吸收不完全;可以使用石灰乳吸收。
③实验结束后,先使反应停止并排出装置中残留的氯气,再拆卸装置,避免污染空气。
制取氯气的注意事项
已知反应:6HCl(浓)+KClO3===KCl+3Cl2 ↑+3H2O。
下列说法正确的是( )
A.浓盐酸只作还原剂
B.生成3分子Cl2有6个电子转移
C.被氧化和被还原的氯元素的质量比为6∶1
D.氯气既是氧化产物又是还原产物
随课练习
北宋王安石在《元日》中描述迎新春的“爆竹声中一岁除”,涉及的化学反应为S+2KNO3+3C===K2S+N2↑+3CO2↑。
下列叙述错误的是( )
A.S发生还原反应
B.只有K2S为还原产物
C.该反应中氧化性:KNO3>CO2
D.依据不同的分类标准,可将KNO3分类为钾盐、硝酸盐、
含氧酸盐等
随课练习
通常将氯气通入消石灰中,在低温条件下反应制备漂白粉,若温度控制不当易产生Ca(ClO3)2,若测得反应后的混合溶液中ClO-与ClO3-的个数比为5∶2,则被还原的氯原子和被氧化的氯原子的个数比为( )
A.5∶2 B.2∶5
C.7∶15 D.15∶7
随课练习
THANK YOU
