3.1.1 氯气的发现与制备 课件(共28张PPT)_高中化学苏教版(2019)必修一
文档属性
| 名称 | 3.1.1 氯气的发现与制备 课件(共28张PPT)_高中化学苏教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 48.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 19:25:36 | ||
图片预览






文档简介
(共28张PPT)
3.1.1 氯气的发现与制备
素养目标
宏观辨识与微观探析
能从宏观上观察氯气的颜色、状态等物理性质,以及电解饱和食盐水等反应的现象;从微观角度理解氯元素在自然界的存在形式,以及氯气制备反应的微观本质,如原子的重新组合等。
科学态度与社会责任
了解氯气的发现史,学习科学家的探索精神,培养严谨的科学态度;体会化学学科在利用自然资源创造新物质方面的独特作用,增强社会责任感。
变化观念与平衡思想
理解氯气制备反应中的物质变化和能量变化;了解电解饱和食盐水反应的原理,初步形成对化学反应中物质转化和能量变化的认识。
教学重难点
重点:
1. 氯气的实验室制备原理和工业制备原理
2. 电解饱和食盐水的反应原理及产物判断
难点:
1. 理解电解饱和食盐水过程中离子的移动和放电顺序
2. 从微观角度解释氯气制备反应的本质
1
氯气的发现及实验室制法
氯元素的存在
每千克海水中几种氯化物的含量
氯元素在自然界中只以化合态的形式存在,不存在游离态的氯,
以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中
盐湖
盐矿
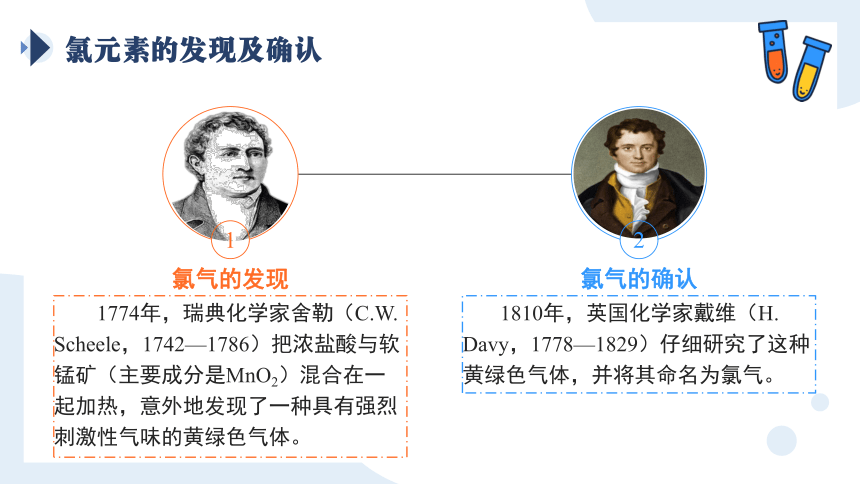
氯元素的发现及确认
1774年,瑞典化学家舍勒(C.W. Scheele,1742—1786)把浓盐酸与软锰矿(主要成分是MnO2)混合在一起加热,意外地发现了一种具有强烈刺激性气味的黄绿色气体。
氯气的发现
1
1810年,英国化学家戴维(H. Davy,1778—1829)仔细研究了这种黄绿色气体,并将其命名为氯气。
氯气的确认
2
氯气的实验室制法——制取原理
在实验室中,通常用浓盐酸与二氧化锰反应来制取氯气。
MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O
△
MnO2+4H+ + 2Cl- === Mn2++Cl2↑+2H2O
△
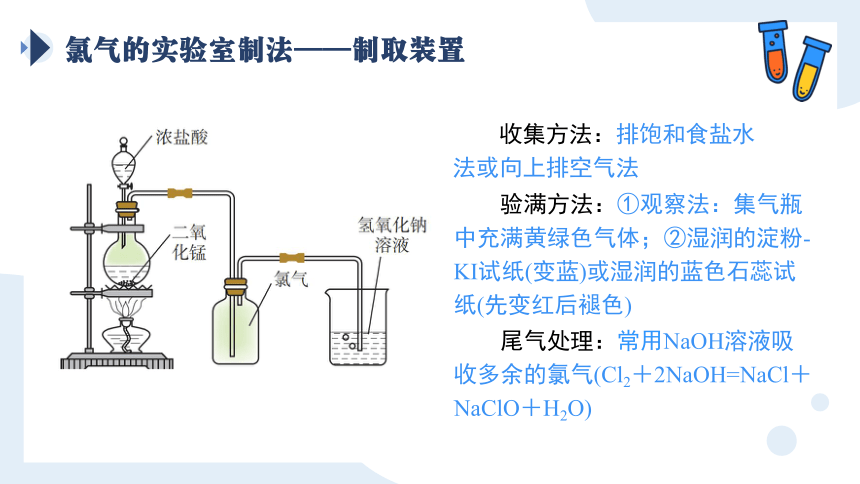
氯气的实验室制法——制取装置
收集方法:排饱和食盐水法或向上排空气法
验满方法:①观察法:集气瓶中充满黄绿色气体;②湿润的淀粉-KI试纸(变蓝)或湿润的蓝色石蕊试纸(先变红后褪色)
尾气处理:常用NaOH溶液吸收多余的氯气(Cl2+2NaOH=NaCl+NaClO+H2O)
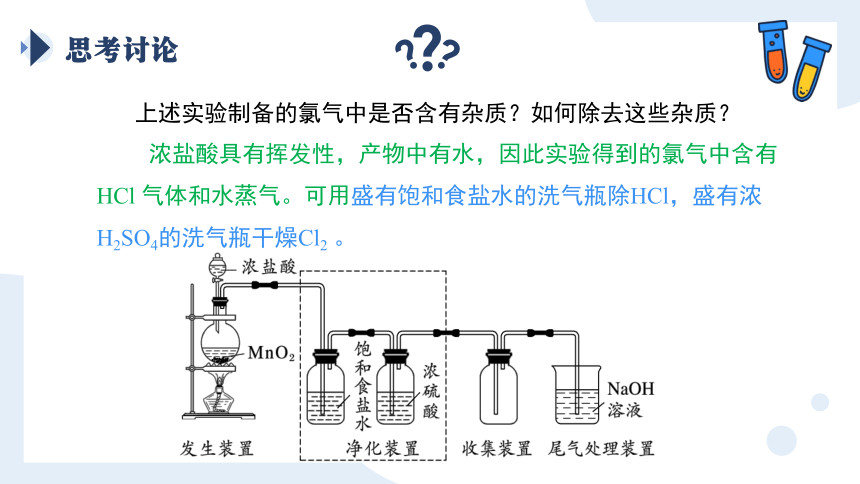
思考讨论
上述实验制备的氯气中是否含有杂质?如何除去这些杂质?
浓盐酸具有挥发性,产物中有水,因此实验得到的氯气中含有 HCl 气体和水蒸气。可用盛有饱和食盐水的洗气瓶除HCl,盛有浓H2SO4的洗气瓶干燥Cl2 。
思考讨论
1. 实验中,用4份浓盐酸与足量的MnO2反应,能生成1份Cl2吗?
不能,因为随着反应的进行,盐酸的浓度变小,MnO2与稀盐酸不反应,故生成的Cl2小于1。
2. 为何能用饱和食盐水除去HCl?
Cl2在饱和食盐水中的溶解度很小,而HCl极易溶于水。
3. 除浓硫酸外,还能用其他的干燥剂来干燥Cl2吗?
也可用无水CaCl2干燥,但不能选用CaO和NaOH为主要成分的碱石灰(会和Cl2反应)。
特别提醒
进行实验时必须加热,且加热时温度不宜过高,减少HCl的挥发
2
实验室用MnO2和盐酸制Cl2,必须用浓盐酸
1
收集Cl2还可以用排饱和食盐水法,但不能用排水法
3
一般不用澄清石灰水来吸收Cl2,因为Ca(OH)2在水中的溶解度很小,不能保证Cl2吸收完全
4
拓展延伸——实验室制取氯气的其他方法
1. 实验室制氯气时,氧化剂MnO2还可以用其他能氧化浓盐酸中的氯离子的氧化剂(相同条件下,氧化性强于MnO2)代替。
2. 常见的氧化剂有:KMnO4、KClO3、NaClO、Ca(ClO)2等。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
NaClO+2HCl(浓)= NaCl+H2O+ Cl2↑
3. 浓盐酸也可以用NaCl和浓硫酸代替。反应的总化学方程式:
MnO2+2NaCl+H2SO4(浓)MnSO4+Cl2↑+2H2O
2
常见气体的制备
发生装置的选择
依据反应物的状态及反应条件
①
②
③
净化装置的选择
原则:不减少被净化气体的量;不引入新杂质;操作简便,易于分离。
洗气瓶:盛液体除杂试剂,气流方向是长管进,短管出
干燥管:盛固体除杂试剂,气流方向是粗口进,细口出
收集装置的选择
依据产生气体的状态及溶解性
排水法:适用于难溶于水且不与水反应的气体
向上排空气法:气体不与空气反应,且密度比空气大
向下排空气法:气体不与空气反应,且密度比空气小
尾气处理装置的选择
根据气体的物理性质、化学性质,将气体转化成无毒物质或吸收
点燃法:如CO、H2、CH4等易燃性气体可用此法
吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收
3
氯气的工业制取
电解饱和食盐水
(1)接通电源,观察铁棒和石墨棒上发生的现象。通电一段时间后,将小试管套在a管上,收集U形管左端产生的气体。2 min 后,提起小试管,并迅速用拇指堵住试管口,移近点燃的酒精灯,松开拇指,检验收集到的气体。
(2)取一支小试管,用向上排空气法收集从 b 管导出的气体,观察收集到的气体的颜色。
(3)关闭电源,打开 U 形管左端的橡皮塞,向溶液中滴加 1~2 滴酚酞溶液,观察溶液颜色的变化。
工业生产氯气
工业上对氯气的需求量很大。大量生产氯气不仅要求原料易得,而且价格也是必须考虑的重要因素,因此地球上巨量的海水就成为制备氯气首选的原料。19世纪,科学家发明了电解饱和食盐水制取氯气的方法,为工业制备氯气奠定了基础。如今,工业生产氯气主要是通
过海水晒盐得到粗盐,除去杂质后,电解氯化钠饱和溶液来制备。
电解饱和食盐水
实验操作 (1) (2) (3)
实验现象
实验结论
化学方程式 接通电源后,铁棒上有无色气泡产生,将从a管处收集到的气体靠近酒精灯火焰,有爆鸣声产生
通电后,石墨棒上有黄绿色气体产生
U形管左端溶液在滴加酚酞溶液后变红
与负极相连的铁棒上有氢气生成
与正极相连的石墨棒上有氯气生成
U形管左端溶液中有碱性物质生成
4
随堂练习
1. 实验室用二氧化锰和浓盐酸来制取氯气,主要操作有:①将烧瓶固定在铁架台上;②把酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈放好石棉网;③用药匙向烧瓶中加二氧化锰,再向分液漏斗中加入浓盐酸,并将导气管放入集气瓶中;④检查装置的气密性;⑤在烧瓶上装好分液漏斗,连接好导气管。则最好的实验操作顺序是( )
A. ①②③④⑤ B. ②①③④⑤
C. ②①④③⑤ D. ②①⑤④③
D
2. 如图为教科书中电解饱和食盐水的实验装置。据此,下列叙述不正确的是( )
A. 装置中,a管能产生氢气
B. b管导出的是氯气
C. 以食盐水为基础原料制取氯气等产品的工业
称为“氯碱工业”
D. 在石墨棒电极区域有NaOH生成
D
3. 1774年舍勒发现了氯气。下列有关氯气制备的实验装置不正确的是( )
A
4. 实验室用如图装置制取并收集Cl2。下列说法正确的是( )
A. 该图所示的过程中存在3处明显错误
B. 实验室还可以用排水法收集Cl2
C. 收集氯气时可用干燥的蓝色石蕊试纸验满
D. 含有14.6 g HCl的浓盐酸与足量MnO2反应生成0.1 mol Cl2
A
5. 下列有关氯碱工业的说法错误的是( )
A. 氯碱工业是以电解饱和食盐水为基础制取氯气等产品的工业
B. 根据氯碱工业原理分析,若电解氯化钾溶液,则发生的反应为
2KCl+2H2O 2KOH+Cl2↑+H2↑
C. 氯碱工业中产生两种气体,一种是无色的,一种是黄绿色的
D. 地球上的海水可以供人们使用,因此节约用水是没有意义的
D
感谢您的观看
“THANK YOU”
3.1.1 氯气的发现与制备
素养目标
宏观辨识与微观探析
能从宏观上观察氯气的颜色、状态等物理性质,以及电解饱和食盐水等反应的现象;从微观角度理解氯元素在自然界的存在形式,以及氯气制备反应的微观本质,如原子的重新组合等。
科学态度与社会责任
了解氯气的发现史,学习科学家的探索精神,培养严谨的科学态度;体会化学学科在利用自然资源创造新物质方面的独特作用,增强社会责任感。
变化观念与平衡思想
理解氯气制备反应中的物质变化和能量变化;了解电解饱和食盐水反应的原理,初步形成对化学反应中物质转化和能量变化的认识。
教学重难点
重点:
1. 氯气的实验室制备原理和工业制备原理
2. 电解饱和食盐水的反应原理及产物判断
难点:
1. 理解电解饱和食盐水过程中离子的移动和放电顺序
2. 从微观角度解释氯气制备反应的本质
1
氯气的发现及实验室制法
氯元素的存在
每千克海水中几种氯化物的含量
氯元素在自然界中只以化合态的形式存在,不存在游离态的氯,
以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中
盐湖
盐矿
氯元素的发现及确认
1774年,瑞典化学家舍勒(C.W. Scheele,1742—1786)把浓盐酸与软锰矿(主要成分是MnO2)混合在一起加热,意外地发现了一种具有强烈刺激性气味的黄绿色气体。
氯气的发现
1
1810年,英国化学家戴维(H. Davy,1778—1829)仔细研究了这种黄绿色气体,并将其命名为氯气。
氯气的确认
2
氯气的实验室制法——制取原理
在实验室中,通常用浓盐酸与二氧化锰反应来制取氯气。
MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O
△
MnO2+4H+ + 2Cl- === Mn2++Cl2↑+2H2O
△
氯气的实验室制法——制取装置
收集方法:排饱和食盐水法或向上排空气法
验满方法:①观察法:集气瓶中充满黄绿色气体;②湿润的淀粉-KI试纸(变蓝)或湿润的蓝色石蕊试纸(先变红后褪色)
尾气处理:常用NaOH溶液吸收多余的氯气(Cl2+2NaOH=NaCl+NaClO+H2O)
思考讨论
上述实验制备的氯气中是否含有杂质?如何除去这些杂质?
浓盐酸具有挥发性,产物中有水,因此实验得到的氯气中含有 HCl 气体和水蒸气。可用盛有饱和食盐水的洗气瓶除HCl,盛有浓H2SO4的洗气瓶干燥Cl2 。
思考讨论
1. 实验中,用4份浓盐酸与足量的MnO2反应,能生成1份Cl2吗?
不能,因为随着反应的进行,盐酸的浓度变小,MnO2与稀盐酸不反应,故生成的Cl2小于1。
2. 为何能用饱和食盐水除去HCl?
Cl2在饱和食盐水中的溶解度很小,而HCl极易溶于水。
3. 除浓硫酸外,还能用其他的干燥剂来干燥Cl2吗?
也可用无水CaCl2干燥,但不能选用CaO和NaOH为主要成分的碱石灰(会和Cl2反应)。
特别提醒
进行实验时必须加热,且加热时温度不宜过高,减少HCl的挥发
2
实验室用MnO2和盐酸制Cl2,必须用浓盐酸
1
收集Cl2还可以用排饱和食盐水法,但不能用排水法
3
一般不用澄清石灰水来吸收Cl2,因为Ca(OH)2在水中的溶解度很小,不能保证Cl2吸收完全
4
拓展延伸——实验室制取氯气的其他方法
1. 实验室制氯气时,氧化剂MnO2还可以用其他能氧化浓盐酸中的氯离子的氧化剂(相同条件下,氧化性强于MnO2)代替。
2. 常见的氧化剂有:KMnO4、KClO3、NaClO、Ca(ClO)2等。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
NaClO+2HCl(浓)= NaCl+H2O+ Cl2↑
3. 浓盐酸也可以用NaCl和浓硫酸代替。反应的总化学方程式:
MnO2+2NaCl+H2SO4(浓)MnSO4+Cl2↑+2H2O
2
常见气体的制备
发生装置的选择
依据反应物的状态及反应条件
①
②
③
净化装置的选择
原则:不减少被净化气体的量;不引入新杂质;操作简便,易于分离。
洗气瓶:盛液体除杂试剂,气流方向是长管进,短管出
干燥管:盛固体除杂试剂,气流方向是粗口进,细口出
收集装置的选择
依据产生气体的状态及溶解性
排水法:适用于难溶于水且不与水反应的气体
向上排空气法:气体不与空气反应,且密度比空气大
向下排空气法:气体不与空气反应,且密度比空气小
尾气处理装置的选择
根据气体的物理性质、化学性质,将气体转化成无毒物质或吸收
点燃法:如CO、H2、CH4等易燃性气体可用此法
吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收
3
氯气的工业制取
电解饱和食盐水
(1)接通电源,观察铁棒和石墨棒上发生的现象。通电一段时间后,将小试管套在a管上,收集U形管左端产生的气体。2 min 后,提起小试管,并迅速用拇指堵住试管口,移近点燃的酒精灯,松开拇指,检验收集到的气体。
(2)取一支小试管,用向上排空气法收集从 b 管导出的气体,观察收集到的气体的颜色。
(3)关闭电源,打开 U 形管左端的橡皮塞,向溶液中滴加 1~2 滴酚酞溶液,观察溶液颜色的变化。
工业生产氯气
工业上对氯气的需求量很大。大量生产氯气不仅要求原料易得,而且价格也是必须考虑的重要因素,因此地球上巨量的海水就成为制备氯气首选的原料。19世纪,科学家发明了电解饱和食盐水制取氯气的方法,为工业制备氯气奠定了基础。如今,工业生产氯气主要是通
过海水晒盐得到粗盐,除去杂质后,电解氯化钠饱和溶液来制备。
电解饱和食盐水
实验操作 (1) (2) (3)
实验现象
实验结论
化学方程式 接通电源后,铁棒上有无色气泡产生,将从a管处收集到的气体靠近酒精灯火焰,有爆鸣声产生
通电后,石墨棒上有黄绿色气体产生
U形管左端溶液在滴加酚酞溶液后变红
与负极相连的铁棒上有氢气生成
与正极相连的石墨棒上有氯气生成
U形管左端溶液中有碱性物质生成
4
随堂练习
1. 实验室用二氧化锰和浓盐酸来制取氯气,主要操作有:①将烧瓶固定在铁架台上;②把酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈放好石棉网;③用药匙向烧瓶中加二氧化锰,再向分液漏斗中加入浓盐酸,并将导气管放入集气瓶中;④检查装置的气密性;⑤在烧瓶上装好分液漏斗,连接好导气管。则最好的实验操作顺序是( )
A. ①②③④⑤ B. ②①③④⑤
C. ②①④③⑤ D. ②①⑤④③
D
2. 如图为教科书中电解饱和食盐水的实验装置。据此,下列叙述不正确的是( )
A. 装置中,a管能产生氢气
B. b管导出的是氯气
C. 以食盐水为基础原料制取氯气等产品的工业
称为“氯碱工业”
D. 在石墨棒电极区域有NaOH生成
D
3. 1774年舍勒发现了氯气。下列有关氯气制备的实验装置不正确的是( )
A
4. 实验室用如图装置制取并收集Cl2。下列说法正确的是( )
A. 该图所示的过程中存在3处明显错误
B. 实验室还可以用排水法收集Cl2
C. 收集氯气时可用干燥的蓝色石蕊试纸验满
D. 含有14.6 g HCl的浓盐酸与足量MnO2反应生成0.1 mol Cl2
A
5. 下列有关氯碱工业的说法错误的是( )
A. 氯碱工业是以电解饱和食盐水为基础制取氯气等产品的工业
B. 根据氯碱工业原理分析,若电解氯化钾溶液,则发生的反应为
2KCl+2H2O 2KOH+Cl2↑+H2↑
C. 氯碱工业中产生两种气体,一种是无色的,一种是黄绿色的
D. 地球上的海水可以供人们使用,因此节约用水是没有意义的
D
感谢您的观看
“THANK YOU”
