3.2.2硫的转化(2)课件 (共38张PPT) 高中化学鲁科版(2019)必修一
文档属性
| 名称 | 3.2.2硫的转化(2)课件 (共38张PPT) 高中化学鲁科版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 302.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-01 21:38:25 | ||
图片预览









文档简介
硫的转化(2)
核心素养目标
1.掌握SO2的重要物理、化学性质及实验现象。
2.能从物质类别及化合价的角度预测常见含硫化合物的转化关系,会设计实验实现不同价态含硫物质的相互转化。
一.二氧化硫
01
二氧化硫的物理性质
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}颜色
状态
气味
毒性
密度
溶解性
无色
气体
刺激性气味
有毒
比空气大
易溶于水
(1:40)
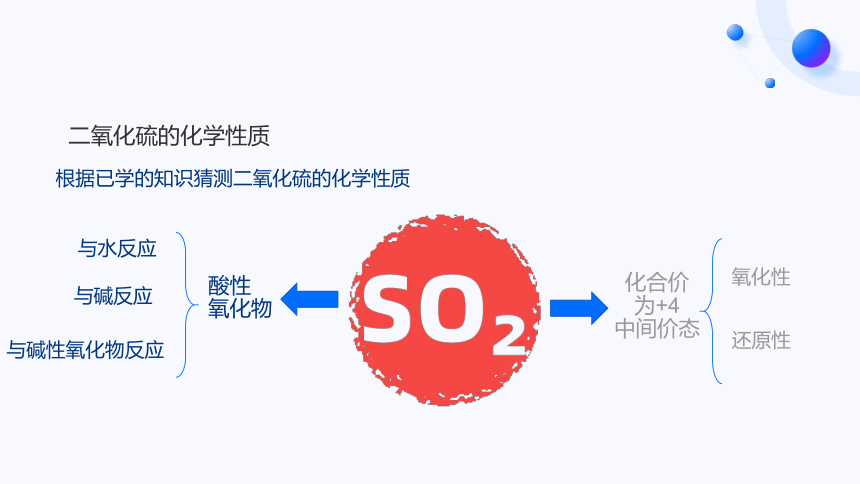
二氧化硫的化学性质
根据已学的知识猜测二氧化硫的化学性质
酸性
氧化物
化合价
为+4
中间价态
与水反应
与碱反应
与碱性氧化物反应
氧化性
还原性
SO2与水的反应
把充有SO2、塞有橡胶塞的试管倒立于水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验现象
实验结论
试管内液面上升
SO2易溶于水
pH试纸变为红色
SO2水溶液显酸性
二氧化硫与碱反应
SO2 + CaO = CaSO3
SO2通入NaOH溶液:
二氧化硫与碱性氧化物反应
SO2 + 2NaOH = Na2SO3 + H2O
二氧化硫尾气吸收
SO2 + Ca(OH)2 = CaSO3 ↓ + H2O
二氧化硫能使澄清石灰水变浑浊
SO2通入澄清石灰水:
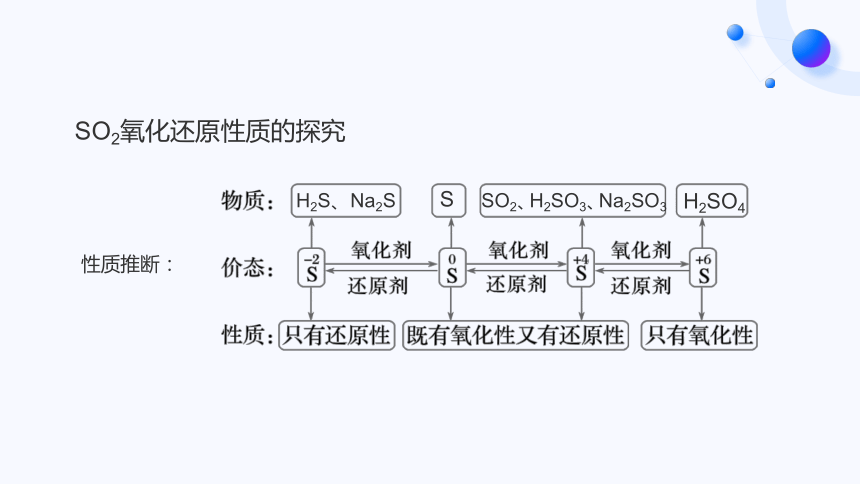
H2S、Na2S
SO2、H2SO3、Na2SO3
H2SO4
S
SO2氧化还原性质的探究
性质推断:
课本实验:不同价态硫元素之间的转化(以SO2为主要对象)
实验用品:SO2 水溶液,Na2SO3 溶液,浓硫酸,Na2S溶液,
稀硫酸,NaOH 溶液,酸性 KMnO4 溶液,
氯水,KI 溶液,淀粉溶液,品红溶液,铜片
氧化性物质:SO2 水溶液,Na2SO3 溶液,浓硫酸,稀硫酸,酸性 KMnO4 溶液,氯水
还原性物质:SO2 水溶液,Na2SO3 溶液,Na2S溶液,KI 溶液,铜片
性质不明:品红溶液
结合实验目的和氧化还原反应,进行实验设计
①SO2 水溶液+酸性 KMnO4 溶液
④SO2 水溶液+品红溶液
③SO2 水溶液+硫化钠溶液
②SO2 水溶液+氯水
⑤SO2 水溶液+KI 溶液
哪些实验能发生,
哪些不能发生?
SO2 只具有弱氧化性,不足以氧化I-
{4EF03731-DDC3-41A1-BE11-CD2086E007D1}试剂
SO2 水溶液+
酸性 KMnO4 溶液
SO2 水溶液+
氯水
SO2 水溶液+
品红溶液,
加热
SO2 水溶液+
硫化钠溶液
现象
解释与
结论
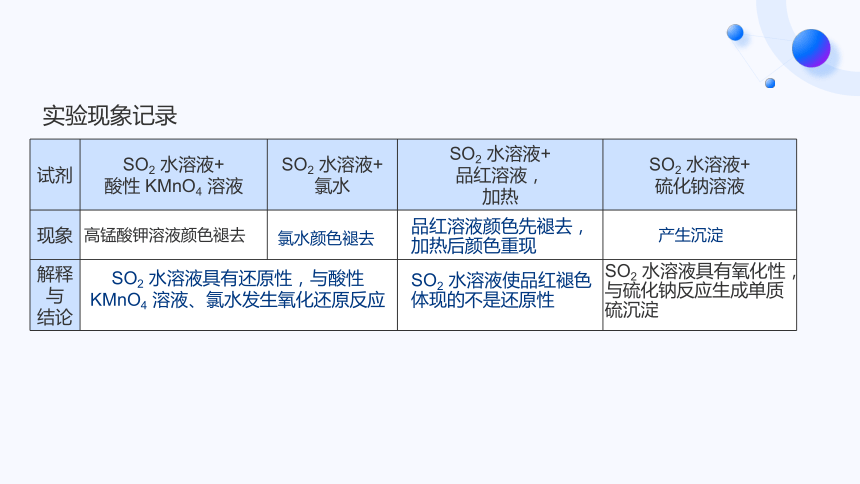
实验现象记录
高锰酸钾溶液颜色褪去
氯水颜色褪去
品红溶液颜色先褪去,
加热后颜色重现
SO2 水溶液具有还原性,与酸性
KMnO4 溶液、氯水发生氧化还原反应
SO2 水溶液使品红褪色
体现的不是还原性
产生沉淀
SO2 水溶液具有氧化性,
与硫化钠反应生成单质
硫沉淀
SO2+H2O H2SO3
SO2+2NaOH===Na2SO3+H2O
SO2+CaO===CaSO3
SO2+2H2S===3S↓+2H2O
2SO2+O2 2SO3
SO2+Cl2+2H2O===H2SO4+2HCl
褪色
又恢复红色
SO2化学性质总结
SO2的用途
生产硫酸
葡萄酒抗氧化
生产农药
生产染料
食品添加剂
制冷剂
二.浓硫酸
02
浓硫酸的物理性质
①基本性状:无色、黏稠、难挥发的油状液体;密度比水大;易溶于水。
②吸水性:可作干燥剂。可干燥酸性气体(CO2、SO2、Cl2、HCl等)和
中性气体(N2、O2、H2等);不能干燥碱性气体(NH3)和某些还原性
气体(H2S、HBr、HI)。
③溶于水放出大量的热:稀释时,将浓硫酸沿烧杯内壁缓缓倒入水中,
并用玻璃棒不断搅拌。
浓硫酸的化学性质
(1)酸的通性
①与酸碱指示剂作用
②与活泼金属反应
Fe+H2SO4══FeSO4+H2↑
③与碱性氧化物反应
CuO+H2SO4══CuSO4+H2O
④与碱反应
2NaOH+H2SO4══Na2SO4+2H2O
⑤与某些盐等反应
Na2CO3+H2SO4══Na2SO4+H2O+CO2↑
使紫色石蕊溶液变红
(2)强氧化性
硫酸中的硫元素处于最高价态。与稀硫酸主要体现H+的氧化性不同,
浓硫酸的氧化性来自硫酸分子中+6价硫的强得电子能力?,其能与许多
物质发生氧化还原反应,是常见的氧化剂。例如,在加热时浓硫酸可
与铜、木炭等单质发生反应。
2H2SO4(浓)+Cu ==== CuSO4 + SO2 ↑ + 2H2O
△
△
2H2SO4(浓)+ C ==== 2SO2 ↑ + CO2 ↑ + 2H2O
{D36F6785-E956-48E3-9B18-7F593D358D02}反应
试剂
浓硫酸和铜单质
反应
现象
解释与结论
化学方程式
未加热前,铜与浓硫酸不反应
加热后,铜丝表面变黑,同时有气泡产生
品红溶液褪色,紫色石蕊溶液变为红色
2H2SO4(浓)+Cu == CuSO4 + SO2 ↑ + 2H2O
△
S元素的化合价降低生成SO2,硫酸做氧化剂
反应后生成了盐,硫酸又起到酸的作用
浓硫酸虽具有强氧化性,但其与铁、铝在常温下并不能顺利反应。
浓硫酸与铁、铝接触时,会使金属表面生成一层致密的氧化物薄膜
而钝化,阻止了内部的金属继续与硫酸发生反应。
因此冷的浓硫酸可以用铁质或铝质容器储存。
(3)脱水性
浓硫酸能把有机化合物中的_________________________ _ _______脱去,而使这些有机化合物炭化。
氢、氧元素按水的元素组成质量比
“黑面包”实验:向蔗糖中加入浓硫酸,并不断搅拌(要在通风的地方进行实验)
浓硫酸脱水性与吸水性的比较
{6990078A-EF19-4AB4-94A1-49CAE780AFFB}
吸水性
脱水性
原理
浓硫酸吸收气体、液体中的水分子及固体中的结晶水
浓硫酸把有机物中氢、氧元素按水的组成比脱去
区别
物质中含有H2O
物质中不含H2O,只含有氢元素和氧元素
作用对象
含有水分子或结晶水的物质
一般为含氢、氧元素的有机物
变化类型
物理变化、化学变化
化学变化
应用
作干燥剂
硫酸的用途
硫酸既是化学实验室中的重要试剂,也是重要的化工原料。工业上,硫酸
常用于制造化肥、农药、炸药、染料等,还用于石油精炼、金属加工等。
接触法制硫酸的生产流程
三.酸雨及其防治
03
酸雨:
硫酸型酸雨:
pH<5.6 的降水(雨、雪等)
排放到空气中的二氧化硫在氧气和水蒸气的共同作用
下形成酸雾,随雨水降落就成为酸雨。这样所形成的酸雨也常称硫酸型酸雨。
①硫酸型酸雨的形成
化石燃料燃烧产生SO2
途径Ⅰ—
途径Ⅱ—
SO2经两种途径
可转化为硫酸
(1)使湖泊的水质变 ,导致水生生物死亡。
(2)浸渍土壤,会使土壤变得贫瘠。
(3)造成森林大面积死亡。
(4)腐蚀建筑,会使建筑变得面目全非。
(5)酸雨对人体健康也有直接影响,如使饮用水中 含量增加。
酸
重金属元素
②酸雨的危害
(1)消除 ,改变 结构,开发利用 ,如太阳能、风能、氢能等。
(2)对酸性物质的排放加以控制,如对含硫燃料预先进行脱硫,对废气中的二氧化硫进行回收处理等。
(3)健全法律法规,严格规定污染物的排放标准,提高环境保护意识等。
③酸雨的防治
污染源
能源
清洁能源
下列有关说法正确的是
A.常温下浓硫酸不能与铁、铝发生反应而使铁、铝等金属钝化
B.用浓硫酸能在白纸上写出黑色文字,这体现了浓硫酸的吸水性
C.浓硫酸中硫酸主要以H2SO4分子形式存在
D.稀硫酸和浓硫酸因为均含有硫酸,所以其性质相同
随课练习
环境污染是人类社会面临的重大威胁。酸雨是一种严重的环境污染,酸雨形成的主要原因是
A.燃放烟花爆竹
B.大气中二氧化碳的含量增加
C.森林乱砍滥伐,破坏了生态平衡
D.大量燃烧煤炭和石油等含硫化石燃料
随课练习
下列现象或用途与浓硫酸的脱水性有关的是
A.浓硫酸可用作氯气的干燥剂
B.浓硫酸滴到胆矾上,蓝色晶体变成白色粉末
C.浓硫酸滴加到蔗糖中,蔗糖变黑
D.浓硫酸在加热条件下可与铜等不活泼金属反应
随课练习
某同学选用下列实验装置,验证浓硫酸与碳反应的生成物。下列说法正确的是
A.浓硫酸与碳反应中,浓硫酸
表现出酸性和强氧化性
B.验证产物的正确连接顺序为Ⅰ
→Ⅳ→Ⅲ→Ⅱ
C.装置Ⅱ中两侧品红溶液在实验设计中的作用不相同
D.若连接顺序为Ⅰ→Ⅱ→Ⅲ→Ⅳ,无法验证产物中有无CO2
随课练习
随课练习
下列有关SO2的叙述不正确的是
A.SO2的水溶液能导电,SO2是电解质
B.用NaOH等碱溶液吸收尾气中的SO2,体现了SO2的酸性氧化物的性质
C.SO2在大气中能转化为SO3,体现了SO2的还原性
D.SO2的水溶液久置于空气中,水溶液的酸性会增强
随课练习
下列物质能使品红溶液褪色,且褪色原理基本相同的是
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥过氧化氢
A.①②④⑥ B.①②③⑤
C.②④⑤⑥ D.③④⑤⑥
将SO2分别通入如图四种溶液中,现象及SO2表现的性质均正确的是(已知:NO3?在酸性条件下具有强氧化性)
A.a中紫色溶液褪色,SO2表现氧化性
B.b中红色溶液先褪色,后重新变红,
SO2表现漂白性
C.c中溶液中出现白色沉淀,SO2表现还原性,其水溶液呈酸性
D.d中溶液中无明显现象,SO2表现酸性氧化物的性质
?
随课练习
某小组用如图装置探究SO2的性质。下列离子方程式书写不正确的是
A.甲中紫色褪去:5SO2+2MnO4?+
2H2O===2Mn2++5SO42?+4H+
B.乙中蓝色逐渐变浅:I2+SO2+2H2O
===2I-+SO42?+4H+
C.丙中产生少量白色沉淀:Ba2++SO2+H2O===BaSO3↓+2H+
D.丁中可能的反应:SO2+2OH-===SO32?+H2O
?
随课练习
为测定某区域空气中SO2的含量,课外小组的同学将空气样品通入200 mL 0.100 mol·L-1的酸性KMnO4溶液中(假定样品中无其他还原性气体,SO2可被溶液充分吸收),反应的离子方程式为5SO2+2MnO4?+2H2O===5SO42?+2Mn2++4H+。若空气流量为a L·min-1,经过b min溶液恰好褪色,则该空气样品中SO2的含量(单位:g·L-1)为
A.825???????? B.1625????????
C.85???????? D.165????????
?
随课练习
THANK YOU
核心素养目标
1.掌握SO2的重要物理、化学性质及实验现象。
2.能从物质类别及化合价的角度预测常见含硫化合物的转化关系,会设计实验实现不同价态含硫物质的相互转化。
一.二氧化硫
01
二氧化硫的物理性质
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}颜色
状态
气味
毒性
密度
溶解性
无色
气体
刺激性气味
有毒
比空气大
易溶于水
(1:40)
二氧化硫的化学性质
根据已学的知识猜测二氧化硫的化学性质
酸性
氧化物
化合价
为+4
中间价态
与水反应
与碱反应
与碱性氧化物反应
氧化性
还原性
SO2与水的反应
把充有SO2、塞有橡胶塞的试管倒立于水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验现象
实验结论
试管内液面上升
SO2易溶于水
pH试纸变为红色
SO2水溶液显酸性
二氧化硫与碱反应
SO2 + CaO = CaSO3
SO2通入NaOH溶液:
二氧化硫与碱性氧化物反应
SO2 + 2NaOH = Na2SO3 + H2O
二氧化硫尾气吸收
SO2 + Ca(OH)2 = CaSO3 ↓ + H2O
二氧化硫能使澄清石灰水变浑浊
SO2通入澄清石灰水:
H2S、Na2S
SO2、H2SO3、Na2SO3
H2SO4
S
SO2氧化还原性质的探究
性质推断:
课本实验:不同价态硫元素之间的转化(以SO2为主要对象)
实验用品:SO2 水溶液,Na2SO3 溶液,浓硫酸,Na2S溶液,
稀硫酸,NaOH 溶液,酸性 KMnO4 溶液,
氯水,KI 溶液,淀粉溶液,品红溶液,铜片
氧化性物质:SO2 水溶液,Na2SO3 溶液,浓硫酸,稀硫酸,酸性 KMnO4 溶液,氯水
还原性物质:SO2 水溶液,Na2SO3 溶液,Na2S溶液,KI 溶液,铜片
性质不明:品红溶液
结合实验目的和氧化还原反应,进行实验设计
①SO2 水溶液+酸性 KMnO4 溶液
④SO2 水溶液+品红溶液
③SO2 水溶液+硫化钠溶液
②SO2 水溶液+氯水
⑤SO2 水溶液+KI 溶液
哪些实验能发生,
哪些不能发生?
SO2 只具有弱氧化性,不足以氧化I-
{4EF03731-DDC3-41A1-BE11-CD2086E007D1}试剂
SO2 水溶液+
酸性 KMnO4 溶液
SO2 水溶液+
氯水
SO2 水溶液+
品红溶液,
加热
SO2 水溶液+
硫化钠溶液
现象
解释与
结论
实验现象记录
高锰酸钾溶液颜色褪去
氯水颜色褪去
品红溶液颜色先褪去,
加热后颜色重现
SO2 水溶液具有还原性,与酸性
KMnO4 溶液、氯水发生氧化还原反应
SO2 水溶液使品红褪色
体现的不是还原性
产生沉淀
SO2 水溶液具有氧化性,
与硫化钠反应生成单质
硫沉淀
SO2+H2O H2SO3
SO2+2NaOH===Na2SO3+H2O
SO2+CaO===CaSO3
SO2+2H2S===3S↓+2H2O
2SO2+O2 2SO3
SO2+Cl2+2H2O===H2SO4+2HCl
褪色
又恢复红色
SO2化学性质总结
SO2的用途
生产硫酸
葡萄酒抗氧化
生产农药
生产染料
食品添加剂
制冷剂
二.浓硫酸
02
浓硫酸的物理性质
①基本性状:无色、黏稠、难挥发的油状液体;密度比水大;易溶于水。
②吸水性:可作干燥剂。可干燥酸性气体(CO2、SO2、Cl2、HCl等)和
中性气体(N2、O2、H2等);不能干燥碱性气体(NH3)和某些还原性
气体(H2S、HBr、HI)。
③溶于水放出大量的热:稀释时,将浓硫酸沿烧杯内壁缓缓倒入水中,
并用玻璃棒不断搅拌。
浓硫酸的化学性质
(1)酸的通性
①与酸碱指示剂作用
②与活泼金属反应
Fe+H2SO4══FeSO4+H2↑
③与碱性氧化物反应
CuO+H2SO4══CuSO4+H2O
④与碱反应
2NaOH+H2SO4══Na2SO4+2H2O
⑤与某些盐等反应
Na2CO3+H2SO4══Na2SO4+H2O+CO2↑
使紫色石蕊溶液变红
(2)强氧化性
硫酸中的硫元素处于最高价态。与稀硫酸主要体现H+的氧化性不同,
浓硫酸的氧化性来自硫酸分子中+6价硫的强得电子能力?,其能与许多
物质发生氧化还原反应,是常见的氧化剂。例如,在加热时浓硫酸可
与铜、木炭等单质发生反应。
2H2SO4(浓)+Cu ==== CuSO4 + SO2 ↑ + 2H2O
△
△
2H2SO4(浓)+ C ==== 2SO2 ↑ + CO2 ↑ + 2H2O
{D36F6785-E956-48E3-9B18-7F593D358D02}反应
试剂
浓硫酸和铜单质
反应
现象
解释与结论
化学方程式
未加热前,铜与浓硫酸不反应
加热后,铜丝表面变黑,同时有气泡产生
品红溶液褪色,紫色石蕊溶液变为红色
2H2SO4(浓)+Cu == CuSO4 + SO2 ↑ + 2H2O
△
S元素的化合价降低生成SO2,硫酸做氧化剂
反应后生成了盐,硫酸又起到酸的作用
浓硫酸虽具有强氧化性,但其与铁、铝在常温下并不能顺利反应。
浓硫酸与铁、铝接触时,会使金属表面生成一层致密的氧化物薄膜
而钝化,阻止了内部的金属继续与硫酸发生反应。
因此冷的浓硫酸可以用铁质或铝质容器储存。
(3)脱水性
浓硫酸能把有机化合物中的_________________________ _ _______脱去,而使这些有机化合物炭化。
氢、氧元素按水的元素组成质量比
“黑面包”实验:向蔗糖中加入浓硫酸,并不断搅拌(要在通风的地方进行实验)
浓硫酸脱水性与吸水性的比较
{6990078A-EF19-4AB4-94A1-49CAE780AFFB}
吸水性
脱水性
原理
浓硫酸吸收气体、液体中的水分子及固体中的结晶水
浓硫酸把有机物中氢、氧元素按水的组成比脱去
区别
物质中含有H2O
物质中不含H2O,只含有氢元素和氧元素
作用对象
含有水分子或结晶水的物质
一般为含氢、氧元素的有机物
变化类型
物理变化、化学变化
化学变化
应用
作干燥剂
硫酸的用途
硫酸既是化学实验室中的重要试剂,也是重要的化工原料。工业上,硫酸
常用于制造化肥、农药、炸药、染料等,还用于石油精炼、金属加工等。
接触法制硫酸的生产流程
三.酸雨及其防治
03
酸雨:
硫酸型酸雨:
pH<5.6 的降水(雨、雪等)
排放到空气中的二氧化硫在氧气和水蒸气的共同作用
下形成酸雾,随雨水降落就成为酸雨。这样所形成的酸雨也常称硫酸型酸雨。
①硫酸型酸雨的形成
化石燃料燃烧产生SO2
途径Ⅰ—
途径Ⅱ—
SO2经两种途径
可转化为硫酸
(1)使湖泊的水质变 ,导致水生生物死亡。
(2)浸渍土壤,会使土壤变得贫瘠。
(3)造成森林大面积死亡。
(4)腐蚀建筑,会使建筑变得面目全非。
(5)酸雨对人体健康也有直接影响,如使饮用水中 含量增加。
酸
重金属元素
②酸雨的危害
(1)消除 ,改变 结构,开发利用 ,如太阳能、风能、氢能等。
(2)对酸性物质的排放加以控制,如对含硫燃料预先进行脱硫,对废气中的二氧化硫进行回收处理等。
(3)健全法律法规,严格规定污染物的排放标准,提高环境保护意识等。
③酸雨的防治
污染源
能源
清洁能源
下列有关说法正确的是
A.常温下浓硫酸不能与铁、铝发生反应而使铁、铝等金属钝化
B.用浓硫酸能在白纸上写出黑色文字,这体现了浓硫酸的吸水性
C.浓硫酸中硫酸主要以H2SO4分子形式存在
D.稀硫酸和浓硫酸因为均含有硫酸,所以其性质相同
随课练习
环境污染是人类社会面临的重大威胁。酸雨是一种严重的环境污染,酸雨形成的主要原因是
A.燃放烟花爆竹
B.大气中二氧化碳的含量增加
C.森林乱砍滥伐,破坏了生态平衡
D.大量燃烧煤炭和石油等含硫化石燃料
随课练习
下列现象或用途与浓硫酸的脱水性有关的是
A.浓硫酸可用作氯气的干燥剂
B.浓硫酸滴到胆矾上,蓝色晶体变成白色粉末
C.浓硫酸滴加到蔗糖中,蔗糖变黑
D.浓硫酸在加热条件下可与铜等不活泼金属反应
随课练习
某同学选用下列实验装置,验证浓硫酸与碳反应的生成物。下列说法正确的是
A.浓硫酸与碳反应中,浓硫酸
表现出酸性和强氧化性
B.验证产物的正确连接顺序为Ⅰ
→Ⅳ→Ⅲ→Ⅱ
C.装置Ⅱ中两侧品红溶液在实验设计中的作用不相同
D.若连接顺序为Ⅰ→Ⅱ→Ⅲ→Ⅳ,无法验证产物中有无CO2
随课练习
随课练习
下列有关SO2的叙述不正确的是
A.SO2的水溶液能导电,SO2是电解质
B.用NaOH等碱溶液吸收尾气中的SO2,体现了SO2的酸性氧化物的性质
C.SO2在大气中能转化为SO3,体现了SO2的还原性
D.SO2的水溶液久置于空气中,水溶液的酸性会增强
随课练习
下列物质能使品红溶液褪色,且褪色原理基本相同的是
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥过氧化氢
A.①②④⑥ B.①②③⑤
C.②④⑤⑥ D.③④⑤⑥
将SO2分别通入如图四种溶液中,现象及SO2表现的性质均正确的是(已知:NO3?在酸性条件下具有强氧化性)
A.a中紫色溶液褪色,SO2表现氧化性
B.b中红色溶液先褪色,后重新变红,
SO2表现漂白性
C.c中溶液中出现白色沉淀,SO2表现还原性,其水溶液呈酸性
D.d中溶液中无明显现象,SO2表现酸性氧化物的性质
?
随课练习
某小组用如图装置探究SO2的性质。下列离子方程式书写不正确的是
A.甲中紫色褪去:5SO2+2MnO4?+
2H2O===2Mn2++5SO42?+4H+
B.乙中蓝色逐渐变浅:I2+SO2+2H2O
===2I-+SO42?+4H+
C.丙中产生少量白色沉淀:Ba2++SO2+H2O===BaSO3↓+2H+
D.丁中可能的反应:SO2+2OH-===SO32?+H2O
?
随课练习
为测定某区域空气中SO2的含量,课外小组的同学将空气样品通入200 mL 0.100 mol·L-1的酸性KMnO4溶液中(假定样品中无其他还原性气体,SO2可被溶液充分吸收),反应的离子方程式为5SO2+2MnO4?+2H2O===5SO42?+2Mn2++4H+。若空气流量为a L·min-1,经过b min溶液恰好褪色,则该空气样品中SO2的含量(单位:g·L-1)为
A.825???????? B.1625????????
C.85???????? D.165????????
?
随课练习
THANK YOU
