第一章 分子动理论 知识点清单 高中物理人教版(2019)选择性必修第三册
文档属性
| 名称 | 第一章 分子动理论 知识点清单 高中物理人教版(2019)选择性必修第三册 |  | |
| 格式 | docx | ||
| 文件大小 | 368.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2025-08-03 09:01:16 | ||
图片预览




文档简介
新教材 人教版 高中物理
选择性必修第三册
第1章知识点清单
目录
第1章 分子动理论
第1节 分子动理论的基本内容
第2节 实验用油膜法估测油酸分子的大小
第3节 分子运动速率分布规律
第4节 分子动能和分子势能
第1章 分子动理论
第1节 分子动理论的基本内容
一、物体是由大量分子组成的
1. 分子模型:
①球体模型:固体、液体;
②立方体模型:气体。
2. 分子大小:
①分子直径:数量级为10-10 m;
②分子质量:数量级为10-26 kg。
3. 阿伏加德罗常数:1 mol的任何物质都含有相同的粒子数,这个数量用阿伏加德罗常数表示,即NA=6. 02×1023 mol-1。
二、分子热运动
1. 扩散现象
(1)定义:不同种物质能够彼此进入对方的现象。
(2)实质:不是外界作用引起的,也不是化学反应的结果,而是由物质分子的无规则运动产生的,温度越高,扩散现象越明显。
2. 布朗运动
(1)定义:悬浮在液体(或气体)中的小颗粒的永不停息的无规则运动。
(2)实质:悬浮小颗粒受到做无规则运动的液体分子的撞击,颗粒越小、温度越高,运动越剧烈。
3. 热运动
(1)定义:分子永不停息的无规则运动。
(2)特点:温度是分子热运动剧烈程度的标志。温度越高,热运动越剧烈。
三、分子间的作用力
(1)分子间的引力和斥力是同时存在的,实际表现出的分子间作用力是引力和斥力的合力。
(2)分子间作用力与分子间距离的关系
①当r=r0时F引=F斥,分子间的作用力为0;
②当r>r0时,F引>F斥,分子间的作用力表现为引力;
③当r四、对阿伏加德罗常数的理解
阿伏加德罗常数是联系微观物理量和宏观物理量的桥梁。它把摩尔质量Mmol、摩尔体积Vmol、物体的质量m、物体的体积V、物体的密度ρ等宏观量,跟单个分子的质量m0、单个分子的体积V0等微观量联系起来。
注意要点
(1)密度ρ==,但要切记对单个分子ρ=是没有物理意义的。
(2)阿伏加德罗常数公式NA=只适用于固体、液体,对气体不成立,这是因为固体和液体分子排列比较紧密,分子间距可以忽略,但气体分子间距较大,分子间距不能忽略。
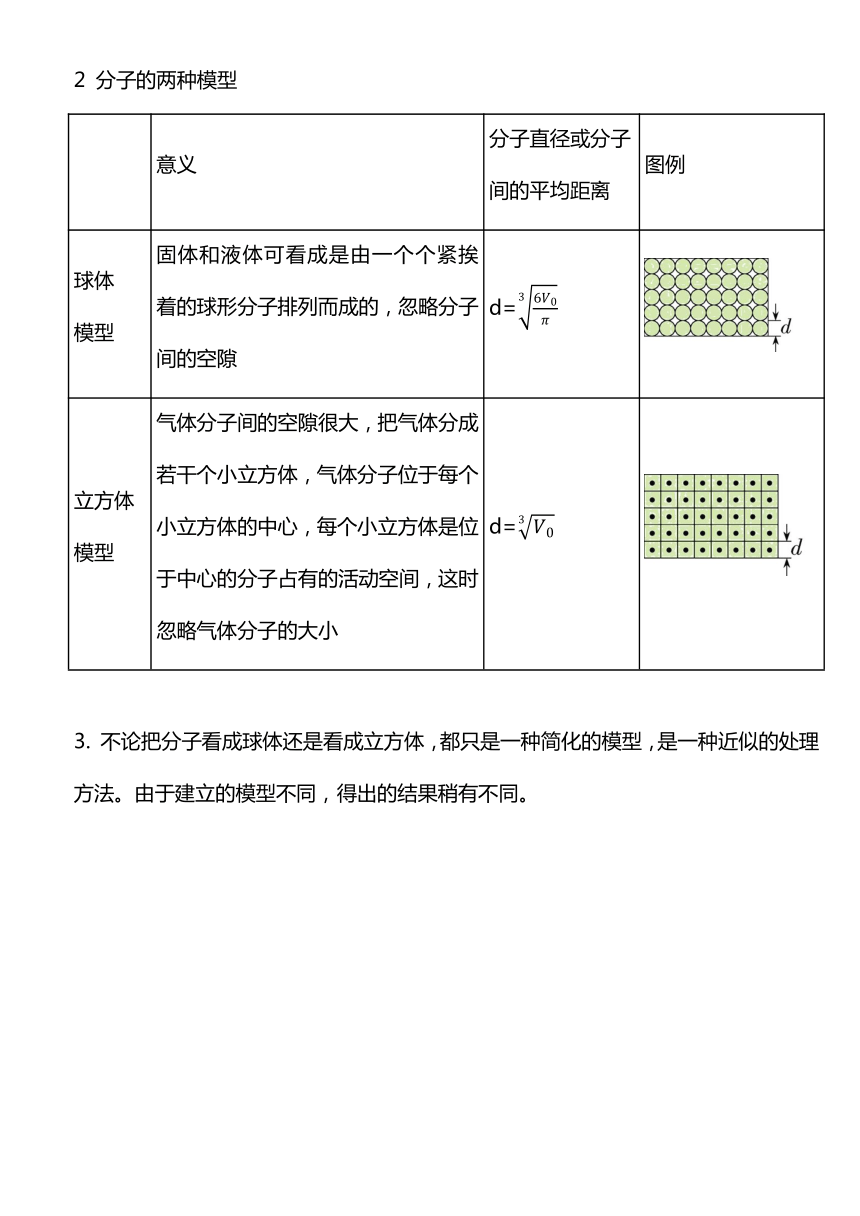
2 分子的两种模型
意义 分子直径或分子 间的平均距离 图例
球体 模型 固体和液体可看成是由一个个紧挨着的球形分子排列而成的,忽略分子间的空隙 d=
立方体 模型 气体分子间的空隙很大,把气体分成若干个小立方体,气体分子位于每个小立方体的中心,每个小立方体是位于中心的分子占有的活动空间,这时忽略气体分子的大小 d=
3. 不论把分子看成球体还是看成立方体,都只是一种简化的模型,是一种近似的处理方法。由于建立的模型不同,得出的结果稍有不同。
第2节 实验用油膜法估测油酸分子的大小
一、实验思路
将油酸在酒精中稀释后再滴入水中,使油酸充分展开,溶液中的酒精溶于水并很快挥发,从而获得纯油酸形成的单分子油膜。可以粗略地认为,油膜的厚度d等于1滴油酸酒精溶液中纯油酸的体积V与它在水面上摊开的面积S之比,即d= 。
二、实验过程与数据处理
1. 测量1滴油酸酒精溶液中纯油酸的体积V
(1)配制一定浓度的油酸酒精溶液。
(2)用注射器吸取一段油酸酒精溶液,由注射器上的刻度读取该段溶液的总体积,再把它一滴一滴地滴入烧杯中,记下滴液的总滴数。
(3)用它们的总体积除以总滴数,得到1滴油酸酒精溶液的体积,再根据浓度计算其所含纯油酸的体积V。
2. 测量1滴油酸酒精溶液在水面上形成的油膜面积S
(1)在浅盘里盛上水,一只手捏住盛有爽身粉的布袋,另一只手拍打,将爽身粉均匀地撒在水面上。
(2)用注射器向水面上滴1滴油酸酒精溶液,油酸立即在水面散开,形成一块油膜。油膜上没有爽身粉,可以清楚地看出它的轮廓。
(3)待油膜形状稳定后,将事先准备好的带有坐标方格的玻璃板放在浅盘上,在玻璃板上描下薄膜的形状。
(4)根据画有油膜轮廓的玻璃板上的坐标方格,计算轮廓范围内正方形的个数,不足半个的舍去,多于半个的算一个,然后用正方形的个数乘以单个正方形的面积就得到油膜的面积S。
3. 根据d=计算油酸分子的直径。
三、数据处理与误差分析
1. 数据处理
(1)1滴油酸酒精溶液的平均体积: =。
(2)1滴油酸酒精溶液中含纯油酸的体积:
V=×油酸酒精溶液的体积浓度。(体积浓度=)
(3)油膜的面积S=n×1 cm2。(n为有效格数,小方格的边长为1 cm)
(4)油酸分子直径d=。(代入数据时注意统一单位)
2. 误差来源
(1)偶然误差
①实验时油酸酒精溶液的实际浓度和理论值间存在偏差。
②实验时1滴油酸酒精溶液的实际体积和理论值间存在偏差。
③实验时采用“互补法”(即不足半个舍去,多于半个的算一个)计算获得的油膜面积与实际的油膜面积间存在偏差。
(2)系统误差
实验时爽身粉和油酸在水面上的实际分布情况和理想中的“均匀”“单层分子纯油酸层”间存在偏差。
第3节 分子运动速率分布规律
一、气体分子运动的特点
1. 气体分子间距离大约是分子直径的10倍,分子间作用力很弱。
2. 通常认为,气体分子除了相互碰撞或者跟器壁碰撞外不受力而做匀速直线运动。
3. 在某一时刻,向着各个方向运动的气体分子数目几乎相等。
二、分子运动速率分布图像
1. 在一定温度下,气体分子的速率表现出“中间多、两头少”的分布规律。
2. 当温度升高时,“中间多、两头少”的分布规律不变,气体分子的平均速率增大,速率小的分子数减少,速率大的分子数增加,分布曲线的峰值向速率大的一方移动。
三、气体压强的微观解释
1. 气体压强的形成原因
气体分子飞到器壁时,就会跟器壁发生碰撞(可视为弹性碰撞),就是这个撞击对器壁产生了作用力,从而产生了压强。
2. 用动量定理和牛顿运动定律解释撞击力
质量为m的气体分子以速度v与器壁碰撞后原速率反弹,气体分子受到的冲量为
FΔt=-mv-mv=-2mv,气体分子受到的作用力为F=-,根据牛顿第三定律,器壁受到的作用力为F‘=。
3. 气体对容器的压强
对于单个分子来说,这种撞击是间断的、不均匀的,但对于大量分子总的作用来说,就表现为连续的、均匀的了。器壁单位面积上受到的压力,就是气体的压强。
四、气体压强的产生原因及决定因素
1. 决定气体压强的微观因素
(1)气体分子的平均速率:气体的温度高,气体分子的平均速率就大,气体分子与器壁碰撞(可视为弹性碰撞)时给器壁的作用力就大,则气体的压强就大。
(2)气体分子的数密度(单位体积内气体分子的个数):气体分子的数密度大,在单位时间内,与单位面积器壁碰撞的分子数就多,给器壁的平均作用力就大,则气体的压强就大。
2. 决定气体压强的宏观因素
(1)与温度有关:在体积不变的情况下,温度越高,气体分子的平均速率越大,则气体的压强越大。
(2)与体积有关:在温度不变的情况下,体积越小,气体分子的数密度越大,则气体的压强越大。
第4节 分子动能和分子势能
一、分子动能
1. 分子动能:做热运动的分子具有的动能。
2. 分子的平均动能:所有分子的动能的平均值。
3. 温度的微观含义:温度是分子热运动平均动能的标志。
二、分子势能
1. 分子势能:分子间存在着相互作用力,可以证明分子间的作用力所做的功与路径无关,分子组成的系统具有分子势能。
2. 决定因素
(1)宏观:分子势能与物体体积有关。
(2)微观:分子势能与分子间距离有关。
3. 分子势能与分子间距离的关系
(1)当r>r0时,分子间的作用力表现为引力;若r减小,分子间的作用力做正功,分子势能减小。
(2)当r=r0时,分子间的作用力为零。当分子间距离r减小到r0时,分子势能减小到最小。
(3)当r三、物体的内能
1. 物体的内能:物体中所有分子的热运动动能与分子势能的总和。
2. 影响因素
(1)宏观:温度、体积及物质的量。
(2)微观:分子平均动能、分子势能及分子数。
四、分子动能
1. 单个分子的动能
(1)物体由大量分子组成,在某一瞬间,物体中分子热运动的速率大小不一,各个分子的动能也有大有小。
(2)分子在永不停息地做无规则热运动,各个分子热运动的速率会发生变化,各个分子的动能也在不断改变。
2. 大量分子平均动能的必然性(温度的内涵)
(1)温度的微观含义
温度升高时,分子的热运动加剧,温度越高,分子热运动的平均动能越大。温度越低,分子热运动的平均动能越小。因此可以得出结论:物体温度升高时,分子热运动的平均动能增加。
(2)温度的统计意义
温度升高,个别分子的动能可能增大也可能减小,但总体上所有分子的动能之和一定是增加的,分子的平均动能一定增加;即个别分子的动能大小与温度是没有关系的,大量分子的平均动能大小与温度是有关系的。热现象是大量分子无规则运动的统计结果,所以单个分子的动能没有实际意义,有意义的是所有分子动能的平均值,即分子热运动的平均动能。
物体的每一温度值都对应着分子热运动的一个平均动能值,只要温度相同,任何分子的平均动能都相同。因此我们说“温度是物体分子热运动的平均动能的标志”。
五、分子势能的理解
1. 分子势能与分子间的作用力做功的关系
(1)分子间的作用力做正功,分子势能减少,分子间的作用力做了多少正功,分子势能就减少多少。
(2)分子间的作用力做负功,分子势能增加,克服分子间的作用力做了多少功,分子势能就增加多少。
2. 分子势能与分子间距离的关系
取两分子相距无穷远时分子势能为零,一般两分子间距离r>10r0时,分子势能均视为零。
图示
rr=r0 分子势能最小。在此位置左右分子间距离r不论减小或增大,分子势能都增大,所以说,平衡位置处是分子势能最小点
r>r0 分子间的作用力表现为引力,随着r的增大,分子间的作用力做负功,分子势能增大
r>10 r0 分子势能均视为零
3. 分子势能的特点
(1)分子势能是标量,正负表示的是大小,具体的值与零势能位置的选择有关。
(2)分子势能为零和分子势能最小的含义不同。一般选定分子间距离r为无穷远时的分子势能Ep为零,分子势能最小的位置一定在r=r0处。
(3)分子势能同重力势能、弹性势能、电势能一样,都是与某种力对应、由相对位置决定的能量,且该种力做功等于对应势能的变化。
六、物体的内能
1. 对内能的理解
(1)从微观上看,物体内能的大小由物体所含的分子总数、分子热运动的平均动能和分子间距离三个因素决定。
(2)从宏观上看,物体内能的大小由物质的量、温度和体积三个因素共同决定。
(3)从统计规律上看,内能是对大量分子而言的,对单个分子来说无意义。
(4)物体的内能受物态变化的影响。
2. 内能与机械能的区别和联系
内能 机械能
对应的运动形式 微观分子的热运动 宏观物体的机械运动
能量常见形式 分子动能、分子势能 物体的动能、重力势能和弹性势能
能量存在的原因 物体内大量分子的热运动和分子间存在相互作用力 物体做机械运动、被举高和发生形变
影响因素 物质的量、物体的温度、物体的体积及物态 物体的质量、机械运动的速度、相对于零势能面的高度和弹性形变程度
是否为零 永远不可能等于零 一定条件下可以等于零
联系 在一定条件下可以相互转化
3. 内能与热量的区别
(1)内能是一个状态量,一个物体在不同的状态下有不同的内能,而热量是一个过程量,它表示由于传热而引起的内能变化过程中转移的能量,即内能的改变量。
(2)如果没有传热,就无所谓热量,但此时物体仍具有一定的内能。例如,我们不能说“某物体在某温度时具有多少热量”。
(3)热能是内能通俗而不确切的说法,热量是物体在传热过程中内能转移的多少。
选择性必修第三册
第1章知识点清单
目录
第1章 分子动理论
第1节 分子动理论的基本内容
第2节 实验用油膜法估测油酸分子的大小
第3节 分子运动速率分布规律
第4节 分子动能和分子势能
第1章 分子动理论
第1节 分子动理论的基本内容
一、物体是由大量分子组成的
1. 分子模型:
①球体模型:固体、液体;
②立方体模型:气体。
2. 分子大小:
①分子直径:数量级为10-10 m;
②分子质量:数量级为10-26 kg。
3. 阿伏加德罗常数:1 mol的任何物质都含有相同的粒子数,这个数量用阿伏加德罗常数表示,即NA=6. 02×1023 mol-1。
二、分子热运动
1. 扩散现象
(1)定义:不同种物质能够彼此进入对方的现象。
(2)实质:不是外界作用引起的,也不是化学反应的结果,而是由物质分子的无规则运动产生的,温度越高,扩散现象越明显。
2. 布朗运动
(1)定义:悬浮在液体(或气体)中的小颗粒的永不停息的无规则运动。
(2)实质:悬浮小颗粒受到做无规则运动的液体分子的撞击,颗粒越小、温度越高,运动越剧烈。
3. 热运动
(1)定义:分子永不停息的无规则运动。
(2)特点:温度是分子热运动剧烈程度的标志。温度越高,热运动越剧烈。
三、分子间的作用力
(1)分子间的引力和斥力是同时存在的,实际表现出的分子间作用力是引力和斥力的合力。
(2)分子间作用力与分子间距离的关系
①当r=r0时F引=F斥,分子间的作用力为0;
②当r>r0时,F引>F斥,分子间的作用力表现为引力;
③当r
阿伏加德罗常数是联系微观物理量和宏观物理量的桥梁。它把摩尔质量Mmol、摩尔体积Vmol、物体的质量m、物体的体积V、物体的密度ρ等宏观量,跟单个分子的质量m0、单个分子的体积V0等微观量联系起来。
注意要点
(1)密度ρ==,但要切记对单个分子ρ=是没有物理意义的。
(2)阿伏加德罗常数公式NA=只适用于固体、液体,对气体不成立,这是因为固体和液体分子排列比较紧密,分子间距可以忽略,但气体分子间距较大,分子间距不能忽略。
2 分子的两种模型
意义 分子直径或分子 间的平均距离 图例
球体 模型 固体和液体可看成是由一个个紧挨着的球形分子排列而成的,忽略分子间的空隙 d=
立方体 模型 气体分子间的空隙很大,把气体分成若干个小立方体,气体分子位于每个小立方体的中心,每个小立方体是位于中心的分子占有的活动空间,这时忽略气体分子的大小 d=
3. 不论把分子看成球体还是看成立方体,都只是一种简化的模型,是一种近似的处理方法。由于建立的模型不同,得出的结果稍有不同。
第2节 实验用油膜法估测油酸分子的大小
一、实验思路
将油酸在酒精中稀释后再滴入水中,使油酸充分展开,溶液中的酒精溶于水并很快挥发,从而获得纯油酸形成的单分子油膜。可以粗略地认为,油膜的厚度d等于1滴油酸酒精溶液中纯油酸的体积V与它在水面上摊开的面积S之比,即d= 。
二、实验过程与数据处理
1. 测量1滴油酸酒精溶液中纯油酸的体积V
(1)配制一定浓度的油酸酒精溶液。
(2)用注射器吸取一段油酸酒精溶液,由注射器上的刻度读取该段溶液的总体积,再把它一滴一滴地滴入烧杯中,记下滴液的总滴数。
(3)用它们的总体积除以总滴数,得到1滴油酸酒精溶液的体积,再根据浓度计算其所含纯油酸的体积V。
2. 测量1滴油酸酒精溶液在水面上形成的油膜面积S
(1)在浅盘里盛上水,一只手捏住盛有爽身粉的布袋,另一只手拍打,将爽身粉均匀地撒在水面上。
(2)用注射器向水面上滴1滴油酸酒精溶液,油酸立即在水面散开,形成一块油膜。油膜上没有爽身粉,可以清楚地看出它的轮廓。
(3)待油膜形状稳定后,将事先准备好的带有坐标方格的玻璃板放在浅盘上,在玻璃板上描下薄膜的形状。
(4)根据画有油膜轮廓的玻璃板上的坐标方格,计算轮廓范围内正方形的个数,不足半个的舍去,多于半个的算一个,然后用正方形的个数乘以单个正方形的面积就得到油膜的面积S。
3. 根据d=计算油酸分子的直径。
三、数据处理与误差分析
1. 数据处理
(1)1滴油酸酒精溶液的平均体积: =。
(2)1滴油酸酒精溶液中含纯油酸的体积:
V=×油酸酒精溶液的体积浓度。(体积浓度=)
(3)油膜的面积S=n×1 cm2。(n为有效格数,小方格的边长为1 cm)
(4)油酸分子直径d=。(代入数据时注意统一单位)
2. 误差来源
(1)偶然误差
①实验时油酸酒精溶液的实际浓度和理论值间存在偏差。
②实验时1滴油酸酒精溶液的实际体积和理论值间存在偏差。
③实验时采用“互补法”(即不足半个舍去,多于半个的算一个)计算获得的油膜面积与实际的油膜面积间存在偏差。
(2)系统误差
实验时爽身粉和油酸在水面上的实际分布情况和理想中的“均匀”“单层分子纯油酸层”间存在偏差。
第3节 分子运动速率分布规律
一、气体分子运动的特点
1. 气体分子间距离大约是分子直径的10倍,分子间作用力很弱。
2. 通常认为,气体分子除了相互碰撞或者跟器壁碰撞外不受力而做匀速直线运动。
3. 在某一时刻,向着各个方向运动的气体分子数目几乎相等。
二、分子运动速率分布图像
1. 在一定温度下,气体分子的速率表现出“中间多、两头少”的分布规律。
2. 当温度升高时,“中间多、两头少”的分布规律不变,气体分子的平均速率增大,速率小的分子数减少,速率大的分子数增加,分布曲线的峰值向速率大的一方移动。
三、气体压强的微观解释
1. 气体压强的形成原因
气体分子飞到器壁时,就会跟器壁发生碰撞(可视为弹性碰撞),就是这个撞击对器壁产生了作用力,从而产生了压强。
2. 用动量定理和牛顿运动定律解释撞击力
质量为m的气体分子以速度v与器壁碰撞后原速率反弹,气体分子受到的冲量为
FΔt=-mv-mv=-2mv,气体分子受到的作用力为F=-,根据牛顿第三定律,器壁受到的作用力为F‘=。
3. 气体对容器的压强
对于单个分子来说,这种撞击是间断的、不均匀的,但对于大量分子总的作用来说,就表现为连续的、均匀的了。器壁单位面积上受到的压力,就是气体的压强。
四、气体压强的产生原因及决定因素
1. 决定气体压强的微观因素
(1)气体分子的平均速率:气体的温度高,气体分子的平均速率就大,气体分子与器壁碰撞(可视为弹性碰撞)时给器壁的作用力就大,则气体的压强就大。
(2)气体分子的数密度(单位体积内气体分子的个数):气体分子的数密度大,在单位时间内,与单位面积器壁碰撞的分子数就多,给器壁的平均作用力就大,则气体的压强就大。
2. 决定气体压强的宏观因素
(1)与温度有关:在体积不变的情况下,温度越高,气体分子的平均速率越大,则气体的压强越大。
(2)与体积有关:在温度不变的情况下,体积越小,气体分子的数密度越大,则气体的压强越大。
第4节 分子动能和分子势能
一、分子动能
1. 分子动能:做热运动的分子具有的动能。
2. 分子的平均动能:所有分子的动能的平均值。
3. 温度的微观含义:温度是分子热运动平均动能的标志。
二、分子势能
1. 分子势能:分子间存在着相互作用力,可以证明分子间的作用力所做的功与路径无关,分子组成的系统具有分子势能。
2. 决定因素
(1)宏观:分子势能与物体体积有关。
(2)微观:分子势能与分子间距离有关。
3. 分子势能与分子间距离的关系
(1)当r>r0时,分子间的作用力表现为引力;若r减小,分子间的作用力做正功,分子势能减小。
(2)当r=r0时,分子间的作用力为零。当分子间距离r减小到r0时,分子势能减小到最小。
(3)当r
1. 物体的内能:物体中所有分子的热运动动能与分子势能的总和。
2. 影响因素
(1)宏观:温度、体积及物质的量。
(2)微观:分子平均动能、分子势能及分子数。
四、分子动能
1. 单个分子的动能
(1)物体由大量分子组成,在某一瞬间,物体中分子热运动的速率大小不一,各个分子的动能也有大有小。
(2)分子在永不停息地做无规则热运动,各个分子热运动的速率会发生变化,各个分子的动能也在不断改变。
2. 大量分子平均动能的必然性(温度的内涵)
(1)温度的微观含义
温度升高时,分子的热运动加剧,温度越高,分子热运动的平均动能越大。温度越低,分子热运动的平均动能越小。因此可以得出结论:物体温度升高时,分子热运动的平均动能增加。
(2)温度的统计意义
温度升高,个别分子的动能可能增大也可能减小,但总体上所有分子的动能之和一定是增加的,分子的平均动能一定增加;即个别分子的动能大小与温度是没有关系的,大量分子的平均动能大小与温度是有关系的。热现象是大量分子无规则运动的统计结果,所以单个分子的动能没有实际意义,有意义的是所有分子动能的平均值,即分子热运动的平均动能。
物体的每一温度值都对应着分子热运动的一个平均动能值,只要温度相同,任何分子的平均动能都相同。因此我们说“温度是物体分子热运动的平均动能的标志”。
五、分子势能的理解
1. 分子势能与分子间的作用力做功的关系
(1)分子间的作用力做正功,分子势能减少,分子间的作用力做了多少正功,分子势能就减少多少。
(2)分子间的作用力做负功,分子势能增加,克服分子间的作用力做了多少功,分子势能就增加多少。
2. 分子势能与分子间距离的关系
取两分子相距无穷远时分子势能为零,一般两分子间距离r>10r0时,分子势能均视为零。
图示
r
r>r0 分子间的作用力表现为引力,随着r的增大,分子间的作用力做负功,分子势能增大
r>10 r0 分子势能均视为零
3. 分子势能的特点
(1)分子势能是标量,正负表示的是大小,具体的值与零势能位置的选择有关。
(2)分子势能为零和分子势能最小的含义不同。一般选定分子间距离r为无穷远时的分子势能Ep为零,分子势能最小的位置一定在r=r0处。
(3)分子势能同重力势能、弹性势能、电势能一样,都是与某种力对应、由相对位置决定的能量,且该种力做功等于对应势能的变化。
六、物体的内能
1. 对内能的理解
(1)从微观上看,物体内能的大小由物体所含的分子总数、分子热运动的平均动能和分子间距离三个因素决定。
(2)从宏观上看,物体内能的大小由物质的量、温度和体积三个因素共同决定。
(3)从统计规律上看,内能是对大量分子而言的,对单个分子来说无意义。
(4)物体的内能受物态变化的影响。
2. 内能与机械能的区别和联系
内能 机械能
对应的运动形式 微观分子的热运动 宏观物体的机械运动
能量常见形式 分子动能、分子势能 物体的动能、重力势能和弹性势能
能量存在的原因 物体内大量分子的热运动和分子间存在相互作用力 物体做机械运动、被举高和发生形变
影响因素 物质的量、物体的温度、物体的体积及物态 物体的质量、机械运动的速度、相对于零势能面的高度和弹性形变程度
是否为零 永远不可能等于零 一定条件下可以等于零
联系 在一定条件下可以相互转化
3. 内能与热量的区别
(1)内能是一个状态量,一个物体在不同的状态下有不同的内能,而热量是一个过程量,它表示由于传热而引起的内能变化过程中转移的能量,即内能的改变量。
(2)如果没有传热,就无所谓热量,但此时物体仍具有一定的内能。例如,我们不能说“某物体在某温度时具有多少热量”。
(3)热能是内能通俗而不确切的说法,热量是物体在传热过程中内能转移的多少。
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
