江苏省盐城市2015-2016学年高一下学期期末考试 化学
文档属性
| 名称 | 江苏省盐城市2015-2016学年高一下学期期末考试 化学 |  | |
| 格式 | zip | ||
| 文件大小 | 522.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-20 23:00:59 | ||
图片预览


文档简介
2015/2016学年度第二学期高一年级期终考试
化
学
试
题
本卷可能用到的相对原子质量:
H
1
C
12
N
14
O
16
S
32
Ca
40
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3
分,共69分)。
1.最近中美科学家首次研获单层硼原子构成的
“硼烯”(如图),有关“硼烯”的说法正确的是
A.是一种新型化合物
B.与金刚石结构相似
C.与B互为同素异形体
D.由共价键构成的单质
2.只含离子键的化合物为
A.CaO
B.NaOH
C.NH3
D.C60
3.118号元素(Og)是2015年底进入周期表的新成员之一,Og的中子数为
A.297
B.179
C.118
D.61
4.某导电性塑料的结构如下图所示,合成该塑料的单体为
A.乙炔
B.乙烯
C.乙烷
D.甲烷
5.下列物质中,一定条件下能和氢氧化钠溶液发生反应的是
A.乙醇
B.乙烯
C.油脂
D.汽油
6.一种氢能的制取、贮存及利用如右图所示,图示中能量转化方式不涉及
A.电能→化学能
B.光能→化学能
C.化学能→电能
D.电能→机械能
7.LiH(氢化锂)常用作干燥剂、氢气发生剂等,可利用下列
反应制备:2Li(熔融)
+H2
2LiH。有关说法不正确的是
A.微粒半径:r(H-)
>
r(H+)
B.H-与Li+电子层结构相同
C.还原性:H
>
Li
D.碱性:LiOH
<
NaOH
8.下列各组混合物中,不能混溶的是
A.苯和水
B.植物油和乙醇
C.酒精和水
D.汽油和煤油
9.2015年美国生物学家Joe
Hanson博士测算出新生婴儿的化学式为:
Co1Mo3
Se4
Cr7
F13
…C85,700,000
O132,000,000
H375,000,000(原子数目递增排序)。
有关新生婴儿组成元素的说法正确的是
A.全部为非金属元素
B.全部由短周期元素组成
C.原子序数越小其原子数目越多
D.氧的质量分数大于氢的质量分数
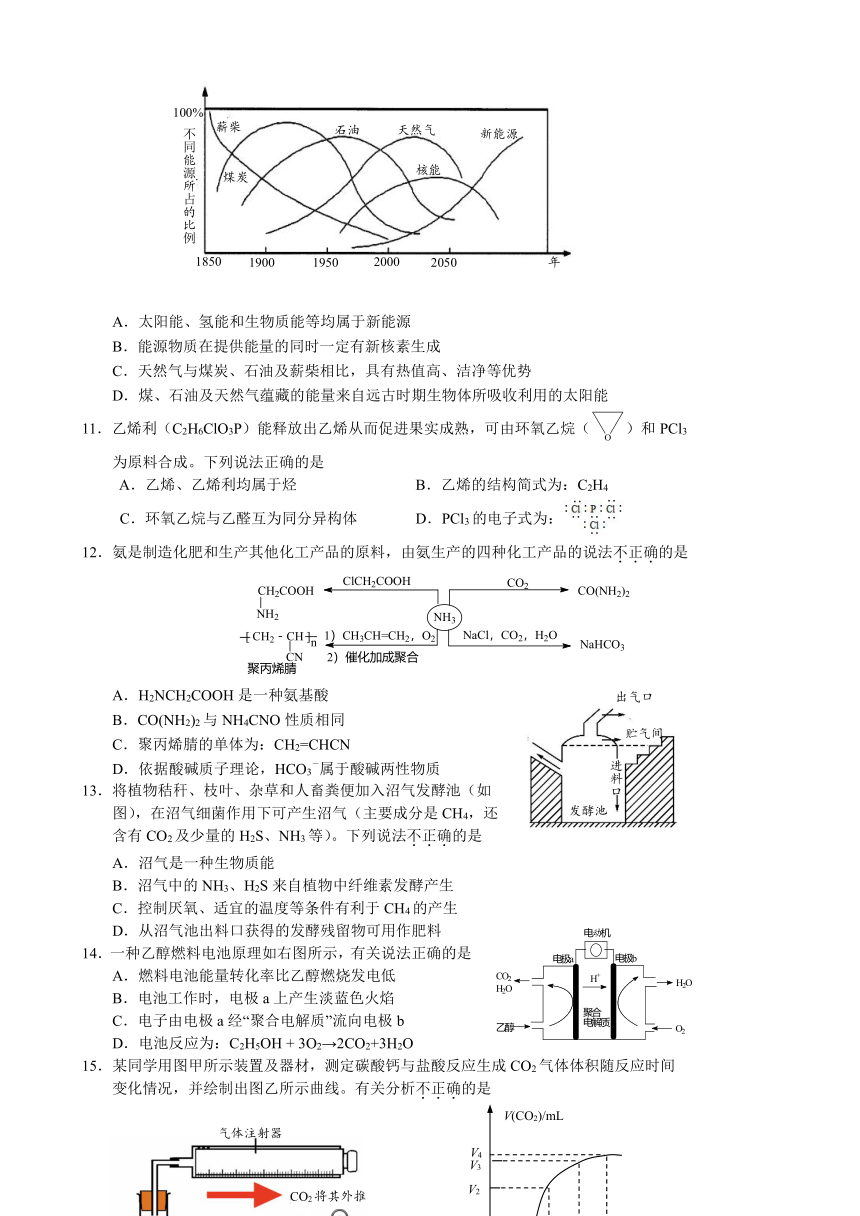
10.美国Marchetin博士对世界一次能源替代趋势曾作如下预测。有关说法不正确的是
A.太阳能、氢能和生物质能等均属于新能源
B.能源物质在提供能量的同时一定有新核素生成
C.天然气与煤炭、石油及薪柴相比,具有热值高、洁净等优势
D.煤、石油及天然气蕴藏的能量来自远古时期生物体所吸收利用的太阳能
11.乙烯利(C2H6ClO3P)能释放出乙烯从而促进果实成熟,可由环氧乙烷()和PCl3
为原料合成。下列说法正确的是
A.乙烯、乙烯利均属于烃
B.乙烯的结构简式为:C2H4
C.环氧乙烷与乙醛互为同分异构体
D.PCl3的电子式为:
12.氨是制造化肥和生产其他化工产品的原料,由氨生产的四种化工产品的说法不正确的是
A.H2NCH2COOH是一种氨基酸
B.CO(NH2)2与NH4CNO性质相同
C.聚丙烯腈的单体为:CH2=CHCN
D.依据酸碱质子理论,HCO3-属于酸碱两性物质
13.将植物秸秆、枝叶、杂草和人畜粪便加入沼气发酵池(如
图),在沼气细菌作用下可产生沼气(主要成分是CH4,还
含有CO2及少量的H2S、NH3等)。下列说法不正确的是
A.沼气是一种生物质能
B.沼气中的NH3、H2S来自植物中纤维素发酵产生
C.控制厌氧、适宜的温度等条件有利于CH4的产生
D.从沼气池出料口获得的发酵残留物可用作肥料
14.一种乙醇燃料电池原理如右图所示,有关说法正确的是
A.燃料电池能量转化率比乙醇燃烧发电低
B.电池工作时,电极a上产生淡蓝色火焰
C.电子由电极a经“聚合电解质”流向电极b
D.电池反应为:C2H5OH
+
3O2→2CO2+3H2O
15.某同学用图甲所示装置及器材,测定碳酸钙与盐酸反应生成CO2气体体积随反应时间
变化情况,并绘制出图乙所示曲线。有关分析不正确的是
A.CaCO3与盐酸的反应为放热反应
B.收集气体最多的时间段为t1~t2
C.平均反应速率:v(t1~t2)>
v(t2~t3)>
v(0~t1)>
v(t3~t4)
D.在t4后,收集到的CO2气体不再增加,一定是碳酸钙已完全反应
16.给定条件下,下列选项中所示的物质间转化,均能一步实现的是
①
②
③
④
A.①②③④
B.①③④
C.③④
D.①②
17.下列鉴别物质的方法不能达到目的的是
A.用碘水鉴别淀粉溶液和蔗糖溶液
B.用酸性高锰酸钾溶液鉴别乙烯和乙炔
C.用溴水鉴别四氯化碳和苯两种无色液体
D.用金属钠鉴别乙醇与二甲醚(CH3OCH3)
18.下列设计的实验方案正确且能达到实验目的的是
A.验证镁、铝金属性强弱:分别在MgCl2和AlCl3溶液中滴加氨水直至过量,观察现象
B.检验淀粉水解是否生成葡萄糖:取少量水解液于试管中,直接加入新制的银氨溶液,水浴加热,观察现象
C.探究NaCl是否属于离子化合物:将两个电极插入熔融的NaCl中,进行导电性试验
D.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量NaOH溶液,
振荡后静置分液,并除去有机相中的水
19.下表中对应关系正确的是
A
①;②
均为加成反应
B
①CH3CH3
+Cl2CH3CH2Cl+HCl;②CH2=CH2+HCl→CH3CH2Cl
均为取代反应
C
①;②6CO2+6H2OC6H12O6+6O2
均为加聚反应
D
①C(s)
+
CO2(g)
=
2CO(g)②2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2(s)+2NH3(g)+10H2O(l)
均为H
>0的反应
20.下列实验现象或事实解释不正确的是
选项
现象或事实
解释
A
醋酸滴在碳酸钙表面,产生大量气体
醋酸的酸性比H2CO3强
B
热的纯碱溶液和汽油均可除去器皿上的油脂
两者均只发生物理变化
C
5mL0.1mol·L-1KI溶液中加入4~5滴0.1mol·L-1FeCl3溶液及CCl4充分振荡,分液,水相中滴入KSCN溶液,溶液变红
FeCl3与KI的反应有一定的限度
D
苯不能使溴水褪色,也不能被酸性高锰酸钾溶液氧化
苯分子中的碳原子间的化学键是一种介于C-C和C=C之间的特殊共价键
21.下列图示与对应的叙述不正确的是
A.图甲可表示短周期主族元素的原子半径随原子序数的变化规律
B.图乙可表示第二周期主族元素最外层电子数随原子序数的变化规律
C.图丙可表示CH4与Cl2经两步反应生成CH3Cl,则两步反应均为放热反应
D.图丁可表示一定条件下,合成氨反应正、逆反应速率随时间的变化,则t1~t2
时间:
v(正反应)=
v(逆反应)
≠
0
22.短周期主族元素X、Y、Z、W、R原子序数依次增大,X原子的最外层电子数是次外
层的3倍,Y与X可形成离子化合物Y2X和Y2X2,Z所在的周期数等于族序数的位置,
W的单质广泛用作半导体材料,R的常见化合价为-1、+1、+4、+5、+7。下列叙述不
正确的是
A.WX2是生产光导纤维的原料
B.RX2可用作自来水的消毒剂
C.工业上获得单质Y是用氢气热还原YR得到
D.Y、Z、R的最高价氧化物的水化物两两之间均能发生反应
23.含SO2的工业尾气可用石灰乳吸收处理,再经氧化制得CaSO4·2H2O(石膏),若处理含SO2
0.224%(体积分数)的尾气1×106
m3(标准状况),假定原料利用率均为100%,理论上可得到石膏的质量为(吨)
A.17.2
B.1.72
C.1.2
D.0.0172
二、非选择题(本部分3题,共31分)
24.(10分)①~⑧是元素周期表中前四周期的8种元素,其相对位置如下图所示。
①
②
③
④
⑤
⑥
⑦
⑧
(1)在8种元素中:非金属性最强的元素位于周期表第
▲
周期
▲
族;最高价氧化物的水化物酸性最强的是
▲
(填化学式)。
(2)⑤、⑥、⑦三种元素的简单氢化物中稳定性最差的
是
▲
(填化学式);⑥的阴离子结构示意图为
▲
。
(3)②与③形成的化合物是常见的大气污染物之一,
可用②的简单氢化物在催化剂及加热条件下还原
为无害气体,该反应的化学方程式为
▲
。
(4)能说明⑧的非金属性比⑥的强的化学方程式为
▲
(举1例)。
(5)由①、②、③三种元素可形成一种摩尔质量为84g·mol-1的分子X,且X中三种元
素的原子数目之比为1∶1∶1。已知X分子中各原子均达到8电子稳定结构,且分
子中无双键,画出X分子的结构式:
▲
。
25.(10分)图示中物质转化最终生成乙酸和高分子涂料胶黏剂Y的合成路线如下(部分反
应条件已省略):
(1)化合物CH2=CHCOOH中所含官能团名称为
▲
和
▲
。
(2)正丁烷的一种同分异构体的结构简式为
▲
;Y的结构简式为
▲
。
(3)图中8步反应中,原子利用率没有达到100%的为
▲
(填序号)。
(4)写出下列反应的化学方程式(注明反应条件):
反应⑥为
▲
;反应⑧为(同时有水生成)
▲
。
26.(11分)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2,Na2O2
的电子式为
▲
。
(2)一种正在开发的利用O2和H2O作原料通过化合制取
H2O2的方法,其原理如右图所示。该方法制取H2O2
的总化学反应方程式为
▲
。
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消
毒,其消毒原理是
▲
。
(4)为探究外界条件对H2O2分解化学反应速率的影响,相
关实验设计如下表所示:
试管编号
实验目的
H2O2溶液
温度
水的体积/mL
FeCl3溶液体积/mL
质量分数
体积/mL
Ⅰ
为编号Ⅱ实验参照
12%
5.0
常温
0
0
Ⅱ
温度对反应速率的影响
▲
5.0
60℃
0
0
Ⅲ
为编号Ⅳ实验参照
4.0%
5.0
常温
▲
0
Ⅳ
▲
4.0%
5.0
常温
0
1.0
填写表中缺少的内容:Ⅱ
▲
;Ⅲ
▲
;Ⅳ
▲
。
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动。
则:Au一侧为电池的
▲
极(选填:“正”或“负”);纳米棒向
▲
(选
填:“左”或“右”)移动。
(6)断裂1mol过氧化氢中的O-O键和氧气中的O=O键所需的能量依次分别为142
kJ·mol-1、497.3
kJ·mol-1。则反应2H2O2(l)
=2H2O(l)
+
O2(g)
H=
▲
kJ·mol-1。
高一化学参考答案及评分标准
一、单项选择题(每题3分,共69分)
1.D
2.A
3.B
4.A
5.C
6.A
7.C
8.A
9.D
10.B
11.C
12.B
13.B
14.D
15.D
16.A
17.B
18.
C
19.
D
20.B 21.C
22.C
23.A
二、非选择题(共31分)
24.
(10分)
(1)二
ⅦA
(共1分)
HClO4(1分)
(2)PH3
(各1分)
(3)4NH3+6NO5N2+6H2O(或8NH3+6NO27N2+12H2O)(2分)
(4)H2S
+
Br2
=
2HBr
+
S↓(或Na2S
+
Br2
=
2NaBr
+
S↓等)(2分)
(5)N≡C-O-O-C≡N(2分)
25.
(10分)
(1)碳碳双键
羧基(各1分)
(2)
(各1分)
(3)②⑥⑧(2分
)
(4)2CH3CH2OH
+
O2
2CH3CHO
+
2H2O
2CH3CH2CH2CH3
+
5O2
4CH3COOH
+
2H2O(各2分)
26.(11分)
(1)(2分)
(2)O2+2H2O2H2O2(1分)
(3)H2O2使病毒蛋白质发生变性,失去活性(1分)
(4)12%
1.0
催化剂对反应速率的影响(各1分)
(5)正(1分)
右(1分)
(6)-213.3(2分)
硼烯的结构
H2
贮H2
H2O
H2燃料电池车
O2
光催化剂
薪柴
煤炭
石油
天然气
核能
新能源
1850
1900
1950
2000
2050
年
100%
不同能源所占的比例
出气口
贮气间
进料口
发酵池
气体注射器
碳酸钙
CO2将其外推
3mol·L-1盐酸
图甲
t2
t1
t4
t3
时间/min
V2
V3
V4
V1
V(CO2)/mL
0
图乙
甲
乙
丙
丁
反应时间
0
v(正反应)
反应速率
v(逆反应)
t1
t2
3
4
5
6
7
8
9
原子序数
CH4(g)+Cl2(g)
CH3Cl(g)+HCl(g)
反应进程
0
原子序数
50
100
150
200
原子半径/
pm
10
20
能量
2H2O
2H++2e-+H2O2
H2O2-2e-
2H++O2
H+
Pt
Au
化
学
试
题
本卷可能用到的相对原子质量:
H
1
C
12
N
14
O
16
S
32
Ca
40
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3
分,共69分)。
1.最近中美科学家首次研获单层硼原子构成的
“硼烯”(如图),有关“硼烯”的说法正确的是
A.是一种新型化合物
B.与金刚石结构相似
C.与B互为同素异形体
D.由共价键构成的单质
2.只含离子键的化合物为
A.CaO
B.NaOH
C.NH3
D.C60
3.118号元素(Og)是2015年底进入周期表的新成员之一,Og的中子数为
A.297
B.179
C.118
D.61
4.某导电性塑料的结构如下图所示,合成该塑料的单体为
A.乙炔
B.乙烯
C.乙烷
D.甲烷
5.下列物质中,一定条件下能和氢氧化钠溶液发生反应的是
A.乙醇
B.乙烯
C.油脂
D.汽油
6.一种氢能的制取、贮存及利用如右图所示,图示中能量转化方式不涉及
A.电能→化学能
B.光能→化学能
C.化学能→电能
D.电能→机械能
7.LiH(氢化锂)常用作干燥剂、氢气发生剂等,可利用下列
反应制备:2Li(熔融)
+H2
2LiH。有关说法不正确的是
A.微粒半径:r(H-)
>
r(H+)
B.H-与Li+电子层结构相同
C.还原性:H
>
Li
D.碱性:LiOH
<
NaOH
8.下列各组混合物中,不能混溶的是
A.苯和水
B.植物油和乙醇
C.酒精和水
D.汽油和煤油
9.2015年美国生物学家Joe
Hanson博士测算出新生婴儿的化学式为:
Co1Mo3
Se4
Cr7
F13
…C85,700,000
O132,000,000
H375,000,000(原子数目递增排序)。
有关新生婴儿组成元素的说法正确的是
A.全部为非金属元素
B.全部由短周期元素组成
C.原子序数越小其原子数目越多
D.氧的质量分数大于氢的质量分数
10.美国Marchetin博士对世界一次能源替代趋势曾作如下预测。有关说法不正确的是
A.太阳能、氢能和生物质能等均属于新能源
B.能源物质在提供能量的同时一定有新核素生成
C.天然气与煤炭、石油及薪柴相比,具有热值高、洁净等优势
D.煤、石油及天然气蕴藏的能量来自远古时期生物体所吸收利用的太阳能
11.乙烯利(C2H6ClO3P)能释放出乙烯从而促进果实成熟,可由环氧乙烷()和PCl3
为原料合成。下列说法正确的是
A.乙烯、乙烯利均属于烃
B.乙烯的结构简式为:C2H4
C.环氧乙烷与乙醛互为同分异构体
D.PCl3的电子式为:
12.氨是制造化肥和生产其他化工产品的原料,由氨生产的四种化工产品的说法不正确的是
A.H2NCH2COOH是一种氨基酸
B.CO(NH2)2与NH4CNO性质相同
C.聚丙烯腈的单体为:CH2=CHCN
D.依据酸碱质子理论,HCO3-属于酸碱两性物质
13.将植物秸秆、枝叶、杂草和人畜粪便加入沼气发酵池(如
图),在沼气细菌作用下可产生沼气(主要成分是CH4,还
含有CO2及少量的H2S、NH3等)。下列说法不正确的是
A.沼气是一种生物质能
B.沼气中的NH3、H2S来自植物中纤维素发酵产生
C.控制厌氧、适宜的温度等条件有利于CH4的产生
D.从沼气池出料口获得的发酵残留物可用作肥料
14.一种乙醇燃料电池原理如右图所示,有关说法正确的是
A.燃料电池能量转化率比乙醇燃烧发电低
B.电池工作时,电极a上产生淡蓝色火焰
C.电子由电极a经“聚合电解质”流向电极b
D.电池反应为:C2H5OH
+
3O2→2CO2+3H2O
15.某同学用图甲所示装置及器材,测定碳酸钙与盐酸反应生成CO2气体体积随反应时间
变化情况,并绘制出图乙所示曲线。有关分析不正确的是
A.CaCO3与盐酸的反应为放热反应
B.收集气体最多的时间段为t1~t2
C.平均反应速率:v(t1~t2)>
v(t2~t3)>
v(0~t1)>
v(t3~t4)
D.在t4后,收集到的CO2气体不再增加,一定是碳酸钙已完全反应
16.给定条件下,下列选项中所示的物质间转化,均能一步实现的是
①
②
③
④
A.①②③④
B.①③④
C.③④
D.①②
17.下列鉴别物质的方法不能达到目的的是
A.用碘水鉴别淀粉溶液和蔗糖溶液
B.用酸性高锰酸钾溶液鉴别乙烯和乙炔
C.用溴水鉴别四氯化碳和苯两种无色液体
D.用金属钠鉴别乙醇与二甲醚(CH3OCH3)
18.下列设计的实验方案正确且能达到实验目的的是
A.验证镁、铝金属性强弱:分别在MgCl2和AlCl3溶液中滴加氨水直至过量,观察现象
B.检验淀粉水解是否生成葡萄糖:取少量水解液于试管中,直接加入新制的银氨溶液,水浴加热,观察现象
C.探究NaCl是否属于离子化合物:将两个电极插入熔融的NaCl中,进行导电性试验
D.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量NaOH溶液,
振荡后静置分液,并除去有机相中的水
19.下表中对应关系正确的是
A
①;②
均为加成反应
B
①CH3CH3
+Cl2CH3CH2Cl+HCl;②CH2=CH2+HCl→CH3CH2Cl
均为取代反应
C
①;②6CO2+6H2OC6H12O6+6O2
均为加聚反应
D
①C(s)
+
CO2(g)
=
2CO(g)②2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2(s)+2NH3(g)+10H2O(l)
均为H
>0的反应
20.下列实验现象或事实解释不正确的是
选项
现象或事实
解释
A
醋酸滴在碳酸钙表面,产生大量气体
醋酸的酸性比H2CO3强
B
热的纯碱溶液和汽油均可除去器皿上的油脂
两者均只发生物理变化
C
5mL0.1mol·L-1KI溶液中加入4~5滴0.1mol·L-1FeCl3溶液及CCl4充分振荡,分液,水相中滴入KSCN溶液,溶液变红
FeCl3与KI的反应有一定的限度
D
苯不能使溴水褪色,也不能被酸性高锰酸钾溶液氧化
苯分子中的碳原子间的化学键是一种介于C-C和C=C之间的特殊共价键
21.下列图示与对应的叙述不正确的是
A.图甲可表示短周期主族元素的原子半径随原子序数的变化规律
B.图乙可表示第二周期主族元素最外层电子数随原子序数的变化规律
C.图丙可表示CH4与Cl2经两步反应生成CH3Cl,则两步反应均为放热反应
D.图丁可表示一定条件下,合成氨反应正、逆反应速率随时间的变化,则t1~t2
时间:
v(正反应)=
v(逆反应)
≠
0
22.短周期主族元素X、Y、Z、W、R原子序数依次增大,X原子的最外层电子数是次外
层的3倍,Y与X可形成离子化合物Y2X和Y2X2,Z所在的周期数等于族序数的位置,
W的单质广泛用作半导体材料,R的常见化合价为-1、+1、+4、+5、+7。下列叙述不
正确的是
A.WX2是生产光导纤维的原料
B.RX2可用作自来水的消毒剂
C.工业上获得单质Y是用氢气热还原YR得到
D.Y、Z、R的最高价氧化物的水化物两两之间均能发生反应
23.含SO2的工业尾气可用石灰乳吸收处理,再经氧化制得CaSO4·2H2O(石膏),若处理含SO2
0.224%(体积分数)的尾气1×106
m3(标准状况),假定原料利用率均为100%,理论上可得到石膏的质量为(吨)
A.17.2
B.1.72
C.1.2
D.0.0172
二、非选择题(本部分3题,共31分)
24.(10分)①~⑧是元素周期表中前四周期的8种元素,其相对位置如下图所示。
①
②
③
④
⑤
⑥
⑦
⑧
(1)在8种元素中:非金属性最强的元素位于周期表第
▲
周期
▲
族;最高价氧化物的水化物酸性最强的是
▲
(填化学式)。
(2)⑤、⑥、⑦三种元素的简单氢化物中稳定性最差的
是
▲
(填化学式);⑥的阴离子结构示意图为
▲
。
(3)②与③形成的化合物是常见的大气污染物之一,
可用②的简单氢化物在催化剂及加热条件下还原
为无害气体,该反应的化学方程式为
▲
。
(4)能说明⑧的非金属性比⑥的强的化学方程式为
▲
(举1例)。
(5)由①、②、③三种元素可形成一种摩尔质量为84g·mol-1的分子X,且X中三种元
素的原子数目之比为1∶1∶1。已知X分子中各原子均达到8电子稳定结构,且分
子中无双键,画出X分子的结构式:
▲
。
25.(10分)图示中物质转化最终生成乙酸和高分子涂料胶黏剂Y的合成路线如下(部分反
应条件已省略):
(1)化合物CH2=CHCOOH中所含官能团名称为
▲
和
▲
。
(2)正丁烷的一种同分异构体的结构简式为
▲
;Y的结构简式为
▲
。
(3)图中8步反应中,原子利用率没有达到100%的为
▲
(填序号)。
(4)写出下列反应的化学方程式(注明反应条件):
反应⑥为
▲
;反应⑧为(同时有水生成)
▲
。
26.(11分)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2,Na2O2
的电子式为
▲
。
(2)一种正在开发的利用O2和H2O作原料通过化合制取
H2O2的方法,其原理如右图所示。该方法制取H2O2
的总化学反应方程式为
▲
。
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消
毒,其消毒原理是
▲
。
(4)为探究外界条件对H2O2分解化学反应速率的影响,相
关实验设计如下表所示:
试管编号
实验目的
H2O2溶液
温度
水的体积/mL
FeCl3溶液体积/mL
质量分数
体积/mL
Ⅰ
为编号Ⅱ实验参照
12%
5.0
常温
0
0
Ⅱ
温度对反应速率的影响
▲
5.0
60℃
0
0
Ⅲ
为编号Ⅳ实验参照
4.0%
5.0
常温
▲
0
Ⅳ
▲
4.0%
5.0
常温
0
1.0
填写表中缺少的内容:Ⅱ
▲
;Ⅲ
▲
;Ⅳ
▲
。
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动。
则:Au一侧为电池的
▲
极(选填:“正”或“负”);纳米棒向
▲
(选
填:“左”或“右”)移动。
(6)断裂1mol过氧化氢中的O-O键和氧气中的O=O键所需的能量依次分别为142
kJ·mol-1、497.3
kJ·mol-1。则反应2H2O2(l)
=2H2O(l)
+
O2(g)
H=
▲
kJ·mol-1。
高一化学参考答案及评分标准
一、单项选择题(每题3分,共69分)
1.D
2.A
3.B
4.A
5.C
6.A
7.C
8.A
9.D
10.B
11.C
12.B
13.B
14.D
15.D
16.A
17.B
18.
C
19.
D
20.B 21.C
22.C
23.A
二、非选择题(共31分)
24.
(10分)
(1)二
ⅦA
(共1分)
HClO4(1分)
(2)PH3
(各1分)
(3)4NH3+6NO5N2+6H2O(或8NH3+6NO27N2+12H2O)(2分)
(4)H2S
+
Br2
=
2HBr
+
S↓(或Na2S
+
Br2
=
2NaBr
+
S↓等)(2分)
(5)N≡C-O-O-C≡N(2分)
25.
(10分)
(1)碳碳双键
羧基(各1分)
(2)
(各1分)
(3)②⑥⑧(2分
)
(4)2CH3CH2OH
+
O2
2CH3CHO
+
2H2O
2CH3CH2CH2CH3
+
5O2
4CH3COOH
+
2H2O(各2分)
26.(11分)
(1)(2分)
(2)O2+2H2O2H2O2(1分)
(3)H2O2使病毒蛋白质发生变性,失去活性(1分)
(4)12%
1.0
催化剂对反应速率的影响(各1分)
(5)正(1分)
右(1分)
(6)-213.3(2分)
硼烯的结构
H2
贮H2
H2O
H2燃料电池车
O2
光催化剂
薪柴
煤炭
石油
天然气
核能
新能源
1850
1900
1950
2000
2050
年
100%
不同能源所占的比例
出气口
贮气间
进料口
发酵池
气体注射器
碳酸钙
CO2将其外推
3mol·L-1盐酸
图甲
t2
t1
t4
t3
时间/min
V2
V3
V4
V1
V(CO2)/mL
0
图乙
甲
乙
丙
丁
反应时间
0
v(正反应)
反应速率
v(逆反应)
t1
t2
3
4
5
6
7
8
9
原子序数
CH4(g)+Cl2(g)
CH3Cl(g)+HCl(g)
反应进程
0
原子序数
50
100
150
200
原子半径/
pm
10
20
能量
2H2O
2H++2e-+H2O2
H2O2-2e-
2H++O2
H+
Pt
Au
同课章节目录
