福建省福州第一中学2024-2025学年高一下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 福建省福州第一中学2024-2025学年高一下学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 499.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-03 18:45:35 | ||
图片预览


文档简介
福州一中 2024-2025 学年第二学期第四学段模块考试
高一 化学学科必修二模块试卷
(完卷 75 分钟 满分 100 分)
班级 座号 姓名
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32一、选择题(本大题共 14 小题,共 42 分。每题只.有.一.个.选项符合题意) 1.化学与生产、生活密切相关。下列说法正确的是( )
光纤通讯是当代新技术革命特征之一,光纤的主要成分为单质硅
制造汽车使用的铝合金材料具有强度大、质量轻、耐腐蚀等优点
制作医用口罩的无纺布,主要成分为聚丙烯,聚丙烯有固定的熔点
对氨气进行冷却或加压,就液化成无色液体,该过程属于人工固氮
下列说法正确的是( )
中含有三种官能团
用苯乙烯合成聚苯乙烯: nC6H5CH CH2 催 化 剂
CH2 CH CH3 的所有原子均在同一平面上
相同质量的乙烯和乙烷完全燃烧,产生 H2O 的质量不相同
下列现象或事实不能用同一原理解释的是( )
浓硝酸和氯水用棕色试剂瓶保存
Cl2 和 SO2 都能使品红溶液褪色
常温下铁和铝都不溶于浓硝酸
乙醇和水都能与钠反应放出氢气
下列实验操作可以达到实验目的的是( )
实验操作 实验目的
A 取样,加入 NaOH 溶液 除去乙酸乙酯中的乙酸
B 酒精中加入无水硫酸铜 检验酒精中是否含有水
C 取样,加入溴水,过滤 除去苯中含有的乙烯杂质
D 蔗糖溶液在稀硫酸存在下水浴加热一段时间 后,再与银氨溶液混合加热 检验蔗糖是否水解
下列各组离子能大量共存的是( )
在使酚酞变红的溶液中:K+、[Al(OH)4]-、NO 、Cl-
1.0 mol·L-1 的 KNO3 溶液中:H+、Fe2+、Cl-、SO2-
与铝反应产生大量氢气的溶液中:Na+、NH+、CO2 、NO
4 3 3
在无色透明的溶液中:Fe3+、Mn2+、SO2 、Cl-
设 NA 表示阿伏加德罗常数的值,下列说法正确的是( ) A.0.1mol Cl2 通入水中充分反应后,转移电子数为 0.2NA
B.20 g D2O 与 20 g H2O 含有的中子数均为 10 NA
C.1 L l mol L 1 Al(NO3)3 溶液中含有 3NA 个 NO
D.50 mL 12 mol L 1 盐酸与足量 MnO2 共热,转移的电子数为 0.3NA
在 2L 恒温密闭容器中通入气体 X 并发生反应:2X(g)Y(g) △H<0,X 的物质的量 n(X)随时间 t 变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是( )
反应进行到 a 点时放出的热量多于反应进行到 b 点时放出的热量
实线表示有催化剂的情形
b、c 两点表明反应在相应的条件下达到了平衡状态
反应从开始到 a 点的平均反应速率可表示为 v(Y) = 0.01mol L-1 min-1 8.下列离子方程式书写正确的是( )
刻蚀印刷电路板的原理: Fe3++Cu=Fe2++Cu2+
过量的 CO2 与澄清石灰水反应: OH CO HCO
Fe2(SO4)3 溶液和 Ba(OH)2 溶液反应: SO2 Ba2 BaSO
向 AlCl3 溶液中滴加过量的氨水: Al3++4OH-=[Al(OH)4]- 9.某有机物的结构简式如图所示,下列说法不正确的是( )
1mol 该有机物和过量的金属钠反应最多可以生成 1.5mol H2
该物质最多消耗 Na、NaOH、NaHCO3 的物质的量之比为 3∶2∶2
可以用酸性 KMnO4 溶液检验其中的碳碳双键
该物质能够在催化剂作用下被氧化为含有-CHO 的有机物
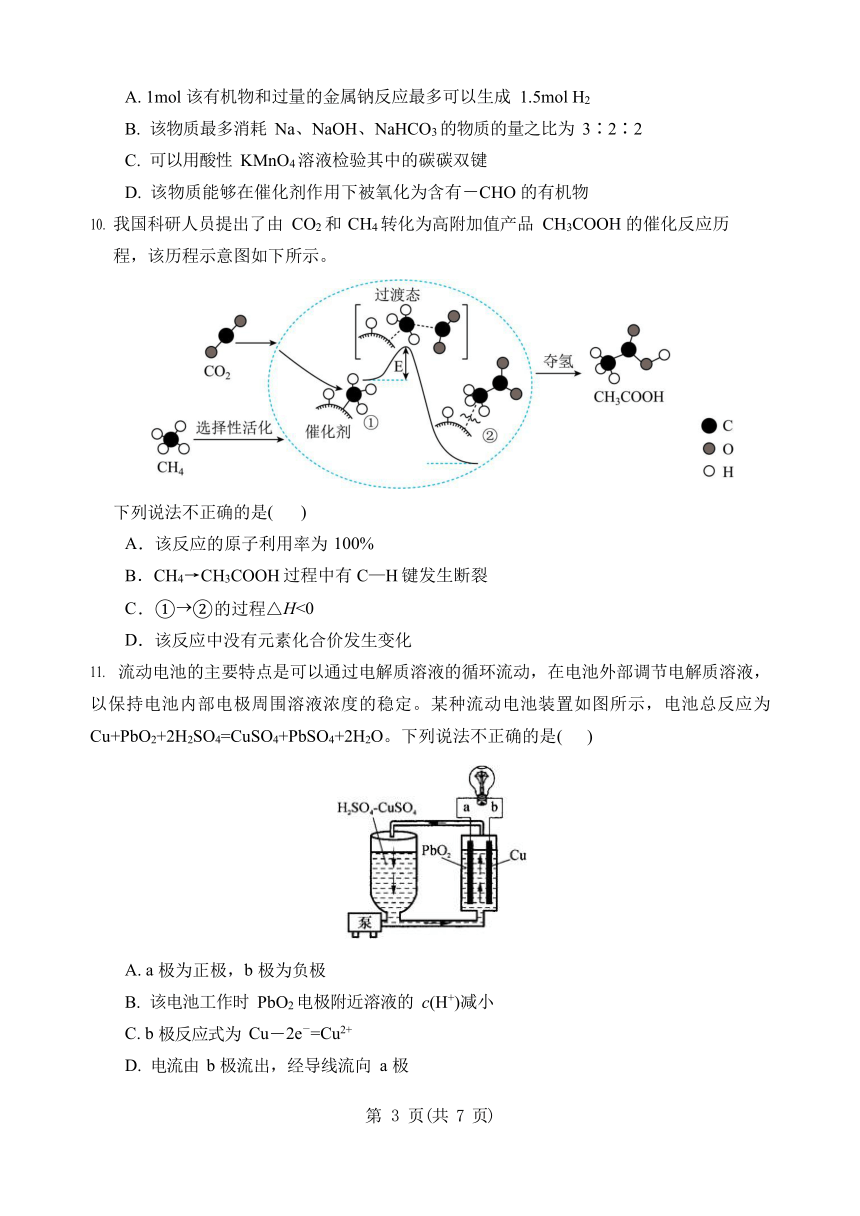
我国科研人员提出了由 CO2 和 CH4 转化为高附加值产品 CH3COOH 的催化反应历程,该历程示意图如下所示。
下列说法不正确的是( ) A.该反应的原子利用率为 100% B.CH4→CH3COOH 过程中有 C—H 键发生断裂 C.① ②的过程△H<0 D.该反应中没有元素化合价发生变化
流动电池的主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。某种流动电池装置如图所示,电池总反应为 Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是( )
a 极为正极,b 极为负极
该电池工作时 PbO2 电极附近溶液的 c(H+)减小
b 极反应式为 Cu-2e-=Cu2+
电流由 b 极流出,经导线流向 a 极
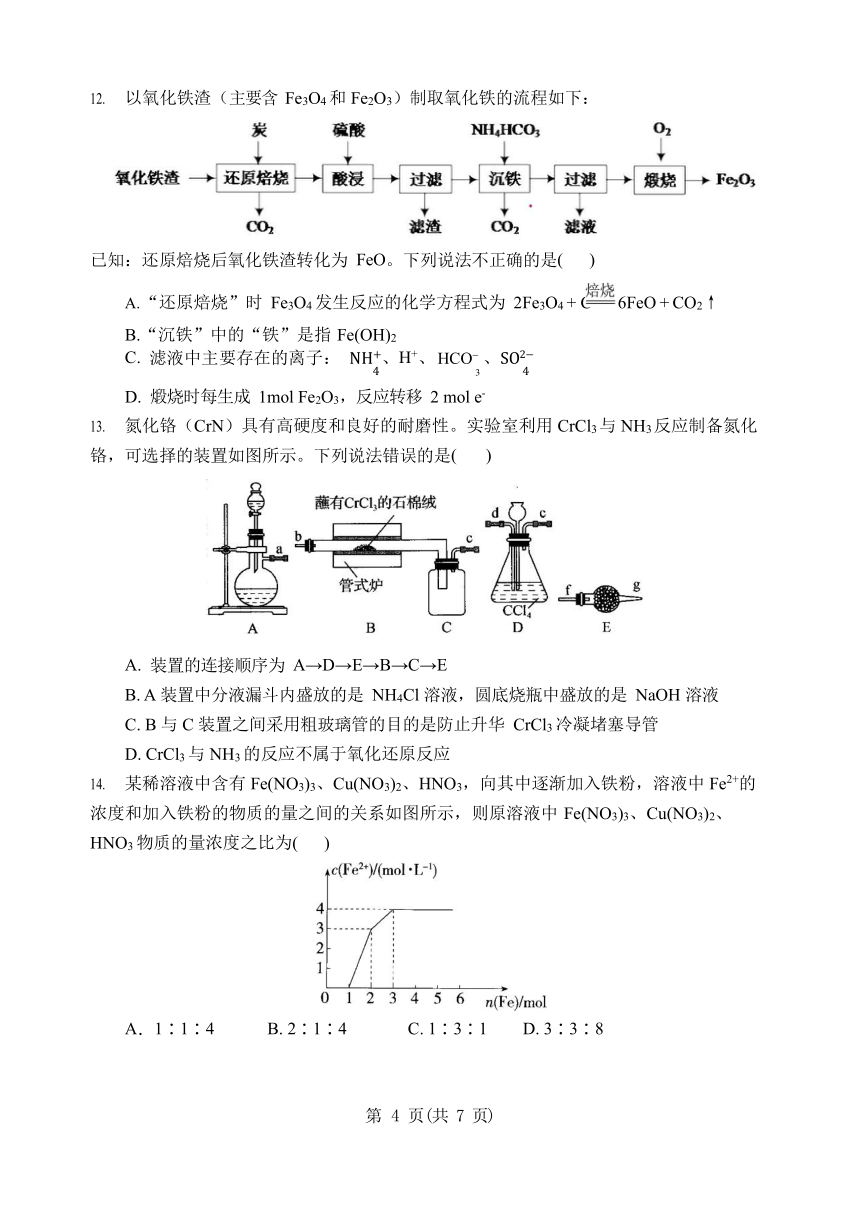
以氧化铁渣(主要含 Fe3O4 和 Fe2O3)制取氧化铁的流程如下:
已知:还原焙烧后氧化铁渣转化为 FeO。下列说法不正确的是( )
“还原焙烧”时 Fe3O4 发生反应的化学方程式为 2Fe3O4 + C 6FeO + CO2↑ B.“沉铁”中的“铁”是指 Fe(OH)2
滤液中主要存在的离子: NH+、H+、HCO 、SO2
4 3 4
煅烧时每生成 1mol Fe2O3,反应转移 2 mol e-
氮化铬(CrN)具有高硬度和良好的耐磨性。实验室利用 CrCl3 与 NH3 反应制备氮化铬,可选择的装置如图所示。下列说法错误的是( )
装置的连接顺序为 A→D→E→B→C→E
A 装置中分液漏斗内盛放的是 NH4Cl 溶液,圆底烧瓶中盛放的是 NaOH 溶液
B 与 C 装置之间采用粗玻璃管的目的是防止升华 CrCl3 冷凝堵塞导管
CrCl3 与 NH3 的反应不属于氧化还原反应
某稀溶液中含有 Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中 Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示,则原溶液中 Fe(NO3)3、Cu(NO3)2、 HNO3 物质的量浓度之比为( )
A.1∶1∶4 B. 2∶1∶4 C. 1∶3∶1 D. 3∶3∶8
二、填空题(本大题共 4 小题,共 58 分)
15.(15 分)电子工业常用足量 FeCl3 溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液中回收铜,并重新获得 FeCl3 溶液的处理流程如下:
步骤①中分离操作名称是 。
沉淀 B 中主要含有 。
在滤液 A 中加入 NaOH 溶液,现象是 ,用化学方程式表示最后现象出现的原因: 。
取少量最后所得溶液于试管中,然后滴加 (写名称)溶液,若变为血红色,则证明有 Fe3+存在。
步骤③中,也可用 H2O2 代替氯气,H2O2 的电子式为 ;当 H2O2 恰好完全反应时,消耗的 n(Cl2)∶n(H2O2)= 。
16.(13 分)氨气广泛应用于化工、化肥、制药、合成纤维等领域。反应原理:N2(g)+
3H2(g) 2NH3(g) △H<0。工业上合成氨的部分工艺流程如图:
气体需要干燥净化的目的是 。
恒温下,向体积为 4L 的密闭容器中通入 2mol N2 和 6mol H2,记录数据如下表:
时间/min 5 10 15 20 25 30
n(NH3)/mol 0.32 0.56 x 0.94 0.94 0.94
0~10min,v(N2)= mol·L-1·min-1;15min 时,x 0.80(选填“>”、
“=”或“<”)。20 分钟时测得反应放出 43.4kJ 热量,则该反应的热化学方程式为:
。
反应达到化学平衡状态时,下列说法正确的是 。
A.2v 正(NH3)=3v 逆(H2) B.混合气体的密度保持不变
C.c(N2)∶c(H2)=1∶3 D.混合气体的平均分子量保持不变
(4)(NH4)2SO3 氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3 初始浓度对空气氧化(NH4)2SO3 速率的影响,结果如图:
下列说法错误的是 。
A.该反应原理为:2(NH4)2SO3+O2=2(NH4)2SO4
B.60℃之前,氧化速率增大与温度升高有关 C.60℃之后,氧化速率降低与 O2 的溶解度有关
D.当(NH4)2SO3 的浓度增大到一定程度后氧化速率变化不大,与 O2 的溶解速率无关
17.(15 分)氨基磺酸(H2NSO3H)是一种无味无毒的固体强酸,微溶于乙醇,260℃时分解,溶于水时存在反应:H2O+ H2NSO3H=NH4HSO4。实验室用羟胺(NH2OH)和 SO2 反应制备氨基磺酸。回答下列问题:
已知:①NH2OH 性质不稳定,室温下同时吸收水蒸气和 CO2 时迅速分解,加热时爆炸。
②实验室常用亚硫酸钠粉末与 75%硫酸制备 SO2。
仪器 X 的名称是 。
气流从左至右,导管接口连接顺序是:
a→ → d→e→ → → (装置可以重复使用)
实验过程中,先旋开 (填“A”或“C”)装置的分液漏斗活塞,后旋开另一个活塞,这样操作的目的是 ,C 装置中发生反应的化学方程式
为 。
(4)D 装置可以用下列装置替代的是 (填标号)。
a.盛装饱和食盐水的洗气瓶 b.盛装品红溶液的洗气瓶
c.盛装碱石灰的 U 形管 d.盛装五氧化二磷的 U 形管
(5)取 W g 氨基磺酸产品溶于蒸馏水配制成 100mL 溶液,准确量取 25.00mL 溶液加入 V
mL c mol L 1 NaOH 标准溶液恰好完全反应,最后溶液中的溶质只有(NH4)2SO4 和
Na2SO4。产品纯度为 (用含 W、c、V 的代数式表示)。
18.(15 分)丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以用有机物 A 和石油化工产品 C、E 等为原料进行合成:
已知:A 是遇碘水显蓝色的有机物;E 是 C 的同系物,其相对分子质量比 C 大 14。回答下列问题:
(1)A 的名称是 ,E 的结构简式为 。
(2)C 转化成 D 的化学方程式为 。
(3)D 与 F 反应的反应类型是 。
流程中,有机物 B 的结构简式为 CH2OH-CHOH-CHOH-CHOH-CHOH-CHO,其所含官能团的名称是 。
写出丙烯酸乙酯自身发生加成聚合反应生成高聚物的化学方程式 。
工业上用 162 t 的 A 和足量的 E 为主要有机原料来生成丙烯酸乙酯,共得到 100 t 产品,则该生产过程的产率为 。
高一 化学学科必修二模块试卷
(完卷 75 分钟 满分 100 分)
班级 座号 姓名
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32一、选择题(本大题共 14 小题,共 42 分。每题只.有.一.个.选项符合题意) 1.化学与生产、生活密切相关。下列说法正确的是( )
光纤通讯是当代新技术革命特征之一,光纤的主要成分为单质硅
制造汽车使用的铝合金材料具有强度大、质量轻、耐腐蚀等优点
制作医用口罩的无纺布,主要成分为聚丙烯,聚丙烯有固定的熔点
对氨气进行冷却或加压,就液化成无色液体,该过程属于人工固氮
下列说法正确的是( )
中含有三种官能团
用苯乙烯合成聚苯乙烯: nC6H5CH CH2 催 化 剂
CH2 CH CH3 的所有原子均在同一平面上
相同质量的乙烯和乙烷完全燃烧,产生 H2O 的质量不相同
下列现象或事实不能用同一原理解释的是( )
浓硝酸和氯水用棕色试剂瓶保存
Cl2 和 SO2 都能使品红溶液褪色
常温下铁和铝都不溶于浓硝酸
乙醇和水都能与钠反应放出氢气
下列实验操作可以达到实验目的的是( )
实验操作 实验目的
A 取样,加入 NaOH 溶液 除去乙酸乙酯中的乙酸
B 酒精中加入无水硫酸铜 检验酒精中是否含有水
C 取样,加入溴水,过滤 除去苯中含有的乙烯杂质
D 蔗糖溶液在稀硫酸存在下水浴加热一段时间 后,再与银氨溶液混合加热 检验蔗糖是否水解
下列各组离子能大量共存的是( )
在使酚酞变红的溶液中:K+、[Al(OH)4]-、NO 、Cl-
1.0 mol·L-1 的 KNO3 溶液中:H+、Fe2+、Cl-、SO2-
与铝反应产生大量氢气的溶液中:Na+、NH+、CO2 、NO
4 3 3
在无色透明的溶液中:Fe3+、Mn2+、SO2 、Cl-
设 NA 表示阿伏加德罗常数的值,下列说法正确的是( ) A.0.1mol Cl2 通入水中充分反应后,转移电子数为 0.2NA
B.20 g D2O 与 20 g H2O 含有的中子数均为 10 NA
C.1 L l mol L 1 Al(NO3)3 溶液中含有 3NA 个 NO
D.50 mL 12 mol L 1 盐酸与足量 MnO2 共热,转移的电子数为 0.3NA
在 2L 恒温密闭容器中通入气体 X 并发生反应:2X(g)Y(g) △H<0,X 的物质的量 n(X)随时间 t 变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是( )
反应进行到 a 点时放出的热量多于反应进行到 b 点时放出的热量
实线表示有催化剂的情形
b、c 两点表明反应在相应的条件下达到了平衡状态
反应从开始到 a 点的平均反应速率可表示为 v(Y) = 0.01mol L-1 min-1 8.下列离子方程式书写正确的是( )
刻蚀印刷电路板的原理: Fe3++Cu=Fe2++Cu2+
过量的 CO2 与澄清石灰水反应: OH CO HCO
Fe2(SO4)3 溶液和 Ba(OH)2 溶液反应: SO2 Ba2 BaSO
向 AlCl3 溶液中滴加过量的氨水: Al3++4OH-=[Al(OH)4]- 9.某有机物的结构简式如图所示,下列说法不正确的是( )
1mol 该有机物和过量的金属钠反应最多可以生成 1.5mol H2
该物质最多消耗 Na、NaOH、NaHCO3 的物质的量之比为 3∶2∶2
可以用酸性 KMnO4 溶液检验其中的碳碳双键
该物质能够在催化剂作用下被氧化为含有-CHO 的有机物
我国科研人员提出了由 CO2 和 CH4 转化为高附加值产品 CH3COOH 的催化反应历程,该历程示意图如下所示。
下列说法不正确的是( ) A.该反应的原子利用率为 100% B.CH4→CH3COOH 过程中有 C—H 键发生断裂 C.① ②的过程△H<0 D.该反应中没有元素化合价发生变化
流动电池的主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。某种流动电池装置如图所示,电池总反应为 Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是( )
a 极为正极,b 极为负极
该电池工作时 PbO2 电极附近溶液的 c(H+)减小
b 极反应式为 Cu-2e-=Cu2+
电流由 b 极流出,经导线流向 a 极
以氧化铁渣(主要含 Fe3O4 和 Fe2O3)制取氧化铁的流程如下:
已知:还原焙烧后氧化铁渣转化为 FeO。下列说法不正确的是( )
“还原焙烧”时 Fe3O4 发生反应的化学方程式为 2Fe3O4 + C 6FeO + CO2↑ B.“沉铁”中的“铁”是指 Fe(OH)2
滤液中主要存在的离子: NH+、H+、HCO 、SO2
4 3 4
煅烧时每生成 1mol Fe2O3,反应转移 2 mol e-
氮化铬(CrN)具有高硬度和良好的耐磨性。实验室利用 CrCl3 与 NH3 反应制备氮化铬,可选择的装置如图所示。下列说法错误的是( )
装置的连接顺序为 A→D→E→B→C→E
A 装置中分液漏斗内盛放的是 NH4Cl 溶液,圆底烧瓶中盛放的是 NaOH 溶液
B 与 C 装置之间采用粗玻璃管的目的是防止升华 CrCl3 冷凝堵塞导管
CrCl3 与 NH3 的反应不属于氧化还原反应
某稀溶液中含有 Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中 Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示,则原溶液中 Fe(NO3)3、Cu(NO3)2、 HNO3 物质的量浓度之比为( )
A.1∶1∶4 B. 2∶1∶4 C. 1∶3∶1 D. 3∶3∶8
二、填空题(本大题共 4 小题,共 58 分)
15.(15 分)电子工业常用足量 FeCl3 溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液中回收铜,并重新获得 FeCl3 溶液的处理流程如下:
步骤①中分离操作名称是 。
沉淀 B 中主要含有 。
在滤液 A 中加入 NaOH 溶液,现象是 ,用化学方程式表示最后现象出现的原因: 。
取少量最后所得溶液于试管中,然后滴加 (写名称)溶液,若变为血红色,则证明有 Fe3+存在。
步骤③中,也可用 H2O2 代替氯气,H2O2 的电子式为 ;当 H2O2 恰好完全反应时,消耗的 n(Cl2)∶n(H2O2)= 。
16.(13 分)氨气广泛应用于化工、化肥、制药、合成纤维等领域。反应原理:N2(g)+
3H2(g) 2NH3(g) △H<0。工业上合成氨的部分工艺流程如图:
气体需要干燥净化的目的是 。
恒温下,向体积为 4L 的密闭容器中通入 2mol N2 和 6mol H2,记录数据如下表:
时间/min 5 10 15 20 25 30
n(NH3)/mol 0.32 0.56 x 0.94 0.94 0.94
0~10min,v(N2)= mol·L-1·min-1;15min 时,x 0.80(选填“>”、
“=”或“<”)。20 分钟时测得反应放出 43.4kJ 热量,则该反应的热化学方程式为:
。
反应达到化学平衡状态时,下列说法正确的是 。
A.2v 正(NH3)=3v 逆(H2) B.混合气体的密度保持不变
C.c(N2)∶c(H2)=1∶3 D.混合气体的平均分子量保持不变
(4)(NH4)2SO3 氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3 初始浓度对空气氧化(NH4)2SO3 速率的影响,结果如图:
下列说法错误的是 。
A.该反应原理为:2(NH4)2SO3+O2=2(NH4)2SO4
B.60℃之前,氧化速率增大与温度升高有关 C.60℃之后,氧化速率降低与 O2 的溶解度有关
D.当(NH4)2SO3 的浓度增大到一定程度后氧化速率变化不大,与 O2 的溶解速率无关
17.(15 分)氨基磺酸(H2NSO3H)是一种无味无毒的固体强酸,微溶于乙醇,260℃时分解,溶于水时存在反应:H2O+ H2NSO3H=NH4HSO4。实验室用羟胺(NH2OH)和 SO2 反应制备氨基磺酸。回答下列问题:
已知:①NH2OH 性质不稳定,室温下同时吸收水蒸气和 CO2 时迅速分解,加热时爆炸。
②实验室常用亚硫酸钠粉末与 75%硫酸制备 SO2。
仪器 X 的名称是 。
气流从左至右,导管接口连接顺序是:
a→ → d→e→ → → (装置可以重复使用)
实验过程中,先旋开 (填“A”或“C”)装置的分液漏斗活塞,后旋开另一个活塞,这样操作的目的是 ,C 装置中发生反应的化学方程式
为 。
(4)D 装置可以用下列装置替代的是 (填标号)。
a.盛装饱和食盐水的洗气瓶 b.盛装品红溶液的洗气瓶
c.盛装碱石灰的 U 形管 d.盛装五氧化二磷的 U 形管
(5)取 W g 氨基磺酸产品溶于蒸馏水配制成 100mL 溶液,准确量取 25.00mL 溶液加入 V
mL c mol L 1 NaOH 标准溶液恰好完全反应,最后溶液中的溶质只有(NH4)2SO4 和
Na2SO4。产品纯度为 (用含 W、c、V 的代数式表示)。
18.(15 分)丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以用有机物 A 和石油化工产品 C、E 等为原料进行合成:
已知:A 是遇碘水显蓝色的有机物;E 是 C 的同系物,其相对分子质量比 C 大 14。回答下列问题:
(1)A 的名称是 ,E 的结构简式为 。
(2)C 转化成 D 的化学方程式为 。
(3)D 与 F 反应的反应类型是 。
流程中,有机物 B 的结构简式为 CH2OH-CHOH-CHOH-CHOH-CHOH-CHO,其所含官能团的名称是 。
写出丙烯酸乙酯自身发生加成聚合反应生成高聚物的化学方程式 。
工业上用 162 t 的 A 和足量的 E 为主要有机原料来生成丙烯酸乙酯,共得到 100 t 产品,则该生产过程的产率为 。
同课章节目录
