2026高考化学一轮复习 第一章 第4讲 氧化还原反应的概念和规律 教学课件(90张)
文档属性
| 名称 | 2026高考化学一轮复习 第一章 第4讲 氧化还原反应的概念和规律 教学课件(90张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-04 00:00:00 | ||
图片预览








文档简介
(共90张PPT)
第一章 第4讲
氧化还原反应的概念和规律
高考化学大一轮复习
复习目标
1.了解氧化还原反应的概念。
2.会用“单、双线桥”分析电子转移的方向和数目。
3.掌握氧化性、还原性强弱的比较及价态规律的应用。
4.会判断氧化还原反应的产物及方程式正误。
考点一 氧化还原反应及相关概念
考点二 氧化还原反应基本规律
课时精练
练真题 明考向
内容索引
考点一
氧化还原反应及相关概念
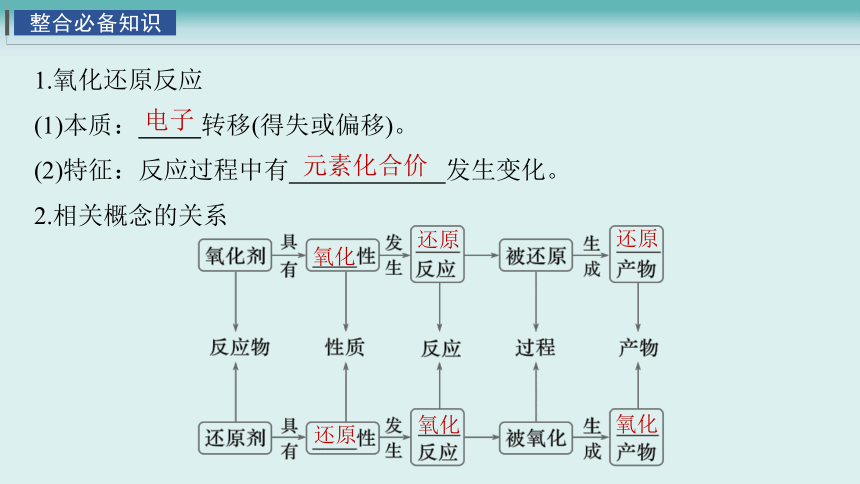
1.氧化还原反应
(1)本质: 转移(得失或偏移)。
(2)特征:反应过程中有 发生变化。
2.相关概念的关系
整合必备知识
氧化
电子
元素化合价
还原
还原
还原
氧化
氧化
3.电子转移的表示方法
(1)分别用双线桥法、单线桥法标出MnO2与浓盐酸在加热条件下反应的电子转移的方向和数目,并指出氧化剂、还原剂、氧化产物、还原产物。
答案
(2)上述反应若产生1 mol Cl2时,转移电子数目为 ,被氧化的HCl的物质的量是 mol。
2NA(或1.204×1024)
2
分析氧化还原反应,走好关键第一步——正确标出元素的化合价。
下列陌生物质中指定元素的化合价:
Li2NH:N-3,LiNH2:N-3,N2H4:N-2,
Na2S2O3:S+2,S2:S+6、O-1、-2,
C2:C+3,HCN:C+2、N-3,
B:B+3、H-1,CuH:Cu+1、H-1,
MnO(OH):Mn+3,FePO4:Fe+3,
Cr:Cr+6,K2FeO4:Fe+6,
LiFePO4:Fe+2,CuFeS2:Fe+2。
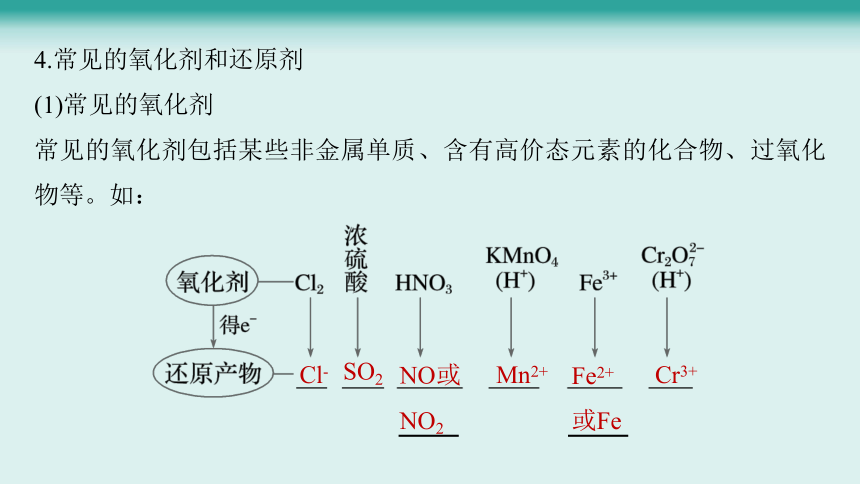
4.常见的氧化剂和还原剂
(1)常见的氧化剂
常见的氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
Cl-
SO2
NO或
NO2
Mn2+
Fe2+
或Fe
Cr3+
(2)常见的还原剂
常见的还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
Zn2+
H2O
CO2
Fe3+
S
I2
金属氢化物(如NaH等)、NaBH4也是重要的还原剂。
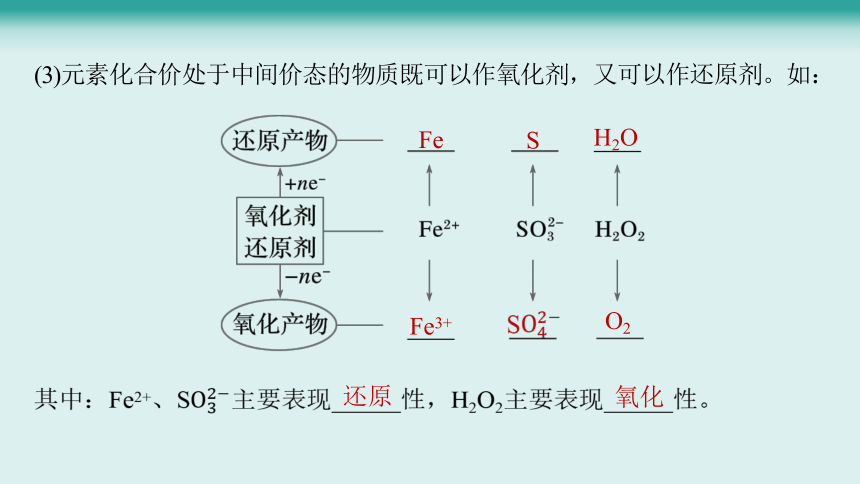
(3)元素化合价处于中间价态的物质既可以作氧化剂,又可以作还原剂。如:
Fe
S
H2O
Fe3+
S
O2
其中:Fe2+、S主要表现 性,H2O2主要表现 性。
还原
氧化
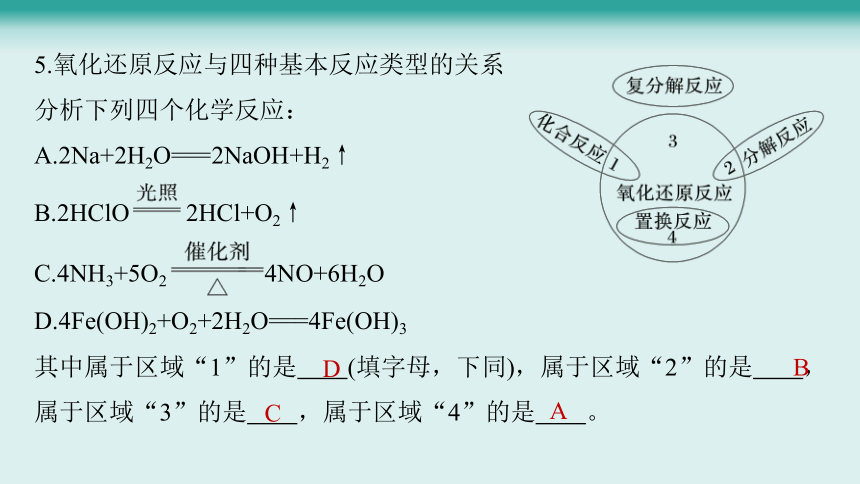
5.氧化还原反应与四种基本反应类型的关系
分析下列四个化学反应:
A.2Na+2H2O===2NaOH+H2↑
B.2HClO 2HCl+O2↑
C.4NH3+5O2 4NO+6H2O
D.4Fe(OH)2+O2+2H2O===4Fe(OH)3
其中属于区域“1”的是 (填字母,下同),属于区域“2”的是 ,属于区域“3”的是 ,属于区域“4”的是 。
D
B
C
A
1.某元素从游离态变为化合态,则该元素一定被还原( )
2.有单质参加或生成的化学反应不一定是氧化还原反应( )
3.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
( )
4.向0.01 mol·L-1硫酸酸化的KMnO4溶液中滴加0.1 mol·L-1 H2O2溶液,溶液褪色,则H2O2具有氧化性( )
5.反应2Na2O2+2H2O 4NaOH+O2↑与反应Cl2+H2O HCl+
HClO均为水作还原剂的氧化还原反应( )
×
√
×
×
×
6. ( )
×
1.3NF3+5H2O 9HF+2NO+HNO3,用双线桥表示该反应的电子转移:
。其中NF3是 。
提升关键能力
氧化剂、还原剂
2.K2Cr2O7+3H2C2O4+4H2SO4 Cr2(SO4)3+6CO2↑+K2SO4+7H2O,用双线
桥表示该反应的电子转移: 。
3.已知NaBH4与水反应的化学方程式为NaBH4+2H2O NaBO2+4H2↑。
(1)氧化剂为 ,还原剂为 。
(2)用“单线桥”标出电子转移的方向和数目:
,其中氧化产物与还原产物的质量比为
。
(3)若生成标准状况下4.48 L H2,则转移电子的物质的量为 。
H2O
NaBH4
1∶1
0.2 mol
4.在高温条件下,碳酸锂(Li2CO3)、葡萄糖(C6H12O6)和磷酸铁(FePO4)可制备电极材料磷酸亚铁锂(LiFePO4),发生反应的化学方程式为12FePO4+
6Li2CO3+C6H12O6 12LiFePO4+6CO↑+6CO2↑+6H2O↑。下列说法错
误的是
A.反应中氧化剂和还原剂的物质的量之比为12∶1
B.反应中LiFePO4是还原产物,CO是氧化产物
C.生成1 mol LiFePO4时,转移2 mol电子
D.1 mol H2O中所含的中子总数为8NA
√
反应12FePO4+6Li2CO3+C6H12O6 12LiFePO4+6CO↑+6CO2↑+6H2O↑中铁元素化合价从+3价降低到+2价,FePO4是氧化剂,葡萄糖中碳元素化合价从0价升高到+2价,葡萄糖是还原剂,因此氧化剂和还原剂的物质的量之比为12∶1,A正确;
铁元素化合价从+3价降低到+2价,生成1 mol LiFePO4时,转移1 mol电子,C错误;
1个H2O分子中含有8个中子,1 mol H2O中所含的中子总数为8NA,D正确。
5.从矿物学资料查得一定条件下自然界存在反应:14CuSO4+5FeS2+12H2O
7Cu2S+5FeSO4+12H2SO4,则下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有24 mol电子转移
C.产物中的S有一部分是氧化产物
D.FeS2只作还原剂
√
在反应14CuSO4+5FeS2+12H2O 7Cu2S+5FeSO4+12H2SO4中,CuSO4中的Cu元素由+2价降低到+1价,FeS2中的S元素,一部分由-1价降低到-2价,一部分由-1价升高到+6价,则Cu2S是还原产物,A不正确;
5 mol FeS2发生反应,Fe元素价态不变,有3 mol S由-1价升高到+6价,所以有21 mol电子转移,B不正确;
产物中,来自CuSO4的S价态不变,FeS2中有一部分S元素转化为S,此部分S是氧化产物,C正确;
FeS2中,S元素一部分由-1价降低到-2价,一部分由-1价升高到+6价,所以FeS2既作氧化剂又作还原剂,D不正确。
返回
考点二
氧化还原反应基本规律
1.价态规律
(1)升降规律
氧化还原反应中,化合价有升必有降,升降总值相等。
(2)价态归中规律
含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。
整合必备知识
某同学将H2S溶液与浓硫酸的反应表示为 ,
这种表示方法是否正确?若不正确,请写出正确的表示方式。
思考
答案 不正确
(3)歧化反应规律
同一元素发生氧化还原反应生成不同价态的物质时,该元素的价态变化一定遵循“中间价态→高价态+低价态”,不会出现“一边倒”的现象,即生成物中该元素的价态不能都比反应物中该元素价态高,或都比反应物中该元素价态低。
如:Cl2+2NaOH NaCl+NaClO+H2O。
2.强弱规律
(1)在同一化学反应中:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2)越易失电子的物质(还原态),失电子后就越难得电子(氧化态),所以,氧化剂的氧化性越强,得电子后生成的还原产物的还原性就越弱, 反应生成的物质就越稳定。还原剂同理。
(3)熟记常见的物质(离子)的氧化性或还原性强弱顺序
氧化性:Mn(H+)>MnO2>Cl2>Br2>Fe3+>I2>S;还原性:Mn2+Fe2+[应用举例]
(1)试比较下列单质或离子的氧化性。
①Cl2、Br2、I2、S: 。
②H+、Cu2+、Zn2+、Na+: 。
(2)试比较下列单质或离子的还原性。
①Mg、Fe、Cu、Ag: 。
②Br-、I-、S2-: 。
③Cl-、S、OH-、Cu: 。
Mg>Fe>Cu>Ag
Cl2>Br2>I2>S
Na+Br-Cu>Cl->OH->S
(4)影响物质氧化性或还原性强弱的因素
①本质:物质氧化性、还原性的强弱取决于得、失电子的 程度,与得、失电子数目的 无关。
②影响因素:物质还原性、氧化性的强弱还与反应环境的许多因素有关,如温度、浓度、酸碱性。一般浓度越大,物质的氧化性或还原性越强;酸性增强时,氧化剂的氧化性增强。
难易
多少
[应用举例]
下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液 ⑤Cl2与NaOH溶液 ⑥Fe与HNO3溶液 ⑦Fe与H2SO4溶液 ⑧Na与O2
(1)由于浓度不同而发生不同氧化还原反应的是 (填序号,下同)。
(2)由于温度不同而发生不同氧化还原反应的是 。
(3)氧化还原反应不受浓度、温度影响的是 。
①③⑥⑦
⑤⑥⑦⑧
②④
⑥Fe和浓HNO3常温下钝化,加热继续反应;Fe和稀HNO3反应,HNO3被还原成NO。
⑦Fe和浓H2SO4常温下钝化,加热继续反应;Fe和稀H2SO4反应生成FeSO4和H2。
3.先后规律
(1)同时含有几种还原剂时将按照还原性由强到弱的顺序依次反应。如:在FeBr2溶液中通入少量Cl2时,因为还原性:Fe2+>Br-,所以Fe2+先与Cl2反应。
(2)同时含有几种氧化剂时将按照氧化性由强到弱的顺序依次反应。如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
[应用举例]
(1)向含Fe3+、H+、N的混合液中加入少量S,充分反应后,下列表示该反应的离子方程式正确的是
A.2Fe3++S+H2O===2Fe2++S+2H+
B.2H++S===H2O+SO2↑
C.2H++2N+3S===3S+2NO↑+H2O
D.2Fe3++3S+3H2O===2Fe(OH)3↓+3SO2↑
√
三价铁离子、硝酸根离子都具有氧化性,都能氧化亚硫酸根离子,硝酸根离子在酸性环境下氧化性强于三价铁离子,所以通入亚硫酸根离子,先与硝酸根离子反应,若亚硫酸根离子剩余再与三价铁离子反应,题干中亚硫酸根离子少量,所以只与硝酸根离子反应,离子方程式为2H++
2N+3S===3S+2NO↑+H2O,C项正确。
(2)已知还原性:SO2>I->Fe2+,下列离子反应不能发生的是
A.SO2+2Fe3++2H2O===S+2Fe2++4H+
B.I2+2Fe2+===2I-+2Fe3+
C.SO2+I2+2H2O===2I-+4H++S
D.少量Cl2通入FeI2溶液中:Cl2+2I-===2Cl-+I2
√
反应中还原剂SO2的还原性大于还原产物Fe2+,符合题给条件,反应能发生,故不选A;
反应中还原剂二氧化硫的还原性大于还原产物I-,符合题给条件,反应能发生,故不选C;
还原性:I->Fe2+,I-先和氯气反应,故不选D。
4.得失电子守恒规律
氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等。
运用“得失电子守恒规律”可直接计算参与氧化还原反应物质间的数量关系,配平氧化还原反应方程式(下一讲集中突破)。
1.NO2和NH3之间反应可能生成N2( )
2.1 mol Cl2与足量Ca(OH)2完全反应,转移电子数是2NA( )
3.SO2的还原性较强,而浓硫酸具有很强的氧化性,浓硫酸不能干燥SO2气体( )
4.向浓硫酸中通入H2S气体,1 mol浓硫酸转移电子数可能是6NA,也可能是2NA( )
5.含硫化合物X、Y的转化关系为S+NaOH X+Y+H2O,硫单质的化合价最低( )
×
√
×
×
√
一、氧化性、还原性判断
1.有下列化学反应:
①2Na+2H2O===2NaOH+H2↑ ②2F2+2H2O===4HF+O2
③Cl2+H2O HCl+HClO ④C+H2O(g) CO+H2
⑤CaO+H2O===Ca(OH)2 ⑥2H2O 2H2↑+O2↑
提升关键能力
分析H2O在反应中表现出的性质,完成表格:
元素价态 表现性质 具体反应
H:____ ______ _______
O:___ ______ ____
+1
氧化性
①④⑥
-2
还原性
②⑥
二、反应产物判断
2.已知在热的碱性溶液中,NaClO发生反应:3NaClO===2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
√
已知反应中氯元素的化合价由+1变为+5和-1。相同条件下NaClO2也能发生类似的反应,则氯元素的化合价应既有升高,也有降低,A项中均降低,D项中化合价均升高;
B、C两项与题意相符,但C项中NaClO不是最终产物。
3.在一定温度下,向KOH溶液中通入标准状况下11.2 L氯气,恰好完全反应生成三种含氯盐:0.7 mol KCl、0.2 mol KClO和X。则X是
A.0.1 mol KClO3 B.0.2 mol KClO3
C.0.1 mol KClO4 D.0.2 mol KClO4
√
标准状况下11.2 L氯气的物质的量为0.5 mol,根据原子守恒可知,生成X的物质的量为0.5 mol×2-0.7 mol-0.2 mol=0.1 mol;设X中氯元素的化合价为n,根据得失电子守恒可得0.7 mol×1=0.2 mol×(1-0)+0.1 mol×(n-0),解得n=+5,所以X为KClO3,故选A。
三、反应历程中的氧化还原反应分析
4.微生物在电子供体的作用下可将Sb(+5)(存在形式为)还原为更易被去除的Sb(+3),根据电子供体的不同可分为自养还原和异养还原。为去除水中锑(+5)酸盐,某大学建立升流式硫自养固定床生物反应器,其反应机理如图所示。下列说法正确的是
A.在生物反应器中可以实现S单质的循
环利用
B.自养还原过程的离子方程式为3Sb
+S+10H+===S+3Sb3++5H2O
C.歧化过程中,氧化产物与还原产物的物质的量之比为3∶1
D.Sb(+3)的沉淀去除过程发生了氧化还原反应
√
在生物反应器中并没有再重新生成S单质,不能实现S单质的循环利用,故A错误;
根据反应机理图可知,自养还原过程的离子方程式为3Sb+S+10H+===S
+3Sb3++5H2O,故B正确;
根据反应机理图可知,S单质歧化生成硫酸根离子和硫化氢,正确的离子方程式为4S+4H2O===3H2S+S+2H+,氧化产物(S)与还原产物(H2S)的物质的量之比为1∶3,故C错误;
Sb(+3)的沉淀去除过程中,Sb元素和S元素的化合价均没有发生变化,没有发生氧化还原反应,故D错误。
四、实验情景中氧化还原反应分析
5.验证氧化性强弱:Cl2>Br2>I2,设计如下实验(已知:稀溴水呈黄色,浓溴水呈红棕色,碘水呈棕黄色;忽略氧气的影响)。下列说法不正确的是
实验① 实验② 实验③ 实验④
溶液变为浅黄绿色 溶液变为黄色 溶液变为棕黄色 溶液变为蓝色
A.实验①设计目的:排除实验②③④水稀释的影响
B.实验②发生反应为2Br-+Cl2===Br2+2Cl-
C.实验③的现象可以证明氧化性:Cl2>I2
D.实验④能证明氧化性:Br2>I2
√
实验① 实验② 实验③ 实验④
溶液变为浅黄绿色 溶液变为黄色 溶液变为棕黄色 溶液变为蓝色
实验①是将氯水加入蒸馏水将其稀释,后续实验都是在溶液中进行的,这样可以排除实验②③④水稀释的影响,故A正确;
溶液变为黄色是因为产生溴单质,说明氯气可以将溴单质置换出来,发生的反应为2Br-+Cl2===Br2+2Cl-,故B正确;
溶液变为棕黄色是因为产生碘单质,说明氯气可以将碘单质置换出来,发生的反应为2I-+Cl2===I2+2Cl-,可以证明氧化性:Cl2>I2,故C正确;
②反应后的黄色溶液是含有溴单质的溶液,但是不能排除含有氯单质,加入淀粉碘化钾溶液会变蓝,证明产生了碘单质,可能是氯气或是溴单质置换出了碘单质,不能证明氧化性:Br2>I2,故D错误。
6.(2025·洛阳模拟)浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是
A.对比①和②可以说明还原性:Br->Cl-
B.①和③相比可说明氧化性:
Br2>SO2
C.②中试管口白雾是HCl遇水
蒸气所致,说明酸性:H2SO4>HCl
D.③中浓H2SO4被还原成SO2
√
反应①生成的红棕色气体是溴蒸气,反应②的白雾是氯化氢,说明浓硫酸能将溴离子氧化成溴单质,而不能将氯离子氧化成氯气,说明还原性:Br->Cl-,故A正确;
反应③生成二氧化硫气体,为非氧化还原反应,所以不能比较Br2、SO2的氧化性,故B、D错误;
白雾说明氯化氢易挥发,说明挥发性:H2SO4返回
LIANZHENTI MINGKAOXIANG
练真题 明考向
1.(2022·山东,1)古医典富载化学知识,下述之物见其氧化性者为
A.金(Au):“虽被火亦未熟”
B.石灰(CaO):“以水沃之,即热蒸而解”
C.石硫黄(S):“能化……银、铜、铁,奇物”
D.石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”
√
金(Au):“虽被火亦未熟”是指金单质在空气中被火灼烧也不反应,体现金的稳定性,与其氧化性无关,A不符合题意;
石灰(CaO):“以水沃之,即热蒸而解”是指CaO+H2O===Ca(OH)2,反应放热,产生大量的水汽,而CaO由块状变为粉末状,未发生氧化还原反应,与其氧化性无关,B不符合题意;
石硫黄(S):“能化……银、铜、铁,奇物”是指2Ag+S Ag2S、Fe+S
FeS、2Cu+S Cu2S,反应中S作氧化剂,与其氧化性有关,C符合题意;
石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”是指CaCO3+
2CH3COOH===(CH3COO)2Ca+H2O+CO2↑,未发生氧化还原反应,与其氧化性无关,D不符合题意。
2.(2024·浙江1月选考,4)汽车尾气中的NO和CO在催化剂作用下发生反应:2NO+2CO 2CO2+N2,下列说法不正确的是(NA为阿伏加德罗常数的值)
A.生成1 mol CO2转移电子的数目为2NA
B.催化剂降低NO与CO反应的活化能
C.NO是氧化剂,CO是还原剂
D.N2既是氧化产物又是还原产物
√
N2为还原产物,CO2为氧化产物,D错误。
3.(2024·甘肃,11)兴趣小组设计了从AgCl中提取Ag的实验方案,下列说法正确的是
A.还原性:Ag>Cu>Fe
B.按上述方案消耗1 mol Fe可回收1 mol Ag
C.反应①的离子方程式是[Cu(NH3)4]2++4H+===Cu2++4N
D.溶液①中的金属离子是Fe2+
√
金属活动性越强,金属
的还原性越强,还原性
从强到弱的顺序为Fe>Cu>Ag,A不正确;
由电子转移守恒可知,1 mol Fe可以置换1 mol Cu,而1 mol Cu可以置换2 mol Ag,因此,按上述方案消耗1 mol Fe可回收2 mol Ag,B不正确;
反应①中,氯化四氨合铜溶液与浓盐酸反应生成氯化铜和氯化铵,该反应的离子方程式是[Cu(NH3)4]2++4H+===Cu2++4N,C正确;
向氯化铜和氯化铵的混合液中加入铁,铁置换出铜后生成Fe2+,Fe2+被通入的氧气氧化为Fe3+,D不正确。
返回
KESHIJINGLIAN
课时精练
对一对
题号 1 2 3 4 5 6 7 8
答案 C B B C D D C B
题号 9 10 11 12 答案 D C D D 答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.
(1)D B C A
(2)① +10KOH===2K2CrO4+3K2SO4+8H2O
②H2O2 Cr
14.
(1)CuI I2 (2)2Cu+I2===2CuI
(3)> 高 (4)AC
1.(2025·陕西宝鸡高三上学期模拟)下列生活中常见的现象不涉及氧化还原反应的是
A.金属的冶炼 B.铁锅生锈
C.钟乳石的形成 D.天然气燃烧
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
金属的冶炼过程中,是把金属从化合态变为游离态,存在化合价变化,属于氧化还原反应,故A不选;
铁锅生锈,铁元素化合价升高,属于氧化还原反应,故B不选;
钟乳石的形成,不存在元素化合价变化,则不属于氧化还原反应,故C选;
天然气的燃烧属于氧化还原反应,故D不选。
答案
2.(2025·甘肃武威凉州高三上学期质量检测)下列物质间的转化需要通过氧化还原反应才能实现的是
A.CO2→NaHCO3 B.Fe(OH)2→Fe(OH)3
C.CaCO3→Na2CO3 D.CuO→Cu(NO3)2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
Fe(OH)2中铁元素为+2价,Fe(OH)3中铁元素为+3价,元素化合价发生变化,故Fe(OH)2→Fe(OH)3一定是通过氧化还原反应实现的,B符合题意;CO2→NaHCO3、CaCO3→Na2CO3、CuO→Cu(NO3)2没有元素化合价发生变化,不需要通过氧化还原反应实现,A、C、D不符合题意。
3.(2024·北京顺义一模)下列实验中的颜色变化与氧化还原反应无关的是
A.将充满NO2的试管倒立在水中,气体由红棕色变为无色
B.向Mg(OH)2悬浊液中滴加FeCl3溶液,固体由白色变为红褐色
C.将湿润的有色布条放入盛有干燥Cl2的集气瓶中,布条褪色
D.将一块绿豆大的Na放入坩埚中加热,有淡黄色固体生成
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
将充满NO2的试管倒立在水中,发生反应:3NO2+H2O===2HNO3+NO,气体由红棕色变为无色,与氧化还原反应有关,A不符合题意;
向Mg(OH)2悬浊液中滴加FeCl3溶液发生反应:3Mg(OH)2+2FeCl3===
2Fe(OH)3+3MgCl2,固体由白色变为红褐色,与氧化还原反应无关,B符合题意;
Cl2与水反应:Cl2+H2O HCl+HClO,生成的次氯酸使有色布条褪色,与氧化还原反应有关,C不符合题意;
Na与氧气反应:2Na+O2 Na2O2,与氧化还原反应有关,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
4.(2024·江苏淮安期中)室温下进行下列实验,根据实验操作和现象所得到的结论不正确的是
选项 实验操作和现象 结论
A 向PbO2中滴加浓盐酸,出现黄绿色气体 PbO2具有氧化性
B 向KI溶液中滴加几滴NaNO2溶液,再滴加淀粉溶液后变蓝色
C 向FeSO4溶液中先滴加KSCN溶液,无明显现象,再滴加H2O2溶液,溶液变成红色 Fe2+既有氧化性又有还原性
D 向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色 I-的还原性强于Cl-
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
Cl从-1价升高到0价,被氧化,PbO2具有氧化性,A项正确;
滴加淀粉溶液后变蓝色,说明有I2生成,可证明N的氧化性比I2的强,B项正确;
Fe2+遇KSCN溶液不变红,Fe3+遇KSCN溶液变红,由此说明加入的H2O2能氧化Fe2+为Fe3+,该反应中Fe2+只表现出还原性,C项错误;
新制氯水与KI反应生成I2,I2易溶于四氯化碳,则溶液下层呈紫红色,可知I-的还原性强于Cl-,D项正确。
5.(2025·陕西宝鸡高三上学期模拟)已知:①2+16H++10Cl-===2Mn2+
+5Cl2↑+8H2O;
②Cl2+2Fe2+===2Fe3++2Cl-;
③2Fe3++2I-===I2+2Fe2+。
由此判断,下列说法错误的是
A.还原性:I->Fe2+>Cl->Mn2+
B.反应3Cl2+6FeI2===2FeCl3+4FeI3不能发生
C.若某溶液中含有Fe2+、Cl-、I-,要氧化I-而不氧化Fe2+和Cl-,可以加入FeCl3溶液
D.将酸性KMnO4溶液加入到FeCl2和Fe2(SO4)3混合物溶液中,若紫色褪去,则
溶液中含有Fe2+
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
还原剂的还原性大于还原产物的还原性,反应①中还原性:Cl->Mn2+,反应②中还原性:Fe2+>Cl-,反应③中还原性:I->Fe2+,则还原性:I->Fe2+>Cl->Mn2+,故A正确;
Fe3+的氧化性大于I2的氧化性,Fe3+能氧化I-,所以不能生成FeI3,则反应3Cl2+6FeI2===2FeCl3+4FeI3不能发生,故B正确;
氧化性:>Cl2>Fe3+>I2,FeCl3能氧化除去I-而不影响Fe2+和Cl-,故C正确;
结合反应①,氯离子也可以使酸性KMnO4溶液褪色,不能确定是否是亚铁离子使其褪色,故D错误。
6.(2025·陕西十七校联考)①向蓝色的VOSO4溶液中滴加酸性KMnO4溶液,溶液由蓝色变为淡黄色;
②向(VO2)2SO4溶液中滴加浓盐酸产生黄绿色气体(Cl2),溶液变蓝;
③2FeI2+3Cl2(足量)===2FeCl3+2I2。
下列说法错误的是
A.①中还原剂与氧化剂的物质的量之比为5∶1
B.由①、②可知,酸性条件下氧化性:>>Cl2
C.②中每生成1 mol Cl2,转移2 mol电子
D.向酸性(VO2)2SO4溶液中滴加少量FeI2溶液,发生的反应为Fe2+++
2H+===Fe3++VO2++H2O
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
向蓝色的VOSO4溶液中滴加酸性KMnO4溶液,溶液由蓝色变为淡黄色,反应的离子方程式为5VO2+++H2O===5+Mn2++2H+,还原剂VOSO4与氧化剂KMnO4的物质的量之比为5∶1,A正确;
向(VO2)2SO4溶液中滴加浓盐酸产生黄绿色气体(Cl2),溶液变蓝,则生成VOSO4,反应的离子方程式为2+2Cl-+4H+===2VO2++Cl2↑+2H2O,
①中酸性条件下氧化性:>,②中酸性条件下氧化性:>Cl2,故由①、②可知,酸性条件下氧化性:>>Cl2,B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
②中反应的离子方程式为2+2Cl-+4H+===2VO2++Cl2↑+2H2O,每生成1 mol Cl2,转移2 mol电子,C正确;
因为氧化性:>Cl2,所以也能把少量FeI2氧化为Fe3+和I2,发生的反应为Fe2++2I-++6H+===Fe3++I2+3VO2++3H2O,D错误。
7.(2025·甘肃西北师范大学附属中学高三上学模拟)高铁酸钾(K2FeO4)是一种既能杀菌消毒又能絮凝净水的水处理剂。工业制备高铁酸钾反应的离子方程式为Fe(OH)3+ClO-+OH- Fe+Cl-+H2O(未配平)。下列有关说法不正确的是
A.上述反应中氧化剂和还原剂的物质的量之比为3∶2
B.高铁酸钾中铁显+6价
C.由上述反应可知,Fe(OH)3的氧化性强于Fe
D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3
胶体能吸附水中的悬浮杂质
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
离子方程式配平后为2Fe(OH)3+3ClO-+4OH-===2Fe+3Cl-+5H2O,由此可知氧化剂和还原剂的物质的量之比为3∶2,A正确;
高铁酸钾中铁显+6价,B正确;
由上述反应可知,ClO-的氧化性强于Fe,C错误;
K2FeO4处理水时,因具有强氧化性能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
8.(2025·甘肃武威凉州高三上学期质量检测)已知反应:①SO2+2Fe3++
2H2O +2Fe2++W;
②+aFe2++bH+ Cr3++Fe3++H2O(未配平)
下列有关说法正确的是
A.方程式①中W为4OH-
B.还原性:SO2>Fe2+
C.a=6,b=7
D.反应+3SO2+2H+===2Cr3++3+H2O不能发生
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
根据元素守恒和电荷守恒可知,反应①为SO2+2Fe3++2H2O=== +2Fe2++4H+,W为4H+,A错误;
由反应①可知,还原性:SO2>Fe2+,B正确;
反应②中,Cr元素的化合价由+6价降到+3价,Fe元素化合价由+2价升高到+3价,根据得失电子守恒和电荷守恒可得,a=6,b=14,C错误;
具有强氧化性,SO2具有还原性,且由①、②可知氧化性:Cr2>,则Cr2能将SO2氧化为S,即反应Cr2+3SO2+2H+
===2Cr3++3S+H2O能发生,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
9.(2024·辽宁朝阳期中)关于反应:KClO3+6HCl===KCl+3H2O+3Cl2↑,用同位素示踪法进行研究,反应前将KClO3标记为K37ClO3,HCl标记为H35Cl,下列说法正确的是
A.反应后,37Cl全部存在于氯化钾中
B.产物氯气的摩尔质量为72 g·mo
C.在氯气和氯化钾中都含有37Cl
D.产物氯气中37Cl与35Cl的原子个数比为1∶5
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
反应KClO3+6HCl===KCl+3H2O+3Cl2↑中,只有Cl元素化合价发生了变化,
用双线桥法表示该反应中转移电子的情况为 。
将KClO3标记为K37ClO3,37Cl应全部存在于氯气中,A、C错误;
根据得失电子守恒可知,产物氯气中37Cl与35Cl的原子个数比为1∶5,因此产物氯气的摩尔质量为 g·mol-1≈70.67 g·mo,B错误、D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
10.CH4和CO2按照一定物质的量之比向某容器中投料,反应经如下流程(主要产物已经标出)实现CO2的高效转化,下列说法正确的是
A.过程ⅰ中,每消耗22.4 L CH4反应中转移的电子数为6NA
B.过程ⅱ中,氧化剂为Fe3O4和H2
√
C.过程ⅲ中,C得到电子,发生
还原反应
D.上述流程只涉及两种单质
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
CH4所处的状态,故无法计算22.4 L
CH4的物质的量,即无法计算反应中
转移的电子数,A错误;
由转化流程图可知,过程ⅱ中涉及
反应Fe3O4+4CO 3Fe+4CO2和Fe3O4+4H2 3Fe+4H2O,故Fe3O4为
氧化剂,而H2作还原剂,B错误;
由转化流程图可知,过程ⅲ中反应为4CaCO3+3Fe 4CaO+Fe3O4+4CO,故C得到电子,发生还原反应,C正确;
由转化流程图可知,上述流程涉及Fe、H2、He三种单质,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
11.次磷酸钠(NaH2PO2)可用作药物和镀镍时的还原剂,反应原理为CuSO4+2NaH2PO2+2NaOH===Cu+2NaH2PO3+Na2SO4+H2↑。下列说法错误的是
A.参加反应的NaH2PO2有被CuSO4氧化
B.若1 mol H3PO3最多消耗2 mol NaOH,则NaH2PO3是酸式盐
C.反应中每转移6.02×1023个电子,则生成标准状况下5.6 L H2
D.NaH2PO3和H2均是还原产物
√
反应中P元素化合价从+1价升高到+3价,铜元素化合价从+2价降低到0价,氢元素化合价从+1价降低到0价,因此根据得失电子守恒可知,参加反应
的NaH2PO2有被CuSO4氧化,A正确;
若1 mol H3PO3最多消耗2 mol NaOH,说明H3PO3是二元酸,因此NaH2PO3是酸式盐,B正确;
根据选项A分析,可知转移4 mol电子生成1 mol氢气,因此反应中每转移6.02×1023个电子即1 mol电子,生成0.25 mol氢气,在标准状况下的体积为5.6 L,C正确;
NaH2PO3是氧化产物,Cu和H2是还原产物,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
12.(2025·开封模拟)已知有如下反应:
①K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O;②Cr+2HCl(稀)
===CrCl2+H2↑;③2KMnO4+16HCl(稀)===2KCl+2MnCl2+5Cl2↑+8H2O。下列说法正确的是
A.氧化性:K2Cr2O7>KMnO4>Cl2
B.反应③中氧化剂与还原剂的物质的量之比为5∶1
C.向金属Cr中滴入浓硝酸无明显变化,说明两者不能发生反应
D.向Cr2(SO4)3溶液中滴入酸性KMnO4溶液,可发生反应:10Cr3++
6Mn+11H2O===5Cr2+6Mn2++22H+
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
根据氧化性:氧化剂>氧化产物,结合①~③分别可得,氧化性:K2Cr2O7
>Cl2、HCl>CrCl2、KMnO4>Cl2,①中使用浓盐酸,③中使用稀盐酸,则氧化性:KMnO4>K2Cr2O7,A错误;
反应③中,KMnO4是氧化剂,HCl是还原剂,根据得失电子守恒可知,氧化剂和还原剂的物质的量之比为1∶5,B错误;
②中Cr与稀盐酸反应生成H2,向金属Cr中滴入浓硝酸无明显变化,可能是发生了钝化,C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
13.针对以下A~D四个涉及H2O2的反应(未配平)填空。
A.Na2O2+HCl H2O2+NaCl
B.Ag2O+H2O2 Ag+O2↑+H2O
C.H2O2 H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是 (填字母,下同),H2O2仅体现还原性的反应是 ,H2O2既体现氧化性又体现还原性的反应是 ,H2O2既不作氧化剂又不作还原剂的反应是 。
D
B
C
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
Na2O2+HCl H2O2+NaCl,不属于氧化还原反应,H2O2既不是氧化剂,也不是还原剂;Ag2O+H2O2 Ag+O2↑+H2O,Ag2O被还原成单质银,H2O2仅表现为还原性,其中O转化为O2;H2O2 H2O+O2↑,H2O2既表现了氧化性,又表现了还原性;H2O2+Cr2(SO4)3+KOH K2CrO4+K2SO4
+H2O,H2O2中O的化合价由-1价变成-2价,H2O2仅作氧化剂。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
(2)①用单线桥法标出D反应中电子转移的方向和数目,并将D反应配平。
H2O2+ Cr2(SO4)3+ KOH=== K2CrO4+ K2SO4+
H2O
②上述反应中氧化剂是 ,被氧化的元素是 。
答案 +10KOH===2K2CrO4+3K2SO4+8H2O
H2O2
Cr
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
Cr2(SO4)3中Cr的化合价为+3价,反应后变成了K2CrO4,化合价变成+6价,Cr的化合价升高,被氧化;H2O2中O的化合价降低,被还原,作氧化剂;被氧化的元素为Cr。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
14.CuI是难溶于水的白色固体。已知:氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+。
(1)根据物质氧化性和还原性的强弱推测,在溶液中Cu2+和I-反应的产物是 、 。
CuI
I2
氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+,所以Cu2+和I-反应,Cu2+被还原为Cu+、I-被氧化为I2,Cu+和I-结合生成难溶于水的CuI沉淀,所以反应的产物是CuI、I2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为 。
2Cu+I2===2CuI
久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质,加入金属铜,金属铜可以和碘单质反应生成CuI,反应的化学方程式为2Cu+I2===2CuI。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性:H2S (填“>”“<”或“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度 (填“高”“低”或“相等”)。
>
高
欲消除HI溶液的黄色,也可向其中通入少量H2S,碘单质可以和硫化氢反应生成单质硫和碘化氢,还原性:H2S>I-。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg===Cu2HgI4
(亮黄色)+2Cu。下列关于该化学方程式的说法错误的是 (填字母)。
A.该反应中被氧化的元素是铜元素和汞元素
B.该反应的氧化剂为CuI
C.Cu2HgI4既是氧化产物又是还原产物
D.反应中每生成1 mol Cu2HgI4转移2 mol电子
AC
该反应中Cu元素化合价由+1降低为0,被氧化的元素是汞元素,氧化剂为CuI,Cu2HgI4是氧化产物,反应中每生成1 mol Cu2HgI4转移2 mol电子。
返回
化学
大
一
轮
复
习
本课结束
第一章 第4讲
氧化还原反应的概念和规律
高考化学大一轮复习
复习目标
1.了解氧化还原反应的概念。
2.会用“单、双线桥”分析电子转移的方向和数目。
3.掌握氧化性、还原性强弱的比较及价态规律的应用。
4.会判断氧化还原反应的产物及方程式正误。
考点一 氧化还原反应及相关概念
考点二 氧化还原反应基本规律
课时精练
练真题 明考向
内容索引
考点一
氧化还原反应及相关概念
1.氧化还原反应
(1)本质: 转移(得失或偏移)。
(2)特征:反应过程中有 发生变化。
2.相关概念的关系
整合必备知识
氧化
电子
元素化合价
还原
还原
还原
氧化
氧化
3.电子转移的表示方法
(1)分别用双线桥法、单线桥法标出MnO2与浓盐酸在加热条件下反应的电子转移的方向和数目,并指出氧化剂、还原剂、氧化产物、还原产物。
答案
(2)上述反应若产生1 mol Cl2时,转移电子数目为 ,被氧化的HCl的物质的量是 mol。
2NA(或1.204×1024)
2
分析氧化还原反应,走好关键第一步——正确标出元素的化合价。
下列陌生物质中指定元素的化合价:
Li2NH:N-3,LiNH2:N-3,N2H4:N-2,
Na2S2O3:S+2,S2:S+6、O-1、-2,
C2:C+3,HCN:C+2、N-3,
B:B+3、H-1,CuH:Cu+1、H-1,
MnO(OH):Mn+3,FePO4:Fe+3,
Cr:Cr+6,K2FeO4:Fe+6,
LiFePO4:Fe+2,CuFeS2:Fe+2。
4.常见的氧化剂和还原剂
(1)常见的氧化剂
常见的氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
Cl-
SO2
NO或
NO2
Mn2+
Fe2+
或Fe
Cr3+
(2)常见的还原剂
常见的还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
Zn2+
H2O
CO2
Fe3+
S
I2
金属氢化物(如NaH等)、NaBH4也是重要的还原剂。
(3)元素化合价处于中间价态的物质既可以作氧化剂,又可以作还原剂。如:
Fe
S
H2O
Fe3+
S
O2
其中:Fe2+、S主要表现 性,H2O2主要表现 性。
还原
氧化
5.氧化还原反应与四种基本反应类型的关系
分析下列四个化学反应:
A.2Na+2H2O===2NaOH+H2↑
B.2HClO 2HCl+O2↑
C.4NH3+5O2 4NO+6H2O
D.4Fe(OH)2+O2+2H2O===4Fe(OH)3
其中属于区域“1”的是 (填字母,下同),属于区域“2”的是 ,属于区域“3”的是 ,属于区域“4”的是 。
D
B
C
A
1.某元素从游离态变为化合态,则该元素一定被还原( )
2.有单质参加或生成的化学反应不一定是氧化还原反应( )
3.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
( )
4.向0.01 mol·L-1硫酸酸化的KMnO4溶液中滴加0.1 mol·L-1 H2O2溶液,溶液褪色,则H2O2具有氧化性( )
5.反应2Na2O2+2H2O 4NaOH+O2↑与反应Cl2+H2O HCl+
HClO均为水作还原剂的氧化还原反应( )
×
√
×
×
×
6. ( )
×
1.3NF3+5H2O 9HF+2NO+HNO3,用双线桥表示该反应的电子转移:
。其中NF3是 。
提升关键能力
氧化剂、还原剂
2.K2Cr2O7+3H2C2O4+4H2SO4 Cr2(SO4)3+6CO2↑+K2SO4+7H2O,用双线
桥表示该反应的电子转移: 。
3.已知NaBH4与水反应的化学方程式为NaBH4+2H2O NaBO2+4H2↑。
(1)氧化剂为 ,还原剂为 。
(2)用“单线桥”标出电子转移的方向和数目:
,其中氧化产物与还原产物的质量比为
。
(3)若生成标准状况下4.48 L H2,则转移电子的物质的量为 。
H2O
NaBH4
1∶1
0.2 mol
4.在高温条件下,碳酸锂(Li2CO3)、葡萄糖(C6H12O6)和磷酸铁(FePO4)可制备电极材料磷酸亚铁锂(LiFePO4),发生反应的化学方程式为12FePO4+
6Li2CO3+C6H12O6 12LiFePO4+6CO↑+6CO2↑+6H2O↑。下列说法错
误的是
A.反应中氧化剂和还原剂的物质的量之比为12∶1
B.反应中LiFePO4是还原产物,CO是氧化产物
C.生成1 mol LiFePO4时,转移2 mol电子
D.1 mol H2O中所含的中子总数为8NA
√
反应12FePO4+6Li2CO3+C6H12O6 12LiFePO4+6CO↑+6CO2↑+6H2O↑中铁元素化合价从+3价降低到+2价,FePO4是氧化剂,葡萄糖中碳元素化合价从0价升高到+2价,葡萄糖是还原剂,因此氧化剂和还原剂的物质的量之比为12∶1,A正确;
铁元素化合价从+3价降低到+2价,生成1 mol LiFePO4时,转移1 mol电子,C错误;
1个H2O分子中含有8个中子,1 mol H2O中所含的中子总数为8NA,D正确。
5.从矿物学资料查得一定条件下自然界存在反应:14CuSO4+5FeS2+12H2O
7Cu2S+5FeSO4+12H2SO4,则下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有24 mol电子转移
C.产物中的S有一部分是氧化产物
D.FeS2只作还原剂
√
在反应14CuSO4+5FeS2+12H2O 7Cu2S+5FeSO4+12H2SO4中,CuSO4中的Cu元素由+2价降低到+1价,FeS2中的S元素,一部分由-1价降低到-2价,一部分由-1价升高到+6价,则Cu2S是还原产物,A不正确;
5 mol FeS2发生反应,Fe元素价态不变,有3 mol S由-1价升高到+6价,所以有21 mol电子转移,B不正确;
产物中,来自CuSO4的S价态不变,FeS2中有一部分S元素转化为S,此部分S是氧化产物,C正确;
FeS2中,S元素一部分由-1价降低到-2价,一部分由-1价升高到+6价,所以FeS2既作氧化剂又作还原剂,D不正确。
返回
考点二
氧化还原反应基本规律
1.价态规律
(1)升降规律
氧化还原反应中,化合价有升必有降,升降总值相等。
(2)价态归中规律
含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。
整合必备知识
某同学将H2S溶液与浓硫酸的反应表示为 ,
这种表示方法是否正确?若不正确,请写出正确的表示方式。
思考
答案 不正确
(3)歧化反应规律
同一元素发生氧化还原反应生成不同价态的物质时,该元素的价态变化一定遵循“中间价态→高价态+低价态”,不会出现“一边倒”的现象,即生成物中该元素的价态不能都比反应物中该元素价态高,或都比反应物中该元素价态低。
如:Cl2+2NaOH NaCl+NaClO+H2O。
2.强弱规律
(1)在同一化学反应中:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2)越易失电子的物质(还原态),失电子后就越难得电子(氧化态),所以,氧化剂的氧化性越强,得电子后生成的还原产物的还原性就越弱, 反应生成的物质就越稳定。还原剂同理。
(3)熟记常见的物质(离子)的氧化性或还原性强弱顺序
氧化性:Mn(H+)>MnO2>Cl2>Br2>Fe3+>I2>S;还原性:Mn2+
(1)试比较下列单质或离子的氧化性。
①Cl2、Br2、I2、S: 。
②H+、Cu2+、Zn2+、Na+: 。
(2)试比较下列单质或离子的还原性。
①Mg、Fe、Cu、Ag: 。
②Br-、I-、S2-: 。
③Cl-、S、OH-、Cu: 。
Mg>Fe>Cu>Ag
Cl2>Br2>I2>S
Na+
(4)影响物质氧化性或还原性强弱的因素
①本质:物质氧化性、还原性的强弱取决于得、失电子的 程度,与得、失电子数目的 无关。
②影响因素:物质还原性、氧化性的强弱还与反应环境的许多因素有关,如温度、浓度、酸碱性。一般浓度越大,物质的氧化性或还原性越强;酸性增强时,氧化剂的氧化性增强。
难易
多少
[应用举例]
下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液 ⑤Cl2与NaOH溶液 ⑥Fe与HNO3溶液 ⑦Fe与H2SO4溶液 ⑧Na与O2
(1)由于浓度不同而发生不同氧化还原反应的是 (填序号,下同)。
(2)由于温度不同而发生不同氧化还原反应的是 。
(3)氧化还原反应不受浓度、温度影响的是 。
①③⑥⑦
⑤⑥⑦⑧
②④
⑥Fe和浓HNO3常温下钝化,加热继续反应;Fe和稀HNO3反应,HNO3被还原成NO。
⑦Fe和浓H2SO4常温下钝化,加热继续反应;Fe和稀H2SO4反应生成FeSO4和H2。
3.先后规律
(1)同时含有几种还原剂时将按照还原性由强到弱的顺序依次反应。如:在FeBr2溶液中通入少量Cl2时,因为还原性:Fe2+>Br-,所以Fe2+先与Cl2反应。
(2)同时含有几种氧化剂时将按照氧化性由强到弱的顺序依次反应。如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
[应用举例]
(1)向含Fe3+、H+、N的混合液中加入少量S,充分反应后,下列表示该反应的离子方程式正确的是
A.2Fe3++S+H2O===2Fe2++S+2H+
B.2H++S===H2O+SO2↑
C.2H++2N+3S===3S+2NO↑+H2O
D.2Fe3++3S+3H2O===2Fe(OH)3↓+3SO2↑
√
三价铁离子、硝酸根离子都具有氧化性,都能氧化亚硫酸根离子,硝酸根离子在酸性环境下氧化性强于三价铁离子,所以通入亚硫酸根离子,先与硝酸根离子反应,若亚硫酸根离子剩余再与三价铁离子反应,题干中亚硫酸根离子少量,所以只与硝酸根离子反应,离子方程式为2H++
2N+3S===3S+2NO↑+H2O,C项正确。
(2)已知还原性:SO2>I->Fe2+,下列离子反应不能发生的是
A.SO2+2Fe3++2H2O===S+2Fe2++4H+
B.I2+2Fe2+===2I-+2Fe3+
C.SO2+I2+2H2O===2I-+4H++S
D.少量Cl2通入FeI2溶液中:Cl2+2I-===2Cl-+I2
√
反应中还原剂SO2的还原性大于还原产物Fe2+,符合题给条件,反应能发生,故不选A;
反应中还原剂二氧化硫的还原性大于还原产物I-,符合题给条件,反应能发生,故不选C;
还原性:I->Fe2+,I-先和氯气反应,故不选D。
4.得失电子守恒规律
氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等。
运用“得失电子守恒规律”可直接计算参与氧化还原反应物质间的数量关系,配平氧化还原反应方程式(下一讲集中突破)。
1.NO2和NH3之间反应可能生成N2( )
2.1 mol Cl2与足量Ca(OH)2完全反应,转移电子数是2NA( )
3.SO2的还原性较强,而浓硫酸具有很强的氧化性,浓硫酸不能干燥SO2气体( )
4.向浓硫酸中通入H2S气体,1 mol浓硫酸转移电子数可能是6NA,也可能是2NA( )
5.含硫化合物X、Y的转化关系为S+NaOH X+Y+H2O,硫单质的化合价最低( )
×
√
×
×
√
一、氧化性、还原性判断
1.有下列化学反应:
①2Na+2H2O===2NaOH+H2↑ ②2F2+2H2O===4HF+O2
③Cl2+H2O HCl+HClO ④C+H2O(g) CO+H2
⑤CaO+H2O===Ca(OH)2 ⑥2H2O 2H2↑+O2↑
提升关键能力
分析H2O在反应中表现出的性质,完成表格:
元素价态 表现性质 具体反应
H:____ ______ _______
O:___ ______ ____
+1
氧化性
①④⑥
-2
还原性
②⑥
二、反应产物判断
2.已知在热的碱性溶液中,NaClO发生反应:3NaClO===2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
√
已知反应中氯元素的化合价由+1变为+5和-1。相同条件下NaClO2也能发生类似的反应,则氯元素的化合价应既有升高,也有降低,A项中均降低,D项中化合价均升高;
B、C两项与题意相符,但C项中NaClO不是最终产物。
3.在一定温度下,向KOH溶液中通入标准状况下11.2 L氯气,恰好完全反应生成三种含氯盐:0.7 mol KCl、0.2 mol KClO和X。则X是
A.0.1 mol KClO3 B.0.2 mol KClO3
C.0.1 mol KClO4 D.0.2 mol KClO4
√
标准状况下11.2 L氯气的物质的量为0.5 mol,根据原子守恒可知,生成X的物质的量为0.5 mol×2-0.7 mol-0.2 mol=0.1 mol;设X中氯元素的化合价为n,根据得失电子守恒可得0.7 mol×1=0.2 mol×(1-0)+0.1 mol×(n-0),解得n=+5,所以X为KClO3,故选A。
三、反应历程中的氧化还原反应分析
4.微生物在电子供体的作用下可将Sb(+5)(存在形式为)还原为更易被去除的Sb(+3),根据电子供体的不同可分为自养还原和异养还原。为去除水中锑(+5)酸盐,某大学建立升流式硫自养固定床生物反应器,其反应机理如图所示。下列说法正确的是
A.在生物反应器中可以实现S单质的循
环利用
B.自养还原过程的离子方程式为3Sb
+S+10H+===S+3Sb3++5H2O
C.歧化过程中,氧化产物与还原产物的物质的量之比为3∶1
D.Sb(+3)的沉淀去除过程发生了氧化还原反应
√
在生物反应器中并没有再重新生成S单质,不能实现S单质的循环利用,故A错误;
根据反应机理图可知,自养还原过程的离子方程式为3Sb+S+10H+===S
+3Sb3++5H2O,故B正确;
根据反应机理图可知,S单质歧化生成硫酸根离子和硫化氢,正确的离子方程式为4S+4H2O===3H2S+S+2H+,氧化产物(S)与还原产物(H2S)的物质的量之比为1∶3,故C错误;
Sb(+3)的沉淀去除过程中,Sb元素和S元素的化合价均没有发生变化,没有发生氧化还原反应,故D错误。
四、实验情景中氧化还原反应分析
5.验证氧化性强弱:Cl2>Br2>I2,设计如下实验(已知:稀溴水呈黄色,浓溴水呈红棕色,碘水呈棕黄色;忽略氧气的影响)。下列说法不正确的是
实验① 实验② 实验③ 实验④
溶液变为浅黄绿色 溶液变为黄色 溶液变为棕黄色 溶液变为蓝色
A.实验①设计目的:排除实验②③④水稀释的影响
B.实验②发生反应为2Br-+Cl2===Br2+2Cl-
C.实验③的现象可以证明氧化性:Cl2>I2
D.实验④能证明氧化性:Br2>I2
√
实验① 实验② 实验③ 实验④
溶液变为浅黄绿色 溶液变为黄色 溶液变为棕黄色 溶液变为蓝色
实验①是将氯水加入蒸馏水将其稀释,后续实验都是在溶液中进行的,这样可以排除实验②③④水稀释的影响,故A正确;
溶液变为黄色是因为产生溴单质,说明氯气可以将溴单质置换出来,发生的反应为2Br-+Cl2===Br2+2Cl-,故B正确;
溶液变为棕黄色是因为产生碘单质,说明氯气可以将碘单质置换出来,发生的反应为2I-+Cl2===I2+2Cl-,可以证明氧化性:Cl2>I2,故C正确;
②反应后的黄色溶液是含有溴单质的溶液,但是不能排除含有氯单质,加入淀粉碘化钾溶液会变蓝,证明产生了碘单质,可能是氯气或是溴单质置换出了碘单质,不能证明氧化性:Br2>I2,故D错误。
6.(2025·洛阳模拟)浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是
A.对比①和②可以说明还原性:Br->Cl-
B.①和③相比可说明氧化性:
Br2>SO2
C.②中试管口白雾是HCl遇水
蒸气所致,说明酸性:H2SO4>HCl
D.③中浓H2SO4被还原成SO2
√
反应①生成的红棕色气体是溴蒸气,反应②的白雾是氯化氢,说明浓硫酸能将溴离子氧化成溴单质,而不能将氯离子氧化成氯气,说明还原性:Br->Cl-,故A正确;
反应③生成二氧化硫气体,为非氧化还原反应,所以不能比较Br2、SO2的氧化性,故B、D错误;
白雾说明氯化氢易挥发,说明挥发性:H2SO4
LIANZHENTI MINGKAOXIANG
练真题 明考向
1.(2022·山东,1)古医典富载化学知识,下述之物见其氧化性者为
A.金(Au):“虽被火亦未熟”
B.石灰(CaO):“以水沃之,即热蒸而解”
C.石硫黄(S):“能化……银、铜、铁,奇物”
D.石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”
√
金(Au):“虽被火亦未熟”是指金单质在空气中被火灼烧也不反应,体现金的稳定性,与其氧化性无关,A不符合题意;
石灰(CaO):“以水沃之,即热蒸而解”是指CaO+H2O===Ca(OH)2,反应放热,产生大量的水汽,而CaO由块状变为粉末状,未发生氧化还原反应,与其氧化性无关,B不符合题意;
石硫黄(S):“能化……银、铜、铁,奇物”是指2Ag+S Ag2S、Fe+S
FeS、2Cu+S Cu2S,反应中S作氧化剂,与其氧化性有关,C符合题意;
石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”是指CaCO3+
2CH3COOH===(CH3COO)2Ca+H2O+CO2↑,未发生氧化还原反应,与其氧化性无关,D不符合题意。
2.(2024·浙江1月选考,4)汽车尾气中的NO和CO在催化剂作用下发生反应:2NO+2CO 2CO2+N2,下列说法不正确的是(NA为阿伏加德罗常数的值)
A.生成1 mol CO2转移电子的数目为2NA
B.催化剂降低NO与CO反应的活化能
C.NO是氧化剂,CO是还原剂
D.N2既是氧化产物又是还原产物
√
N2为还原产物,CO2为氧化产物,D错误。
3.(2024·甘肃,11)兴趣小组设计了从AgCl中提取Ag的实验方案,下列说法正确的是
A.还原性:Ag>Cu>Fe
B.按上述方案消耗1 mol Fe可回收1 mol Ag
C.反应①的离子方程式是[Cu(NH3)4]2++4H+===Cu2++4N
D.溶液①中的金属离子是Fe2+
√
金属活动性越强,金属
的还原性越强,还原性
从强到弱的顺序为Fe>Cu>Ag,A不正确;
由电子转移守恒可知,1 mol Fe可以置换1 mol Cu,而1 mol Cu可以置换2 mol Ag,因此,按上述方案消耗1 mol Fe可回收2 mol Ag,B不正确;
反应①中,氯化四氨合铜溶液与浓盐酸反应生成氯化铜和氯化铵,该反应的离子方程式是[Cu(NH3)4]2++4H+===Cu2++4N,C正确;
向氯化铜和氯化铵的混合液中加入铁,铁置换出铜后生成Fe2+,Fe2+被通入的氧气氧化为Fe3+,D不正确。
返回
KESHIJINGLIAN
课时精练
对一对
题号 1 2 3 4 5 6 7 8
答案 C B B C D D C B
题号 9 10 11 12 答案 D C D D 答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.
(1)D B C A
(2)① +10KOH===2K2CrO4+3K2SO4+8H2O
②H2O2 Cr
14.
(1)CuI I2 (2)2Cu+I2===2CuI
(3)> 高 (4)AC
1.(2025·陕西宝鸡高三上学期模拟)下列生活中常见的现象不涉及氧化还原反应的是
A.金属的冶炼 B.铁锅生锈
C.钟乳石的形成 D.天然气燃烧
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
金属的冶炼过程中,是把金属从化合态变为游离态,存在化合价变化,属于氧化还原反应,故A不选;
铁锅生锈,铁元素化合价升高,属于氧化还原反应,故B不选;
钟乳石的形成,不存在元素化合价变化,则不属于氧化还原反应,故C选;
天然气的燃烧属于氧化还原反应,故D不选。
答案
2.(2025·甘肃武威凉州高三上学期质量检测)下列物质间的转化需要通过氧化还原反应才能实现的是
A.CO2→NaHCO3 B.Fe(OH)2→Fe(OH)3
C.CaCO3→Na2CO3 D.CuO→Cu(NO3)2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
Fe(OH)2中铁元素为+2价,Fe(OH)3中铁元素为+3价,元素化合价发生变化,故Fe(OH)2→Fe(OH)3一定是通过氧化还原反应实现的,B符合题意;CO2→NaHCO3、CaCO3→Na2CO3、CuO→Cu(NO3)2没有元素化合价发生变化,不需要通过氧化还原反应实现,A、C、D不符合题意。
3.(2024·北京顺义一模)下列实验中的颜色变化与氧化还原反应无关的是
A.将充满NO2的试管倒立在水中,气体由红棕色变为无色
B.向Mg(OH)2悬浊液中滴加FeCl3溶液,固体由白色变为红褐色
C.将湿润的有色布条放入盛有干燥Cl2的集气瓶中,布条褪色
D.将一块绿豆大的Na放入坩埚中加热,有淡黄色固体生成
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
将充满NO2的试管倒立在水中,发生反应:3NO2+H2O===2HNO3+NO,气体由红棕色变为无色,与氧化还原反应有关,A不符合题意;
向Mg(OH)2悬浊液中滴加FeCl3溶液发生反应:3Mg(OH)2+2FeCl3===
2Fe(OH)3+3MgCl2,固体由白色变为红褐色,与氧化还原反应无关,B符合题意;
Cl2与水反应:Cl2+H2O HCl+HClO,生成的次氯酸使有色布条褪色,与氧化还原反应有关,C不符合题意;
Na与氧气反应:2Na+O2 Na2O2,与氧化还原反应有关,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
4.(2024·江苏淮安期中)室温下进行下列实验,根据实验操作和现象所得到的结论不正确的是
选项 实验操作和现象 结论
A 向PbO2中滴加浓盐酸,出现黄绿色气体 PbO2具有氧化性
B 向KI溶液中滴加几滴NaNO2溶液,再滴加淀粉溶液后变蓝色
C 向FeSO4溶液中先滴加KSCN溶液,无明显现象,再滴加H2O2溶液,溶液变成红色 Fe2+既有氧化性又有还原性
D 向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色 I-的还原性强于Cl-
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
Cl从-1价升高到0价,被氧化,PbO2具有氧化性,A项正确;
滴加淀粉溶液后变蓝色,说明有I2生成,可证明N的氧化性比I2的强,B项正确;
Fe2+遇KSCN溶液不变红,Fe3+遇KSCN溶液变红,由此说明加入的H2O2能氧化Fe2+为Fe3+,该反应中Fe2+只表现出还原性,C项错误;
新制氯水与KI反应生成I2,I2易溶于四氯化碳,则溶液下层呈紫红色,可知I-的还原性强于Cl-,D项正确。
5.(2025·陕西宝鸡高三上学期模拟)已知:①2+16H++10Cl-===2Mn2+
+5Cl2↑+8H2O;
②Cl2+2Fe2+===2Fe3++2Cl-;
③2Fe3++2I-===I2+2Fe2+。
由此判断,下列说法错误的是
A.还原性:I->Fe2+>Cl->Mn2+
B.反应3Cl2+6FeI2===2FeCl3+4FeI3不能发生
C.若某溶液中含有Fe2+、Cl-、I-,要氧化I-而不氧化Fe2+和Cl-,可以加入FeCl3溶液
D.将酸性KMnO4溶液加入到FeCl2和Fe2(SO4)3混合物溶液中,若紫色褪去,则
溶液中含有Fe2+
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
还原剂的还原性大于还原产物的还原性,反应①中还原性:Cl->Mn2+,反应②中还原性:Fe2+>Cl-,反应③中还原性:I->Fe2+,则还原性:I->Fe2+>Cl->Mn2+,故A正确;
Fe3+的氧化性大于I2的氧化性,Fe3+能氧化I-,所以不能生成FeI3,则反应3Cl2+6FeI2===2FeCl3+4FeI3不能发生,故B正确;
氧化性:>Cl2>Fe3+>I2,FeCl3能氧化除去I-而不影响Fe2+和Cl-,故C正确;
结合反应①,氯离子也可以使酸性KMnO4溶液褪色,不能确定是否是亚铁离子使其褪色,故D错误。
6.(2025·陕西十七校联考)①向蓝色的VOSO4溶液中滴加酸性KMnO4溶液,溶液由蓝色变为淡黄色;
②向(VO2)2SO4溶液中滴加浓盐酸产生黄绿色气体(Cl2),溶液变蓝;
③2FeI2+3Cl2(足量)===2FeCl3+2I2。
下列说法错误的是
A.①中还原剂与氧化剂的物质的量之比为5∶1
B.由①、②可知,酸性条件下氧化性:>>Cl2
C.②中每生成1 mol Cl2,转移2 mol电子
D.向酸性(VO2)2SO4溶液中滴加少量FeI2溶液,发生的反应为Fe2+++
2H+===Fe3++VO2++H2O
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
向蓝色的VOSO4溶液中滴加酸性KMnO4溶液,溶液由蓝色变为淡黄色,反应的离子方程式为5VO2+++H2O===5+Mn2++2H+,还原剂VOSO4与氧化剂KMnO4的物质的量之比为5∶1,A正确;
向(VO2)2SO4溶液中滴加浓盐酸产生黄绿色气体(Cl2),溶液变蓝,则生成VOSO4,反应的离子方程式为2+2Cl-+4H+===2VO2++Cl2↑+2H2O,
①中酸性条件下氧化性:>,②中酸性条件下氧化性:>Cl2,故由①、②可知,酸性条件下氧化性:>>Cl2,B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
②中反应的离子方程式为2+2Cl-+4H+===2VO2++Cl2↑+2H2O,每生成1 mol Cl2,转移2 mol电子,C正确;
因为氧化性:>Cl2,所以也能把少量FeI2氧化为Fe3+和I2,发生的反应为Fe2++2I-++6H+===Fe3++I2+3VO2++3H2O,D错误。
7.(2025·甘肃西北师范大学附属中学高三上学模拟)高铁酸钾(K2FeO4)是一种既能杀菌消毒又能絮凝净水的水处理剂。工业制备高铁酸钾反应的离子方程式为Fe(OH)3+ClO-+OH- Fe+Cl-+H2O(未配平)。下列有关说法不正确的是
A.上述反应中氧化剂和还原剂的物质的量之比为3∶2
B.高铁酸钾中铁显+6价
C.由上述反应可知,Fe(OH)3的氧化性强于Fe
D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3
胶体能吸附水中的悬浮杂质
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
离子方程式配平后为2Fe(OH)3+3ClO-+4OH-===2Fe+3Cl-+5H2O,由此可知氧化剂和还原剂的物质的量之比为3∶2,A正确;
高铁酸钾中铁显+6价,B正确;
由上述反应可知,ClO-的氧化性强于Fe,C错误;
K2FeO4处理水时,因具有强氧化性能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
8.(2025·甘肃武威凉州高三上学期质量检测)已知反应:①SO2+2Fe3++
2H2O +2Fe2++W;
②+aFe2++bH+ Cr3++Fe3++H2O(未配平)
下列有关说法正确的是
A.方程式①中W为4OH-
B.还原性:SO2>Fe2+
C.a=6,b=7
D.反应+3SO2+2H+===2Cr3++3+H2O不能发生
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
根据元素守恒和电荷守恒可知,反应①为SO2+2Fe3++2H2O=== +2Fe2++4H+,W为4H+,A错误;
由反应①可知,还原性:SO2>Fe2+,B正确;
反应②中,Cr元素的化合价由+6价降到+3价,Fe元素化合价由+2价升高到+3价,根据得失电子守恒和电荷守恒可得,a=6,b=14,C错误;
具有强氧化性,SO2具有还原性,且由①、②可知氧化性:Cr2>,则Cr2能将SO2氧化为S,即反应Cr2+3SO2+2H+
===2Cr3++3S+H2O能发生,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
9.(2024·辽宁朝阳期中)关于反应:KClO3+6HCl===KCl+3H2O+3Cl2↑,用同位素示踪法进行研究,反应前将KClO3标记为K37ClO3,HCl标记为H35Cl,下列说法正确的是
A.反应后,37Cl全部存在于氯化钾中
B.产物氯气的摩尔质量为72 g·mo
C.在氯气和氯化钾中都含有37Cl
D.产物氯气中37Cl与35Cl的原子个数比为1∶5
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
反应KClO3+6HCl===KCl+3H2O+3Cl2↑中,只有Cl元素化合价发生了变化,
用双线桥法表示该反应中转移电子的情况为 。
将KClO3标记为K37ClO3,37Cl应全部存在于氯气中,A、C错误;
根据得失电子守恒可知,产物氯气中37Cl与35Cl的原子个数比为1∶5,因此产物氯气的摩尔质量为 g·mol-1≈70.67 g·mo,B错误、D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
10.CH4和CO2按照一定物质的量之比向某容器中投料,反应经如下流程(主要产物已经标出)实现CO2的高效转化,下列说法正确的是
A.过程ⅰ中,每消耗22.4 L CH4反应中转移的电子数为6NA
B.过程ⅱ中,氧化剂为Fe3O4和H2
√
C.过程ⅲ中,C得到电子,发生
还原反应
D.上述流程只涉及两种单质
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
CH4所处的状态,故无法计算22.4 L
CH4的物质的量,即无法计算反应中
转移的电子数,A错误;
由转化流程图可知,过程ⅱ中涉及
反应Fe3O4+4CO 3Fe+4CO2和Fe3O4+4H2 3Fe+4H2O,故Fe3O4为
氧化剂,而H2作还原剂,B错误;
由转化流程图可知,过程ⅲ中反应为4CaCO3+3Fe 4CaO+Fe3O4+4CO,故C得到电子,发生还原反应,C正确;
由转化流程图可知,上述流程涉及Fe、H2、He三种单质,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
11.次磷酸钠(NaH2PO2)可用作药物和镀镍时的还原剂,反应原理为CuSO4+2NaH2PO2+2NaOH===Cu+2NaH2PO3+Na2SO4+H2↑。下列说法错误的是
A.参加反应的NaH2PO2有被CuSO4氧化
B.若1 mol H3PO3最多消耗2 mol NaOH,则NaH2PO3是酸式盐
C.反应中每转移6.02×1023个电子,则生成标准状况下5.6 L H2
D.NaH2PO3和H2均是还原产物
√
反应中P元素化合价从+1价升高到+3价,铜元素化合价从+2价降低到0价,氢元素化合价从+1价降低到0价,因此根据得失电子守恒可知,参加反应
的NaH2PO2有被CuSO4氧化,A正确;
若1 mol H3PO3最多消耗2 mol NaOH,说明H3PO3是二元酸,因此NaH2PO3是酸式盐,B正确;
根据选项A分析,可知转移4 mol电子生成1 mol氢气,因此反应中每转移6.02×1023个电子即1 mol电子,生成0.25 mol氢气,在标准状况下的体积为5.6 L,C正确;
NaH2PO3是氧化产物,Cu和H2是还原产物,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
12.(2025·开封模拟)已知有如下反应:
①K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O;②Cr+2HCl(稀)
===CrCl2+H2↑;③2KMnO4+16HCl(稀)===2KCl+2MnCl2+5Cl2↑+8H2O。下列说法正确的是
A.氧化性:K2Cr2O7>KMnO4>Cl2
B.反应③中氧化剂与还原剂的物质的量之比为5∶1
C.向金属Cr中滴入浓硝酸无明显变化,说明两者不能发生反应
D.向Cr2(SO4)3溶液中滴入酸性KMnO4溶液,可发生反应:10Cr3++
6Mn+11H2O===5Cr2+6Mn2++22H+
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
根据氧化性:氧化剂>氧化产物,结合①~③分别可得,氧化性:K2Cr2O7
>Cl2、HCl>CrCl2、KMnO4>Cl2,①中使用浓盐酸,③中使用稀盐酸,则氧化性:KMnO4>K2Cr2O7,A错误;
反应③中,KMnO4是氧化剂,HCl是还原剂,根据得失电子守恒可知,氧化剂和还原剂的物质的量之比为1∶5,B错误;
②中Cr与稀盐酸反应生成H2,向金属Cr中滴入浓硝酸无明显变化,可能是发生了钝化,C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
13.针对以下A~D四个涉及H2O2的反应(未配平)填空。
A.Na2O2+HCl H2O2+NaCl
B.Ag2O+H2O2 Ag+O2↑+H2O
C.H2O2 H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是 (填字母,下同),H2O2仅体现还原性的反应是 ,H2O2既体现氧化性又体现还原性的反应是 ,H2O2既不作氧化剂又不作还原剂的反应是 。
D
B
C
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
Na2O2+HCl H2O2+NaCl,不属于氧化还原反应,H2O2既不是氧化剂,也不是还原剂;Ag2O+H2O2 Ag+O2↑+H2O,Ag2O被还原成单质银,H2O2仅表现为还原性,其中O转化为O2;H2O2 H2O+O2↑,H2O2既表现了氧化性,又表现了还原性;H2O2+Cr2(SO4)3+KOH K2CrO4+K2SO4
+H2O,H2O2中O的化合价由-1价变成-2价,H2O2仅作氧化剂。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
(2)①用单线桥法标出D反应中电子转移的方向和数目,并将D反应配平。
H2O2+ Cr2(SO4)3+ KOH=== K2CrO4+ K2SO4+
H2O
②上述反应中氧化剂是 ,被氧化的元素是 。
答案 +10KOH===2K2CrO4+3K2SO4+8H2O
H2O2
Cr
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
Cr2(SO4)3中Cr的化合价为+3价,反应后变成了K2CrO4,化合价变成+6价,Cr的化合价升高,被氧化;H2O2中O的化合价降低,被还原,作氧化剂;被氧化的元素为Cr。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
14.CuI是难溶于水的白色固体。已知:氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+。
(1)根据物质氧化性和还原性的强弱推测,在溶液中Cu2+和I-反应的产物是 、 。
CuI
I2
氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+,所以Cu2+和I-反应,Cu2+被还原为Cu+、I-被氧化为I2,Cu+和I-结合生成难溶于水的CuI沉淀,所以反应的产物是CuI、I2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为 。
2Cu+I2===2CuI
久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质,加入金属铜,金属铜可以和碘单质反应生成CuI,反应的化学方程式为2Cu+I2===2CuI。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性:H2S (填“>”“<”或“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度 (填“高”“低”或“相等”)。
>
高
欲消除HI溶液的黄色,也可向其中通入少量H2S,碘单质可以和硫化氢反应生成单质硫和碘化氢,还原性:H2S>I-。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg===Cu2HgI4
(亮黄色)+2Cu。下列关于该化学方程式的说法错误的是 (填字母)。
A.该反应中被氧化的元素是铜元素和汞元素
B.该反应的氧化剂为CuI
C.Cu2HgI4既是氧化产物又是还原产物
D.反应中每生成1 mol Cu2HgI4转移2 mol电子
AC
该反应中Cu元素化合价由+1降低为0,被氧化的元素是汞元素,氧化剂为CuI,Cu2HgI4是氧化产物,反应中每生成1 mol Cu2HgI4转移2 mol电子。
返回
化学
大
一
轮
复
习
本课结束
同课章节目录
