人教版高一必修1化学第3章第1节金属的化学性质 (共54张PPT)
文档属性
| 名称 | 人教版高一必修1化学第3章第1节金属的化学性质 (共54张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-21 09:41:34 | ||
图片预览










文档简介
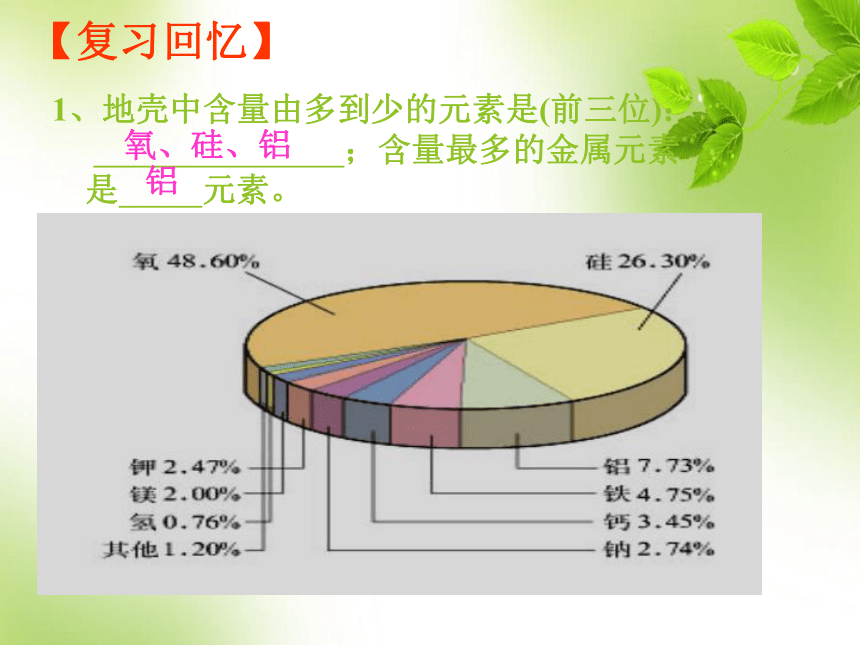
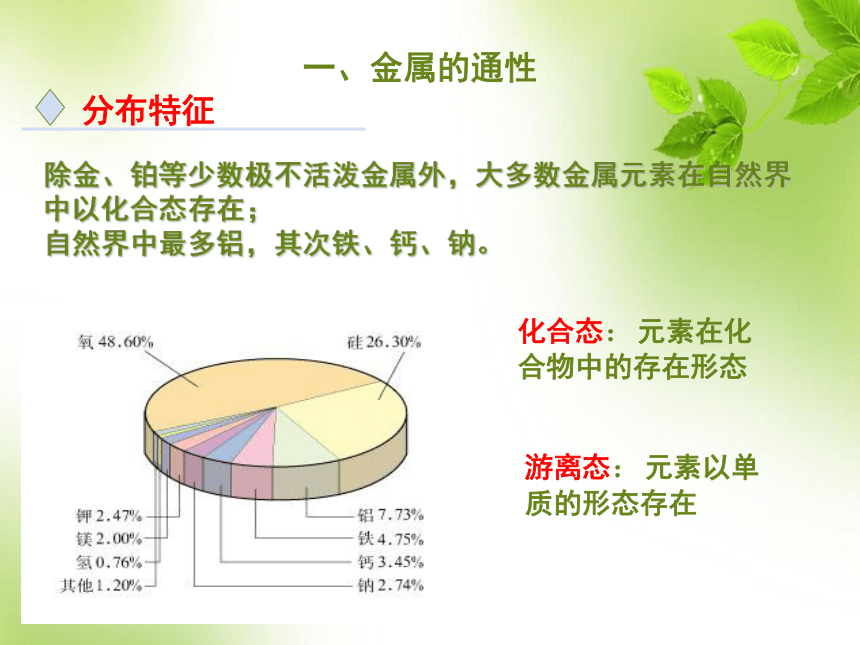
课件54张PPT。3.1金属的化学性质铜 Cu铁 Fe铝 Al镁 Mg商后期的司母戊鼎东汉 马踏飞燕 铜制导线第三章第一讲金属的化学性质1、地壳中含量由多到少的元素是(前三位): ;含量最多的金属元素 是 元素。【复习回忆】氧、硅、铝铝一、金属的通性分布特征除金、铂等少数极不活泼金属外,大多数金属元素在自然界中以化合态存在;
自然界中最多铝,其次铁、钙、钠。化合态:元素在化
合物中的存在形态游离态:元素以单
质的形态存在物理通性2、金属的颜色、光泽3、良好的导电、导热性绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。4、延展性延性:拉成细丝的性质。
展性:压成薄片的性质。1、金属在常温下的状态除汞是液体外,其他在常温下是固体;一、金属的通性81、化学性质(1)与氧气反应(铝、镁、铜、铁)4Al+3O2==2Al2O3
2Mg+O2==2MgO
2Cu+O2==2CuO
4Fe+3O2==2Fe2O3(铁锈)
3Fe+2O2==4Fe3O4(磁性氧化铁)点燃点燃点燃点燃常温思考与交流(2)金属与酸的反应排在H前面的金属能置换出酸里的氢金属活动性顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt AuZn+H2SO4==ZnSO4+H2
Mg+2HCl==MgCl2+H2(3)与盐反应(金属之间的置换反应) 排在前面的金属能把排在后面的金属从其盐溶液中置换出来
如:2Al+3CuSO4==3Cu+Al2(SO4)3
Cu+2AgNO3==2Ag+Cu(NO3)2小 结(1)与氧气反应(2)与酸反应(3)与某些盐溶液反应2.分析下列图片,写出反应的化学方程式。2Al+3CuSO4=Al2(SO4)3+3Cu2Mg+O2=2MgOCu+2AgNO3=Cu(NO3)2+2AgMg+2HCl=MgCl2+H2↑3、依据 Na、Mg、Al的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系?金属最外层上的电子一般少于4个,反应中很容易失去电子,表现出较强的还原性。(做还原剂)
化学通性1、化合态金属元素只有正化合价2、金属单质易失电子,表现还原性3、易与氧气反应,得到氧化物4、活动性排在氢前的金属元素与酸反应得到盐和氢气5、与盐反应,置换出活动性弱的金属单质一、金属的通性(一).金属与氧气的反应 讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象.二、金属的性质1.为银白色的固体
2.质软(硬度小)
很活泼 ,常温下能与氧气反应.
3.密度比煤油大 钠必须保存在隔绝空气环境中,实验室将钠保存在煤油或石蜡中(2)加热后反应------实验3-2钠还可以和其他非金属单质反应,如Cl2、S
2Na+Cl2==2NaCl
2Na+S==Na2S点燃点燃3、铁、铝和镁分别与氧气反应(1)铁与氧气在常温下缓慢反应,生成疏松氧化层—氧化铁(红褐色Fe2O3)
4Fe + 3O2 == 2Fe2O3 (2)镁和铝与氧气在常温下能反应,生成致密氧化膜,保护内层金属不被继续氧化
2Mg + O2 == 2MgO
4Al + 3O2 == 2Al2O3铁丝在氧气中点燃,生成四氧化三铁(黑色)
点燃
3Fe + 2O2 == Fe3O4科学探究: 现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落 因为铝表面有一层氧化膜保护了铝。即使打磨过的铝箔,在空气中也会很快生成新的氧化膜。构有薄膜的Al2O3的熔点(2050℃)高于Al(660 ℃ ),没有熔化,包在铝的外面使熔化的液态铝不会滴落下来。加热铝箔2、铝与氧气反应 现象解释: 资料卡片:铝的氧化膜----采用化学方法对铝表面的氧化膜进行处理,得到应有更广泛的金属材料。 应用:人们日常用的铝制品,表面总是覆盖着保护膜,这层膜起着保护内部金属的作用,这也正是性质活泼的铝在空气中能够稳定存在的原因。也由于氧化膜的存在,使得性质活泼的金属铝成为一种应用广泛的金属材料。资料卡片:铝的氧化膜K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属与氧气反应的规律常温下易被氧化常温下能被氧化加热时能被氧化不能被氧化小结: 一、 金属于非金属的反应
1、钠与氧气的反应
常温
加热
4Na + O2 == 2Na2O2、铝与氧气的反应3、金属与Cl2或 S 的反应思考:观察此图,你有何看法?结论:金属活动性顺序表中(H)前面的金属与酸反应产生H2。金属越活泼,与酸反应越剧烈。二、金属与酸和水反应二、金属与酸和水反应2、钠与水反应演示实验,观察现象 浮
熔
游、响
红钠浮在水面上
立刻熔成一个小球
在水面上四处游动,发出“嘶嘶声”
反应后溶液变红密度比水小
反应放热,熔点低
产生气体
生成碱性物质钠与水反应的实验问题问题1:请设计尽可能多的实验,完成钠与水的反应实验,并验证产物。问题3:请设计完成钠与水的反应实验,要求产生氢气必须缓慢并验证产物。问题2:请利用钠与水反应设计喷泉实验,要求喷出红色喷泉。问题4:请利用钠与水的反应设计测得钠的相对原子质量的最简便实验,要求不测气体体积。是否可行?如何检验金属钠与水反应生成的气体是H2?2Na+2H2O=2NaOH+H2↑ 实 验 改 进 方法2方法32、设计喷泉实验,要求喷出红色喷泉实验步骤及现象:
在广口瓶内加适量蒸馏水和2滴酚酞试液,如图2装置好仪器。在广口瓶胶塞的大头针上扎一块比豆粒略大的金属钠,立即盖上胶塞,,接着形成美丽的红色喷泉。同时可看到钠与水剧烈反应,钠熔化成小球,在水面上四处游动。喷泉可维持半分钟。3、钠与水反应产生氢气必须缓慢并验证产物实验说明:
1.分液漏斗中加入水的体积必须大于烧瓶容积的一半,这样流入烧瓶的水与原烧瓶中的煤油充满烧瓶,保证烧瓶中的空气被完全排开,不会给氢气的点燃带来意外事故。
2.烧瓶中煤油的体积不要超过烧瓶容积的一半,并且分液漏斗末端必须恰好接触煤油液面,目的在于:确保煤油能被完全压回漏斗。保证烧瓶中保持一定体积的水。4、设计最简便实验测定钠的相对原子质量,要求不测气体体积问题1:实验中不用测量产生氢气的体积,就可以得到钠的相对原子质量。请问实验中应该测量那些数据?问题2:干燥管的作用是什么?若不用,测得的钠的相对原子质量比实际值大还是小?
将钠放入硫酸铜溶液中,能否置换出铜单质?
将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?
2Na+CuSO4=Cu+Na2SO4
2Na+2HCl=2NaCl+H2↑课堂思考:× 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 2Na+2H2O=2NaOH+H2↑ 钠与酸反应时,如酸过量则钠只与酸反应,如酸不足量则钠先与酸反应再与水反应
一般规律:
钠与酸溶液反应时,钠直接与溶液中的酸反应,但当钠与其它溶液反应时,一般是钠先与水反应生成氢氧化钠和氢气,然后再看生成的氢氧化钠是否与原溶液中的溶质反应!3、钠的保存、在自然界的存在、用途、制法 保存在煤油里。 易与空气中的氧气反应 易与水反应钠着火的处理?性质:用干燥的砂土扑灭1、保存:决
定铁与水如何反应? 在钢铁厂《炼钢安全操作规程》中有这么一条严格的规定: 炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水,并应保持地面干燥。 推 测从这一则规定中,结合刚才学到的知识,你想到了什么?红热的铁遇到 水蒸气请设计一个产生水蒸气试验装置?动手画画看注:导管不够可以再添加,胶塞可以是单孔或双孔。
连接用的胶管及固定仪器用的夹持装置均略去。作图时酒精灯可用 代替再设计一个装置让产生的水蒸气与还原铁粉在高温下反应。注:导管不够可以再添加,胶塞可以是单孔或双孔。
连接用的胶管及固定仪器用的夹持装置均略去。动手画画看作图时酒精喷灯可用 代替最后,再设计还原铁粉与水蒸汽反应时收集反应所产生的气体的装置。注:导管不够可以再添加,胶塞可以是单孔或双孔。
连接用的胶管及固定仪器用的夹持装置均略去。动手画画看水蒸气的发生装置水蒸气与铁粉反应装置产物收集装置水蒸气的发生装置水蒸气与铁粉反应装置产物收集检验装置该装置有何缺点?可以进行哪些改进?大家来找碴装置简单
操作方便铁 粉该装置所具的优点:3Fe+4H2O(g) Fe3O4+4H2现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声。注意事项:
1、整套装置试管口应低于试管底;
2、先预热;
3、加热一会儿后再将导管插入到肥皂水中,用燃着的火柴去点燃肥皂泡,可发出爆鸣声;
4、实验结束时,应先从肥皂水中撤出导管,再移去燃着的酒精灯。
在该实验中能代替湿棉花的物质:1、吸水性强且高温时不与水反应的物质有:高温煅烧后建筑用的红砖粉末,河沙,粉笔等。
2、加热到一定温度时能产生水蒸气的固体药品:4、金属与水反应小结2Na+2H2O=2NaOH+H2↑ 2K+2H2O=2KOH+H2↑
(剧烈,氢气易爆炸)金属性越强,越容易与水反应讨论:金属与水反应的规律K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au与冷水反应生成碱和氢气与热水反应生成碱和氢气高温下与水蒸气反应生成氧化物和氢气不与水反应小结金属性越强,常温下与酸反应越剧烈;
金属性越强,常温下与水反应越强烈;三.铝与氢氧化钠溶液的反应1.铝与稀盐酸的反应化学方程式为:
2.铝与氢氧化钠溶液的反应 铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。(可看作分两步进行)铝既能与强酸反应,又能与强碱反应,是两性金属四、物质的量在化学方程式计算中的应用2Na + 2H2O = 2NaOH + H2↑ 化学计量数之比 2 : 2 : 2 : 1物质的量之比 2mol :2mol :2mol :1mol 横(量)相当,竖(单位)相同化学计量数之比等于物质的量之比 扩大NA倍 2NA :2NA : 2NA : NA实验室用6.5g Zn与足量盐酸完全反应。求:① Zn的物质的量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。解:【例 题 】 2、根据化学方程式进行计算的基本步骤 : (1)根据题意写出相关反应的化学方程式
(2)找出相关物质的计量数之比
(3)对应计量系数,找出相关物质的物质的量
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系进行计算。解:n(HCl)= 0.2 mol 1n (H2)n(H2)= 0.1 mol V(H2)= n(H2) × Vm = 0.1 mol × 22.4 L/mol= 2.24 L1mol22.4LV (H2)0.1mol1mol0.1mol=22.4LV (H2)
(1)横(量)相当,竖(单位)相同;
(2)带单位运算,结果单位要合理。注意:新解法:将8.1g铝与足量的氢氧化钠反应,计算生成氢气 ___ L,需要氢氧化钠 __ mol,有__ mol电子发生转移。 例题2:2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑ ~ 6e-54g 2mol 22.4L 6mol8.1g xmol yL zmolX=0.3molY=3.36LZ=0.9mol∴生成氢气3.36 L,需要氢氧化钠 0.3 mol,有0.9 mol电子发生转移。
自然界中最多铝,其次铁、钙、钠。化合态:元素在化
合物中的存在形态游离态:元素以单
质的形态存在物理通性2、金属的颜色、光泽3、良好的导电、导热性绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。4、延展性延性:拉成细丝的性质。
展性:压成薄片的性质。1、金属在常温下的状态除汞是液体外,其他在常温下是固体;一、金属的通性81、化学性质(1)与氧气反应(铝、镁、铜、铁)4Al+3O2==2Al2O3
2Mg+O2==2MgO
2Cu+O2==2CuO
4Fe+3O2==2Fe2O3(铁锈)
3Fe+2O2==4Fe3O4(磁性氧化铁)点燃点燃点燃点燃常温思考与交流(2)金属与酸的反应排在H前面的金属能置换出酸里的氢金属活动性顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt AuZn+H2SO4==ZnSO4+H2
Mg+2HCl==MgCl2+H2(3)与盐反应(金属之间的置换反应) 排在前面的金属能把排在后面的金属从其盐溶液中置换出来
如:2Al+3CuSO4==3Cu+Al2(SO4)3
Cu+2AgNO3==2Ag+Cu(NO3)2小 结(1)与氧气反应(2)与酸反应(3)与某些盐溶液反应2.分析下列图片,写出反应的化学方程式。2Al+3CuSO4=Al2(SO4)3+3Cu2Mg+O2=2MgOCu+2AgNO3=Cu(NO3)2+2AgMg+2HCl=MgCl2+H2↑3、依据 Na、Mg、Al的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系?金属最外层上的电子一般少于4个,反应中很容易失去电子,表现出较强的还原性。(做还原剂)
化学通性1、化合态金属元素只有正化合价2、金属单质易失电子,表现还原性3、易与氧气反应,得到氧化物4、活动性排在氢前的金属元素与酸反应得到盐和氢气5、与盐反应,置换出活动性弱的金属单质一、金属的通性(一).金属与氧气的反应 讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象.二、金属的性质1.为银白色的固体
2.质软(硬度小)
很活泼 ,常温下能与氧气反应.
3.密度比煤油大 钠必须保存在隔绝空气环境中,实验室将钠保存在煤油或石蜡中(2)加热后反应------实验3-2钠还可以和其他非金属单质反应,如Cl2、S
2Na+Cl2==2NaCl
2Na+S==Na2S点燃点燃3、铁、铝和镁分别与氧气反应(1)铁与氧气在常温下缓慢反应,生成疏松氧化层—氧化铁(红褐色Fe2O3)
4Fe + 3O2 == 2Fe2O3 (2)镁和铝与氧气在常温下能反应,生成致密氧化膜,保护内层金属不被继续氧化
2Mg + O2 == 2MgO
4Al + 3O2 == 2Al2O3铁丝在氧气中点燃,生成四氧化三铁(黑色)
点燃
3Fe + 2O2 == Fe3O4科学探究: 现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落 因为铝表面有一层氧化膜保护了铝。即使打磨过的铝箔,在空气中也会很快生成新的氧化膜。构有薄膜的Al2O3的熔点(2050℃)高于Al(660 ℃ ),没有熔化,包在铝的外面使熔化的液态铝不会滴落下来。加热铝箔2、铝与氧气反应 现象解释: 资料卡片:铝的氧化膜----采用化学方法对铝表面的氧化膜进行处理,得到应有更广泛的金属材料。 应用:人们日常用的铝制品,表面总是覆盖着保护膜,这层膜起着保护内部金属的作用,这也正是性质活泼的铝在空气中能够稳定存在的原因。也由于氧化膜的存在,使得性质活泼的金属铝成为一种应用广泛的金属材料。资料卡片:铝的氧化膜K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属与氧气反应的规律常温下易被氧化常温下能被氧化加热时能被氧化不能被氧化小结: 一、 金属于非金属的反应
1、钠与氧气的反应
常温
加热
4Na + O2 == 2Na2O2、铝与氧气的反应3、金属与Cl2或 S 的反应思考:观察此图,你有何看法?结论:金属活动性顺序表中(H)前面的金属与酸反应产生H2。金属越活泼,与酸反应越剧烈。二、金属与酸和水反应二、金属与酸和水反应2、钠与水反应演示实验,观察现象 浮
熔
游、响
红钠浮在水面上
立刻熔成一个小球
在水面上四处游动,发出“嘶嘶声”
反应后溶液变红密度比水小
反应放热,熔点低
产生气体
生成碱性物质钠与水反应的实验问题问题1:请设计尽可能多的实验,完成钠与水的反应实验,并验证产物。问题3:请设计完成钠与水的反应实验,要求产生氢气必须缓慢并验证产物。问题2:请利用钠与水反应设计喷泉实验,要求喷出红色喷泉。问题4:请利用钠与水的反应设计测得钠的相对原子质量的最简便实验,要求不测气体体积。是否可行?如何检验金属钠与水反应生成的气体是H2?2Na+2H2O=2NaOH+H2↑ 实 验 改 进 方法2方法32、设计喷泉实验,要求喷出红色喷泉实验步骤及现象:
在广口瓶内加适量蒸馏水和2滴酚酞试液,如图2装置好仪器。在广口瓶胶塞的大头针上扎一块比豆粒略大的金属钠,立即盖上胶塞,,接着形成美丽的红色喷泉。同时可看到钠与水剧烈反应,钠熔化成小球,在水面上四处游动。喷泉可维持半分钟。3、钠与水反应产生氢气必须缓慢并验证产物实验说明:
1.分液漏斗中加入水的体积必须大于烧瓶容积的一半,这样流入烧瓶的水与原烧瓶中的煤油充满烧瓶,保证烧瓶中的空气被完全排开,不会给氢气的点燃带来意外事故。
2.烧瓶中煤油的体积不要超过烧瓶容积的一半,并且分液漏斗末端必须恰好接触煤油液面,目的在于:确保煤油能被完全压回漏斗。保证烧瓶中保持一定体积的水。4、设计最简便实验测定钠的相对原子质量,要求不测气体体积问题1:实验中不用测量产生氢气的体积,就可以得到钠的相对原子质量。请问实验中应该测量那些数据?问题2:干燥管的作用是什么?若不用,测得的钠的相对原子质量比实际值大还是小?
将钠放入硫酸铜溶液中,能否置换出铜单质?
将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?
2Na+CuSO4=Cu+Na2SO4
2Na+2HCl=2NaCl+H2↑课堂思考:× 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 2Na+2H2O=2NaOH+H2↑ 钠与酸反应时,如酸过量则钠只与酸反应,如酸不足量则钠先与酸反应再与水反应
一般规律:
钠与酸溶液反应时,钠直接与溶液中的酸反应,但当钠与其它溶液反应时,一般是钠先与水反应生成氢氧化钠和氢气,然后再看生成的氢氧化钠是否与原溶液中的溶质反应!3、钠的保存、在自然界的存在、用途、制法 保存在煤油里。 易与空气中的氧气反应 易与水反应钠着火的处理?性质:用干燥的砂土扑灭1、保存:决
定铁与水如何反应? 在钢铁厂《炼钢安全操作规程》中有这么一条严格的规定: 炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水,并应保持地面干燥。 推 测从这一则规定中,结合刚才学到的知识,你想到了什么?红热的铁遇到 水蒸气请设计一个产生水蒸气试验装置?动手画画看注:导管不够可以再添加,胶塞可以是单孔或双孔。
连接用的胶管及固定仪器用的夹持装置均略去。作图时酒精灯可用 代替再设计一个装置让产生的水蒸气与还原铁粉在高温下反应。注:导管不够可以再添加,胶塞可以是单孔或双孔。
连接用的胶管及固定仪器用的夹持装置均略去。动手画画看作图时酒精喷灯可用 代替最后,再设计还原铁粉与水蒸汽反应时收集反应所产生的气体的装置。注:导管不够可以再添加,胶塞可以是单孔或双孔。
连接用的胶管及固定仪器用的夹持装置均略去。动手画画看水蒸气的发生装置水蒸气与铁粉反应装置产物收集装置水蒸气的发生装置水蒸气与铁粉反应装置产物收集检验装置该装置有何缺点?可以进行哪些改进?大家来找碴装置简单
操作方便铁 粉该装置所具的优点:3Fe+4H2O(g) Fe3O4+4H2现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声。注意事项:
1、整套装置试管口应低于试管底;
2、先预热;
3、加热一会儿后再将导管插入到肥皂水中,用燃着的火柴去点燃肥皂泡,可发出爆鸣声;
4、实验结束时,应先从肥皂水中撤出导管,再移去燃着的酒精灯。
在该实验中能代替湿棉花的物质:1、吸水性强且高温时不与水反应的物质有:高温煅烧后建筑用的红砖粉末,河沙,粉笔等。
2、加热到一定温度时能产生水蒸气的固体药品:4、金属与水反应小结2Na+2H2O=2NaOH+H2↑ 2K+2H2O=2KOH+H2↑
(剧烈,氢气易爆炸)金属性越强,越容易与水反应讨论:金属与水反应的规律K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au与冷水反应生成碱和氢气与热水反应生成碱和氢气高温下与水蒸气反应生成氧化物和氢气不与水反应小结金属性越强,常温下与酸反应越剧烈;
金属性越强,常温下与水反应越强烈;三.铝与氢氧化钠溶液的反应1.铝与稀盐酸的反应化学方程式为:
2.铝与氢氧化钠溶液的反应 铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。(可看作分两步进行)铝既能与强酸反应,又能与强碱反应,是两性金属四、物质的量在化学方程式计算中的应用2Na + 2H2O = 2NaOH + H2↑ 化学计量数之比 2 : 2 : 2 : 1物质的量之比 2mol :2mol :2mol :1mol 横(量)相当,竖(单位)相同化学计量数之比等于物质的量之比 扩大NA倍 2NA :2NA : 2NA : NA实验室用6.5g Zn与足量盐酸完全反应。求:① Zn的物质的量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。解:【例 题 】 2、根据化学方程式进行计算的基本步骤 : (1)根据题意写出相关反应的化学方程式
(2)找出相关物质的计量数之比
(3)对应计量系数,找出相关物质的物质的量
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系进行计算。解:n(HCl)= 0.2 mol 1n (H2)n(H2)= 0.1 mol V(H2)= n(H2) × Vm = 0.1 mol × 22.4 L/mol= 2.24 L1mol22.4LV (H2)0.1mol1mol0.1mol=22.4LV (H2)
(1)横(量)相当,竖(单位)相同;
(2)带单位运算,结果单位要合理。注意:新解法:将8.1g铝与足量的氢氧化钠反应,计算生成氢气 ___ L,需要氢氧化钠 __ mol,有__ mol电子发生转移。 例题2:2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑ ~ 6e-54g 2mol 22.4L 6mol8.1g xmol yL zmolX=0.3molY=3.36LZ=0.9mol∴生成氢气3.36 L,需要氢氧化钠 0.3 mol,有0.9 mol电子发生转移。
