人教版高一必修1化学第3章第2节几种重要金属的化合物 (共81张PPT)
文档属性
| 名称 | 人教版高一必修1化学第3章第2节几种重要金属的化合物 (共81张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-21 09:42:19 | ||
图片预览











文档简介
课件81张PPT。§2.几种重要的金属化合物回忆钠、铝、铁都可以和哪些物质发生化学反应?1.钠、铝、铁和非金属单质的反应
(O2等)2. 钠、铁与水的反应3.钠、 铝、铁与酸反应4. 铝与碱液反应1、氧化钠和过氧化钠
(1)氧化钠是_______色固体,
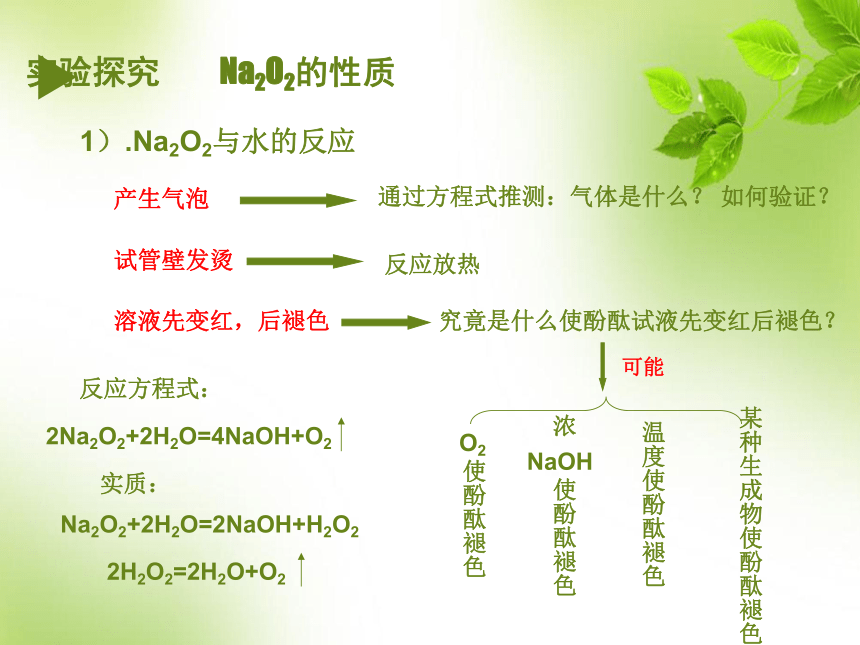
过氧化钠是_______色固体。 白淡黄色一、钠的重要化合物1、Na2O 是哪种性质的氧化物?2、碱性氧化物有哪些性质? 3、请写出Na2O 与H2O、CO2、盐酸反应的方程式,是离子反应的,请写出离子方程式碱性氧化物+水→碱碱性氧化物+酸性氧化物→含氧酸盐碱性氧化物+酸→盐+水Na2O+H2O=2NaOH Na2O+H2O=2Na++2OH-Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O Na2O+2H+=2Na++H2O Na2O2? 把水滴入在盛有少量过氧化钠固体的试管中,立即用带火星木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞,有什么现象? 实验3-5 Na2O2的化学性质实验探究 Na2O2的性质1).Na2O2与水的反应产生气泡溶液先变红,后褪色试管壁发烫通过方程式推测:气体是什么? 如何验证?究竟是什么使酚酞试液先变红后褪色?反应放热温度使酚酞褪色某种生成物使酚酞褪色反应方程式:实质:Na2O2+2H2O=2NaOH+H2O22Na2O2+2H2O = 4NaOH+O2↑ Na2O2既是氧化剂又是还原剂, O2 是氧化产物Na2O2是强氧化剂。
用途:可做漂白剂 (强氧化性漂白)过氧化钠与水反应的化学方程式:2Na2O2+2H2O = 4Na++4OH-+O2↑ 2Na2O2+2CO2=2Na2CO3 +O2该反应是不是离子反应?为什么?应用:呼吸面具或潜艇中的供氧剂。Na2O2既是氧化剂又是还原剂过氧化钠与二氧化碳反应的化学方程式:O2 是氧化产物2).Na2O2与CO2的反应滴水生火,吹气能生火呼吸面具 练习:写出过氧化钠与盐酸反应的化学方程式2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑思考:过氧化钠是碱性氧化物吗? 不是。因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。思考: (1)如何保存Na2O2?
(2)在空气中变质后最终产物是什么?(1)密封,隔绝空气和水
(2)Na2CO3【归纳】?
点燃Na2O+CO2=Na2CO3Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2 ↑2Na2O2+2CO2==2Na2CO3+O2Na2O+2HCl=2NaCl+H2O2Na2O2+4HCl=4NaCl+O2↑+2H2O与酸反应与酸性氧化物
反应2Na2O+O2===2Na2O2不稳定稳定离子化合物离子化合物稳定性
碳酸钠俗名叫_______,也叫_______ ,
碳酸氢钠俗名叫_______ 。
碳酸钠晶体的化学式是______________,
碳酸钠晶体在干燥的空气中容易失
去________变成碳酸钠粉末。纯碱苏打小苏打Na2CO3· 10H2O结晶水2、碳酸钠和碳酸氢钠碳酸钠和碳酸氢钠的性质1、Na2CO3+ 2HCl ==2NaCl + CO2↑ + H2O
CO3 2-+ 2H+ == CO2↑ + H2O
2、NaHCO3 + HCl ==NaCl + CO2↑ + H2O
HCO3- + H+ == CO2 ↑ + H2O(1)与酸反应 结论:碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。 (2)与盐反应Na2CO3+CaCl2=CaCO3 ↓+2NaClCO32-+Ca2+=CaCO3↓Na2CO3与可溶性的钙盐、钡盐反应生成沉淀Na2CO3+BaCl2=BaCO3 ↓+2NaClCO32-+Ba2+=BaCO3↓应用:利用能否与可溶性的钙盐、钡盐反应生成沉淀来来鉴别Na2CO3与NaHCO3(3)与碱反应Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOHCO32 -+Ca2+=CaCO3↓NaHCO3能与所有可溶碱反应生成碳酸正盐和水NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=CO32-+H2O Na2CO3:易与Ba2+、Ca2+的碱反应生成碳酸盐沉淀和NaOH Na2CO3+Ba(OH)2=BaCO3 ↓+2NaOHCO32 -+Ba2+=BaCO3↓关于NaHCO3与Ca(OH)2反应(1)NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH
(2)2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+Na2CO3NaHCO3过量即Ca(OH)2少量NaHCO3少量即Ca(OH)2过量(2)(1)(1)Ca2++OH-+HCO3-=CaCO3↓+H2O
(2) Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
(4)对热稳定性结论:加热时,碳酸钠不分解,而碳酸氢钠
则分解。即:碳酸钠比碳酸氢钠更稳定。碳酸钠受热不分解所以利用它们对热的稳定性来鉴别它们。碳酸氢钠不稳定,受热易分解NaHCO3Na2CO3澄清的石灰水(5)Na2CO3与NaHCO3的相互转化:Na2CO3NaHCO3CO2+H2O①固体加热,
②溶液氢氧化钠HCO3-+OH -=CO32-+H2ONaHCO3+NaOH=Na2CO3+H2ONa2CO3+H2O+CO2 == 2NaHCO3
CO32-+H2O+CO2 = 2HCO3-
化学式Na2CO3NaHCO3俗名苏打、纯碱小苏打色、态白色粉末白色细小晶体溶解度大小溶解度:Na2CO3 >NaHCO3水溶液碱性碱性(同浓度):Na2CO3>NaHCO3与酸反应
离子方程式NaHCO3比Na2CO3快HCO3-+H+=H2O+CO2↑热稳定性热稳定性:Na2CO3>NaHCO3CO32-+2H+=H2O+CO2↑想一想:如何区别Na2CO3和NaHCO3?① 加热 加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3②滴入CaCl2或BaCl2溶液产生白色沉淀的是Na2CO3③逐滴滴入稀盐酸反应较剧烈的是NaHCO3Na2CO3+CaCl2=CaCO3↓+2NaClNaHCO3+CaCl2 不反应滴入Ca(OH)2呢?碳酸钠和碳酸氢钠的用途3、焰色反应:是元素的性质1)概念:金属或它们的化合物在灼烧时使火焰呈现特殊的颜色,这在化学上叫焰色反应。 焰色反应是物理变化。元素原子发射一定波长的光而产生各种颜色。注:钠的焰色是黄色,钾的焰色是紫色实验步骤:①将铂丝放在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。“洗” “烧” ,“蘸” “烧” ,“洗” “烧” 焰色反应铯的焰色钠黄色铜 绿色钾紫色钙砖红色铷的焰色锶洋红色钡黄绿色几种金属的焰色:课堂小结注意重点:1、过氧化钠的性质。 2、碳酸钠和碳酸氢钠的性质比较
3、焰色反应的本质及操作过程
难点:过氧化钠的性质。 焰色反应洗、烧、蘸、烧、洗、烧
钠:黄色火焰 钾:透过钴玻璃紫色火焰 再 见二、铝的重要化合物1、氧化铝(Al2O3)①物性:Al2O3是一种白色难熔的固体,不溶于水,可作耐火材料(熔点2050℃)
(天然产物称作刚玉)
氧化铝的天然存在形式铝土矿由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成刚 玉氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)闪耀着六射星光的天然蓝宝石“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。天然红宝石“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。精美的氧化铝陶瓷制品耐火坩埚耐火砖燃器具点火瓷头
实验一 氧化铝的性质探究实验内容实验
现象结论化学方程式和离子方程式氧化铝中
滴加盐酸氧化铝中滴
加氢氧化钠沉淀
溶解氧化铝能
与盐酸反
应沉淀
溶解Al2O3+6HCl = 2AlCl3+3H2OAl2O3+6H+ = 2Al3+ +3H2OAl2O3+2NaOH = 2NaAlO2+ H2OAl2O3+ 2OHˉ= 2AlO2?+H2O氧化铝能
与氢氧化
钠反应氧化铝中滴
加氨水沉淀不溶解氧化铝不与氨水反应无偏铝酸钠②化学性质——两性氧化物
既能和强酸又能和强碱反应生成盐和水的氧化物。
但不与氨水反应
AlO2- Al2O3 Al3+HClNaOH③用途:液态Al2O3被电解生成铝和氧气,氧化铝是冶炼铝的主要原料。[实验3-7]:Al2(SO4)3溶液中加入少量NH3·H2O现象:生成白色胶状沉淀Al2(SO4)3+6NH3·H2O=
2Al(OH)3 ↓+3(NH4)2SO4Al3++ 3NH3·H2O = Al(OH)3↓ +3NH4+(1)实验室制备氢氧化铝——氨水与铝盐反应2、氢氧化铝 (Al(OH)3 )AlCl3+3NH3.H2O =Al(OH)3↓+3NH4Cl(2)物理性质:氢氧化铝是几乎不溶于水的白色固体.在水溶液中新生成的氢氧化铝呈胶状,能凝聚水中悬浮物,又有吸附色素的性能。 氢氧化铝胶体可用作净水剂、色素吸附剂等。(3)氢氧化铝的化学性质:实验3—8
向Al(OH)3沉淀中分别加入NaOH、HCl和NH3·H2O①不稳定性:
沉淀
溶解沉淀
溶解氢氧化铝与氢氧化钠反应而溶解 氢氧化铝
与盐酸反
应而溶解Al(OH)3+ NaOH = NaAlO2+2H2O Al(OH)3+OHˉ = AlO2?+2H2O Al(OH)3+3HCl = AlCl3+3 H2OAl(OH)3+3H+ = Al3++3H2O取一份氢氧化铝,向其中逐滴滴入氢氧化钠观察现象取一份氢氧化铝,向其中滴入盐酸观察现象。 向氢氧化铝中滴加氨水沉淀不溶解氢氧化铝不与氨水反应 无②两性氢氧化物
既能和强酸又能和强碱反应生成盐和水的氢氧化物。
但不与氨水反应。
AlO2- Al(OH)3 Al3+HClNaOH氢氧化铝的用途胃舒平又名复方氢氧化铝,是由能中和胃酸的氢氧化铝和三硅酸镁两药合用,并组合解痉止痛药颠茄浸膏而成。胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:
HCO3-+H+=CO2↑+H2O
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是:
反应生成二氧化碳,压力增大加剧胃穿孔
此时最好用含氢氧化铝的胃药(如胃舒平)离子方程式:
Al(OH)3+3 H+ = Al3+ +3H2O3、硫酸铝钾{ KAl(SO4)2 }KAl(SO4)2·12H2O或
K2SO4?Al2(SO4)3?24H2O
俗名明矾,无色晶体、
易溶于水,是一种复盐,
常用作净水剂。KAl(SO4)2 ==K++Al3++2SO42-说起明矾,人们对它是很熟悉的,也有人管它叫白矾,化学名称叫硫酸钾铝。然而明矾不只用作化工原料,它还是一个净水能手呢!有一次,我们下乡搞调查研究,在做午饭的时候,发现缸里的水太浑,不能用,正在为此而着急的时候,农技站的张技术员来了,他看见我们没有办法,立刻取出几块明矾,把它研成细未,然后撒在水缸里。不一会儿,缸里的水变得清澈透底了。原理: Al3++3H2O Al(OH)3+3H+
胶体
Al3+ AlO2?AlAl2O3Al(OH)3铝及其重要化合物之间的转化②③④⑤⑥⑦⑧⑨⑩⑾⑿⒀①①②③④⑥⑦⑤2Al+2OH-+2H2O=2AlO2-+3H2↑2Al+6H+=2Al3++3H2↑Al2O3+6H+=2Al3++3H2OAl2O3+2OH-+=2AlO2-+H2O⑩ ⑾ ⑨⑧⑿Al3++3OH-=Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl(OH)3 +OH-= AlO2-+2H2OAlO2-+H++H2O=Al(OH)3↓Al3++4OH-=AlO2-+2H2O(13)AlO2-+4H+=Al3++2H2O再 见人体需要的是铁单
质吗?铁怎样转化
为能被吸收的铁元
素呢? 日本横滨弯钢索斜拉大桥芝加哥西尔斯大厦
(钢架结构)Fe3O4黄铁矿(FeS2)赤铁矿(Fe2O3)磁铁矿(Fe3O4)硫酸亚铁陨铁浅绿色浅绿色白色红褐色棕黄色棕黄色1、铁的氧化物: FeO Fe2O3 Fe3O4—— 铁红 磁性氧化铁黑色粉末 红棕色粉末 黑色晶体+2 +3 +2、+3不溶 不溶 不溶FeO +2HCl=FeCl2+H2O
Fe2O3+6HCl= 2FeCl3+3H2O化学性质:FeO +2H+=Fe2++H2O
Fe2O3+6H+= 2Fe3++3H2O
Fe3O4+8H+= 2Fe3++Fe2++4H2O ①不溶于水也不与水反应②与酸反应:③FeO不稳定离子方程式:Fe3O4+8HCl= 2FeCl3+FeCl2+4H2O ④均能被CO还原成Fe 玉石中的氧化亚铁经氧化而成三价铁,颜色变成红棕色,特别是裂缝部位或有空隙的部位,还有暴露在外的截面部分也容易氧化而成红棕色。 用途:Fe2O3:红色的油漆,炼铁原料方案一:能否通过铁和水反应制得?
方案二:能否通过铁的氧化物和水反应得到?
方案三:用可溶性铁盐、亚铁盐与碱溶液反应?2、铁的氢氧化物如何制备铁的氢氧化物?思考:铁有哪些氢氧化物?铁的氢氧化物2、铁的氢氧化物
——氢氧化铁和氢氧化亚铁
Fe(OH)3 Fe(OH)2(1)制备:实验1:用一支试管取2mLFeCl3溶液,使用胶头滴管向其中加入少量NaOH溶液。FeCl3+3NaOH=Fe(OH)3↓+3NaClFe3++3OH-=Fe(OH)3↓(红褐色沉淀)现象:产生红褐色沉淀。实验2:用一支试管取2mLFeSO4溶液,使用胶头滴管向其中加入少量NaOH溶液,观察现象。FeSO4+2NaOH = Fe(OH)2↓+Na2SO4(白色沉淀)现象:生成白色沉淀,迅速变为灰绿色,最后变成红褐色4Fe(OH)2+O2+2H2O = 4Fe(OH)3(红褐色沉淀)如何制备Fe(OH)2?1、除O2:将NaOH溶液、蒸馏水煮沸
不可用自来水。
2、防O2:溶液上层加植物油⑵铁的氢氧化物的化学性质: Fe(OH)2+2H+== Fe2++2H2O;
Fe(OH)3+3H+== Fe3++3H2O; 白色固体 红褐色固体 不溶 不溶 Fe2++2OH-=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3Fe(OH)2+2H+=
Fe2++2H2OFe(OH)3+3H+=
Fe3++3H2OFe3++3OH-=Fe(OH)3↓【小结】:Fe3+的检验试剂: ①KSCN溶液、氯水(双氧水)。【小结】:Fe2+的检验试剂: 现象:开始溶液不变红色,再向溶液中滴加几滴氯水,溶液变成红色;2Fe2+ +Cl2 ===2Fe3++2Cl-;②氢氧化钠溶液:
现象:开始的产生一种白色的絮状沉淀,这就是氢氧化亚铁,但白色絮状沉淀迅速变成灰绿色,最后变成红褐色。4Fe(OH)2+O2+2H2O===4Fe(OH)3; 关于几个铁的化合价的变化
Fe Fe2+ Fe3+(1)Fe2+的还原性:1.与O2反应:
2.与Cl2、Br2反应:
3.与KMnO4反应:
4.与H2O2反应:4Fe2++O2+4H+=4Fe3++2H2O2Fe2++Cl2=2Fe3++2Cl-5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O2Fe2++H2O2+2H+=2Fe3++2H2O3.Fe2+的性质(2)Fe2+的氧化性:Zn+Fe2+=Zn2++Fe4.Fe3+的氧化性1.与Fe反应:
2.与Cu反应:
3.与KI反应:2Fe3++Fe=3Fe2+2Fe3++Cu=2Fe2++Cu2+2Fe3++2I-=2Fe2++I24.与Zn反应:3Zn+2Fe3+=3Zn2++2Fe 铁化合物和亚铁化合物的相互转变氧化性
还原性还原性氧化性弱氧化剂 H+、Cu2+关于Fe3+、Fe2+、Cu2+与 Zn、Fe、Cu反应的情况1.氧化性顺序:Fe3+>Cu2+>Fe2+
2.还原性顺序:Zn>Fe>Cu 直 接 观 色与KSCN显色反应
利 用与铜片与淀粉
KI试纸鉴别方法试纸不变蓝 试纸变蓝色加碱溶液Fe2+Fe3+酸性KMnO4溶液褪色 不褪色 除杂FeCl2(FeCl3):Fe
FeCl3(FeCl2):Cl2【小结】:常见的阳离子的检验:用铂丝蘸取含该离子的溶液在无色火焰灼烧 透过蓝色钴玻璃,火焰呈紫色 用铂丝蘸取含该离子的溶液在无色火焰灼烧 火焰呈黄色 Na2CO3溶液 产生白色沉淀 NaOH溶液 滴加NaOH溶液至过量 产生白色沉淀 先产生白色沉淀,后消失 ①NaOH溶液;
②KSCN溶液 ①红褐色沉淀;
②溶液变成红色NaOH溶液 白色沉淀→迅速变成灰绿色→红褐色 KSCN溶液和氯水 先无明显变化,后溶液变成红色 向FeCl3溶液中加几滴KSCN溶液呈红色FeCl3与NaOH溶液反应,生成红褐色沉淀向FeCl3溶液中加过量铁粉,溶液变为浅绿色向FeCl3溶液中加过量铜粉,溶液变为蓝绿色将FeCl3溶液加入到淀粉KI溶液,溶液变为蓝色向FeCl3溶液中加入 硝酸银溶液,生成白色沉淀将饱和FeCl3溶液 滴入 沸水中 ,溶液呈红褐色 过去电子工业常用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制造印刷线路板。制作时,把应该保留的铜箔遮挡,然后把铜箔放入氯化铁溶液中,这样没有遮挡的铜箔就被腐蚀掉了,留下了可以导电的铜线。请说出其中发生的反应,写出化学方程式。迁移应用 铁及其化合物的性质: Fe隔绝空气加热Fe3O4FeOFe2O3⑩ ⑾ ⑨①③④⑥⑦⑧⒀⑿⒁ ⒂⒃ FeCl2Fe(OH)2Fe(OH)3FeCl3⑤①②③④⑥⑦⑤FeO+2HCl=FeCl2 + H2OFe(OH)2 +2HCl= FeCl2+2H2OFeCl2+2NaOH=Fe(OH)2↓+2NaClFe + 2HCl= FeCl2 + H2↑⑩ ⑾ ⑨⑧⑿Fe2O3+6HCl=2FeCl3 +3H2OFeCl3+3NaOH=Fe(OH)3↓+3NaClFe(OH)3 +3HCl= FeCl3+3H2O⒀⒁ ⒂⒃ 2FeCl2 + Cl2 = 2FeCl32FeCl3 + Fe = 3FeCl24Fe(OH)2 +O2+2H2O=4Fe(OH)3↓
(O2等)2. 钠、铁与水的反应3.钠、 铝、铁与酸反应4. 铝与碱液反应1、氧化钠和过氧化钠
(1)氧化钠是_______色固体,
过氧化钠是_______色固体。 白淡黄色一、钠的重要化合物1、Na2O 是哪种性质的氧化物?2、碱性氧化物有哪些性质? 3、请写出Na2O 与H2O、CO2、盐酸反应的方程式,是离子反应的,请写出离子方程式碱性氧化物+水→碱碱性氧化物+酸性氧化物→含氧酸盐碱性氧化物+酸→盐+水Na2O+H2O=2NaOH Na2O+H2O=2Na++2OH-Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O Na2O+2H+=2Na++H2O Na2O2? 把水滴入在盛有少量过氧化钠固体的试管中,立即用带火星木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞,有什么现象? 实验3-5 Na2O2的化学性质实验探究 Na2O2的性质1).Na2O2与水的反应产生气泡溶液先变红,后褪色试管壁发烫通过方程式推测:气体是什么? 如何验证?究竟是什么使酚酞试液先变红后褪色?反应放热温度使酚酞褪色某种生成物使酚酞褪色反应方程式:实质:Na2O2+2H2O=2NaOH+H2O22Na2O2+2H2O = 4NaOH+O2↑ Na2O2既是氧化剂又是还原剂, O2 是氧化产物Na2O2是强氧化剂。
用途:可做漂白剂 (强氧化性漂白)过氧化钠与水反应的化学方程式:2Na2O2+2H2O = 4Na++4OH-+O2↑ 2Na2O2+2CO2=2Na2CO3 +O2该反应是不是离子反应?为什么?应用:呼吸面具或潜艇中的供氧剂。Na2O2既是氧化剂又是还原剂过氧化钠与二氧化碳反应的化学方程式:O2 是氧化产物2).Na2O2与CO2的反应滴水生火,吹气能生火呼吸面具 练习:写出过氧化钠与盐酸反应的化学方程式2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑思考:过氧化钠是碱性氧化物吗? 不是。因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。思考: (1)如何保存Na2O2?
(2)在空气中变质后最终产物是什么?(1)密封,隔绝空气和水
(2)Na2CO3【归纳】?
点燃Na2O+CO2=Na2CO3Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2 ↑2Na2O2+2CO2==2Na2CO3+O2Na2O+2HCl=2NaCl+H2O2Na2O2+4HCl=4NaCl+O2↑+2H2O与酸反应与酸性氧化物
反应2Na2O+O2===2Na2O2不稳定稳定离子化合物离子化合物稳定性
碳酸钠俗名叫_______,也叫_______ ,
碳酸氢钠俗名叫_______ 。
碳酸钠晶体的化学式是______________,
碳酸钠晶体在干燥的空气中容易失
去________变成碳酸钠粉末。纯碱苏打小苏打Na2CO3· 10H2O结晶水2、碳酸钠和碳酸氢钠碳酸钠和碳酸氢钠的性质1、Na2CO3+ 2HCl ==2NaCl + CO2↑ + H2O
CO3 2-+ 2H+ == CO2↑ + H2O
2、NaHCO3 + HCl ==NaCl + CO2↑ + H2O
HCO3- + H+ == CO2 ↑ + H2O(1)与酸反应 结论:碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。 (2)与盐反应Na2CO3+CaCl2=CaCO3 ↓+2NaClCO32-+Ca2+=CaCO3↓Na2CO3与可溶性的钙盐、钡盐反应生成沉淀Na2CO3+BaCl2=BaCO3 ↓+2NaClCO32-+Ba2+=BaCO3↓应用:利用能否与可溶性的钙盐、钡盐反应生成沉淀来来鉴别Na2CO3与NaHCO3(3)与碱反应Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOHCO32 -+Ca2+=CaCO3↓NaHCO3能与所有可溶碱反应生成碳酸正盐和水NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=CO32-+H2O Na2CO3:易与Ba2+、Ca2+的碱反应生成碳酸盐沉淀和NaOH Na2CO3+Ba(OH)2=BaCO3 ↓+2NaOHCO32 -+Ba2+=BaCO3↓关于NaHCO3与Ca(OH)2反应(1)NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH
(2)2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+Na2CO3NaHCO3过量即Ca(OH)2少量NaHCO3少量即Ca(OH)2过量(2)(1)(1)Ca2++OH-+HCO3-=CaCO3↓+H2O
(2) Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
(4)对热稳定性结论:加热时,碳酸钠不分解,而碳酸氢钠
则分解。即:碳酸钠比碳酸氢钠更稳定。碳酸钠受热不分解所以利用它们对热的稳定性来鉴别它们。碳酸氢钠不稳定,受热易分解NaHCO3Na2CO3澄清的石灰水(5)Na2CO3与NaHCO3的相互转化:Na2CO3NaHCO3CO2+H2O①固体加热,
②溶液氢氧化钠HCO3-+OH -=CO32-+H2ONaHCO3+NaOH=Na2CO3+H2ONa2CO3+H2O+CO2 == 2NaHCO3
CO32-+H2O+CO2 = 2HCO3-
化学式Na2CO3NaHCO3俗名苏打、纯碱小苏打色、态白色粉末白色细小晶体溶解度大小溶解度:Na2CO3 >NaHCO3水溶液碱性碱性(同浓度):Na2CO3>NaHCO3与酸反应
离子方程式NaHCO3比Na2CO3快HCO3-+H+=H2O+CO2↑热稳定性热稳定性:Na2CO3>NaHCO3CO32-+2H+=H2O+CO2↑想一想:如何区别Na2CO3和NaHCO3?① 加热 加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3②滴入CaCl2或BaCl2溶液产生白色沉淀的是Na2CO3③逐滴滴入稀盐酸反应较剧烈的是NaHCO3Na2CO3+CaCl2=CaCO3↓+2NaClNaHCO3+CaCl2 不反应滴入Ca(OH)2呢?碳酸钠和碳酸氢钠的用途3、焰色反应:是元素的性质1)概念:金属或它们的化合物在灼烧时使火焰呈现特殊的颜色,这在化学上叫焰色反应。 焰色反应是物理变化。元素原子发射一定波长的光而产生各种颜色。注:钠的焰色是黄色,钾的焰色是紫色实验步骤:①将铂丝放在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。“洗” “烧” ,“蘸” “烧” ,“洗” “烧” 焰色反应铯的焰色钠黄色铜 绿色钾紫色钙砖红色铷的焰色锶洋红色钡黄绿色几种金属的焰色:课堂小结注意重点:1、过氧化钠的性质。 2、碳酸钠和碳酸氢钠的性质比较
3、焰色反应的本质及操作过程
难点:过氧化钠的性质。 焰色反应洗、烧、蘸、烧、洗、烧
钠:黄色火焰 钾:透过钴玻璃紫色火焰 再 见二、铝的重要化合物1、氧化铝(Al2O3)①物性:Al2O3是一种白色难熔的固体,不溶于水,可作耐火材料(熔点2050℃)
(天然产物称作刚玉)
氧化铝的天然存在形式铝土矿由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成刚 玉氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)闪耀着六射星光的天然蓝宝石“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。天然红宝石“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。精美的氧化铝陶瓷制品耐火坩埚耐火砖燃器具点火瓷头
实验一 氧化铝的性质探究实验内容实验
现象结论化学方程式和离子方程式氧化铝中
滴加盐酸氧化铝中滴
加氢氧化钠沉淀
溶解氧化铝能
与盐酸反
应沉淀
溶解Al2O3+6HCl = 2AlCl3+3H2OAl2O3+6H+ = 2Al3+ +3H2OAl2O3+2NaOH = 2NaAlO2+ H2OAl2O3+ 2OHˉ= 2AlO2?+H2O氧化铝能
与氢氧化
钠反应氧化铝中滴
加氨水沉淀不溶解氧化铝不与氨水反应无偏铝酸钠②化学性质——两性氧化物
既能和强酸又能和强碱反应生成盐和水的氧化物。
但不与氨水反应
AlO2- Al2O3 Al3+HClNaOH③用途:液态Al2O3被电解生成铝和氧气,氧化铝是冶炼铝的主要原料。[实验3-7]:Al2(SO4)3溶液中加入少量NH3·H2O现象:生成白色胶状沉淀Al2(SO4)3+6NH3·H2O=
2Al(OH)3 ↓+3(NH4)2SO4Al3++ 3NH3·H2O = Al(OH)3↓ +3NH4+(1)实验室制备氢氧化铝——氨水与铝盐反应2、氢氧化铝 (Al(OH)3 )AlCl3+3NH3.H2O =Al(OH)3↓+3NH4Cl(2)物理性质:氢氧化铝是几乎不溶于水的白色固体.在水溶液中新生成的氢氧化铝呈胶状,能凝聚水中悬浮物,又有吸附色素的性能。 氢氧化铝胶体可用作净水剂、色素吸附剂等。(3)氢氧化铝的化学性质:实验3—8
向Al(OH)3沉淀中分别加入NaOH、HCl和NH3·H2O①不稳定性:
沉淀
溶解沉淀
溶解氢氧化铝与氢氧化钠反应而溶解 氢氧化铝
与盐酸反
应而溶解Al(OH)3+ NaOH = NaAlO2+2H2O Al(OH)3+OHˉ = AlO2?+2H2O Al(OH)3+3HCl = AlCl3+3 H2OAl(OH)3+3H+ = Al3++3H2O取一份氢氧化铝,向其中逐滴滴入氢氧化钠观察现象取一份氢氧化铝,向其中滴入盐酸观察现象。 向氢氧化铝中滴加氨水沉淀不溶解氢氧化铝不与氨水反应 无②两性氢氧化物
既能和强酸又能和强碱反应生成盐和水的氢氧化物。
但不与氨水反应。
AlO2- Al(OH)3 Al3+HClNaOH氢氧化铝的用途胃舒平又名复方氢氧化铝,是由能中和胃酸的氢氧化铝和三硅酸镁两药合用,并组合解痉止痛药颠茄浸膏而成。胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:
HCO3-+H+=CO2↑+H2O
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是:
反应生成二氧化碳,压力增大加剧胃穿孔
此时最好用含氢氧化铝的胃药(如胃舒平)离子方程式:
Al(OH)3+3 H+ = Al3+ +3H2O3、硫酸铝钾{ KAl(SO4)2 }KAl(SO4)2·12H2O或
K2SO4?Al2(SO4)3?24H2O
俗名明矾,无色晶体、
易溶于水,是一种复盐,
常用作净水剂。KAl(SO4)2 ==K++Al3++2SO42-说起明矾,人们对它是很熟悉的,也有人管它叫白矾,化学名称叫硫酸钾铝。然而明矾不只用作化工原料,它还是一个净水能手呢!有一次,我们下乡搞调查研究,在做午饭的时候,发现缸里的水太浑,不能用,正在为此而着急的时候,农技站的张技术员来了,他看见我们没有办法,立刻取出几块明矾,把它研成细未,然后撒在水缸里。不一会儿,缸里的水变得清澈透底了。原理: Al3++3H2O Al(OH)3+3H+
胶体
Al3+ AlO2?AlAl2O3Al(OH)3铝及其重要化合物之间的转化②③④⑤⑥⑦⑧⑨⑩⑾⑿⒀①①②③④⑥⑦⑤2Al+2OH-+2H2O=2AlO2-+3H2↑2Al+6H+=2Al3++3H2↑Al2O3+6H+=2Al3++3H2OAl2O3+2OH-+=2AlO2-+H2O⑩ ⑾ ⑨⑧⑿Al3++3OH-=Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl(OH)3 +OH-= AlO2-+2H2OAlO2-+H++H2O=Al(OH)3↓Al3++4OH-=AlO2-+2H2O(13)AlO2-+4H+=Al3++2H2O再 见人体需要的是铁单
质吗?铁怎样转化
为能被吸收的铁元
素呢? 日本横滨弯钢索斜拉大桥芝加哥西尔斯大厦
(钢架结构)Fe3O4黄铁矿(FeS2)赤铁矿(Fe2O3)磁铁矿(Fe3O4)硫酸亚铁陨铁浅绿色浅绿色白色红褐色棕黄色棕黄色1、铁的氧化物: FeO Fe2O3 Fe3O4—— 铁红 磁性氧化铁黑色粉末 红棕色粉末 黑色晶体+2 +3 +2、+3不溶 不溶 不溶FeO +2HCl=FeCl2+H2O
Fe2O3+6HCl= 2FeCl3+3H2O化学性质:FeO +2H+=Fe2++H2O
Fe2O3+6H+= 2Fe3++3H2O
Fe3O4+8H+= 2Fe3++Fe2++4H2O ①不溶于水也不与水反应②与酸反应:③FeO不稳定离子方程式:Fe3O4+8HCl= 2FeCl3+FeCl2+4H2O ④均能被CO还原成Fe 玉石中的氧化亚铁经氧化而成三价铁,颜色变成红棕色,特别是裂缝部位或有空隙的部位,还有暴露在外的截面部分也容易氧化而成红棕色。 用途:Fe2O3:红色的油漆,炼铁原料方案一:能否通过铁和水反应制得?
方案二:能否通过铁的氧化物和水反应得到?
方案三:用可溶性铁盐、亚铁盐与碱溶液反应?2、铁的氢氧化物如何制备铁的氢氧化物?思考:铁有哪些氢氧化物?铁的氢氧化物2、铁的氢氧化物
——氢氧化铁和氢氧化亚铁
Fe(OH)3 Fe(OH)2(1)制备:实验1:用一支试管取2mLFeCl3溶液,使用胶头滴管向其中加入少量NaOH溶液。FeCl3+3NaOH=Fe(OH)3↓+3NaClFe3++3OH-=Fe(OH)3↓(红褐色沉淀)现象:产生红褐色沉淀。实验2:用一支试管取2mLFeSO4溶液,使用胶头滴管向其中加入少量NaOH溶液,观察现象。FeSO4+2NaOH = Fe(OH)2↓+Na2SO4(白色沉淀)现象:生成白色沉淀,迅速变为灰绿色,最后变成红褐色4Fe(OH)2+O2+2H2O = 4Fe(OH)3(红褐色沉淀)如何制备Fe(OH)2?1、除O2:将NaOH溶液、蒸馏水煮沸
不可用自来水。
2、防O2:溶液上层加植物油⑵铁的氢氧化物的化学性质: Fe(OH)2+2H+== Fe2++2H2O;
Fe(OH)3+3H+== Fe3++3H2O; 白色固体 红褐色固体 不溶 不溶 Fe2++2OH-=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3Fe(OH)2+2H+=
Fe2++2H2OFe(OH)3+3H+=
Fe3++3H2OFe3++3OH-=Fe(OH)3↓【小结】:Fe3+的检验试剂: ①KSCN溶液、氯水(双氧水)。【小结】:Fe2+的检验试剂: 现象:开始溶液不变红色,再向溶液中滴加几滴氯水,溶液变成红色;2Fe2+ +Cl2 ===2Fe3++2Cl-;②氢氧化钠溶液:
现象:开始的产生一种白色的絮状沉淀,这就是氢氧化亚铁,但白色絮状沉淀迅速变成灰绿色,最后变成红褐色。4Fe(OH)2+O2+2H2O===4Fe(OH)3; 关于几个铁的化合价的变化
Fe Fe2+ Fe3+(1)Fe2+的还原性:1.与O2反应:
2.与Cl2、Br2反应:
3.与KMnO4反应:
4.与H2O2反应:4Fe2++O2+4H+=4Fe3++2H2O2Fe2++Cl2=2Fe3++2Cl-5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O2Fe2++H2O2+2H+=2Fe3++2H2O3.Fe2+的性质(2)Fe2+的氧化性:Zn+Fe2+=Zn2++Fe4.Fe3+的氧化性1.与Fe反应:
2.与Cu反应:
3.与KI反应:2Fe3++Fe=3Fe2+2Fe3++Cu=2Fe2++Cu2+2Fe3++2I-=2Fe2++I24.与Zn反应:3Zn+2Fe3+=3Zn2++2Fe 铁化合物和亚铁化合物的相互转变氧化性
还原性还原性氧化性弱氧化剂 H+、Cu2+关于Fe3+、Fe2+、Cu2+与 Zn、Fe、Cu反应的情况1.氧化性顺序:Fe3+>Cu2+>Fe2+
2.还原性顺序:Zn>Fe>Cu 直 接 观 色与KSCN显色反应
利 用与铜片与淀粉
KI试纸鉴别方法试纸不变蓝 试纸变蓝色加碱溶液Fe2+Fe3+酸性KMnO4溶液褪色 不褪色 除杂FeCl2(FeCl3):Fe
FeCl3(FeCl2):Cl2【小结】:常见的阳离子的检验:用铂丝蘸取含该离子的溶液在无色火焰灼烧 透过蓝色钴玻璃,火焰呈紫色 用铂丝蘸取含该离子的溶液在无色火焰灼烧 火焰呈黄色 Na2CO3溶液 产生白色沉淀 NaOH溶液 滴加NaOH溶液至过量 产生白色沉淀 先产生白色沉淀,后消失 ①NaOH溶液;
②KSCN溶液 ①红褐色沉淀;
②溶液变成红色NaOH溶液 白色沉淀→迅速变成灰绿色→红褐色 KSCN溶液和氯水 先无明显变化,后溶液变成红色 向FeCl3溶液中加几滴KSCN溶液呈红色FeCl3与NaOH溶液反应,生成红褐色沉淀向FeCl3溶液中加过量铁粉,溶液变为浅绿色向FeCl3溶液中加过量铜粉,溶液变为蓝绿色将FeCl3溶液加入到淀粉KI溶液,溶液变为蓝色向FeCl3溶液中加入 硝酸银溶液,生成白色沉淀将饱和FeCl3溶液 滴入 沸水中 ,溶液呈红褐色 过去电子工业常用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制造印刷线路板。制作时,把应该保留的铜箔遮挡,然后把铜箔放入氯化铁溶液中,这样没有遮挡的铜箔就被腐蚀掉了,留下了可以导电的铜线。请说出其中发生的反应,写出化学方程式。迁移应用 铁及其化合物的性质: Fe隔绝空气加热Fe3O4FeOFe2O3⑩ ⑾ ⑨①③④⑥⑦⑧⒀⑿⒁ ⒂⒃ FeCl2Fe(OH)2Fe(OH)3FeCl3⑤①②③④⑥⑦⑤FeO+2HCl=FeCl2 + H2OFe(OH)2 +2HCl= FeCl2+2H2OFeCl2+2NaOH=Fe(OH)2↓+2NaClFe + 2HCl= FeCl2 + H2↑⑩ ⑾ ⑨⑧⑿Fe2O3+6HCl=2FeCl3 +3H2OFeCl3+3NaOH=Fe(OH)3↓+3NaClFe(OH)3 +3HCl= FeCl3+3H2O⒀⒁ ⒂⒃ 2FeCl2 + Cl2 = 2FeCl32FeCl3 + Fe = 3FeCl24Fe(OH)2 +O2+2H2O=4Fe(OH)3↓
