苏教版高中化学必修第一册专题1物质的分类及计量1.2.1物质的量教学课件(共39张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题1物质的分类及计量1.2.1物质的量教学课件(共39张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 10:28:24 | ||
图片预览









文档简介
(共39张PPT)
物质的量
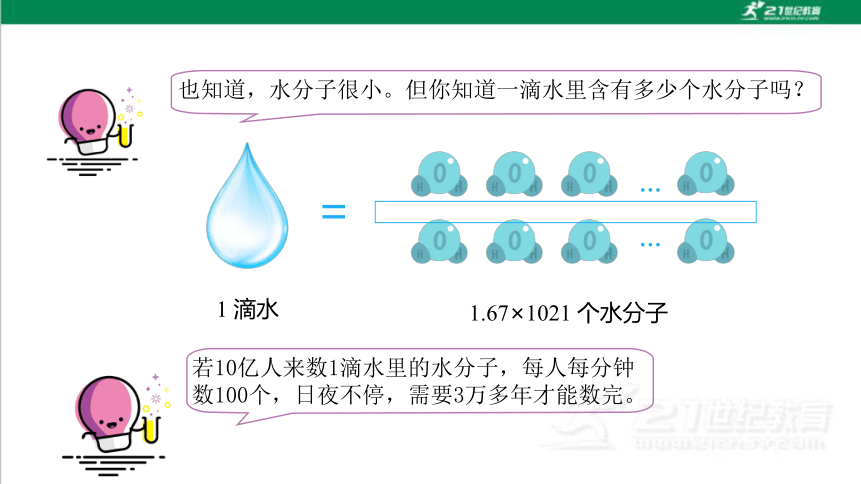
经过初中化学的学习,我们知道,水是由水分子构成的。
也知道,水分子很小。但你知道一滴水里含有多少个水分子吗?
…
…
=
1 滴水
1.67×1021 个水分子
若10亿人来数1滴水里的水分子,每人每分钟数100个,日夜不停,需要3万多年才能数完。
想一下,平时喝一口水,喝进去了多少个水分子?
如果我说,我要喝10个水分子,在现实生活中有意义吗?
化学家在研究中发现,虽然参加化学反应的微粒质量很小,但实际参加反应的微粒数往往很大(如1滴水中大约含有17万亿亿个水分子)。
为了将一定数目的微观粒子与可称量的宏观物质联系起来,在化学上引入了物质的量。
就好比,把很多粒大米打包成整体,叫一袋大米。
引入物理量,把众多微观颗粒,也打包成一个整体。
该物理量,叫物质的量,单位是 mol,如 1mol H2O。
…
…
知识导航
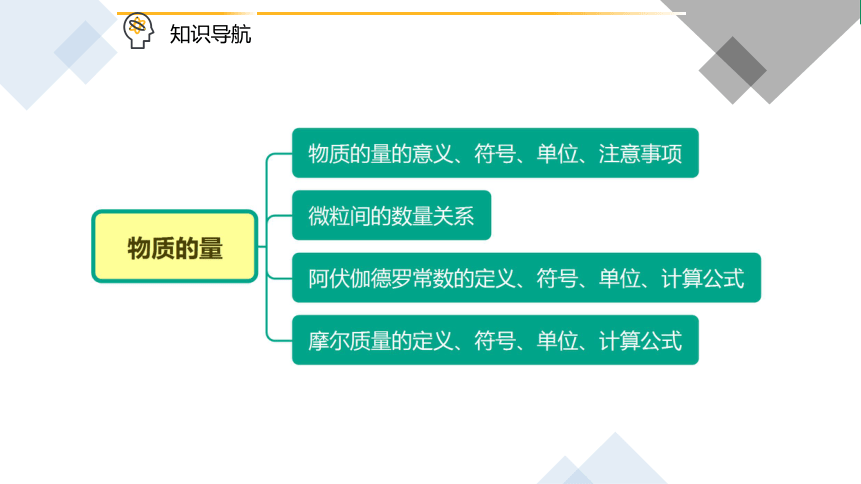
一、物质的量
1.意义:国际单位制中7个基本物理量之一,它表示含有一定数目粒子的集合体。
2. 符号:n
3. 单位:摩尔,简称摩,符号为 mol
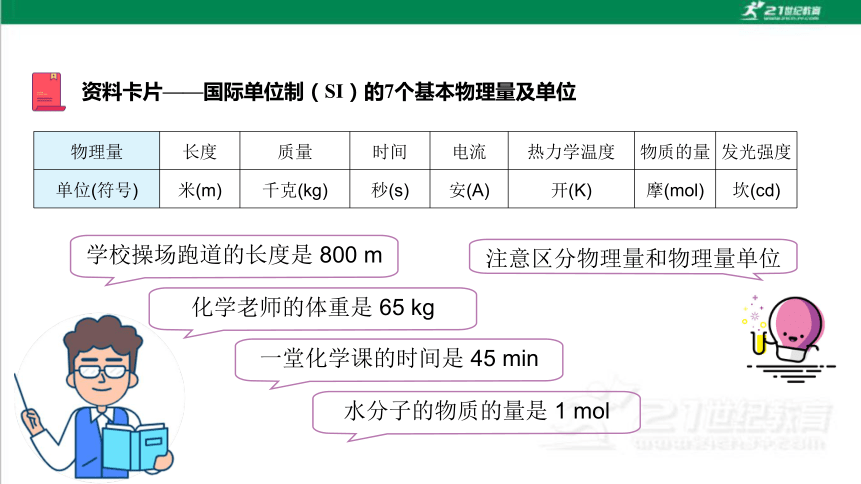
资料卡片——国际单位制(SI)的 7 个基本物理量及单位
物理量 长度 质量 时间 电流 热力学温度 物质的量 发光强度
单位(符号) 米(m) 千克(kg) 秒(s) 安(A) 开(K) 摩(mol) 坎(cd)
资料卡片——国际单位制(SI)的7个基本物理量及单位
物理量 长度 质量 时间 电流 热力学温度 物质的量 发光强度
单位(符号) 米(m) 千克(kg) 秒(s) 安(A) 开(K) 摩(mol) 坎(cd)
学校操场跑道的长度是 800 m
化学老师的体重是 65 kg
一堂化学课的时间是 45 min
水分子的物质的量是 1 mol
注意区分物理量和物理量单位
…
…
假设,这是 1 mol H2O
…
…
…
…
…
…
…
…
…
…
…
…
那么,这是
6 mol H2O
n = 1 mol
n = 6 mol
一、物质的量
1.意义:国际单位制中7个基本物理量之一,它表示含有一定数目粒子的集合体。
2. 符号:n
3. 单位:摩尔,简称摩,符号为 mol
“1 mol 人”这种说法是否正确?
错误。定义里写明,粒子。人不是粒子。
常见的粒子有哪些?
一、物质的量
1.意义:国际单位制中7个基本物理量之一,它表示含有一定数目粒子的集合体。
2. 符号:n
3. 单位:摩尔,简称摩,符号为 mol
“1 mol 氢”这种说法是否正确?
你说的是氢气?氢原子?还是氢离子?
注意
(1)物质的量表示的是集合体,不是数量、质量等。
(2)“物质的量”是一个专有名词,不能说成“物质量”、“物质的质量”、“物质的数量”等。
(3)物质的量是物理量,摩尔是其单位,不要混淆。
(4)物质的量不能表示宏观物质,只能表示微观颗粒(原子、分子、离子、质子、中子、电子)且必须指明微粒的种类,如 1 mol H不能描述为 1 mol氢等。
明辨是非
(1)摩尔是国际七个基本物理量之一( )
(2)物质的量表示物质所含指定粒子集体数目的多少( )
(3)物质的量是衡量物质数量的基本物理量( )
(4)1 mol 苹果( )
(5)1 mol 氧( )
(6)2 mol CO2( )
(7)3 mol OH-( )
(8)参加反应的 H2O 的物质量为 1 mol( )
×
×
×
×
×
√
√
×
…
…
1 mol H2O
2 mol H
1 mol O
1 个 H2O分子里,有 2 个 H 原子,1 个 O 原子。那 1 mol H2O呢?
二、微粒间的数量关系
1. 分子和原子/离子的数量关系
1 mol CO2含_________mol C,含_________mol O
2 mol CO2含_________mol C,含_________mol O
n mol CO2含_________mol C,含_________mol O
即:n mol AxBy中含_______mol A,含_______mol B
1
2
2
4
n
2n
nx
ny
二、微粒间的数量关系
2. 微粒中的质子数、中子数、电子数
质子数 电子数 中子数
H2O
NH3
Na+
F-
OH-
10 10 8
10 10 7
11 10 12
11 10 7
9 10 10
9 10 8
物质的量表示含有一定数目粒子的集合体。
这“一定数目“是多少?以及它是怎么得来的?
资料卡片——物质的量及其标准的由来
1971年,由41个国家参加的第14届国际计量大会上,正式宣布了国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物理量单位的提议,并作出决议。从此,“物质的量”就成为了国际单位制中的一个基本物理量。同时规定0.012 kg 12C中所含的碳原子数目作为1 mol 的标准,即1 mol 粒子所含的数目约为6.02×1023个。
三、阿伏加德罗常数
1. 定义:1 mol 任何粒子含有的粒子数叫做阿伏加德罗常数。
2. 数值:1 mol 任何粒子所含的粒子数与 0.012 kg 12C中所含碳原子数相等,即NA约等于6.02×1023 mol-1。
3. 符号:NA
4. 单位:mol-1 (每摩尔)
5. 表达式:NA≈6.02×1023mol-1
阿伏加德罗常数有单位,单位为mol-1,NA≈6.02×1023 mol-1。
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
(1)阿伏加德罗常数是12 g 碳中所含的碳原子数( )
(2)1 mol N2中含有NA个原子( )
(3)阿伏加德罗常数的符号为NA,近似为6.02×1023( )
(4)1 mol 氧含有6.02×1023个O2( )
(5)1 mol 任何物质都含有6.02×1023个分子( )
明辨是非
×
×
×
×
×
…
…
1 mol H2O有 NA个水分子
…
…
…
…
…
…
…
…
…
…
…
…
n = 1 mol
n = 6 mol
N = NA
N = 6 NA
物质的量 n ,阿伏加德罗常数NA ,粒子数 N 如何换算?
三、阿伏伽德罗常数
6. 计算公式:N=n · NA (其中n表示物质的量,NA 表示阿伏加德罗常数,N表示粒子数)
n N
1 mol
2 mol
1.806 × 1024
9.03 × 1023
6.02 × 1023
1.204 × 1024
3 mol
1.5 mol
1mol 不同物质中所含的粒子数是相同的,都约为6.02×1023个
那么,1mol 不同物质,其质量是否相同呢?为什么?
一般不同。因为不同微粒的质量一般不一样。
四、摩尔质量
1. 定义:单位物质的量的物质所具有的质量。
2. 符号:M。
3. 单位: g mol-1 或 g/mol。
4. 数值:l mol 任何粒子或物质的摩尔质量以 g/mol 为单位时,其数值等于该粒子的相对原子(分子)质量。
摩尔质量和相对原子(分子)质量是否相同?
意义不同,单位不同。两者仅数值相等。(前提:M 以 g/mol 为单位)
明辨是非
(1)NaOH 的摩尔质量为 40 g( )
(2)氦气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量( )
(3)1 mol Na+ 的质量为23 g( )
(4)2 mol CO2 的摩尔质量是 1 mol CO2 的摩尔质量的 2 倍( )
(5)两种不同粒子的摩尔质量一定不同( )
×
√
√
×
×
四、摩尔质量
5. 计算公式:m=n· M(其中n表示物质的量,m表示物质的质量,M表示摩尔质量)
物质 摩尔质量 物质的量 质量
O2 64 g
NaOH 1.5 mol
H2SO4 98 g
Na2CO3 0.5 mol
32 g·mol-1
2 mol
40 g·mol-1
60 g
98 g·mol-1
0.5 mol
106 g·mol-1
53 g
归纳总结——化学计量
物理量 物理量符号 单位符号 表达式
物质的量 n mol
阿伏加德罗常数 NA mol-1 NA = N/ n
摩尔质量 M g / mol M = m/n
即时小练——填写下表
物质 物质的量/mol 分子数
(用数值表示) 原子总数
(用NA表示) 质量/g 摩尔质量/g·mol-1
H2O 2
H2SO4 3.01×1022
N2 14
1.204×1024 6NA 36 18
0.05 0.35NA 4.9 98
0.5 3.01×1023 NA 28
知识点都掌握了吗?来做几道题检测下~
【例1】下列关于物质的量的说法中正确的是
A.摩尔是国际单位制中的一个物理量 B.物质的量是指物质中所含微粒的个数
C.物质的量就是物质的质量 D.物质的量只能计量微观粒子
D
题型一:物质的量的概念辨析
【例2】下列关于阿伏加德罗常数的说法错误的是
A.6.02×1023就是阿伏加德罗常数
B.0.012 kg 12C含有的碳原子数就是阿伏加德罗常数
C.含有阿伏加德罗常数个粒子的物质的量是 1 mol
D.1 mol 氨气所含的原子数约为 2.408×1024
A
题型二:阿伏伽德罗常数的概念辨析
【例3】填空:
(1)0.5mol O2中的氧气分子数目是___________。
(2)1mol NH3中的氢原子数目是___________。
(3)1.5mol Na2CO3中Na+的数目是___________。
(4)1.204×1023个CH4分子的物质的量___________。
(5)6.02×1023个氧原子中所含的质子数目是___________。
题型三:阿伏伽德罗常数的相关计算
(1)3.01×1023
(2)1.806×1024
(3)1.806×1024
(4)0.2 mol
(5)8×6.02×1023
【例4】下列说法中正确的是
A.1mol O2 质量为 32 g·mol-1 B.1mo1OH- 的质量为 17
C.CO2 的相对分子质量为 44 g D.H2O 的摩尔质量为 18 g·mol-1
D
题型四:摩尔质量的概念辨析
【例5】(1)0.5 mol CaCO3的质量_____________。
(2)9.8 g H2SO4的物质的量_____________。
(3)5.3 g Na2CO3的物质的量_____________。
(4)8 克氧气中含氧原子的物质的量是___________。
(5)48 g 中含有___________mol O;含有___________mol S。
(6)14 g 某物质的物质的量为 0.5 mol,则其相对分子质量为________。
题型五:摩尔质量的相关计算
【答案】(1)50 g (2)0.1 mol (3)0.05 mol (4)0.5mol (5)2 0.5 (6)28
【变6-3】填空:
(1)1 mol CO(NH2)2 中含_______mol 碳原子,_______mol 氮原子,_______个氢原子,_______个氧原子。
(2)与0.2mol H3PO4 具有相同氢原子数的 HNO3 的物质的量是_______mol,具有相同氧原子数的硫酸分子有_______个,具有相同的分子数的 HCl 的物质的量是_______mol,具有相同原子总数的 NH3 的物质的量是_______mol。
题型六:微粒间的数量关系
【答案】⑴1 2 2.408×1024 6.02×1023 ⑵0.6 1.204×1023 0.2 0.4
【变7-3】常温下,20 滴水的体积为 1 mL,水的密度为 1g/cm3,若1滴水中含 a 个水分子,则阿伏加德罗常数值为_______。
题型七:化学计量的代数运算
360a
【例8】(1)1 mol H2SO4 中含_____mol O 。4 mol NH4NO3与______ mol H2SO4 所含氧原子数相同。1.204×1024 个 Mg 变成 Mg2+ 失去____ mol eˉ。
(2)4.5 g 水与___________ g 硫酸所含的分子数相等。
(3)乙醇(C2H6O)水溶液中,当乙醇分子和水分子中氢原子个数相等时,溶液中乙醇的质量分数为__________。
题型八:化学计量综合
【答案】⑴4 3 4 ⑵ 24.5 ⑶ 46%
知识导航
物质的量
经过初中化学的学习,我们知道,水是由水分子构成的。
也知道,水分子很小。但你知道一滴水里含有多少个水分子吗?
…
…
=
1 滴水
1.67×1021 个水分子
若10亿人来数1滴水里的水分子,每人每分钟数100个,日夜不停,需要3万多年才能数完。
想一下,平时喝一口水,喝进去了多少个水分子?
如果我说,我要喝10个水分子,在现实生活中有意义吗?
化学家在研究中发现,虽然参加化学反应的微粒质量很小,但实际参加反应的微粒数往往很大(如1滴水中大约含有17万亿亿个水分子)。
为了将一定数目的微观粒子与可称量的宏观物质联系起来,在化学上引入了物质的量。
就好比,把很多粒大米打包成整体,叫一袋大米。
引入物理量,把众多微观颗粒,也打包成一个整体。
该物理量,叫物质的量,单位是 mol,如 1mol H2O。
…
…
知识导航
一、物质的量
1.意义:国际单位制中7个基本物理量之一,它表示含有一定数目粒子的集合体。
2. 符号:n
3. 单位:摩尔,简称摩,符号为 mol
资料卡片——国际单位制(SI)的 7 个基本物理量及单位
物理量 长度 质量 时间 电流 热力学温度 物质的量 发光强度
单位(符号) 米(m) 千克(kg) 秒(s) 安(A) 开(K) 摩(mol) 坎(cd)
资料卡片——国际单位制(SI)的7个基本物理量及单位
物理量 长度 质量 时间 电流 热力学温度 物质的量 发光强度
单位(符号) 米(m) 千克(kg) 秒(s) 安(A) 开(K) 摩(mol) 坎(cd)
学校操场跑道的长度是 800 m
化学老师的体重是 65 kg
一堂化学课的时间是 45 min
水分子的物质的量是 1 mol
注意区分物理量和物理量单位
…
…
假设,这是 1 mol H2O
…
…
…
…
…
…
…
…
…
…
…
…
那么,这是
6 mol H2O
n = 1 mol
n = 6 mol
一、物质的量
1.意义:国际单位制中7个基本物理量之一,它表示含有一定数目粒子的集合体。
2. 符号:n
3. 单位:摩尔,简称摩,符号为 mol
“1 mol 人”这种说法是否正确?
错误。定义里写明,粒子。人不是粒子。
常见的粒子有哪些?
一、物质的量
1.意义:国际单位制中7个基本物理量之一,它表示含有一定数目粒子的集合体。
2. 符号:n
3. 单位:摩尔,简称摩,符号为 mol
“1 mol 氢”这种说法是否正确?
你说的是氢气?氢原子?还是氢离子?
注意
(1)物质的量表示的是集合体,不是数量、质量等。
(2)“物质的量”是一个专有名词,不能说成“物质量”、“物质的质量”、“物质的数量”等。
(3)物质的量是物理量,摩尔是其单位,不要混淆。
(4)物质的量不能表示宏观物质,只能表示微观颗粒(原子、分子、离子、质子、中子、电子)且必须指明微粒的种类,如 1 mol H不能描述为 1 mol氢等。
明辨是非
(1)摩尔是国际七个基本物理量之一( )
(2)物质的量表示物质所含指定粒子集体数目的多少( )
(3)物质的量是衡量物质数量的基本物理量( )
(4)1 mol 苹果( )
(5)1 mol 氧( )
(6)2 mol CO2( )
(7)3 mol OH-( )
(8)参加反应的 H2O 的物质量为 1 mol( )
×
×
×
×
×
√
√
×
…
…
1 mol H2O
2 mol H
1 mol O
1 个 H2O分子里,有 2 个 H 原子,1 个 O 原子。那 1 mol H2O呢?
二、微粒间的数量关系
1. 分子和原子/离子的数量关系
1 mol CO2含_________mol C,含_________mol O
2 mol CO2含_________mol C,含_________mol O
n mol CO2含_________mol C,含_________mol O
即:n mol AxBy中含_______mol A,含_______mol B
1
2
2
4
n
2n
nx
ny
二、微粒间的数量关系
2. 微粒中的质子数、中子数、电子数
质子数 电子数 中子数
H2O
NH3
Na+
F-
OH-
10 10 8
10 10 7
11 10 12
11 10 7
9 10 10
9 10 8
物质的量表示含有一定数目粒子的集合体。
这“一定数目“是多少?以及它是怎么得来的?
资料卡片——物质的量及其标准的由来
1971年,由41个国家参加的第14届国际计量大会上,正式宣布了国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物理量单位的提议,并作出决议。从此,“物质的量”就成为了国际单位制中的一个基本物理量。同时规定0.012 kg 12C中所含的碳原子数目作为1 mol 的标准,即1 mol 粒子所含的数目约为6.02×1023个。
三、阿伏加德罗常数
1. 定义:1 mol 任何粒子含有的粒子数叫做阿伏加德罗常数。
2. 数值:1 mol 任何粒子所含的粒子数与 0.012 kg 12C中所含碳原子数相等,即NA约等于6.02×1023 mol-1。
3. 符号:NA
4. 单位:mol-1 (每摩尔)
5. 表达式:NA≈6.02×1023mol-1
阿伏加德罗常数有单位,单位为mol-1,NA≈6.02×1023 mol-1。
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
(1)阿伏加德罗常数是12 g 碳中所含的碳原子数( )
(2)1 mol N2中含有NA个原子( )
(3)阿伏加德罗常数的符号为NA,近似为6.02×1023( )
(4)1 mol 氧含有6.02×1023个O2( )
(5)1 mol 任何物质都含有6.02×1023个分子( )
明辨是非
×
×
×
×
×
…
…
1 mol H2O有 NA个水分子
…
…
…
…
…
…
…
…
…
…
…
…
n = 1 mol
n = 6 mol
N = NA
N = 6 NA
物质的量 n ,阿伏加德罗常数NA ,粒子数 N 如何换算?
三、阿伏伽德罗常数
6. 计算公式:N=n · NA (其中n表示物质的量,NA 表示阿伏加德罗常数,N表示粒子数)
n N
1 mol
2 mol
1.806 × 1024
9.03 × 1023
6.02 × 1023
1.204 × 1024
3 mol
1.5 mol
1mol 不同物质中所含的粒子数是相同的,都约为6.02×1023个
那么,1mol 不同物质,其质量是否相同呢?为什么?
一般不同。因为不同微粒的质量一般不一样。
四、摩尔质量
1. 定义:单位物质的量的物质所具有的质量。
2. 符号:M。
3. 单位: g mol-1 或 g/mol。
4. 数值:l mol 任何粒子或物质的摩尔质量以 g/mol 为单位时,其数值等于该粒子的相对原子(分子)质量。
摩尔质量和相对原子(分子)质量是否相同?
意义不同,单位不同。两者仅数值相等。(前提:M 以 g/mol 为单位)
明辨是非
(1)NaOH 的摩尔质量为 40 g( )
(2)氦气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量( )
(3)1 mol Na+ 的质量为23 g( )
(4)2 mol CO2 的摩尔质量是 1 mol CO2 的摩尔质量的 2 倍( )
(5)两种不同粒子的摩尔质量一定不同( )
×
√
√
×
×
四、摩尔质量
5. 计算公式:m=n· M(其中n表示物质的量,m表示物质的质量,M表示摩尔质量)
物质 摩尔质量 物质的量 质量
O2 64 g
NaOH 1.5 mol
H2SO4 98 g
Na2CO3 0.5 mol
32 g·mol-1
2 mol
40 g·mol-1
60 g
98 g·mol-1
0.5 mol
106 g·mol-1
53 g
归纳总结——化学计量
物理量 物理量符号 单位符号 表达式
物质的量 n mol
阿伏加德罗常数 NA mol-1 NA = N/ n
摩尔质量 M g / mol M = m/n
即时小练——填写下表
物质 物质的量/mol 分子数
(用数值表示) 原子总数
(用NA表示) 质量/g 摩尔质量/g·mol-1
H2O 2
H2SO4 3.01×1022
N2 14
1.204×1024 6NA 36 18
0.05 0.35NA 4.9 98
0.5 3.01×1023 NA 28
知识点都掌握了吗?来做几道题检测下~
【例1】下列关于物质的量的说法中正确的是
A.摩尔是国际单位制中的一个物理量 B.物质的量是指物质中所含微粒的个数
C.物质的量就是物质的质量 D.物质的量只能计量微观粒子
D
题型一:物质的量的概念辨析
【例2】下列关于阿伏加德罗常数的说法错误的是
A.6.02×1023就是阿伏加德罗常数
B.0.012 kg 12C含有的碳原子数就是阿伏加德罗常数
C.含有阿伏加德罗常数个粒子的物质的量是 1 mol
D.1 mol 氨气所含的原子数约为 2.408×1024
A
题型二:阿伏伽德罗常数的概念辨析
【例3】填空:
(1)0.5mol O2中的氧气分子数目是___________。
(2)1mol NH3中的氢原子数目是___________。
(3)1.5mol Na2CO3中Na+的数目是___________。
(4)1.204×1023个CH4分子的物质的量___________。
(5)6.02×1023个氧原子中所含的质子数目是___________。
题型三:阿伏伽德罗常数的相关计算
(1)3.01×1023
(2)1.806×1024
(3)1.806×1024
(4)0.2 mol
(5)8×6.02×1023
【例4】下列说法中正确的是
A.1mol O2 质量为 32 g·mol-1 B.1mo1OH- 的质量为 17
C.CO2 的相对分子质量为 44 g D.H2O 的摩尔质量为 18 g·mol-1
D
题型四:摩尔质量的概念辨析
【例5】(1)0.5 mol CaCO3的质量_____________。
(2)9.8 g H2SO4的物质的量_____________。
(3)5.3 g Na2CO3的物质的量_____________。
(4)8 克氧气中含氧原子的物质的量是___________。
(5)48 g 中含有___________mol O;含有___________mol S。
(6)14 g 某物质的物质的量为 0.5 mol,则其相对分子质量为________。
题型五:摩尔质量的相关计算
【答案】(1)50 g (2)0.1 mol (3)0.05 mol (4)0.5mol (5)2 0.5 (6)28
【变6-3】填空:
(1)1 mol CO(NH2)2 中含_______mol 碳原子,_______mol 氮原子,_______个氢原子,_______个氧原子。
(2)与0.2mol H3PO4 具有相同氢原子数的 HNO3 的物质的量是_______mol,具有相同氧原子数的硫酸分子有_______个,具有相同的分子数的 HCl 的物质的量是_______mol,具有相同原子总数的 NH3 的物质的量是_______mol。
题型六:微粒间的数量关系
【答案】⑴1 2 2.408×1024 6.02×1023 ⑵0.6 1.204×1023 0.2 0.4
【变7-3】常温下,20 滴水的体积为 1 mL,水的密度为 1g/cm3,若1滴水中含 a 个水分子,则阿伏加德罗常数值为_______。
题型七:化学计量的代数运算
360a
【例8】(1)1 mol H2SO4 中含_____mol O 。4 mol NH4NO3与______ mol H2SO4 所含氧原子数相同。1.204×1024 个 Mg 变成 Mg2+ 失去____ mol eˉ。
(2)4.5 g 水与___________ g 硫酸所含的分子数相等。
(3)乙醇(C2H6O)水溶液中,当乙醇分子和水分子中氢原子个数相等时,溶液中乙醇的质量分数为__________。
题型八:化学计量综合
【答案】⑴4 3 4 ⑵ 24.5 ⑶ 46%
知识导航
