苏教版高中化学必修第一册专题3从海水中获得的化学物质3.1.1氯气的发现与制备教学课件(共21张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题3从海水中获得的化学物质3.1.1氯气的发现与制备教学课件(共21张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 10:32:46 | ||
图片预览







文档简介
(共21张PPT)
氯气的发现与制备(第1课时)
资料卡片——氯气的发现史
18世纪70年代,瑞典化学家舍勒(C.W.Scheele,1742-1786)将软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。受当时流行学说的影响,舍勒未能确认这种气体。
1810年,英国化学家戴维以大量事实为依据,确认黄绿色气体是一种新元素组成的单质,并将这种元素命名为chlorine。这一名称来自希腊文,有“绿色”的意思。中文译名曾为“绿气”,后改为“氯气”。
一、氯气的实验室制法
1. 基本原理与装置
实验原理 试剂
选择
方
程
式
装置
选择
浓盐酸 + 强氧化性物质(如MnO2、KMnO4、KClO3等)
固液加热型发生装置
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
实验装置图
2KMnO4 + 16HCl===2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
KClO3 + 6HCl(浓) === KCl + 3H2O + 3Cl2↑
/ 固液不需加热型发生装置
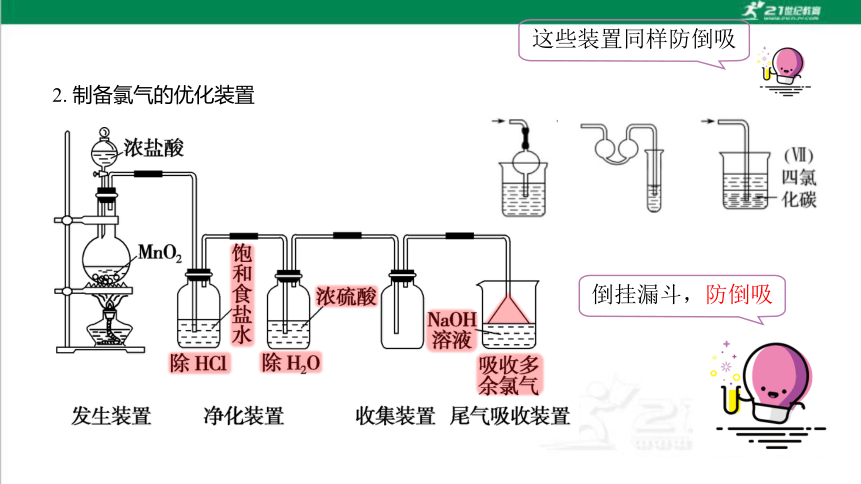
2. 制备氯气的优化装置
倒挂漏斗,防倒吸
这些装置同样防倒吸
如何检验氯气是否已经收集满?
3.Cl2的验满方法
(1)将湿润的淀粉-KI试纸放在集气瓶口,观察到试纸立即变蓝,则证明已集满。
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝;
(2)将湿润的蓝色石蕊试纸放在集气瓶口,观察到试纸____________,则证明已集满。
先变红后褪色
往某溶液中滴加AgNO3,若产生白色沉淀,能否说明溶液中含有Cl-?
实验探究
在3支试管中分别加入2~3 mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
实验试剂 实验现象 反应原理
稀盐酸
NaCl溶液
Na2CO3溶液
产生白色沉淀,沉淀不溶解
HCl+AgNO3===AgCl↓+HNO3
产生白色沉淀,沉淀不溶解
NaCl+AgNO3===AgCl↓+NaNO3
产生白色沉淀,后沉淀溶解,产生气泡
Na2CO3+2AgNO3===Ag2CO3↓+2NaNO3
Ag2CO3+2HNO3===CO2↑+H2O+2AgNO3
二、氯离子的检验
1. 检验原理:__________________________________。
2. 检验步骤:取少量待测液于试管中,加入_______酸化的_______溶液,若____________,说明溶液中含有Cl-。
Ag++Cl-===AgCl↓
稀硝酸
AgNO3
产生白色沉淀
19世纪,科学家发明了电解饱和食盐水的方法可以制取氯气。
知识精讲
二、氯气的工业制法
认识中国的实业家——吴蕴初先生
·吴蕴初 (1891—1953) , 上海嘉定人。第一次世界大战期间, 他在上海创办炽昌硝硷公司, 1921年又创办炽昌牛皮胶公司, 其产品均为替代进口的火柴原料。几经周折, 吴蕴初逐渐在国内化工企业界崭露头角, 先后在上海建起了天厨味精厂、天原电化厂、
天利氮气厂、天盛陶器厂等一系列化工企
业, 形成当时中国南方最大的化工企业集团
——“天”字号集团。他在化学原料及化
学制品制造业领域, 对中国民族化学工业
(无机化学) 的开拓发展做出了杰出贡献。
氯碱工业
知识精讲
知识精讲
根据上述实验现象和分析结果,写出电解氯化钠溶液的化学方程式:
向阴极溶液滴加1~2滴酚酞溶液,观察溶液的颜色
知识精讲
知识点都掌握了吗?来做几道题检测下~
【例1】 1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名―氯气)。实验室制取Cl2时,下列装置能达到相应实验目的的是
D
题型一:氯气的实验室制法
【变1-4】下图表示在没有通风橱时制取纯净的氯气设计的装置图,图中A、B是可控制的弹簧铁夹。
(1)烧杯中盛放的液体是___________,其作用
是___________,水槽中盛放的液体是________。
(2)简述操作过程:(从氯气已经产生开始)在收
集氯气之前,应___________;当氯气纯度合乎要
求时,应___________;当氯气收集完毕时,
应___________。
题型一:氯气的实验室制法
(1) NaOH溶液 吸收多余的Cl2 饱和食盐水
(2) 打开B夹,关闭A夹 打开A夹,关闭B夹 打开B夹,关闭A夹
【例2】有A、B、C、D四种易溶于水的白色固体,分别由
中的一种阳离子和一种阴离子组成(同一种离子只存在一种物质中)。某课外小组做了以下实验:①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述实验事实,推断盐的化学式分别为:A______;D______。
(2)写出下列反应的离子方程式:
①B+D→:______;
③C+HCl→气体:______。
题型二:氯离子的检验
【例2】
(3)在作实验反思时,有同学提出:如果溶液中同时存在CO32-和Cl-,CO32-会对Cl-的检验产生干扰。为了确定该溶液中是否存在 ,该小组同学进行了如下探究实验:
题型二:氯离子的检验
实验步骤 实验操作 实验目的 反应的离子方程式
第一步 向溶液中滴加过量的HNO3 溶液 除去 ______的干扰 略
第二步 向第一步实验后的溶液中滴加______ 检验 ______的存在 略
【例3】某同学用以下装置制备并检验Cl2的性质。下列说法不正确的是
A.Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B.Ⅱ图:证明新制氯水具有酸性和漂白性
C.Ⅲ图:产生了棕黄色的烟
D.Ⅳ图:验证Cl2无漂白性
A
题型三:氯气的制法及性质综合考查
题型三:氯气的制法及性质综合考查
【例6】某校化学实验兴趣小组同学设计了如图所示的实验装置,探究氯气的某些性质。
(1)A中产生现象是___________,甲同学认为是Cl2与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式___________、___________,乙同学则认为A中的现象不足以说明白色沉淀是Cl2与水反应产生新物质的结果,理由是________。
(2)B和C中出现的不同现象可得出的结论是_________。
(3)装置D中产生的现象是___________,该反应的基本
反应类型是___________。
(4)E是尾气吸收装置,写出其中发生的反应方程式:___________,丙同学将充分吸收了尾气之后的吸收液拿来做实验,向吸收液中滴加盐酸,产生了有刺激性气味的气体,写出该反应的化学方程式___________。
(5)工业上用氯气和石灰乳反应可制漂白粉,该反应方程式为:___________,漂白粉需要密闭保存,原因是(用化学方程式表示)___________,丁同学取漂白粉的溶液来做实验,向其中滴加碳酸钠溶液,观察到产生白色沉淀,请推测其中发生反应生成的新物质有___________。
题型三:氯气的制法及性质综合考查
【例6】
【答案】
(1) 溶液中有白色沉淀产生 Cl2 + H2O == HCl + HClO AgNO3+HCl==AgCl↓+HNO3 浓盐酸有挥发性,挥发出的HCl进入到AgNO3溶液中也可以生成AgCl白色沉淀
(2)氯气无漂白性
(3)KI淀粉溶液变蓝 置换反应
(4)Cl2+2NaOH==NaCl+NaClO+H2O NaClO+2HCl==NaCl+Cl2↑+H2O
(5)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+H2O+CO2==2HClO+CaCO3↓ CaCO3、NaCl、NaClO
【例7】如图,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,接通电路后,发现B上的c点显红色,请填空:
(1)电源的A的a为 极;
(2)滤纸B上发生的总反应方程式为:
正
K
A
B
a
b
c
d
对点训练
题型四:氯气的工业制法考查
氯气的发现与制备(第1课时)
资料卡片——氯气的发现史
18世纪70年代,瑞典化学家舍勒(C.W.Scheele,1742-1786)将软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。受当时流行学说的影响,舍勒未能确认这种气体。
1810年,英国化学家戴维以大量事实为依据,确认黄绿色气体是一种新元素组成的单质,并将这种元素命名为chlorine。这一名称来自希腊文,有“绿色”的意思。中文译名曾为“绿气”,后改为“氯气”。
一、氯气的实验室制法
1. 基本原理与装置
实验原理 试剂
选择
方
程
式
装置
选择
浓盐酸 + 强氧化性物质(如MnO2、KMnO4、KClO3等)
固液加热型发生装置
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
实验装置图
2KMnO4 + 16HCl===2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
KClO3 + 6HCl(浓) === KCl + 3H2O + 3Cl2↑
/ 固液不需加热型发生装置
2. 制备氯气的优化装置
倒挂漏斗,防倒吸
这些装置同样防倒吸
如何检验氯气是否已经收集满?
3.Cl2的验满方法
(1)将湿润的淀粉-KI试纸放在集气瓶口,观察到试纸立即变蓝,则证明已集满。
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝;
(2)将湿润的蓝色石蕊试纸放在集气瓶口,观察到试纸____________,则证明已集满。
先变红后褪色
往某溶液中滴加AgNO3,若产生白色沉淀,能否说明溶液中含有Cl-?
实验探究
在3支试管中分别加入2~3 mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
实验试剂 实验现象 反应原理
稀盐酸
NaCl溶液
Na2CO3溶液
产生白色沉淀,沉淀不溶解
HCl+AgNO3===AgCl↓+HNO3
产生白色沉淀,沉淀不溶解
NaCl+AgNO3===AgCl↓+NaNO3
产生白色沉淀,后沉淀溶解,产生气泡
Na2CO3+2AgNO3===Ag2CO3↓+2NaNO3
Ag2CO3+2HNO3===CO2↑+H2O+2AgNO3
二、氯离子的检验
1. 检验原理:__________________________________。
2. 检验步骤:取少量待测液于试管中,加入_______酸化的_______溶液,若____________,说明溶液中含有Cl-。
Ag++Cl-===AgCl↓
稀硝酸
AgNO3
产生白色沉淀
19世纪,科学家发明了电解饱和食盐水的方法可以制取氯气。
知识精讲
二、氯气的工业制法
认识中国的实业家——吴蕴初先生
·吴蕴初 (1891—1953) , 上海嘉定人。第一次世界大战期间, 他在上海创办炽昌硝硷公司, 1921年又创办炽昌牛皮胶公司, 其产品均为替代进口的火柴原料。几经周折, 吴蕴初逐渐在国内化工企业界崭露头角, 先后在上海建起了天厨味精厂、天原电化厂、
天利氮气厂、天盛陶器厂等一系列化工企
业, 形成当时中国南方最大的化工企业集团
——“天”字号集团。他在化学原料及化
学制品制造业领域, 对中国民族化学工业
(无机化学) 的开拓发展做出了杰出贡献。
氯碱工业
知识精讲
知识精讲
根据上述实验现象和分析结果,写出电解氯化钠溶液的化学方程式:
向阴极溶液滴加1~2滴酚酞溶液,观察溶液的颜色
知识精讲
知识点都掌握了吗?来做几道题检测下~
【例1】 1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名―氯气)。实验室制取Cl2时,下列装置能达到相应实验目的的是
D
题型一:氯气的实验室制法
【变1-4】下图表示在没有通风橱时制取纯净的氯气设计的装置图,图中A、B是可控制的弹簧铁夹。
(1)烧杯中盛放的液体是___________,其作用
是___________,水槽中盛放的液体是________。
(2)简述操作过程:(从氯气已经产生开始)在收
集氯气之前,应___________;当氯气纯度合乎要
求时,应___________;当氯气收集完毕时,
应___________。
题型一:氯气的实验室制法
(1) NaOH溶液 吸收多余的Cl2 饱和食盐水
(2) 打开B夹,关闭A夹 打开A夹,关闭B夹 打开B夹,关闭A夹
【例2】有A、B、C、D四种易溶于水的白色固体,分别由
中的一种阳离子和一种阴离子组成(同一种离子只存在一种物质中)。某课外小组做了以下实验:①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述实验事实,推断盐的化学式分别为:A______;D______。
(2)写出下列反应的离子方程式:
①B+D→:______;
③C+HCl→气体:______。
题型二:氯离子的检验
【例2】
(3)在作实验反思时,有同学提出:如果溶液中同时存在CO32-和Cl-,CO32-会对Cl-的检验产生干扰。为了确定该溶液中是否存在 ,该小组同学进行了如下探究实验:
题型二:氯离子的检验
实验步骤 实验操作 实验目的 反应的离子方程式
第一步 向溶液中滴加过量的HNO3 溶液 除去 ______的干扰 略
第二步 向第一步实验后的溶液中滴加______ 检验 ______的存在 略
【例3】某同学用以下装置制备并检验Cl2的性质。下列说法不正确的是
A.Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B.Ⅱ图:证明新制氯水具有酸性和漂白性
C.Ⅲ图:产生了棕黄色的烟
D.Ⅳ图:验证Cl2无漂白性
A
题型三:氯气的制法及性质综合考查
题型三:氯气的制法及性质综合考查
【例6】某校化学实验兴趣小组同学设计了如图所示的实验装置,探究氯气的某些性质。
(1)A中产生现象是___________,甲同学认为是Cl2与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式___________、___________,乙同学则认为A中的现象不足以说明白色沉淀是Cl2与水反应产生新物质的结果,理由是________。
(2)B和C中出现的不同现象可得出的结论是_________。
(3)装置D中产生的现象是___________,该反应的基本
反应类型是___________。
(4)E是尾气吸收装置,写出其中发生的反应方程式:___________,丙同学将充分吸收了尾气之后的吸收液拿来做实验,向吸收液中滴加盐酸,产生了有刺激性气味的气体,写出该反应的化学方程式___________。
(5)工业上用氯气和石灰乳反应可制漂白粉,该反应方程式为:___________,漂白粉需要密闭保存,原因是(用化学方程式表示)___________,丁同学取漂白粉的溶液来做实验,向其中滴加碳酸钠溶液,观察到产生白色沉淀,请推测其中发生反应生成的新物质有___________。
题型三:氯气的制法及性质综合考查
【例6】
【答案】
(1) 溶液中有白色沉淀产生 Cl2 + H2O == HCl + HClO AgNO3+HCl==AgCl↓+HNO3 浓盐酸有挥发性,挥发出的HCl进入到AgNO3溶液中也可以生成AgCl白色沉淀
(2)氯气无漂白性
(3)KI淀粉溶液变蓝 置换反应
(4)Cl2+2NaOH==NaCl+NaClO+H2O NaClO+2HCl==NaCl+Cl2↑+H2O
(5)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+H2O+CO2==2HClO+CaCO3↓ CaCO3、NaCl、NaClO
【例7】如图,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,接通电路后,发现B上的c点显红色,请填空:
(1)电源的A的a为 极;
(2)滤纸B上发生的总反应方程式为:
正
K
A
B
a
b
c
d
对点训练
题型四:氯气的工业制法考查
