苏教版高中化学必修第一册专题1物质的分类及计量1.2.2气体摩尔体积教学课件(共26张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题1物质的分类及计量1.2.2气体摩尔体积教学课件(共26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 10:34:10 | ||
图片预览



文档简介
(共26张PPT)
专题1 物质的分类及计量
第二单元 物质的化学计量
第2课时 气体摩尔体积
我们已经知道,1mol任何微粒的集合体所含的微粒数都相同,但1mol不同物质的质量往往不同。那么,1mol不同物质的体积是否相同呢?
1mol粒子的粒子的数目≈ 6.02×1023
1mol不同物质的质量
物质在不同的温度和压强下,可以呈现出不同的聚集状态。如下:
冰 水蒸气 水
其中,固态冰具有固定的形状,液态水、气态水蒸气没有固定的形状;气体容易被压缩,而固体、液体不易被压缩。为什么同一物质的不同状态,性质不同呢?
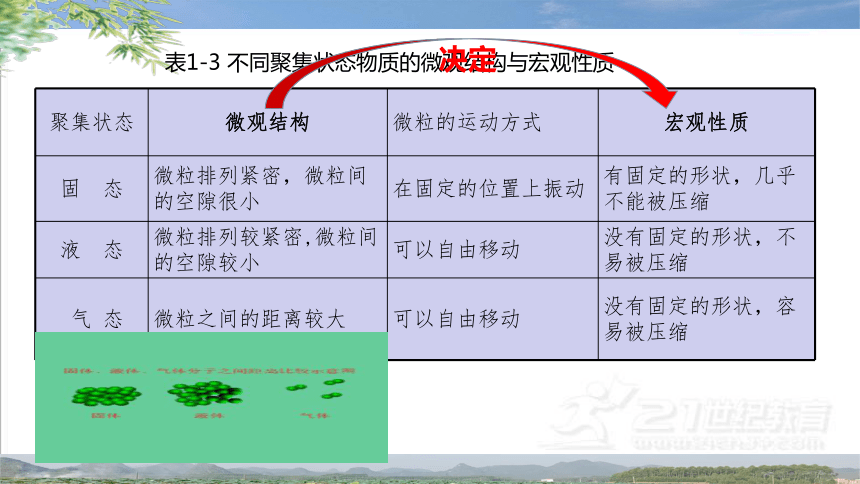
聚集状态 微观结构 微粒的运动方式 宏观性质
固 态 微粒排列紧密,微粒间的空隙很小 在固定的位置上振动 有固定的形状,几乎不能被压缩
液 态 微粒排列较紧密,微粒间的空隙较小 可以自由移动 没有固定的形状,不易被压缩
气 态 微粒之间的距离较大 可以自由移动 没有固定的形状,容易被压缩
表1-3 不同聚集状态物质的微观结构与宏观性质
决定
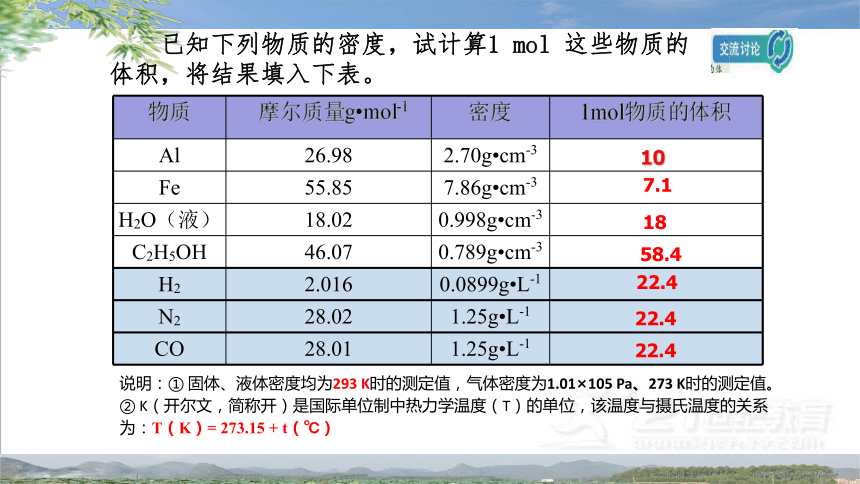
已知下列物质的密度,试计算1 mol 这些物质的体积,将结果填入下表。
物质 摩尔质量g mol-1 密度 1mol物质的体积
Al 26.98 2.70g cm-3
Fe 55.85 7.86g cm-3
H2O(液) 18.02 0.998g cm-3
C2H5OH 46.07 0.789g cm-3
H2 2.016 0.0899g L-1
N2 28.02 1.25g L-1
CO 28.01 1.25g L-1
说明:① 固体、液体密度均为293 K时的测定值,气体密度为1.01×105 Pa、273 K时的测定值。
② K(开尔文,简称开)是国际单位制中热力学温度(T)的单位,该温度与摄氏温度的关系为:T(K)= 273.15 + t(℃)
7.1
18
58.4
22.4
22.4
22.4
10
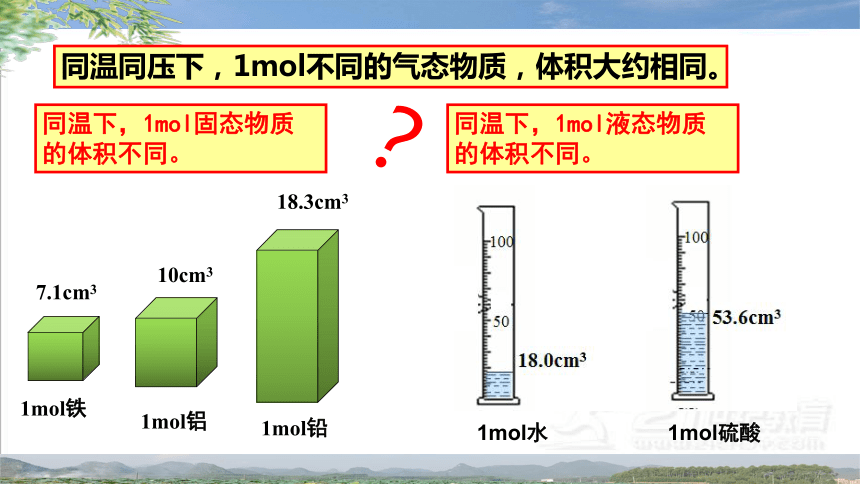
同温下,1mol固态物质的体积不同。
1mol铁
7.1cm3
1mol铝
10cm3
1mol水 1mol硫酸
同温下,1mol液态物质的体积不同。
同温同压下,1mol不同的气态物质,体积大约相同。
?
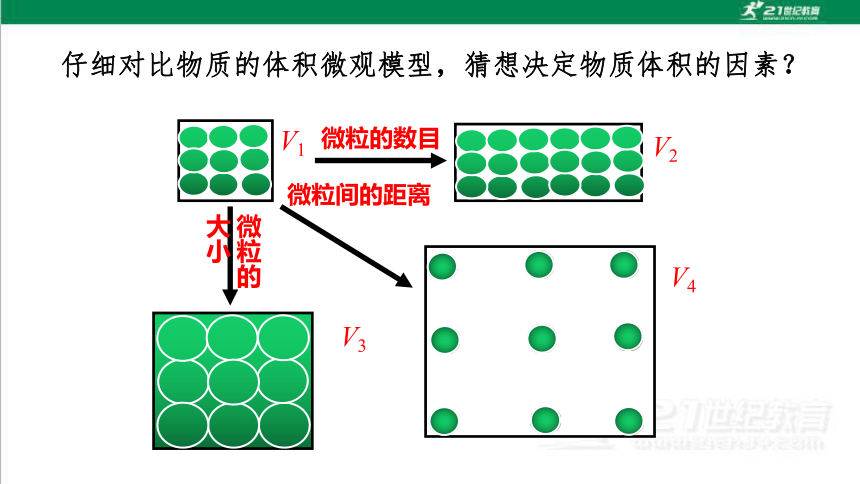
仔细对比物质的体积微观模型,猜想决定物质体积的因素?
V1
V4
V2
V3
微粒的数目
微粒的大小
微粒间的距离
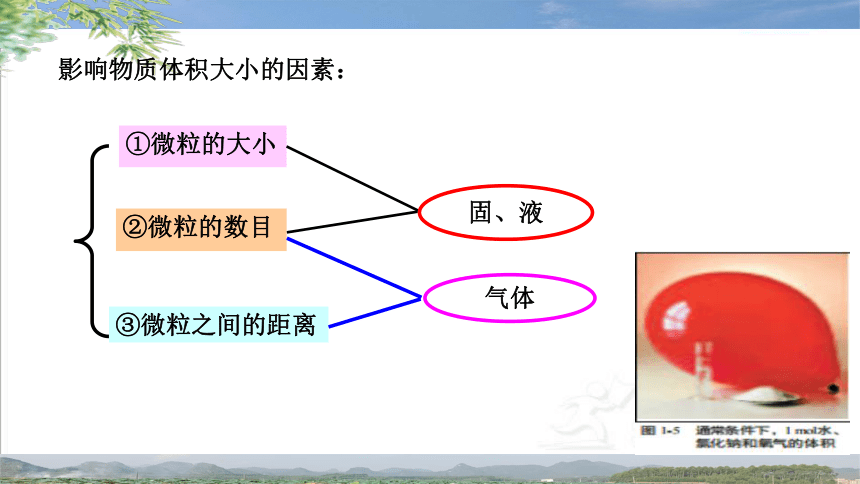
影响物质体积大小的因素:
②微粒的数目
①微粒的大小
③微粒之间的距离
固、液
气体
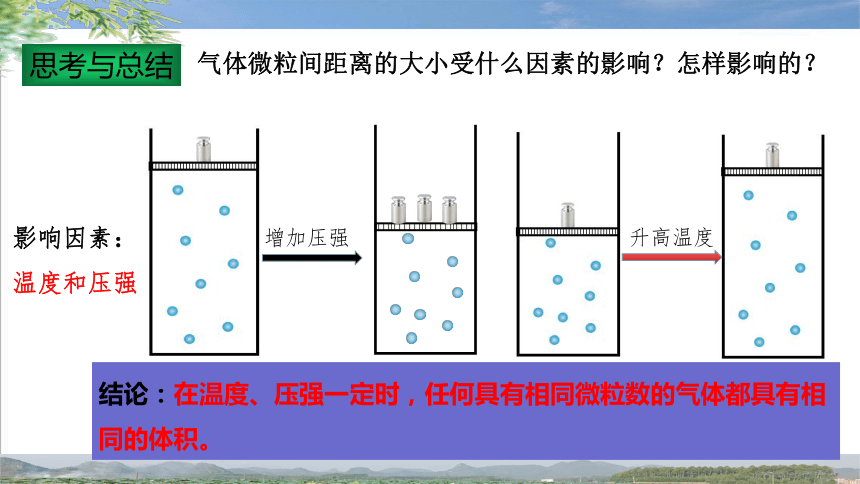
思考与总结
气体微粒间距离的大小受什么因素的影响?怎样影响的?
影响因素:温度和压强
增大压强,微粒间的距离减小,体积缩小;
升高温度,微粒间的距离增大,体积增大。
结论:在温度、压强一定时,任何具有相同微粒数的气体都具有相同的体积。
增加压强
升高温度
1、条件:
2、定量:
3、状态:
4、对象:
5、数值:
在标准状况下,1mol任何气体所占的体积都约为22 .4L。
重要结论
标准状况,简称标况(温度0oC或273K、压强 1.01×105Pa)
物质的量为1mol
必须为气体,固体和液体不适用
任何气体,既可以是单一气体,也可以是混合气体
22.4L,且与气体种类无关。
气体摩尔体积
1.概念:
2.符号:
3.单位:
4.定义式:
5.特例:
标准状况( 温度0oC或273K、压强 1.01×105 Pa)下,
气体摩尔体积Vm约为:22.4L/mol
单位物质的量的气体所占的体积。
Vm
L/mol 或 m3/mol
Vm =V(气体)/n(气体)
1. 标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2. 1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/mol)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
0℃,101Kpa
22.4L/mol
273℃,202Kpa
0℃,55Kpa
-136.5℃,55Kpa
22.4L/mol
标准状况
44.8L/mol
22.4L/mol
0℃,202Kpa
11.2L/mol
气体在不同温度和压强下都有气体摩尔体积,数值可能相同,
也可能不同。
难点
释疑
小结:
1.气体摩尔体积只适用于气体(可以是任何一种单一组分的气体,也可以是相互不反应的混合气体)的有关计算,不适用于固体、液体。标况下,不是气体的物质:H2O、H2O2、HF、CCl4、SO3、酒精、苯等。
2.在非标准状况下,1mol任何气体的体积不一定是22.4L,但也有可能为22.4L
1、下列叙述正确的是( )
A.1 mol任何气体的体积都约为22.4 L
B.1 mol任何物质在标准状况下所占的体积都约为22.4 L
C.标准状况下,1 mol水所占的体积是22.4 L
D.标准状况下,22.4 L任何气体的物质的量都约为1 mol
E.在常温常压下,11.2 L Cl2含有的分子数为0.5NA
D
2.标准状况下,1mol的CO2的体积为: 。
3.标准状况下,0.5mol的H2S的体积为: 。
4.标准状况下,44.8L的CH4的物质的量为: ;
含H的个数为: 。
5.标准状况下,6.72L的NH3的物质的量为: 质量为: 。
22.4L
11.2L
2mol
8NA
0.3mol
5.1g
气体的体积和物质的量的关系:
阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相同数目的分子(相同物质的量的分子)。
注意:
(1)P、T、V、n 任意“三同”可定另“一同”。
(2)适用于任何气态物质,单一气体或混合气体。
(3)标况下的气体摩尔体积是阿伏加德罗定律的一个特例。
2.同温同压下,相同体积的下列气体中,质量最大的是( ) A、氯气 B、氢气 C、氧气 D、氮气
1.同温同压下,同物质的量的CH4气体与CO体积比是( )
A、3:1 B、1:1 C、1:3 D、2:3
B
A
阿伏加德罗定律的数学表达式
克拉珀珑方程(或理想气体状态方程)
PV=nRT
P:气体压强(单位:Pa )
V:气体的体积(单位:L)
n:气体分子的物质的量(单位:mol)
T:温度(单位:K)
R:常数
阿伏加德罗定律的推论
理想气体的状态方程:PV = nRT
P1V1=n1RT1
气体Ⅰ
P2V2=n2RT2
气体Ⅱ
P1V1
P2V2
=
n1RT1
n2RT2
同温同压:
T1=T2 P1=P2
同 T、P :
V1
V2
N1
N2
=
n1
n2
=
推论1:同温同压下,任何气体的体积之比等于物质的量之比(等于所含的分子数之比)
1.两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气。在同温同压下两容器内的气体一定具有相同的是 ( )
A.原子总数 B.质子总数 C.分子总数 D.质量
AC
2.在一定温度和压强下,2体积X2气体与3体积Y2气体恰好完全反应,
生成2体积气体化合物Z,则Z的化学式可能是( )
A.XY3 B.XY C.X3Y D.X2Y3
解析 由体积比等于物质的量之比,可知化学方程式为2X2+3Y2=2Z,再由原子守恒可知Z的化学式为X2Y3。
D
阿伏加德罗定律的推论
根据 标况下:M = ρVm
M1=ρ1Vm1
气体Ⅰ
M2=ρ2Vm2
气体Ⅱ
M1
M2
=
ρ1Vm1
ρ1Vm1
同温同压:
T1=T2 P1=P2 Vm1=Vm2
同 T、P :
ρ1
ρ2
=
M1
M2
推论2:同温同压下,任何气体的密度之比等于其摩尔质量之比
应用:比较常温常压下,气体的密度与空气的密度大小。
阿伏加德罗定律的推论
条件 结论
公式 语言叙述
同温同压 同温同压下,体积比等于物质的量之比,等于分子数之比
T、p相同 同温、同压下,气体的密度与其相对分子质量(或摩尔质量)成正比
同温同容 同温同容下,压强比等于物质的量之比
1、同温同压下,两种气体A和B的体积之比为 2 : 1,质量之比为 8 : 5,则A与B的密度之比为 ,摩尔质量之比为 。
4 : 5
4 : 5
ρ1
ρ2
=
m1 /V1
m2 /V2
ρ1
ρ2
=
M1
M2
2、同温同压下,同体积的氨和硫化氢气体的质量比是 ;同质量的氨和硫化氢气体的体积比是 ;同质量的氨和硫化氢气体中所含氢原子个数比是 ;若两者所含氢原子个数相等,它们的物质的量之比是 。
m1
m2
=
M1
M2
M(NH3):17 g/mol
M(H2S):34 g/mol
1 : 2
V1
V2
=
m1 /M1
m2 /M2
=
M2
M1
2 : 1
N1
N2
=
3n(NH3)
2n(H2S)
3 : 1
2 : 3
课堂总结
专题1 物质的分类及计量
第二单元 物质的化学计量
第2课时 气体摩尔体积
我们已经知道,1mol任何微粒的集合体所含的微粒数都相同,但1mol不同物质的质量往往不同。那么,1mol不同物质的体积是否相同呢?
1mol粒子的粒子的数目≈ 6.02×1023
1mol不同物质的质量
物质在不同的温度和压强下,可以呈现出不同的聚集状态。如下:
冰 水蒸气 水
其中,固态冰具有固定的形状,液态水、气态水蒸气没有固定的形状;气体容易被压缩,而固体、液体不易被压缩。为什么同一物质的不同状态,性质不同呢?
聚集状态 微观结构 微粒的运动方式 宏观性质
固 态 微粒排列紧密,微粒间的空隙很小 在固定的位置上振动 有固定的形状,几乎不能被压缩
液 态 微粒排列较紧密,微粒间的空隙较小 可以自由移动 没有固定的形状,不易被压缩
气 态 微粒之间的距离较大 可以自由移动 没有固定的形状,容易被压缩
表1-3 不同聚集状态物质的微观结构与宏观性质
决定
已知下列物质的密度,试计算1 mol 这些物质的体积,将结果填入下表。
物质 摩尔质量g mol-1 密度 1mol物质的体积
Al 26.98 2.70g cm-3
Fe 55.85 7.86g cm-3
H2O(液) 18.02 0.998g cm-3
C2H5OH 46.07 0.789g cm-3
H2 2.016 0.0899g L-1
N2 28.02 1.25g L-1
CO 28.01 1.25g L-1
说明:① 固体、液体密度均为293 K时的测定值,气体密度为1.01×105 Pa、273 K时的测定值。
② K(开尔文,简称开)是国际单位制中热力学温度(T)的单位,该温度与摄氏温度的关系为:T(K)= 273.15 + t(℃)
7.1
18
58.4
22.4
22.4
22.4
10
同温下,1mol固态物质的体积不同。
1mol铁
7.1cm3
1mol铝
10cm3
1mol水 1mol硫酸
同温下,1mol液态物质的体积不同。
同温同压下,1mol不同的气态物质,体积大约相同。
?
仔细对比物质的体积微观模型,猜想决定物质体积的因素?
V1
V4
V2
V3
微粒的数目
微粒的大小
微粒间的距离
影响物质体积大小的因素:
②微粒的数目
①微粒的大小
③微粒之间的距离
固、液
气体
思考与总结
气体微粒间距离的大小受什么因素的影响?怎样影响的?
影响因素:温度和压强
增大压强,微粒间的距离减小,体积缩小;
升高温度,微粒间的距离增大,体积增大。
结论:在温度、压强一定时,任何具有相同微粒数的气体都具有相同的体积。
增加压强
升高温度
1、条件:
2、定量:
3、状态:
4、对象:
5、数值:
在标准状况下,1mol任何气体所占的体积都约为22 .4L。
重要结论
标准状况,简称标况(温度0oC或273K、压强 1.01×105Pa)
物质的量为1mol
必须为气体,固体和液体不适用
任何气体,既可以是单一气体,也可以是混合气体
22.4L,且与气体种类无关。
气体摩尔体积
1.概念:
2.符号:
3.单位:
4.定义式:
5.特例:
标准状况( 温度0oC或273K、压强 1.01×105 Pa)下,
气体摩尔体积Vm约为:22.4L/mol
单位物质的量的气体所占的体积。
Vm
L/mol 或 m3/mol
Vm =V(气体)/n(气体)
1. 标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2. 1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/mol)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
0℃,101Kpa
22.4L/mol
273℃,202Kpa
0℃,55Kpa
-136.5℃,55Kpa
22.4L/mol
标准状况
44.8L/mol
22.4L/mol
0℃,202Kpa
11.2L/mol
气体在不同温度和压强下都有气体摩尔体积,数值可能相同,
也可能不同。
难点
释疑
小结:
1.气体摩尔体积只适用于气体(可以是任何一种单一组分的气体,也可以是相互不反应的混合气体)的有关计算,不适用于固体、液体。标况下,不是气体的物质:H2O、H2O2、HF、CCl4、SO3、酒精、苯等。
2.在非标准状况下,1mol任何气体的体积不一定是22.4L,但也有可能为22.4L
1、下列叙述正确的是( )
A.1 mol任何气体的体积都约为22.4 L
B.1 mol任何物质在标准状况下所占的体积都约为22.4 L
C.标准状况下,1 mol水所占的体积是22.4 L
D.标准状况下,22.4 L任何气体的物质的量都约为1 mol
E.在常温常压下,11.2 L Cl2含有的分子数为0.5NA
D
2.标准状况下,1mol的CO2的体积为: 。
3.标准状况下,0.5mol的H2S的体积为: 。
4.标准状况下,44.8L的CH4的物质的量为: ;
含H的个数为: 。
5.标准状况下,6.72L的NH3的物质的量为: 质量为: 。
22.4L
11.2L
2mol
8NA
0.3mol
5.1g
气体的体积和物质的量的关系:
阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相同数目的分子(相同物质的量的分子)。
注意:
(1)P、T、V、n 任意“三同”可定另“一同”。
(2)适用于任何气态物质,单一气体或混合气体。
(3)标况下的气体摩尔体积是阿伏加德罗定律的一个特例。
2.同温同压下,相同体积的下列气体中,质量最大的是( ) A、氯气 B、氢气 C、氧气 D、氮气
1.同温同压下,同物质的量的CH4气体与CO体积比是( )
A、3:1 B、1:1 C、1:3 D、2:3
B
A
阿伏加德罗定律的数学表达式
克拉珀珑方程(或理想气体状态方程)
PV=nRT
P:气体压强(单位:Pa )
V:气体的体积(单位:L)
n:气体分子的物质的量(单位:mol)
T:温度(单位:K)
R:常数
阿伏加德罗定律的推论
理想气体的状态方程:PV = nRT
P1V1=n1RT1
气体Ⅰ
P2V2=n2RT2
气体Ⅱ
P1V1
P2V2
=
n1RT1
n2RT2
同温同压:
T1=T2 P1=P2
同 T、P :
V1
V2
N1
N2
=
n1
n2
=
推论1:同温同压下,任何气体的体积之比等于物质的量之比(等于所含的分子数之比)
1.两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气。在同温同压下两容器内的气体一定具有相同的是 ( )
A.原子总数 B.质子总数 C.分子总数 D.质量
AC
2.在一定温度和压强下,2体积X2气体与3体积Y2气体恰好完全反应,
生成2体积气体化合物Z,则Z的化学式可能是( )
A.XY3 B.XY C.X3Y D.X2Y3
解析 由体积比等于物质的量之比,可知化学方程式为2X2+3Y2=2Z,再由原子守恒可知Z的化学式为X2Y3。
D
阿伏加德罗定律的推论
根据 标况下:M = ρVm
M1=ρ1Vm1
气体Ⅰ
M2=ρ2Vm2
气体Ⅱ
M1
M2
=
ρ1Vm1
ρ1Vm1
同温同压:
T1=T2 P1=P2 Vm1=Vm2
同 T、P :
ρ1
ρ2
=
M1
M2
推论2:同温同压下,任何气体的密度之比等于其摩尔质量之比
应用:比较常温常压下,气体的密度与空气的密度大小。
阿伏加德罗定律的推论
条件 结论
公式 语言叙述
同温同压 同温同压下,体积比等于物质的量之比,等于分子数之比
T、p相同 同温、同压下,气体的密度与其相对分子质量(或摩尔质量)成正比
同温同容 同温同容下,压强比等于物质的量之比
1、同温同压下,两种气体A和B的体积之比为 2 : 1,质量之比为 8 : 5,则A与B的密度之比为 ,摩尔质量之比为 。
4 : 5
4 : 5
ρ1
ρ2
=
m1 /V1
m2 /V2
ρ1
ρ2
=
M1
M2
2、同温同压下,同体积的氨和硫化氢气体的质量比是 ;同质量的氨和硫化氢气体的体积比是 ;同质量的氨和硫化氢气体中所含氢原子个数比是 ;若两者所含氢原子个数相等,它们的物质的量之比是 。
m1
m2
=
M1
M2
M(NH3):17 g/mol
M(H2S):34 g/mol
1 : 2
V1
V2
=
m1 /M1
m2 /M2
=
M2
M1
2 : 1
N1
N2
=
3n(NH3)
2n(H2S)
3 : 1
2 : 3
课堂总结
