苏教版高中化学必修第一册专题5微观结构与物质的多样性5.2.1离子键教学课件(共11张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题5微观结构与物质的多样性5.2.1离子键教学课件(共11张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 743.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 10:47:52 | ||
图片预览




文档简介
(共11张PPT)
新苏教版必修第一册
5.2.1离子键
温故知新
1、世界是由丰富多彩的物质构成的,那么这些物质是由哪些微粒组成的?微粒间存在什么作用力?微粒间的相互作用具有什么特点?为什么我们看到的物质外在形态和功能有所差异呢?
2、食盐的主要成分是氯化钠,氯化钠的构成微粒是什么,微粒间的作用力有什么特点?
构成物质的基本微粒:原子、分子、离子。
例如:氯化钠、氧化镁是由Na+、Cl-构成的,氯气是由许多氯分子聚集而成的,每个氯分子是由两个氯原子结合而成的,金刚石是由许多碳原子彼此结合形成的。
食盐
一、化学键
1、定义:
物质中直接相邻的原子或离子之间存在的强烈的相互作用。
2、分类:
离子键和共价键
思考:
NaCl是由Na+、Cl-构成的,那么Na+、Cl-怎样形成的?Na+、Cl-怎样是怎样结合的?
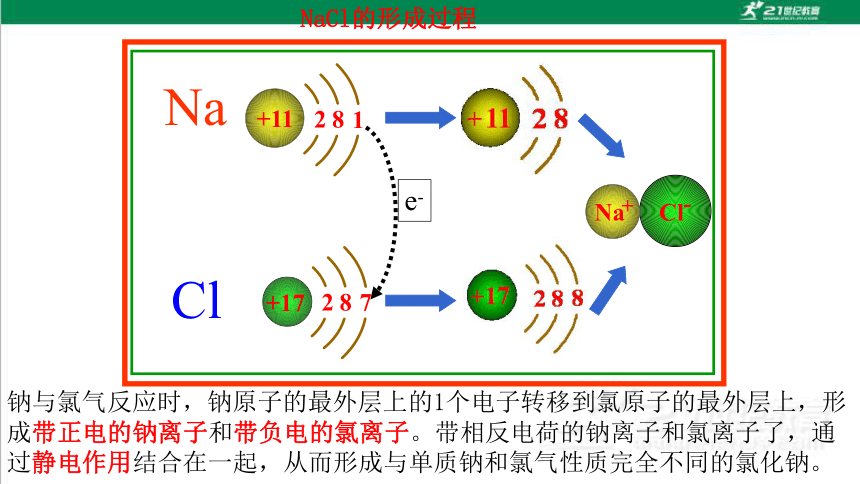
NaCl的形成过程
e-
Na
Cl
钠与氯气反应时,钠原子的最外层上的1个电子转移到氯原子的最外层上,形成带正电的钠离子和带负电的氯离子。带相反电荷的钠离子和氯离子了,通过静电作用结合在一起,从而形成与单质钠和氯气性质完全不同的氯化钠。
离子键
1、定义:______________________________________________________
2、构成微粒:___________________
阴离子和阳离子
3、离子键的实质:_________________
静电作用
静电作用,包括静电引力和静电斥力两个方面。当阴、阳离子相距较远时,相互间的引力起主导作用;而当其距离靠近时,斥力逐渐增大,直至距离缩短到一定的程度,静电斥力与静电引力达到平衡,形成了离子键,也就形成了稳定的离子化合物。
4、离子键的存在:
(1)活泼金属与活泼非金属间形成离子键。如:CaO、Na2O、MgCl2
(2)少数非金属间也能形成离子键。如:NH4Cl、NH4NO3
阴、阳离子之间存在的强烈的相互作用
离子化合物
1、定义:
由离子键构成的化合物
2、构成微粒:
阴、阳离子
思考1:怎样判断一种化合物是离子化合物呢?
3、常见离子化合物
(1)大多数盐:如NaCl、KNO3、CaCO3、MgCl2等
(2)强碱:如KOH、NaOH、 Ba(OH)2等
(3)活泼金属氧化物:Na2O、CaO等
思考2:怎样表示离子化合物的形成呢?
通常我们用电子式来表示原子、离子的最外层电子的排布,离子化合物的组成。
电子式
1、定义:
在元素符号的周围用“·”或“×”来表示原子的最外层电子。
2、电子式书写
(1)原子电子式书写:
(2)离子电子式书写:
①简单阳离子:离子符号本身。如:Na+、Mg2+、Al3+、Ca2+
②多核阳离子用[ ]并在右上角注明电荷数和电性。如:
③阴离子:
(3)离子化合物的电子式书写
注意:相同离子不能合并。
3、用电子式表示离子化合物的形成
电子式
原子的电子式
化合物的电子式
+原子的电子式
(1)氯化钠的形成过程
(2)氯化镁的形成过程
(3)氧化钠的形成过程
相同离子不合并
活泼金属原子
活泼非金属原子
失去电子
得到电子
阳离子
阴离子
静电作用
离 子 键
离子化合物
用电子式表示
课堂总结
课堂检测
判断
1.相邻的两个原子之间强烈的相互作用叫做化学键。( )
2.离子键的实质是阴离子、阳离子之间的静电作用。( )
3.活泼金属与活泼非金属化合时易形成离子键。( )
4.构成离子键的粒子是阳离子和阴离子。( )
5.含有离子键的化合物都是离子化合物。( )
6.酸、碱、盐、氧化物都是离子化合物。( )
√
×
√
√
√
×
下列物质中含有离子键的是 ;下列物质属于离子化合物的是 。
A. Na2O B. H2O C. MgCl2 D. NH3 E. HCl F. MgO
A C F
A C F
课堂检测
新苏教版必修第一册
5.2.1离子键
温故知新
1、世界是由丰富多彩的物质构成的,那么这些物质是由哪些微粒组成的?微粒间存在什么作用力?微粒间的相互作用具有什么特点?为什么我们看到的物质外在形态和功能有所差异呢?
2、食盐的主要成分是氯化钠,氯化钠的构成微粒是什么,微粒间的作用力有什么特点?
构成物质的基本微粒:原子、分子、离子。
例如:氯化钠、氧化镁是由Na+、Cl-构成的,氯气是由许多氯分子聚集而成的,每个氯分子是由两个氯原子结合而成的,金刚石是由许多碳原子彼此结合形成的。
食盐
一、化学键
1、定义:
物质中直接相邻的原子或离子之间存在的强烈的相互作用。
2、分类:
离子键和共价键
思考:
NaCl是由Na+、Cl-构成的,那么Na+、Cl-怎样形成的?Na+、Cl-怎样是怎样结合的?
NaCl的形成过程
e-
Na
Cl
钠与氯气反应时,钠原子的最外层上的1个电子转移到氯原子的最外层上,形成带正电的钠离子和带负电的氯离子。带相反电荷的钠离子和氯离子了,通过静电作用结合在一起,从而形成与单质钠和氯气性质完全不同的氯化钠。
离子键
1、定义:______________________________________________________
2、构成微粒:___________________
阴离子和阳离子
3、离子键的实质:_________________
静电作用
静电作用,包括静电引力和静电斥力两个方面。当阴、阳离子相距较远时,相互间的引力起主导作用;而当其距离靠近时,斥力逐渐增大,直至距离缩短到一定的程度,静电斥力与静电引力达到平衡,形成了离子键,也就形成了稳定的离子化合物。
4、离子键的存在:
(1)活泼金属与活泼非金属间形成离子键。如:CaO、Na2O、MgCl2
(2)少数非金属间也能形成离子键。如:NH4Cl、NH4NO3
阴、阳离子之间存在的强烈的相互作用
离子化合物
1、定义:
由离子键构成的化合物
2、构成微粒:
阴、阳离子
思考1:怎样判断一种化合物是离子化合物呢?
3、常见离子化合物
(1)大多数盐:如NaCl、KNO3、CaCO3、MgCl2等
(2)强碱:如KOH、NaOH、 Ba(OH)2等
(3)活泼金属氧化物:Na2O、CaO等
思考2:怎样表示离子化合物的形成呢?
通常我们用电子式来表示原子、离子的最外层电子的排布,离子化合物的组成。
电子式
1、定义:
在元素符号的周围用“·”或“×”来表示原子的最外层电子。
2、电子式书写
(1)原子电子式书写:
(2)离子电子式书写:
①简单阳离子:离子符号本身。如:Na+、Mg2+、Al3+、Ca2+
②多核阳离子用[ ]并在右上角注明电荷数和电性。如:
③阴离子:
(3)离子化合物的电子式书写
注意:相同离子不能合并。
3、用电子式表示离子化合物的形成
电子式
原子的电子式
化合物的电子式
+原子的电子式
(1)氯化钠的形成过程
(2)氯化镁的形成过程
(3)氧化钠的形成过程
相同离子不合并
活泼金属原子
活泼非金属原子
失去电子
得到电子
阳离子
阴离子
静电作用
离 子 键
离子化合物
用电子式表示
课堂总结
课堂检测
判断
1.相邻的两个原子之间强烈的相互作用叫做化学键。( )
2.离子键的实质是阴离子、阳离子之间的静电作用。( )
3.活泼金属与活泼非金属化合时易形成离子键。( )
4.构成离子键的粒子是阳离子和阴离子。( )
5.含有离子键的化合物都是离子化合物。( )
6.酸、碱、盐、氧化物都是离子化合物。( )
√
×
√
√
√
×
下列物质中含有离子键的是 ;下列物质属于离子化合物的是 。
A. Na2O B. H2O C. MgCl2 D. NH3 E. HCl F. MgO
A C F
A C F
课堂检测
