苏教版高中化学必修第一册专题5微观结构与物质的多样性5.2.2共价键分子间作用力教学课件(共21张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题5微观结构与物质的多样性5.2.2共价键分子间作用力教学课件(共21张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1010.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 10:48:54 | ||
图片预览





文档简介
(共21张PPT)
专题5 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
第2课时 共价键 分子间作用力
学习目标
知道共价键的概念和实质。
2. 学会用电子式表示共价分子的形成过程,用结构式表示简单的共价分子结构。
3. 知道分子间作用力与物质性质的关系。
4.知道共价分子的空间结构可用球棍模型和空间填充模型表示
1. 离子键的定义?
2. 构成离子键的微粒
3,常见的离子化合物
直接相邻的阴、阳离子间强烈的相互作用。
含金属元素(或NH 4+ )的化合物
知识回顾
阴阳离子
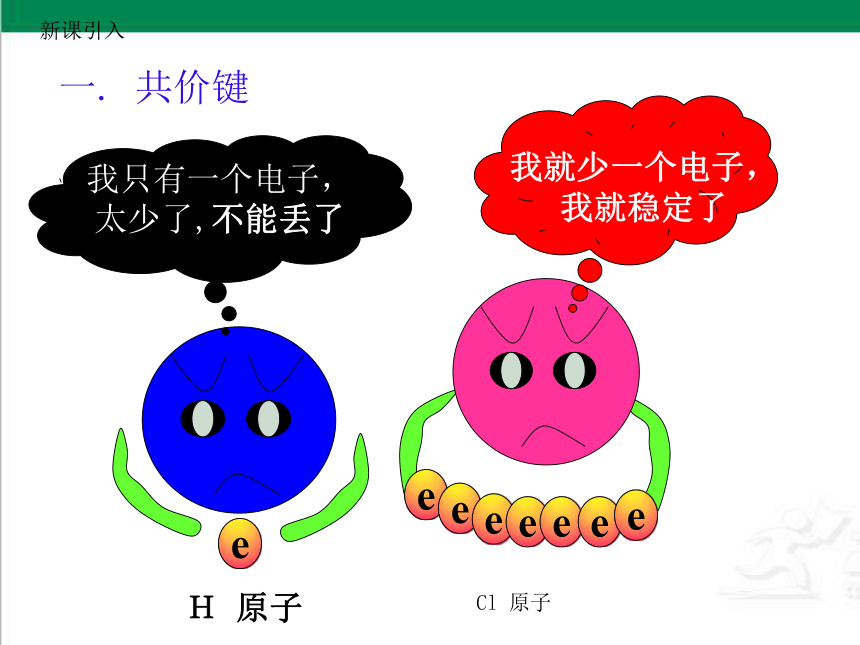
我只有一个电子,太少了,不能丢了
我就少一个电子,我就稳定了
e
H 原子
Cl 原子
e
e
e
e
e
e
e
新课引入
一. 共价键
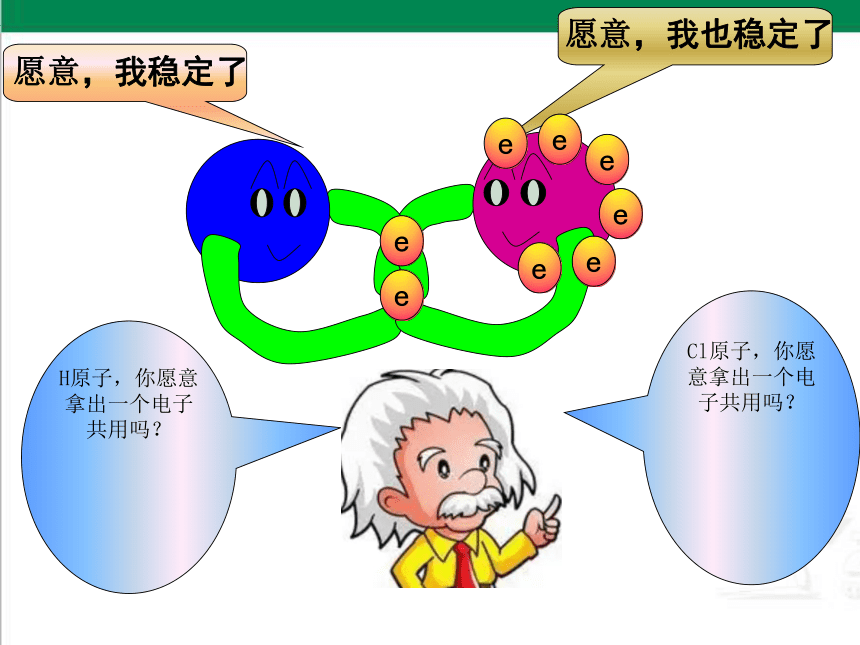
二位好!我有一个好办法.你们每人拿出一个电子共用,就象分享快乐一样共同拥有,不就可以了吗
e
好
呀
好
呀
e
e
e
e
e
e
e
愿意,我稳定了
愿意,我也稳定了
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
e
e
e
e
e
e
e
e
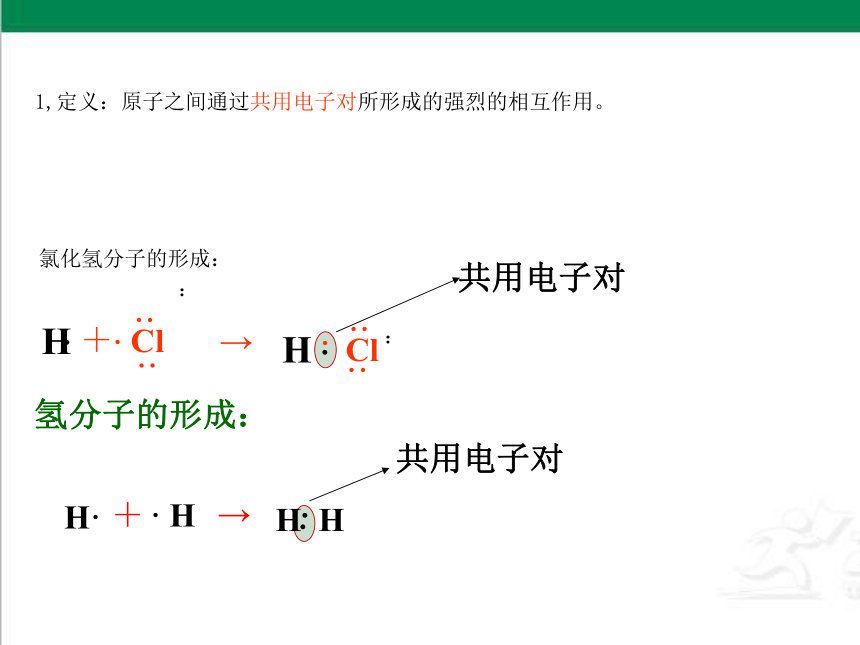
共用电子对
共用电子对
氢分子的形成:
H·
氯化氢分子的形成:
· H
+
→
+
→
1,定义:原子之间通过共用电子对所形成的强烈的相互作用。
·
H
··
Cl
··
:
·
··
Cl
··
:
·
·
H
H H
·
·
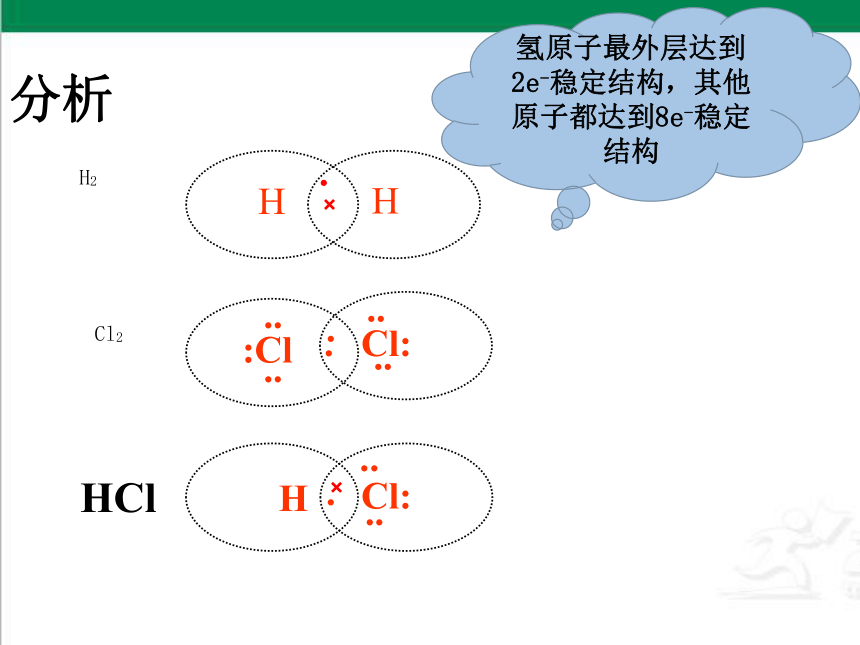
分析
H
H
.
H2
HCl
H
Cl:
..
..
.
Cl2
Cl:
..
..
.
:Cl
..
..
.
氢原子最外层达到2e-稳定结构,其他原子都达到8e-稳定结构
2,成键微粒:非金属原子
3,成键本质:共用电子对
4,成键规律:一般同种或不同种非金属元素之间
特殊:AlCl3、BeCl2
只有非金属间才能形成共价键?
二、共价分子
1,定义:原子间均以共价键结合的分子。
(只含有共价键的分子)
注意:稀有气体分子内无化学键
2,分类:分为共价单质和共价化合物
3,注意:(1)共价分子中只有共价键
(2)某些离子化合物(NaOH、 NH4Cl)也 含有共价键
比 较 离子键 共价键
成键元素
成键微粒
成键本质
键的存在
非金属元素之间
活泼金属与活泼非金属元素之间
阳,阴离子
原子 ~原子
静电作用
共用电子对
活动:比较离子键和共价键
离子化合物
共价分子,也可能存在离子化合物
常见共价分子的电子式
..
:Cl
..
:
..
Cl
..
:
..
H Cl
..
..
..
H H
..
N N
..
..
..
..
..
定义:用一条短线来表示原子间的一对共用电子对,省略其余的电子。
H-H
Cl-Cl
O=C=O
N N
三,结构式:
..
..
O C O
..
..
..
..
..
..
注意:只有共价分子才有结构式
H-Cl
共价分子中各原子有一定的连接方式,分子有一定的空间结构,可用球棍模型和空间填充模型来表示
四,共价分子的空间结构
碳原子之间的连接
观察思考
有机物种类繁多的原因之一
思考:干冰升华、水汽化时分子中的共价键被破坏了吗?为什么要吸热?从微观结构看改变了什么?
干冰升华
水的汽化
五. 分子间作用力
干冰升华,水的汽化过程中没有新物质生成,分子间的共价键也就没有破环,变化的只是分子间的距离
①存在:分子之间
1. 概念:
②作用力大小:比化学键弱得多。
2. 特点:
分子间存在着将分子聚集在一起的作用力称为分子间作用力。又称为范德华力或范德瓦耳斯力。
③影响由分子构成的物质的熔、沸点和溶解性等 物理性质。
分子间作用力越大,由分子构成的物质的熔、沸点越 ,溶解度越 。
高
小
3.化学键与分子间作用力的比较
化学键 范德华力
概 念
存在范围
作用力强弱
影响的性质
相邻的原子、离子间强烈的相互作用
把分子聚集在一起的作用力
离子间、 分子内原子之间
分子之间
强 烈
与化学键相比弱得多
主要影响化学性质
主要影响物理性质
1. 判断下列化合物的类型。
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物
当堂检测
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
2. 写出下列物质的电子式,并指出化合物的类型。
H2O2 HClO
NaOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
H O O
H
H-O-O-H
H-O-Cl
3. 某元素的原子最外层电子只有一个,它跟VIIA元
素化合时,可形成的化学键是( )
A.一定是离子键
B.一定是共价键
C.可能是离子键,也可能是共价键
D.上述说法都不正确
C
4. 判断物质 ①氩气②氯气 ③液溴 ④液态水⑤氯化镁固
体⑥金刚石⑦金属铁中微粒之间的作用力的类型:
(填序号)
(1)存在共价键的是 。
(2)存在离子键的是 。
(3)存在分子间作用力的是 。
②③④⑥
⑤
①②③④
专题5 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
第2课时 共价键 分子间作用力
学习目标
知道共价键的概念和实质。
2. 学会用电子式表示共价分子的形成过程,用结构式表示简单的共价分子结构。
3. 知道分子间作用力与物质性质的关系。
4.知道共价分子的空间结构可用球棍模型和空间填充模型表示
1. 离子键的定义?
2. 构成离子键的微粒
3,常见的离子化合物
直接相邻的阴、阳离子间强烈的相互作用。
含金属元素(或NH 4+ )的化合物
知识回顾
阴阳离子
我只有一个电子,太少了,不能丢了
我就少一个电子,我就稳定了
e
H 原子
Cl 原子
e
e
e
e
e
e
e
新课引入
一. 共价键
二位好!我有一个好办法.你们每人拿出一个电子共用,就象分享快乐一样共同拥有,不就可以了吗
e
好
呀
好
呀
e
e
e
e
e
e
e
愿意,我稳定了
愿意,我也稳定了
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
e
e
e
e
e
e
e
e
共用电子对
共用电子对
氢分子的形成:
H·
氯化氢分子的形成:
· H
+
→
+
→
1,定义:原子之间通过共用电子对所形成的强烈的相互作用。
·
H
··
Cl
··
:
·
··
Cl
··
:
·
·
H
H H
·
·
分析
H
H
.
H2
HCl
H
Cl:
..
..
.
Cl2
Cl:
..
..
.
:Cl
..
..
.
氢原子最外层达到2e-稳定结构,其他原子都达到8e-稳定结构
2,成键微粒:非金属原子
3,成键本质:共用电子对
4,成键规律:一般同种或不同种非金属元素之间
特殊:AlCl3、BeCl2
只有非金属间才能形成共价键?
二、共价分子
1,定义:原子间均以共价键结合的分子。
(只含有共价键的分子)
注意:稀有气体分子内无化学键
2,分类:分为共价单质和共价化合物
3,注意:(1)共价分子中只有共价键
(2)某些离子化合物(NaOH、 NH4Cl)也 含有共价键
比 较 离子键 共价键
成键元素
成键微粒
成键本质
键的存在
非金属元素之间
活泼金属与活泼非金属元素之间
阳,阴离子
原子 ~原子
静电作用
共用电子对
活动:比较离子键和共价键
离子化合物
共价分子,也可能存在离子化合物
常见共价分子的电子式
..
:Cl
..
:
..
Cl
..
:
..
H Cl
..
..
..
H H
..
N N
..
..
..
..
..
定义:用一条短线来表示原子间的一对共用电子对,省略其余的电子。
H-H
Cl-Cl
O=C=O
N N
三,结构式:
..
..
O C O
..
..
..
..
..
..
注意:只有共价分子才有结构式
H-Cl
共价分子中各原子有一定的连接方式,分子有一定的空间结构,可用球棍模型和空间填充模型来表示
四,共价分子的空间结构
碳原子之间的连接
观察思考
有机物种类繁多的原因之一
思考:干冰升华、水汽化时分子中的共价键被破坏了吗?为什么要吸热?从微观结构看改变了什么?
干冰升华
水的汽化
五. 分子间作用力
干冰升华,水的汽化过程中没有新物质生成,分子间的共价键也就没有破环,变化的只是分子间的距离
①存在:分子之间
1. 概念:
②作用力大小:比化学键弱得多。
2. 特点:
分子间存在着将分子聚集在一起的作用力称为分子间作用力。又称为范德华力或范德瓦耳斯力。
③影响由分子构成的物质的熔、沸点和溶解性等 物理性质。
分子间作用力越大,由分子构成的物质的熔、沸点越 ,溶解度越 。
高
小
3.化学键与分子间作用力的比较
化学键 范德华力
概 念
存在范围
作用力强弱
影响的性质
相邻的原子、离子间强烈的相互作用
把分子聚集在一起的作用力
离子间、 分子内原子之间
分子之间
强 烈
与化学键相比弱得多
主要影响化学性质
主要影响物理性质
1. 判断下列化合物的类型。
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物
当堂检测
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
2. 写出下列物质的电子式,并指出化合物的类型。
H2O2 HClO
NaOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
H O O
H
H-O-O-H
H-O-Cl
3. 某元素的原子最外层电子只有一个,它跟VIIA元
素化合时,可形成的化学键是( )
A.一定是离子键
B.一定是共价键
C.可能是离子键,也可能是共价键
D.上述说法都不正确
C
4. 判断物质 ①氩气②氯气 ③液溴 ④液态水⑤氯化镁固
体⑥金刚石⑦金属铁中微粒之间的作用力的类型:
(填序号)
(1)存在共价键的是 。
(2)存在离子键的是 。
(3)存在分子间作用力的是 。
②③④⑥
⑤
①②③④
