苏教版高中化学必修第一册专题1物质的分类及计量1.1.1物质的分类及转化课件(22张)
文档属性
| 名称 | 苏教版高中化学必修第一册专题1物质的分类及计量1.1.1物质的分类及转化课件(22张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 862.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 13:18:28 | ||
图片预览








文档简介
(共22张PPT)
专题1 物质的分类及计量
第一单元 物质及其反应的分类
第一课时 物质的分类及转化
*
学习目标
根据物质的组成和性质进行分类,
培养宏观辨识与微观探析的意志和能力
1
熟知酸碱盐氧化物等化合物的分类,
建立区分常见物质的思维模型
2
熟知物质之间转化的类型,并同时掌握
物质之间转化需要的条件
3
*
新课导入
?思考:将教室里的所有同学进行分类
性别
年龄
身高
……
*
交流与讨论——请将下列物质进行分类,并说明分类的依据
空气、乙醇(C2H5OH) 、水、硫酸铵、铜、碘酒、碘(I2)、
氧气、石墨、食盐水、硫酸、二氧化硫、氧化铜、氢氧化铁
存在状态
导电性
溶解性
气体
液体
固体
导体
半导体
绝缘体
可溶性
微溶性
难溶性
空气
氧气
二氧化硫
乙醇
水
碘酒
食盐水
硫酸
硫酸铵
铜
碘
石墨
……
铜
石墨
食盐水
……
空气
乙醇
碘酒
……
乙醇
硫酸铵
……
碘
氧气
氢氧化钙
……
铜
石墨
氧化铜
碘
*
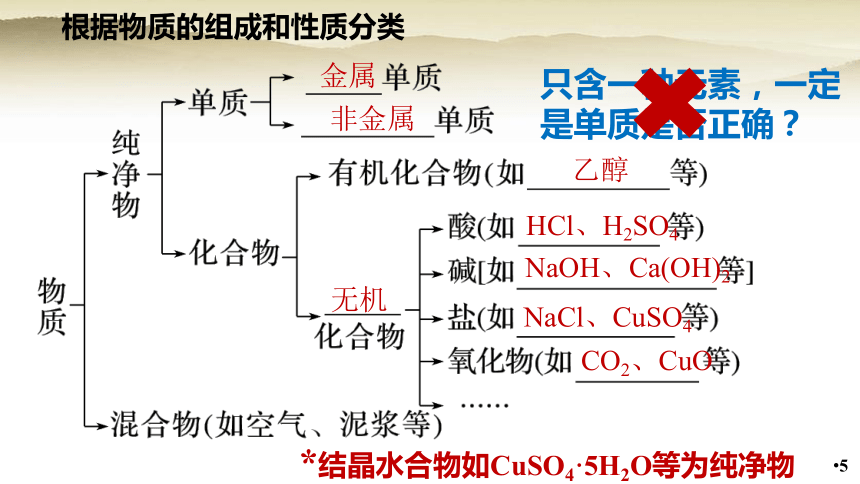
根据物质的组成和性质分类
金属
非金属
乙醇
HCl、H2SO4
NaOH、Ca(OH)2
NaCl、CuSO4
CO2、CuO
无机
只含一种元素,一定是单质是否正确?
*结晶水合物如CuSO4·5H2O等为纯净物
*
混合物:由两种或两种以上的物质组成
纯净物:由一种物质组成
单质:由同种元素组成的纯净物
化合物:由不同种元素组成的纯净物
根据物质的组成和性质分类
*
碱
盐
水
酸
盐
水
根据物质的组成和性质分类
氧化物:由氧元素与另一种元素组成的化合物
*
①与碱反应
②与碱性氧化物
③与水反应
①与酸反应
②与酸性氧化物反应
③与水反应
酸性氧化物
CO2
碱性氧化物
CaO
根据物质的组成和性质分类
CO2+Ca(OH)2===CaCO3+H2O
CO2+CaO===CaCO3
CO2+H2O===H2CO3
CaO+H2CO3===CaCO3+H2O
CaO+CO2===CaCO3
CaO+H2O===Ca(OH)2
*酸性氧化物不一定能与水反应生成酸,如SiO2不溶于水
*碱性氧化物不一定能与水反应生成碱,如Fe2O3是碱性氧化物,但它不能与水反应。
*
随堂练习
根据物质的分类,同类物质化学性质相似。CO2与SO2均为酸性氧化物,请写出SO2与①足量NaOH、②少量NaOH、③NaO、④H2O反应的化学方程式。
提示 ①SO2+2NaOH===Na2SO3+H2O
②SO2+NaOH===NaHSO3
③SO2+Na2O===Na2SO3
④SO2+H2O===H2SO3
*
观察不同氧化物之间的关系图,分析酸(或碱)性氧化物与非金属(或金属)氧化物的关系
根据物质的组成和性质分类
碱性氧化物都是金属氧化物
金属氧化物不一定都是碱性氧化物,如Mn2O7为酸性氧化物
酸性氧化物不一定都是非金属氧化物,如Mn2O7
非金属氧化物也不一定都是酸性氧化物,如CO、NO、H2O等
*
酸
无氧酸
难挥发性酸
挥发性酸
挥发性
H2SO4、HNO3、H2CO3
HCl、H2S
HNO3、HCl
H2SO4
含氧酸
产生出H+的个数
一元酸 HCl
二元酸 H2SO4 H2S
三元酸 H3PO4
CH3COOH
是否含氧
根据物质的组成和性质分类
酸:产生的阳离子都是氢离子的化合物
*
根据物质的组成和性质分类
碱
溶解性
产生OH-个数
难溶碱
可溶碱
NaOH、KOH、Ba(OH)2、NH3·H2O
Cu(OH)2、Mg(OH)2、Fe(OH) 3
Cu(OH)2、Mg(OH)2
微溶碱
Ca(OH) 2
一元碱
二元碱
三元碱
NaOH、KOH
Fe(OH) 3
碱:产生的阴离子都是氢氧根离子的化合物
*
根据物质的组成和性质分类
盐
溶解性
无氧酸盐
按酸根是否含氧分
含氧酸盐
可溶盐
难溶盐
KNO3、KMnO4、FeSO4
NaCl、KF、CaCl2
按是否产生H+、OH-
微溶盐
碱式盐 Cu2(OH)2CO3
酸式盐 NaHCO3
正盐 Na2CO3
盐:由金属阳离子(NH4+)与酸根离子形成的化合物
碳酸只溶钾钠铵,溶碱钾钠氨钙钡
硫酸不溶钙钡银,盐酸不溶氯化银
*
正误判断
(1)Fe2O3与HNO3均属于氧化物
(2)Na2CO3俗称纯碱,它属于碱
(3)只由一种元素组成的物质一定是纯净物
(4)CaCO3既属于难溶性物质,又属于盐
(5)金属氧化物一定是碱性氧化物
(6)NaHCO3属于盐中的酸式盐
课堂练习
×
√
×
×
×
√
*
物质的转化
1.不同类别物质间的转化
(1)在初中阶段,我们已经学习了一些物质转化的知识。请以碳、钙两种元素的单质和化合物的转化关系为例,按要求填写下表。
*
物质的转化反应 实例(化学方程式,标注必要的反应条件)
单质→化合物
碱性氧化物→碱
酸性氧化物→酸
酸→盐
碱→盐
碱性氧化物→盐
酸性氧化物→盐
盐→盐
盐→氧化物
CaO+H2O===Ca(OH)2
CO2+H2O===H2CO3
H2CO3+Ca(OH)2===CaCO3↓+2H2O
Ca(OH)2+CO2===CaCO3↓+H2O
CaO+CO2===CaCO3
2Ca+O2===2CaO、C+O2 === CO2
物质的转化
CO2+Ca(OH)2===CaCO3↓+H2O
CaCO3+2HCl===CaCl2+CO2↑+H2O
点燃
CaCO3===CaO+CO2↑
高温
*
(2)物质间的转化总结
物质的转化
*
2.物质转化的条件
(1)复分解反应的条件
通常有 、 或有 等物质生成,如MgCl2溶液与NaOH溶液反应: 。
(2)酸性氧化物与碱性氧化物可以发生化合反应,如 。
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
CaO+CO2===CaCO3
物质的转化
沉淀
气体
水
*
(3)置换反应发生的条件
金属活动性顺序表中,排在前面的金属可以置换出排在后面的金属(或H+)。如Fe置换Cu的化学方程式: ;锌粒与稀硫酸反应的化学方程式: 。
Fe+CuSO4===FeSO4+Cu
Zn+H2SO4===ZnSO4+H2↑
物质的转化
*
(4)无机化合物与有机化合物在一定条件下可以相互转化
①无机化合物转化为有机化合物
1828年,德国化学家 用氰酸铵(NH4CNO)合成了 ,打破了无机物与有机物之间不可转化的观念,揭开了人工合成有机化合物的序幕。
②有机化合物转化为无机化合物
例如:甲烷燃烧生成CO2和H2O;葡萄糖(C6H12O6)在动物体内经缓慢氧化转化为CO2和H2O等。
维勒
尿素[CO(NH2)2]
物质的转化
*
物质的转化
1.正误判断
(1)可用Fe2O3与H2O反应制取Fe(OH)3
(2)只有利用酸碱中和反应才能生成盐
(3)非金属单质与O2反应一定得到酸性氧化物
(4)酸性氧化物都能与水化合生成酸
(5)常见的酸性氧化物与碱性氧化物可以发生化合反应,生成盐类物质
√
×
×
×
×
*
物质的转化
2.盐是一类常见的物质,下列物质通过一步反应可直接生成盐的是
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥
C.②⑤⑥ D.全部
√
专题1 物质的分类及计量
第一单元 物质及其反应的分类
第一课时 物质的分类及转化
*
学习目标
根据物质的组成和性质进行分类,
培养宏观辨识与微观探析的意志和能力
1
熟知酸碱盐氧化物等化合物的分类,
建立区分常见物质的思维模型
2
熟知物质之间转化的类型,并同时掌握
物质之间转化需要的条件
3
*
新课导入
?思考:将教室里的所有同学进行分类
性别
年龄
身高
……
*
交流与讨论——请将下列物质进行分类,并说明分类的依据
空气、乙醇(C2H5OH) 、水、硫酸铵、铜、碘酒、碘(I2)、
氧气、石墨、食盐水、硫酸、二氧化硫、氧化铜、氢氧化铁
存在状态
导电性
溶解性
气体
液体
固体
导体
半导体
绝缘体
可溶性
微溶性
难溶性
空气
氧气
二氧化硫
乙醇
水
碘酒
食盐水
硫酸
硫酸铵
铜
碘
石墨
……
铜
石墨
食盐水
……
空气
乙醇
碘酒
……
乙醇
硫酸铵
……
碘
氧气
氢氧化钙
……
铜
石墨
氧化铜
碘
*
根据物质的组成和性质分类
金属
非金属
乙醇
HCl、H2SO4
NaOH、Ca(OH)2
NaCl、CuSO4
CO2、CuO
无机
只含一种元素,一定是单质是否正确?
*结晶水合物如CuSO4·5H2O等为纯净物
*
混合物:由两种或两种以上的物质组成
纯净物:由一种物质组成
单质:由同种元素组成的纯净物
化合物:由不同种元素组成的纯净物
根据物质的组成和性质分类
*
碱
盐
水
酸
盐
水
根据物质的组成和性质分类
氧化物:由氧元素与另一种元素组成的化合物
*
①与碱反应
②与碱性氧化物
③与水反应
①与酸反应
②与酸性氧化物反应
③与水反应
酸性氧化物
CO2
碱性氧化物
CaO
根据物质的组成和性质分类
CO2+Ca(OH)2===CaCO3+H2O
CO2+CaO===CaCO3
CO2+H2O===H2CO3
CaO+H2CO3===CaCO3+H2O
CaO+CO2===CaCO3
CaO+H2O===Ca(OH)2
*酸性氧化物不一定能与水反应生成酸,如SiO2不溶于水
*碱性氧化物不一定能与水反应生成碱,如Fe2O3是碱性氧化物,但它不能与水反应。
*
随堂练习
根据物质的分类,同类物质化学性质相似。CO2与SO2均为酸性氧化物,请写出SO2与①足量NaOH、②少量NaOH、③NaO、④H2O反应的化学方程式。
提示 ①SO2+2NaOH===Na2SO3+H2O
②SO2+NaOH===NaHSO3
③SO2+Na2O===Na2SO3
④SO2+H2O===H2SO3
*
观察不同氧化物之间的关系图,分析酸(或碱)性氧化物与非金属(或金属)氧化物的关系
根据物质的组成和性质分类
碱性氧化物都是金属氧化物
金属氧化物不一定都是碱性氧化物,如Mn2O7为酸性氧化物
酸性氧化物不一定都是非金属氧化物,如Mn2O7
非金属氧化物也不一定都是酸性氧化物,如CO、NO、H2O等
*
酸
无氧酸
难挥发性酸
挥发性酸
挥发性
H2SO4、HNO3、H2CO3
HCl、H2S
HNO3、HCl
H2SO4
含氧酸
产生出H+的个数
一元酸 HCl
二元酸 H2SO4 H2S
三元酸 H3PO4
CH3COOH
是否含氧
根据物质的组成和性质分类
酸:产生的阳离子都是氢离子的化合物
*
根据物质的组成和性质分类
碱
溶解性
产生OH-个数
难溶碱
可溶碱
NaOH、KOH、Ba(OH)2、NH3·H2O
Cu(OH)2、Mg(OH)2、Fe(OH) 3
Cu(OH)2、Mg(OH)2
微溶碱
Ca(OH) 2
一元碱
二元碱
三元碱
NaOH、KOH
Fe(OH) 3
碱:产生的阴离子都是氢氧根离子的化合物
*
根据物质的组成和性质分类
盐
溶解性
无氧酸盐
按酸根是否含氧分
含氧酸盐
可溶盐
难溶盐
KNO3、KMnO4、FeSO4
NaCl、KF、CaCl2
按是否产生H+、OH-
微溶盐
碱式盐 Cu2(OH)2CO3
酸式盐 NaHCO3
正盐 Na2CO3
盐:由金属阳离子(NH4+)与酸根离子形成的化合物
碳酸只溶钾钠铵,溶碱钾钠氨钙钡
硫酸不溶钙钡银,盐酸不溶氯化银
*
正误判断
(1)Fe2O3与HNO3均属于氧化物
(2)Na2CO3俗称纯碱,它属于碱
(3)只由一种元素组成的物质一定是纯净物
(4)CaCO3既属于难溶性物质,又属于盐
(5)金属氧化物一定是碱性氧化物
(6)NaHCO3属于盐中的酸式盐
课堂练习
×
√
×
×
×
√
*
物质的转化
1.不同类别物质间的转化
(1)在初中阶段,我们已经学习了一些物质转化的知识。请以碳、钙两种元素的单质和化合物的转化关系为例,按要求填写下表。
*
物质的转化反应 实例(化学方程式,标注必要的反应条件)
单质→化合物
碱性氧化物→碱
酸性氧化物→酸
酸→盐
碱→盐
碱性氧化物→盐
酸性氧化物→盐
盐→盐
盐→氧化物
CaO+H2O===Ca(OH)2
CO2+H2O===H2CO3
H2CO3+Ca(OH)2===CaCO3↓+2H2O
Ca(OH)2+CO2===CaCO3↓+H2O
CaO+CO2===CaCO3
2Ca+O2===2CaO、C+O2 === CO2
物质的转化
CO2+Ca(OH)2===CaCO3↓+H2O
CaCO3+2HCl===CaCl2+CO2↑+H2O
点燃
CaCO3===CaO+CO2↑
高温
*
(2)物质间的转化总结
物质的转化
*
2.物质转化的条件
(1)复分解反应的条件
通常有 、 或有 等物质生成,如MgCl2溶液与NaOH溶液反应: 。
(2)酸性氧化物与碱性氧化物可以发生化合反应,如 。
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
CaO+CO2===CaCO3
物质的转化
沉淀
气体
水
*
(3)置换反应发生的条件
金属活动性顺序表中,排在前面的金属可以置换出排在后面的金属(或H+)。如Fe置换Cu的化学方程式: ;锌粒与稀硫酸反应的化学方程式: 。
Fe+CuSO4===FeSO4+Cu
Zn+H2SO4===ZnSO4+H2↑
物质的转化
*
(4)无机化合物与有机化合物在一定条件下可以相互转化
①无机化合物转化为有机化合物
1828年,德国化学家 用氰酸铵(NH4CNO)合成了 ,打破了无机物与有机物之间不可转化的观念,揭开了人工合成有机化合物的序幕。
②有机化合物转化为无机化合物
例如:甲烷燃烧生成CO2和H2O;葡萄糖(C6H12O6)在动物体内经缓慢氧化转化为CO2和H2O等。
维勒
尿素[CO(NH2)2]
物质的转化
*
物质的转化
1.正误判断
(1)可用Fe2O3与H2O反应制取Fe(OH)3
(2)只有利用酸碱中和反应才能生成盐
(3)非金属单质与O2反应一定得到酸性氧化物
(4)酸性氧化物都能与水化合生成酸
(5)常见的酸性氧化物与碱性氧化物可以发生化合反应,生成盐类物质
√
×
×
×
×
*
物质的转化
2.盐是一类常见的物质,下列物质通过一步反应可直接生成盐的是
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥
C.②⑤⑥ D.全部
√
