苏教版高中化学必修第一册专题1物质的分类及计量1.1.2化学反应的分类课件(11张)
文档属性
| 名称 | 苏教版高中化学必修第一册专题1物质的分类及计量1.1.2化学反应的分类课件(11张) |  | |
| 格式 | ppt | ||
| 文件大小 | 450.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 13:22:33 | ||
图片预览




文档简介
(共11张PPT)
专题1 物质的分类及计量
第一单元 物质及其反应的分类
第2课时 化学反应的分类
学习目标
1.四个基本反应类型的基本特征分析
2.通过阅读课本,从化合价的变化认识氧化还原反应的概念;
3.通过分析化合价变化认识氧化还原反应的特征;
4.培养学生用概念分析问题、解决问题的能力,培养学生归纳能力、推理能力。
反应物和生成物的类别以及反应前后物质种类的多少。
思考:初中学过的化学反应四种基本类型的分类依据是什么?怎么判断反应类型?
引入
分类依据:
反应类型:
化合反应、分解反应、置换反应、复分解反应
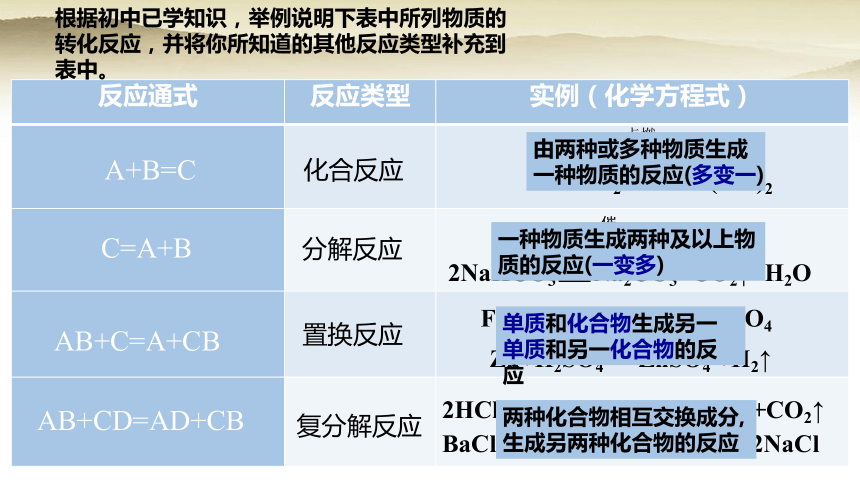
反应通式 反应类型 实例(化学方程式)
C+O2 CO2
点燃
CaO+H2O Ca(OH)2
2H2O2 2H2O+ O2 ↑
2NaHCO3 Na2CO3+CO2↑+H2O
Fe + CuSO4 Cu + FeSO4
Zn+H2SO4 ZnSO4 +H2↑
2HCl+CaCO3 CaCl2+H2O+CO2↑
BaCl2+Na2SO4 BaSO4 +2NaCl
催
A+B=C
C=A+B
AB+C=A+CB
AB+CD=AD+CB
化合反应
分解反应
置换反应
复分解反应
根据初中已学知识,举例说明下表中所列物质的转化反应,并将你所知道的其他反应类型补充到表中。
由两种或多种物质生成一种物质的反应(多变一)
一种物质生成两种及以上物质的反应(一变多)
单质和化合物生成另一单质和另一化合物的反应
两种化合物相互交换成分,生成另两种化合物的反应
判断下列反应能否发生:
1.Zn+HCl 2.Ag+HCl 3.Fe+H2SO4(稀) 4.Zn+CuSO4 5.Cu+ZnSO4
金属与盐溶液发生置换反应的条件:①前置后(K、Ca、Na不行)②H前面的金属遇盐酸或稀硫酸可置换出H2
整理与归纳
思考:请说明一种金属与另一种盐溶液发生置换反应的条件?
判断下列反应能否发生:
1.Na2CO3+HCl 2.NaOH+H2SO4
3.NaCl+K2CO3 4.CaCO3+NaCl
复分解反应发生的条件:①酸、碱、盐在溶液中反应
②生成物有气体、沉淀或水生成
整理与归纳
思考:请说明复分解反应发生的条件?
定义:凡是有元素化合价变化的化学反应叫做氧化还原反应
元素化合价不发生变化的反应称为非氧化还原反应。
根据化学反应中元素化合价是否发生变化,将化学反应又可分为氧化还原反应和非氧化还原反应。
有升必有降
氧化还原反应的特征:
化合价是否发生变化
评讲
+3
+4
0
+2
(1)CaO+H2O= Ca(OH)2
(7)Ca(OH)2 +2HCl = CaCl2+ 2H2O
化合反应
(8)Ca+2H2O= Ca(OH)2+H2↑
分解反应
复分解反应
置换反应
(3)Ca +Cl2= CaCl2
点燃
(4)CaCO3 = CaO+CO2 ↑
高温
(5) CaCl2= Ca +Cl2 ↑
通电
(6)Ca(OH)2+ CO2= CaCO3↓ +H2O
(2) 2Ca + O2 = 2CaO
思考:下列反应哪些属于氧化还原反应?
(9)Fe+CuSO4 = FeSO4+Cu
分析:
氧化还原反应与四种基本反应类型有什么关系?
置换反应一定是氧化还原反应。
化合反应一定是氧化还原反应。
分解反应一定是氧化还原反应。
复分解反应一定不是氧化还原反应。
错
错
对
对
化合反应
分解反应
氧化还原反应
置换反应
复分解反应
氧化还原反应和四大基本反应之间的关系
思考下列问题:
评讲
一价氢氯钾钠银 二价氧钙钡镁锌
三铝四硅五价磷 二三铁,二四碳
二四六硫都齐全 铜汞二价最常见
组成不同价不同 单质为零永不变
一些常见元素化合价口诀
一些常见原子团的化合价
负一硝酸氢氧根 负二硫酸碳酸根
负三记住磷酸根 正一价的是铵根
1.下列各类反应中,全部是氧化还原反应的是( )
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
反馈
C
2.下列反应中属于氧化还原反应,但反应类型不属于四个基本反应类型的是( )
A.Fe2O3+3H2SO4====Fe2(SO4)3+3H2O
B.CuO+H2
Cu+H2O
C.Fe2O3+3CO
D.H2+S H2S
2Fe+3CO2
C
专题1 物质的分类及计量
第一单元 物质及其反应的分类
第2课时 化学反应的分类
学习目标
1.四个基本反应类型的基本特征分析
2.通过阅读课本,从化合价的变化认识氧化还原反应的概念;
3.通过分析化合价变化认识氧化还原反应的特征;
4.培养学生用概念分析问题、解决问题的能力,培养学生归纳能力、推理能力。
反应物和生成物的类别以及反应前后物质种类的多少。
思考:初中学过的化学反应四种基本类型的分类依据是什么?怎么判断反应类型?
引入
分类依据:
反应类型:
化合反应、分解反应、置换反应、复分解反应
反应通式 反应类型 实例(化学方程式)
C+O2 CO2
点燃
CaO+H2O Ca(OH)2
2H2O2 2H2O+ O2 ↑
2NaHCO3 Na2CO3+CO2↑+H2O
Fe + CuSO4 Cu + FeSO4
Zn+H2SO4 ZnSO4 +H2↑
2HCl+CaCO3 CaCl2+H2O+CO2↑
BaCl2+Na2SO4 BaSO4 +2NaCl
催
A+B=C
C=A+B
AB+C=A+CB
AB+CD=AD+CB
化合反应
分解反应
置换反应
复分解反应
根据初中已学知识,举例说明下表中所列物质的转化反应,并将你所知道的其他反应类型补充到表中。
由两种或多种物质生成一种物质的反应(多变一)
一种物质生成两种及以上物质的反应(一变多)
单质和化合物生成另一单质和另一化合物的反应
两种化合物相互交换成分,生成另两种化合物的反应
判断下列反应能否发生:
1.Zn+HCl 2.Ag+HCl 3.Fe+H2SO4(稀) 4.Zn+CuSO4 5.Cu+ZnSO4
金属与盐溶液发生置换反应的条件:①前置后(K、Ca、Na不行)②H前面的金属遇盐酸或稀硫酸可置换出H2
整理与归纳
思考:请说明一种金属与另一种盐溶液发生置换反应的条件?
判断下列反应能否发生:
1.Na2CO3+HCl 2.NaOH+H2SO4
3.NaCl+K2CO3 4.CaCO3+NaCl
复分解反应发生的条件:①酸、碱、盐在溶液中反应
②生成物有气体、沉淀或水生成
整理与归纳
思考:请说明复分解反应发生的条件?
定义:凡是有元素化合价变化的化学反应叫做氧化还原反应
元素化合价不发生变化的反应称为非氧化还原反应。
根据化学反应中元素化合价是否发生变化,将化学反应又可分为氧化还原反应和非氧化还原反应。
有升必有降
氧化还原反应的特征:
化合价是否发生变化
评讲
+3
+4
0
+2
(1)CaO+H2O= Ca(OH)2
(7)Ca(OH)2 +2HCl = CaCl2+ 2H2O
化合反应
(8)Ca+2H2O= Ca(OH)2+H2↑
分解反应
复分解反应
置换反应
(3)Ca +Cl2= CaCl2
点燃
(4)CaCO3 = CaO+CO2 ↑
高温
(5) CaCl2= Ca +Cl2 ↑
通电
(6)Ca(OH)2+ CO2= CaCO3↓ +H2O
(2) 2Ca + O2 = 2CaO
思考:下列反应哪些属于氧化还原反应?
(9)Fe+CuSO4 = FeSO4+Cu
分析:
氧化还原反应与四种基本反应类型有什么关系?
置换反应一定是氧化还原反应。
化合反应一定是氧化还原反应。
分解反应一定是氧化还原反应。
复分解反应一定不是氧化还原反应。
错
错
对
对
化合反应
分解反应
氧化还原反应
置换反应
复分解反应
氧化还原反应和四大基本反应之间的关系
思考下列问题:
评讲
一价氢氯钾钠银 二价氧钙钡镁锌
三铝四硅五价磷 二三铁,二四碳
二四六硫都齐全 铜汞二价最常见
组成不同价不同 单质为零永不变
一些常见元素化合价口诀
一些常见原子团的化合价
负一硝酸氢氧根 负二硫酸碳酸根
负三记住磷酸根 正一价的是铵根
1.下列各类反应中,全部是氧化还原反应的是( )
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
反馈
C
2.下列反应中属于氧化还原反应,但反应类型不属于四个基本反应类型的是( )
A.Fe2O3+3H2SO4====Fe2(SO4)3+3H2O
B.CuO+H2
Cu+H2O
C.Fe2O3+3CO
D.H2+S H2S
2Fe+3CO2
C
