苏教版高中化学必修第一册专题1物质的分类及计量1.2.1物质的量课件(39张)
文档属性
| 名称 | 苏教版高中化学必修第一册专题1物质的分类及计量1.2.1物质的量课件(39张) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 13:28:00 | ||
图片预览







文档简介
(共39张PPT)
第二单元 物质的化学计量
专题1 物质的分类及计量
第1课时 物质的量
学习目标:
1.理解“物质的量”这个物理量及其单位-摩尔。
2.初步学会“物质的量、微粒数”之间的相互转化。
3.了解引进摩尔这一单位的重要性和必要性,懂得阿伏加德罗常数的涵义。
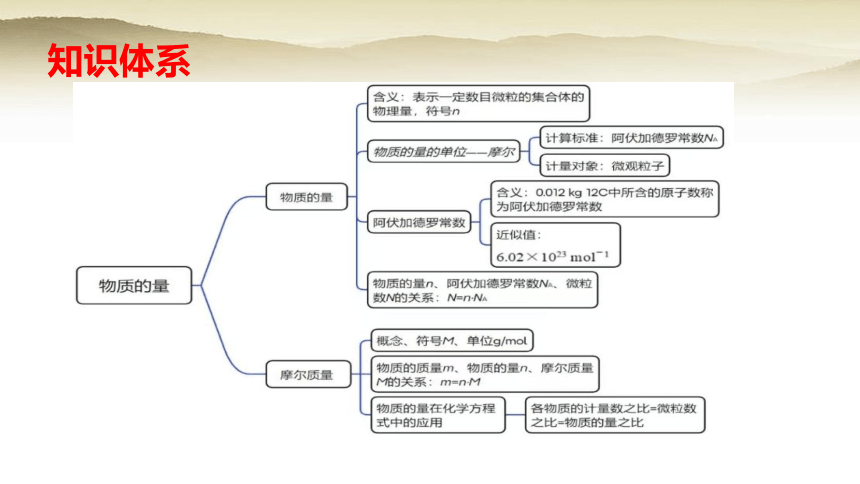
知识体系
新课引入
生命的源泉?
成年人每天需喝多少水?
相当于多少个水分子?
成年人平均2000 mL/天 相当于2 kg
水是由水分子构成的
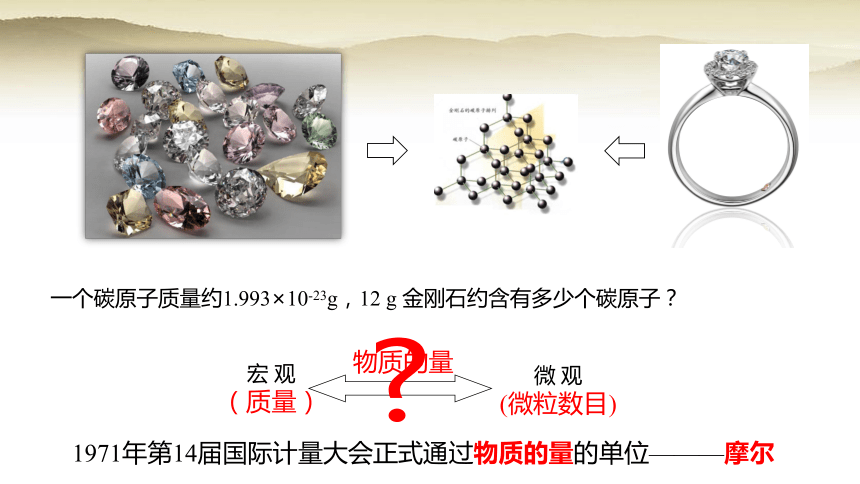
一个碳原子质量约1.993×10-23g,12 g 金刚石约含有多少个碳原子?
宏 观
(质量)
物质的量
微 观
(微粒数目)
1971年第14届国际计量大会正式通过物质的量的单位———摩尔
一、物质的量
n
1.含义:把物质的宏观量(m、V)与微观粒子数量联系起来的物理量,国际单位制中七个基本物理量之一,符号___;
2.单位:____(简称 __ 符号____)
摩尔
摩
mol
宏 观
(m、V)
微 观
(原子、分子、离子、质子、中子、电子)
物质的量
3表示方法:
如1 mol H指1 mol氢原子,1 mol H2指1 mol氢分子而不能指1 mol氢。
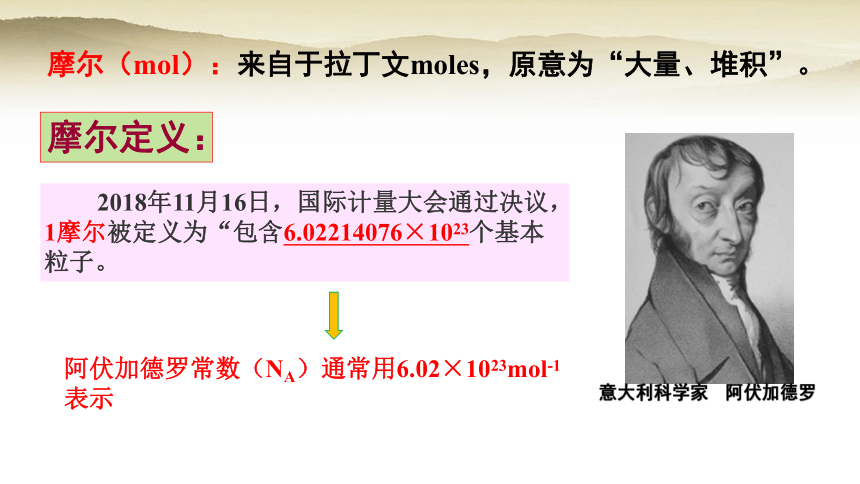
摩尔(mol):来自于拉丁文moles,原意为“大量、堆积”。
摩尔定义:
2018年11月16日,国际计量大会通过决议,1摩尔被定义为“包含6.02214076×1023个基本粒子。
阿伏加德罗常数(NA)通常用6.02×1023mol-1表示
意大利科学家 阿伏加德罗
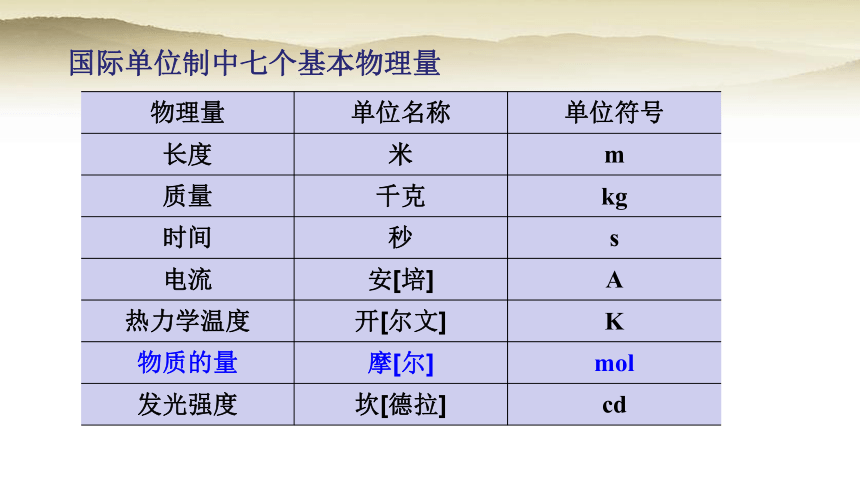
国际单位制中七个基本物理量
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
二、阿伏加德罗常数
1. 定义:0.012 kg 12C中所含碳原子数称为阿伏加德罗常数
2. 符号:NA,近似为 6.02×1023 mol-1
国际上规定,1 mol粒子集合体所含粒子数与0.012 kg 12C中所含碳原子数相同。
已知1个12C原子质量1.993×10-26 kg,0.012 kg12C中有多少个碳原子?
0.012 kg
1.993×10-26 kg
──────────
1 mol 任何粒子所含粒子数NA个,约6.02×1023个。
粒子:分子、原子、离子、质子、中子、电子等
≈ 6.02×1023
(1)1molNa中有 个钠原子
(2)2molNa中有 个钠原子
(3)0.5molH2中有多少个 氢气分子
(4)1.204×1024个水分子的物质的量__________mol
请同学们归纳n、N、NA三者关系
6.02×1023
3.01×1023
1.204×1024
2
2×6.02×1023
0.5×6.02×1023
N
n
NA
3.物质的量(n)、微粒数(N)、阿伏加德罗常数(NA)之间的关系
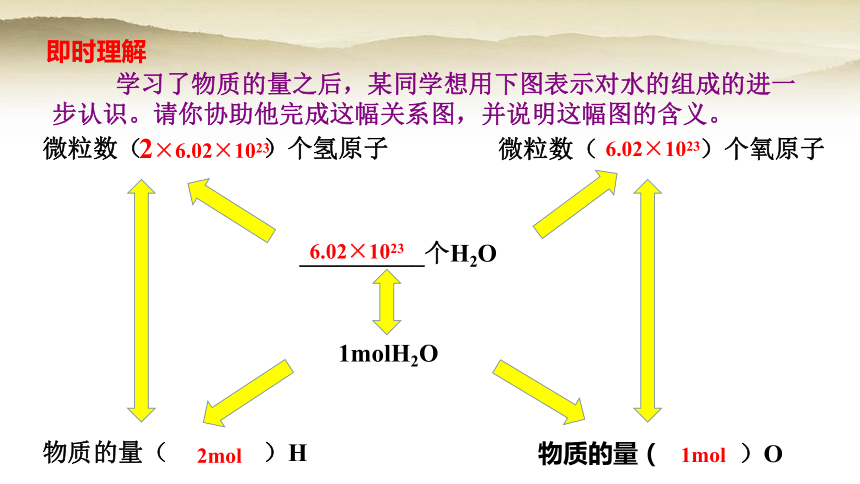
学习了物质的量之后,某同学想用下图表示对水的组成的进一步认识。请你协助他完成这幅关系图,并说明这幅图的含义。
微粒数( )个氢原子
1molH2O
__________个H2O
物质的量( )O
微粒数( )个氧原子
物质的量( )H
6.02×1023
2×6.02×1023
2mol
1mol
6.02×1023
即时理解
经典例题
例1.下列说法中错误的是( )
A.物质的量是表示含有一定数目粒子集合体的物理量
B.使用摩尔作单位时必须指明微粒的名称
C.1 mol 任何物质都含有阿伏加德罗常数个原子
D.物质的量适用于计量分子、原子、离子等粒子
【解析】物质的量是含有一定数目粒子集合体的物理量,其单位是摩尔,使用摩尔所指的对象是微粒,而微粒种类繁多,需要指明其名称;构成物质的粒子除原子外,还有分子、离子等。
C
例2.下列说法不正确的是( )
A.6.02×1023个钠离子的物质的量约为1 mol
B.1 mol氧约含6.02×1023个氧分子
C.1 mol 氯化钙里含3 mol离子
D.1 mol H+中含有的氢离子数为NA
【解析】用摩尔表示物质的量时,要指明微粒的种类。“1 mol氧”没有指明是氧分子还是氧原子。
B
例3.课堂上同学们学习了“物质的量”这一物理量并做了大量的相关练习。下课后大家根据个人体验,对物质的量这一新概念又展开了热烈的讨论,交流学习心得。以下是几位同学的谈话记录。你认为错误的是( )
A.物质的量将一定数目微观粒子与可称量的物质之间联系起来了,以后我们就可让“质量”这一个物理量“下岗”了
B.使用物质的量时要指明所计量的微观粒子是谁,最好用化学式表示,既规范又简洁准确
C.化学方程式中的化学计量数之比等于各物质的物质的量之比,这样以后依据化学方程式进行计算时就可以用物质的量关系进行计算了
D.学习了物质的量后,我们就能大致知道一杯水中大约有多少个水分子了
【解析】物质的量和质量都是基本的物理量,两者不可相互替代。
A
例4.下列说法正确的是( )
A.物质的量是物质粒子的数量的简称
B.摩尔是用来描述物质所含微粒数目多少的基本物理量
C.1 mol氯含有6.02×1023个氯原子
D.1 mol H2中含2 mol电子
【解析】物质的量是一个固定概念,专有名词,是用来描述微观粒子数量的物理量,不是物质的数量或质量,A错;摩尔是物质的量的单位,不是物理量,B错;每个H2中含有2个电子,故6.02×1023个H2中含有2×6.02×1023个电子,即1 mol H2中含有2 mol电子,D对。
。
D
知识归纳
1. 物质的量的计量对象:只适用于微观粒子!!!不适合宏观物质;
1 mol H2O 1.5 mol H 0.5 mol OH- 5 mol e- … …
2. 物质的量是一个专有名词,不得简化或增添任何字;
3.摩尔不是物理量,是物质的量的单位,符号“mol”;
4. 阿伏加德罗常数NA是定值,NA ≈ 6.02×1023 mol-1
三、摩尔质量
1.定义:单位物质的量的物质所具有的质量,符号M ,单位g· mol-1 或 kg· mol-1
2.数值:等于该物质的相对分子质量或相对原子质量
3.公式:
物质的量 n
(mol)
m 物质的质量 (g)
M 摩尔质量 (g/mol)
= ——
m = M × n
m
M = ——
n
辨析:
1 mol O2的质量是( )
O2的摩尔质量是( )
O2的相对分子质量是( )
32 g
32
32 g/mol
该物质的摩尔质量
粒子符号 1mol物质含有的粒子数/个 每个粒子的质量/g 1mol物质
的质量
H2O
C
Fe
Na+
2.990×10-23
1.993×10-23
3.821×10-23
6.02×1023
6.02×1023
6.02×1023
约18g
约12g
约23g
18g/mol
12g/mol
23g/mol
6.02×1023
9.302×10-23
约56g
56g/mol
问题: 1mol任何微粒的质量都一样吗?
1mol微粒的质量到底等于多少呢?
1mol任何物质(粒子)的质量,以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。
4.摩尔质量意义:
物质的量在难以称量的微观粒子与可称量的物质之间搭建了桥梁
微 观
(粒子数)
宏 观
(质量)
物质的量(n)
N
NA
m
M
注意点:一一对应;注意单位
35.5gNa2SO4的物质的量是多少?含有钠离子多少个?
(写出计算过程)
【解】Na2SO4的相对分子质量为142,摩尔质量为142g/mol。
n(Na2SO4)=
m( Na2SO4 )
M( Na2SO4 )
35.5g
142g/mol
=
=0.25mol
2n(Na2SO4 )= 0.5mol
n(Na+ ) =
N(Na+ ) =n (Na+ ) ·NA = 0.5mol×6.02×1023mol-1=3.01×1023
即时理解
经典例题
例5.下列有关摩尔质量的描述或应用正确的是( )
A.1 mol OH-的质量为17 g·mol-1
B.二氧化碳的摩尔质量为44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量约等于6.02×1023(23) g
【解析】A项,质量的单位为“g”;B项,摩尔质量单位应为“g·mol-1”;C项,没有指出以“g·mol-1”为单位,也没有指出在数值上相等。
D
例6.下列关于摩尔质量的说法正确的是( )
A.摩尔质量表示单位物质的量的物质所具有的质量
B.1 mol H2SO4的质量与H2SO4的摩尔质量相同
C.摩尔质量与该物质的相对分子质量或相对原子质量相等
D.某物质的物质的量越多,对应的摩尔质量越大
【解析】B项,二者的数值相同,但单位分别为g和g·mol-1,错误;C项,摩尔质量在数值上与该物质的相对分子质量或相对原子质量相等,错误;D项,摩尔质量不随物质的量的变化而发生变化,错误。
A
例7.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大的能量,可作为航天运载火箭的推动力来源。下列关于偏二甲肼的叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.1 mol偏二甲肼的质量为60 g·mol-1
D.6 g偏二甲肼含有NA个偏二甲肼分子
【解析】偏二甲肼的摩尔质量应为60 g·mol-1;6.02×1023个偏二甲肼约为1 mol,其质量约为60 g;6 g偏二甲肼的物质的量为60 g·mol-1(6 g)=0.1 mol,含有的分子数为0.1NA。
B
例8.有五种物质:①6 g 氢气;②0.5 mol 二氧化碳;③1.204×1024个氯化氢分子;④147 g硫酸;⑤92 g乙醇(C2H5OH)。回答下列问题(填序号):
(1)物质的量最大的是________。
(2)所含分子数最多的是________。
(3)含有原子个数最多的是________。
(4)质量最大的是________。
【解析】首先“见量化摩”,以物质的量为核心再进行转换。①n(H2)=3 mol;②n(CO2)=0.5 mol;③n(HCl)=2 mol;④n(H2SO4)=1.5 mol;⑤n(C2H5OH)=2 mol。物质的量最大的是①,所含分子数最多的是①;①~⑤物质中所含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,所含原子个数最多的是⑤;①~⑤物质的质量分别为6 g、22 g、73 g、147 g、92 g,质量最大的是④。
【答案】(1)① (2)① (3)⑤ (4)④
摩尔质量的计算方法
(2)已知一个分子的质量时:M=m(分子)×NA
(1)已知任意状态物质的质量时:M=——
m
n
(3)已知一个分子的质量和一个12C原子的质量时:M=————×12 g·mol-1
m(分子)
n(12C)
知识归纳
1.化学方程式的含义
C + O2 = CO2
1个 1个 1个
12g 32g 44g
物质的量1mol 1 mol 1mol
个数
质量
n之比 1 : 1 : 1
四.物质的量在化学方程式中的应用
2H2 + O2 == 2H2O
点燃
质量 4g 32g 36g
物质的量 2mol 1 mol 2mol
2.结论:化学方程式中物质化学式前的系数之比等于各物质的物质的量之比。
n之比 2 : 1 : 2
例9. 9.75 g锌与含________ mol HCl的盐酸刚好完全反应,放出________ mol H2,在溶液中有________ mol Zn2+和________ mol Cl-。(已知Zn的相对原子质量为65)
【解析】 n(Zn)=65 g·mol-1(9.75 g)=0.15 mol,
Zn + 2HCl === ZnCl2 + H2↑
1 2 1 1
0.15 mol n(HCl) n(ZnCl2) n(H2)
n(HCl)=1 mol(0.15 mol×2)=0.3 mol,
n(H2)=1 mol(0.15 mol×1)=0.15 mol,
n(ZnCl2)=1 mol(0.15 mol×1)=0.15 mol。
【答案】0.3 0.15 0.15 0.3
经典例题
课堂小结
随堂练习
1.阿伏加德罗常数的命名是为了纪念意大利科学家阿伏加德罗。用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.28gN2含的分子数为2NA
B.1molNa含有的电子数为NA
C.标准状况下,22.4LO2含有的氧原子数为2NA
D.2mol·L-1KCl溶液中含有的离子数为2NA
【解析】A.28gN2的物质的量 =1mol,所含分子数为NA,A错误;
B.电子数=原子序数,1molNa含有的电子数为11NA,B错误;
C.标况下,22.4LO2的物质的量为1mol,含有的氧原子数为2NA,C正确;
D.不确定溶液体积,不能计算离子的物质的量,D错误;
故选C。
C
2.下列叙述中正确的是( )
A.1 mol任何纯净物都含有相同的原子数
B.1 mol O2中约含有6.02×1023个氧气分子
C.1 mol H2中含有2 mol氢离子和2NA个电子
D.阿伏伽德罗常数就是6.02×1023
【解析】A.纯净物不一定都是由原子组成的,1 mol任何纯净物不一定含有相同的原子数,A错误;
B.1mol任何粒子集合体都约有6.02×1023个粒子,则1 mol O2中约含有6.02×1023个氧气分子,B正确;
C. H2中不存在H+,C错误;
D.1mol任何粒子的粒子数叫做阿伏伽德罗常数,阿伏伽德罗常数就是6.02×1023mol-1,D错误;
答案选B。
B
3.下列说法正确的是( )
A.硫酸的摩尔质量是98 g
B.2 mol OH-的质量是34 g
C.铁原子的摩尔质量等于它的相对原子质量
D.1 mol N2的质量是14 g
【解析】硫酸的摩尔质量是98 g·mol-1,故A错误;铁原子的摩尔质量是以g·mol-1为单位,数值上等于铁原子的相对原子质量,故C错误;1 mol N2的质量m(N2)=n·M=1 mol×28 g·
mol-1=28 g,故D错误。
B
【解析】A项,质量的单位为“g”;B项,摩尔质量单位应为“g·mol-1”;C项,没有指出以“g·mol-1”为单位,也没有指出在数值上相等。
4.下列有关摩尔质量的描述或应用正确的是( )
A.1 mol OH-的质量为17 g·mol-1
B.二氧化碳的摩尔质量为44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.6.02×1023个钠原子的质量约等于23g
D
5.现有CO、CO2、O3三种气体,它们分别都含有1 mol氧原子,则三种气体的物质的量之比为( )
A.1∶1∶1 B.1∶2∶3
C.3∶2∶1 D.6∶3∶2
【解析】含有1 mol氧原子的CO、CO2、O3三种气体的物质的量分别为1 mol、1/2 mol和1/3mol,则有n(CO)∶n(CO2)∶n(O3)=1 mol∶1/2mol∶1/3mol=6∶3∶2。
D
6.空气中的氧分子在阳光紫外线、闪电等外界因素作用下,会生成氧负离子(O2 - )。O2 -的摩尔质量为( )
A.33 g B.33 g· mol-1 C.32 g D.32 g· mol-1
【解析】O2 比O2多一个电子,电子的质量可以忽略不计,故O2 的相对分子质量为32,所以O2 的摩尔质量为32g/mol,
答案为D。
D
7.NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.4gMg在足量O2中燃烧,转移的电子数为0.1NA
B.18gD2O和18gH2O中含有的质子数均为10NA
C.标准状况下,2.24LH2O含有的原子总数为0.3NA
D.标准状况下,5.6LCO2和NO2的混合气体中含有的氧原子数为0.5NA
【解析】A.2.4gMg的物质的量为0.1mol,在足量O2中燃烧,Mg转化为Mg2+,则转移的电子数为0.2NA,A不正确;
B.18gD2O的物质的量为0.9mol,18gH2O的物质的量为1mol,含有的质子数前者为9NA,后者为10NA,B不正确;
C.标准状况下,H2O呈液态,无法求出2.24LH2O的物质的量,也就无法求出其含有的原子总数,C不正确;
D.标准状况下,5.6LCO2和5.6L NO2的物质的量都为0.25mol,所含氧原子都为0.5mol,则混合气体中含有的氧原子数也为0.5NA,D正确;
故选D。
D
8.相等物质的量的CO和CO2相比较,下列有关叙述正确的是( )
①它们所含的分子数目之比为1∶1 ②它们所含的氧原子数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的碳原子数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11
A.①②③④ B.②③ C.④⑤ D.①②③④⑤
【解析】CO、CO2的物质的量相同,所含分子数目相同,①正确;二者所含氧原子数目之比等于其分子中所含氧原子个数比,②正确;同理可知③、④正确;1个CO分子中所含电子数为14,而1个CO2分子中所含电子数为22,故等物质的量的CO、CO2所含电子数目之比为14∶22=7∶11,⑤正确。
D
9.下列各物质所含原子个数由多到少的排列顺序为( )
①0.5 mol NH3 ②4 g氦气 ③4 ℃时9 mL水 ④0.2 mol H3PO4
A.①④③② B.④③②① C.②③④① D.①④②③
【解析】①一个NH3分子中含有4个原子,0.5 mol NH3中含有原子的物质的量为0.5 mol×4=2 mol;②4 g氦气的物质的量为1 mol,氦气是单原子分子,故4 g氦气中所含氦原子的物质的量为1 mol;③4 ℃时9 mL水的质量为9 mL×1 g·mL-1=9 g,其物质的量为0.5 mol,一个H2O分子中含有3个原子,故4 ℃时9 mL水中含有原子的物质的量为0.5 mol×3=1.5 mol;④一个H3PO4分子中含有8个原子,故0.2 mol H3PO4中含有原子的物质的量为0.2 mol×8=1.6 mol。故所含原子数由多到少的排列顺序为①④③②,A项正确。
A
10.有五种物质:①6 g 氢气;②0.5 mol 二氧化碳;③1.204×1024个氯化氢分子;④147 g硫酸;⑤92 g乙醇(C2H5OH)。回答下列问题:
(1)物质的量最大的是________。 (2)所含分子数最多的是________。
(3)含有原子个数最多的是________。 (4)质量最大的是________。
【解析】首先“见量化摩”,以物质的量为核心再进行转换。①n(H2)=3 mol;②n(CO2)=0.5 mol;③n(HCl)=2 mol;④n(H2SO4)=1.5 mol;⑤n(C2H5OH)=2 mol。物质的量最大的是①,所含分子数最多的是①;①~⑤物质中所含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,所含原子个数最多的是⑤;①~⑤物质的质量分别为6 g、22 g、73 g、147 g、92 g,质量最大的是④。
【答案】(1)① (2)① (3)⑤ (4)④
第二单元 物质的化学计量
专题1 物质的分类及计量
第1课时 物质的量
学习目标:
1.理解“物质的量”这个物理量及其单位-摩尔。
2.初步学会“物质的量、微粒数”之间的相互转化。
3.了解引进摩尔这一单位的重要性和必要性,懂得阿伏加德罗常数的涵义。
知识体系
新课引入
生命的源泉?
成年人每天需喝多少水?
相当于多少个水分子?
成年人平均2000 mL/天 相当于2 kg
水是由水分子构成的
一个碳原子质量约1.993×10-23g,12 g 金刚石约含有多少个碳原子?
宏 观
(质量)
物质的量
微 观
(微粒数目)
1971年第14届国际计量大会正式通过物质的量的单位———摩尔
一、物质的量
n
1.含义:把物质的宏观量(m、V)与微观粒子数量联系起来的物理量,国际单位制中七个基本物理量之一,符号___;
2.单位:____(简称 __ 符号____)
摩尔
摩
mol
宏 观
(m、V)
微 观
(原子、分子、离子、质子、中子、电子)
物质的量
3表示方法:
如1 mol H指1 mol氢原子,1 mol H2指1 mol氢分子而不能指1 mol氢。
摩尔(mol):来自于拉丁文moles,原意为“大量、堆积”。
摩尔定义:
2018年11月16日,国际计量大会通过决议,1摩尔被定义为“包含6.02214076×1023个基本粒子。
阿伏加德罗常数(NA)通常用6.02×1023mol-1表示
意大利科学家 阿伏加德罗
国际单位制中七个基本物理量
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
二、阿伏加德罗常数
1. 定义:0.012 kg 12C中所含碳原子数称为阿伏加德罗常数
2. 符号:NA,近似为 6.02×1023 mol-1
国际上规定,1 mol粒子集合体所含粒子数与0.012 kg 12C中所含碳原子数相同。
已知1个12C原子质量1.993×10-26 kg,0.012 kg12C中有多少个碳原子?
0.012 kg
1.993×10-26 kg
──────────
1 mol 任何粒子所含粒子数NA个,约6.02×1023个。
粒子:分子、原子、离子、质子、中子、电子等
≈ 6.02×1023
(1)1molNa中有 个钠原子
(2)2molNa中有 个钠原子
(3)0.5molH2中有多少个 氢气分子
(4)1.204×1024个水分子的物质的量__________mol
请同学们归纳n、N、NA三者关系
6.02×1023
3.01×1023
1.204×1024
2
2×6.02×1023
0.5×6.02×1023
N
n
NA
3.物质的量(n)、微粒数(N)、阿伏加德罗常数(NA)之间的关系
学习了物质的量之后,某同学想用下图表示对水的组成的进一步认识。请你协助他完成这幅关系图,并说明这幅图的含义。
微粒数( )个氢原子
1molH2O
__________个H2O
物质的量( )O
微粒数( )个氧原子
物质的量( )H
6.02×1023
2×6.02×1023
2mol
1mol
6.02×1023
即时理解
经典例题
例1.下列说法中错误的是( )
A.物质的量是表示含有一定数目粒子集合体的物理量
B.使用摩尔作单位时必须指明微粒的名称
C.1 mol 任何物质都含有阿伏加德罗常数个原子
D.物质的量适用于计量分子、原子、离子等粒子
【解析】物质的量是含有一定数目粒子集合体的物理量,其单位是摩尔,使用摩尔所指的对象是微粒,而微粒种类繁多,需要指明其名称;构成物质的粒子除原子外,还有分子、离子等。
C
例2.下列说法不正确的是( )
A.6.02×1023个钠离子的物质的量约为1 mol
B.1 mol氧约含6.02×1023个氧分子
C.1 mol 氯化钙里含3 mol离子
D.1 mol H+中含有的氢离子数为NA
【解析】用摩尔表示物质的量时,要指明微粒的种类。“1 mol氧”没有指明是氧分子还是氧原子。
B
例3.课堂上同学们学习了“物质的量”这一物理量并做了大量的相关练习。下课后大家根据个人体验,对物质的量这一新概念又展开了热烈的讨论,交流学习心得。以下是几位同学的谈话记录。你认为错误的是( )
A.物质的量将一定数目微观粒子与可称量的物质之间联系起来了,以后我们就可让“质量”这一个物理量“下岗”了
B.使用物质的量时要指明所计量的微观粒子是谁,最好用化学式表示,既规范又简洁准确
C.化学方程式中的化学计量数之比等于各物质的物质的量之比,这样以后依据化学方程式进行计算时就可以用物质的量关系进行计算了
D.学习了物质的量后,我们就能大致知道一杯水中大约有多少个水分子了
【解析】物质的量和质量都是基本的物理量,两者不可相互替代。
A
例4.下列说法正确的是( )
A.物质的量是物质粒子的数量的简称
B.摩尔是用来描述物质所含微粒数目多少的基本物理量
C.1 mol氯含有6.02×1023个氯原子
D.1 mol H2中含2 mol电子
【解析】物质的量是一个固定概念,专有名词,是用来描述微观粒子数量的物理量,不是物质的数量或质量,A错;摩尔是物质的量的单位,不是物理量,B错;每个H2中含有2个电子,故6.02×1023个H2中含有2×6.02×1023个电子,即1 mol H2中含有2 mol电子,D对。
。
D
知识归纳
1. 物质的量的计量对象:只适用于微观粒子!!!不适合宏观物质;
1 mol H2O 1.5 mol H 0.5 mol OH- 5 mol e- … …
2. 物质的量是一个专有名词,不得简化或增添任何字;
3.摩尔不是物理量,是物质的量的单位,符号“mol”;
4. 阿伏加德罗常数NA是定值,NA ≈ 6.02×1023 mol-1
三、摩尔质量
1.定义:单位物质的量的物质所具有的质量,符号M ,单位g· mol-1 或 kg· mol-1
2.数值:等于该物质的相对分子质量或相对原子质量
3.公式:
物质的量 n
(mol)
m 物质的质量 (g)
M 摩尔质量 (g/mol)
= ——
m = M × n
m
M = ——
n
辨析:
1 mol O2的质量是( )
O2的摩尔质量是( )
O2的相对分子质量是( )
32 g
32
32 g/mol
该物质的摩尔质量
粒子符号 1mol物质含有的粒子数/个 每个粒子的质量/g 1mol物质
的质量
H2O
C
Fe
Na+
2.990×10-23
1.993×10-23
3.821×10-23
6.02×1023
6.02×1023
6.02×1023
约18g
约12g
约23g
18g/mol
12g/mol
23g/mol
6.02×1023
9.302×10-23
约56g
56g/mol
问题: 1mol任何微粒的质量都一样吗?
1mol微粒的质量到底等于多少呢?
1mol任何物质(粒子)的质量,以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。
4.摩尔质量意义:
物质的量在难以称量的微观粒子与可称量的物质之间搭建了桥梁
微 观
(粒子数)
宏 观
(质量)
物质的量(n)
N
NA
m
M
注意点:一一对应;注意单位
35.5gNa2SO4的物质的量是多少?含有钠离子多少个?
(写出计算过程)
【解】Na2SO4的相对分子质量为142,摩尔质量为142g/mol。
n(Na2SO4)=
m( Na2SO4 )
M( Na2SO4 )
35.5g
142g/mol
=
=0.25mol
2n(Na2SO4 )= 0.5mol
n(Na+ ) =
N(Na+ ) =n (Na+ ) ·NA = 0.5mol×6.02×1023mol-1=3.01×1023
即时理解
经典例题
例5.下列有关摩尔质量的描述或应用正确的是( )
A.1 mol OH-的质量为17 g·mol-1
B.二氧化碳的摩尔质量为44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量约等于6.02×1023(23) g
【解析】A项,质量的单位为“g”;B项,摩尔质量单位应为“g·mol-1”;C项,没有指出以“g·mol-1”为单位,也没有指出在数值上相等。
D
例6.下列关于摩尔质量的说法正确的是( )
A.摩尔质量表示单位物质的量的物质所具有的质量
B.1 mol H2SO4的质量与H2SO4的摩尔质量相同
C.摩尔质量与该物质的相对分子质量或相对原子质量相等
D.某物质的物质的量越多,对应的摩尔质量越大
【解析】B项,二者的数值相同,但单位分别为g和g·mol-1,错误;C项,摩尔质量在数值上与该物质的相对分子质量或相对原子质量相等,错误;D项,摩尔质量不随物质的量的变化而发生变化,错误。
A
例7.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大的能量,可作为航天运载火箭的推动力来源。下列关于偏二甲肼的叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.1 mol偏二甲肼的质量为60 g·mol-1
D.6 g偏二甲肼含有NA个偏二甲肼分子
【解析】偏二甲肼的摩尔质量应为60 g·mol-1;6.02×1023个偏二甲肼约为1 mol,其质量约为60 g;6 g偏二甲肼的物质的量为60 g·mol-1(6 g)=0.1 mol,含有的分子数为0.1NA。
B
例8.有五种物质:①6 g 氢气;②0.5 mol 二氧化碳;③1.204×1024个氯化氢分子;④147 g硫酸;⑤92 g乙醇(C2H5OH)。回答下列问题(填序号):
(1)物质的量最大的是________。
(2)所含分子数最多的是________。
(3)含有原子个数最多的是________。
(4)质量最大的是________。
【解析】首先“见量化摩”,以物质的量为核心再进行转换。①n(H2)=3 mol;②n(CO2)=0.5 mol;③n(HCl)=2 mol;④n(H2SO4)=1.5 mol;⑤n(C2H5OH)=2 mol。物质的量最大的是①,所含分子数最多的是①;①~⑤物质中所含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,所含原子个数最多的是⑤;①~⑤物质的质量分别为6 g、22 g、73 g、147 g、92 g,质量最大的是④。
【答案】(1)① (2)① (3)⑤ (4)④
摩尔质量的计算方法
(2)已知一个分子的质量时:M=m(分子)×NA
(1)已知任意状态物质的质量时:M=——
m
n
(3)已知一个分子的质量和一个12C原子的质量时:M=————×12 g·mol-1
m(分子)
n(12C)
知识归纳
1.化学方程式的含义
C + O2 = CO2
1个 1个 1个
12g 32g 44g
物质的量1mol 1 mol 1mol
个数
质量
n之比 1 : 1 : 1
四.物质的量在化学方程式中的应用
2H2 + O2 == 2H2O
点燃
质量 4g 32g 36g
物质的量 2mol 1 mol 2mol
2.结论:化学方程式中物质化学式前的系数之比等于各物质的物质的量之比。
n之比 2 : 1 : 2
例9. 9.75 g锌与含________ mol HCl的盐酸刚好完全反应,放出________ mol H2,在溶液中有________ mol Zn2+和________ mol Cl-。(已知Zn的相对原子质量为65)
【解析】 n(Zn)=65 g·mol-1(9.75 g)=0.15 mol,
Zn + 2HCl === ZnCl2 + H2↑
1 2 1 1
0.15 mol n(HCl) n(ZnCl2) n(H2)
n(HCl)=1 mol(0.15 mol×2)=0.3 mol,
n(H2)=1 mol(0.15 mol×1)=0.15 mol,
n(ZnCl2)=1 mol(0.15 mol×1)=0.15 mol。
【答案】0.3 0.15 0.15 0.3
经典例题
课堂小结
随堂练习
1.阿伏加德罗常数的命名是为了纪念意大利科学家阿伏加德罗。用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.28gN2含的分子数为2NA
B.1molNa含有的电子数为NA
C.标准状况下,22.4LO2含有的氧原子数为2NA
D.2mol·L-1KCl溶液中含有的离子数为2NA
【解析】A.28gN2的物质的量 =1mol,所含分子数为NA,A错误;
B.电子数=原子序数,1molNa含有的电子数为11NA,B错误;
C.标况下,22.4LO2的物质的量为1mol,含有的氧原子数为2NA,C正确;
D.不确定溶液体积,不能计算离子的物质的量,D错误;
故选C。
C
2.下列叙述中正确的是( )
A.1 mol任何纯净物都含有相同的原子数
B.1 mol O2中约含有6.02×1023个氧气分子
C.1 mol H2中含有2 mol氢离子和2NA个电子
D.阿伏伽德罗常数就是6.02×1023
【解析】A.纯净物不一定都是由原子组成的,1 mol任何纯净物不一定含有相同的原子数,A错误;
B.1mol任何粒子集合体都约有6.02×1023个粒子,则1 mol O2中约含有6.02×1023个氧气分子,B正确;
C. H2中不存在H+,C错误;
D.1mol任何粒子的粒子数叫做阿伏伽德罗常数,阿伏伽德罗常数就是6.02×1023mol-1,D错误;
答案选B。
B
3.下列说法正确的是( )
A.硫酸的摩尔质量是98 g
B.2 mol OH-的质量是34 g
C.铁原子的摩尔质量等于它的相对原子质量
D.1 mol N2的质量是14 g
【解析】硫酸的摩尔质量是98 g·mol-1,故A错误;铁原子的摩尔质量是以g·mol-1为单位,数值上等于铁原子的相对原子质量,故C错误;1 mol N2的质量m(N2)=n·M=1 mol×28 g·
mol-1=28 g,故D错误。
B
【解析】A项,质量的单位为“g”;B项,摩尔质量单位应为“g·mol-1”;C项,没有指出以“g·mol-1”为单位,也没有指出在数值上相等。
4.下列有关摩尔质量的描述或应用正确的是( )
A.1 mol OH-的质量为17 g·mol-1
B.二氧化碳的摩尔质量为44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.6.02×1023个钠原子的质量约等于23g
D
5.现有CO、CO2、O3三种气体,它们分别都含有1 mol氧原子,则三种气体的物质的量之比为( )
A.1∶1∶1 B.1∶2∶3
C.3∶2∶1 D.6∶3∶2
【解析】含有1 mol氧原子的CO、CO2、O3三种气体的物质的量分别为1 mol、1/2 mol和1/3mol,则有n(CO)∶n(CO2)∶n(O3)=1 mol∶1/2mol∶1/3mol=6∶3∶2。
D
6.空气中的氧分子在阳光紫外线、闪电等外界因素作用下,会生成氧负离子(O2 - )。O2 -的摩尔质量为( )
A.33 g B.33 g· mol-1 C.32 g D.32 g· mol-1
【解析】O2 比O2多一个电子,电子的质量可以忽略不计,故O2 的相对分子质量为32,所以O2 的摩尔质量为32g/mol,
答案为D。
D
7.NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.4gMg在足量O2中燃烧,转移的电子数为0.1NA
B.18gD2O和18gH2O中含有的质子数均为10NA
C.标准状况下,2.24LH2O含有的原子总数为0.3NA
D.标准状况下,5.6LCO2和NO2的混合气体中含有的氧原子数为0.5NA
【解析】A.2.4gMg的物质的量为0.1mol,在足量O2中燃烧,Mg转化为Mg2+,则转移的电子数为0.2NA,A不正确;
B.18gD2O的物质的量为0.9mol,18gH2O的物质的量为1mol,含有的质子数前者为9NA,后者为10NA,B不正确;
C.标准状况下,H2O呈液态,无法求出2.24LH2O的物质的量,也就无法求出其含有的原子总数,C不正确;
D.标准状况下,5.6LCO2和5.6L NO2的物质的量都为0.25mol,所含氧原子都为0.5mol,则混合气体中含有的氧原子数也为0.5NA,D正确;
故选D。
D
8.相等物质的量的CO和CO2相比较,下列有关叙述正确的是( )
①它们所含的分子数目之比为1∶1 ②它们所含的氧原子数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的碳原子数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11
A.①②③④ B.②③ C.④⑤ D.①②③④⑤
【解析】CO、CO2的物质的量相同,所含分子数目相同,①正确;二者所含氧原子数目之比等于其分子中所含氧原子个数比,②正确;同理可知③、④正确;1个CO分子中所含电子数为14,而1个CO2分子中所含电子数为22,故等物质的量的CO、CO2所含电子数目之比为14∶22=7∶11,⑤正确。
D
9.下列各物质所含原子个数由多到少的排列顺序为( )
①0.5 mol NH3 ②4 g氦气 ③4 ℃时9 mL水 ④0.2 mol H3PO4
A.①④③② B.④③②① C.②③④① D.①④②③
【解析】①一个NH3分子中含有4个原子,0.5 mol NH3中含有原子的物质的量为0.5 mol×4=2 mol;②4 g氦气的物质的量为1 mol,氦气是单原子分子,故4 g氦气中所含氦原子的物质的量为1 mol;③4 ℃时9 mL水的质量为9 mL×1 g·mL-1=9 g,其物质的量为0.5 mol,一个H2O分子中含有3个原子,故4 ℃时9 mL水中含有原子的物质的量为0.5 mol×3=1.5 mol;④一个H3PO4分子中含有8个原子,故0.2 mol H3PO4中含有原子的物质的量为0.2 mol×8=1.6 mol。故所含原子数由多到少的排列顺序为①④③②,A项正确。
A
10.有五种物质:①6 g 氢气;②0.5 mol 二氧化碳;③1.204×1024个氯化氢分子;④147 g硫酸;⑤92 g乙醇(C2H5OH)。回答下列问题:
(1)物质的量最大的是________。 (2)所含分子数最多的是________。
(3)含有原子个数最多的是________。 (4)质量最大的是________。
【解析】首先“见量化摩”,以物质的量为核心再进行转换。①n(H2)=3 mol;②n(CO2)=0.5 mol;③n(HCl)=2 mol;④n(H2SO4)=1.5 mol;⑤n(C2H5OH)=2 mol。物质的量最大的是①,所含分子数最多的是①;①~⑤物质中所含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,所含原子个数最多的是⑤;①~⑤物质的质量分别为6 g、22 g、73 g、147 g、92 g,质量最大的是④。
【答案】(1)① (2)① (3)⑤ (4)④
