苏教版高中化学必修第一册专题2研究物质的基本方法2.3人类对原子结构的认识课件(39张)
文档属性
| 名称 | 苏教版高中化学必修第一册专题2研究物质的基本方法2.3人类对原子结构的认识课件(39张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 13:30:30 | ||
图片预览








文档简介
(共39张PPT)
专题2 研究物质的基本方法
第三单元
人类对原子结构的认识
化学变化中的最小微粒是什么?
原子
阅读课本,梳理总结人类认识原子结构的历程
人类认识原子结构的历程
19世纪初,英国科学家道尔顿总结了一些元素形成化合物时的质量比例关系,提出了近代原子学说。
道尔顿和他的原子结构模型
坚实不可再分的实心球
人类认识原子结构的历程
1897年,汤姆生发现原子中存在电子,并用实验方法测出电子的质量不及氢原子质量的千分之一(后进一步确定为氢原子质量的1/1836)。
汤姆生发现电子,
提出原子结构模型
葡萄干面包式:平均分布着带正电荷的粒子和带负电的电子
人类认识原子结构的历程
1911年,卢瑟福用α粒子轰击金箔。
原子核带正电,电子在其周围高速运动,就像行星围绕太阳运转一样。
卢瑟福根据α粒子散射现象,提出带核的原子结构模型
有核模型或行星模型:带正电荷的核位于中心,质量主要集中在核上,电子沿不同轨道运转。
人类认识原子结构的历程
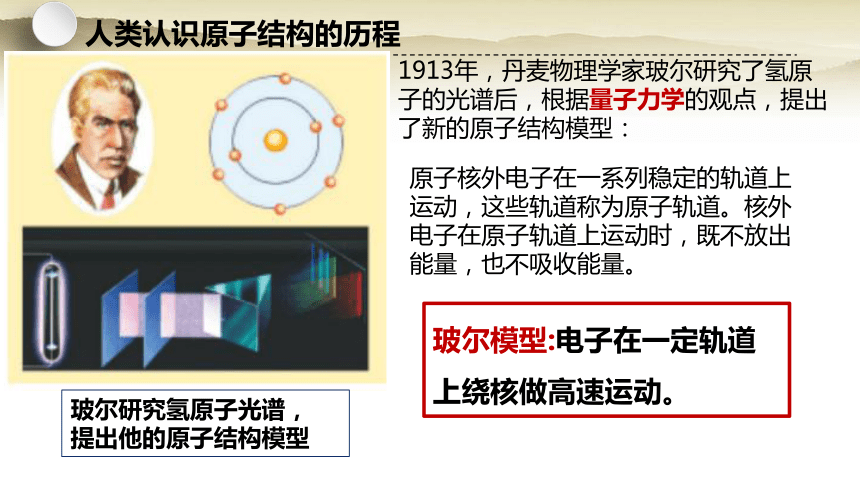
玻尔研究氢原子光谱,
提出他的原子结构模型
1913年,丹麦物理学家玻尔研究了氢原子的光谱后,根据量子力学的观点,提出了新的原子结构模型:
原子核外电子在一系列稳定的轨道上运动,这些轨道称为原子轨道。核外电子在原子轨道上运动时,既不放出能量,也不吸收能量。
玻尔模型:电子在一定轨道上绕核做高速运动。
人类认识原子结构的历程
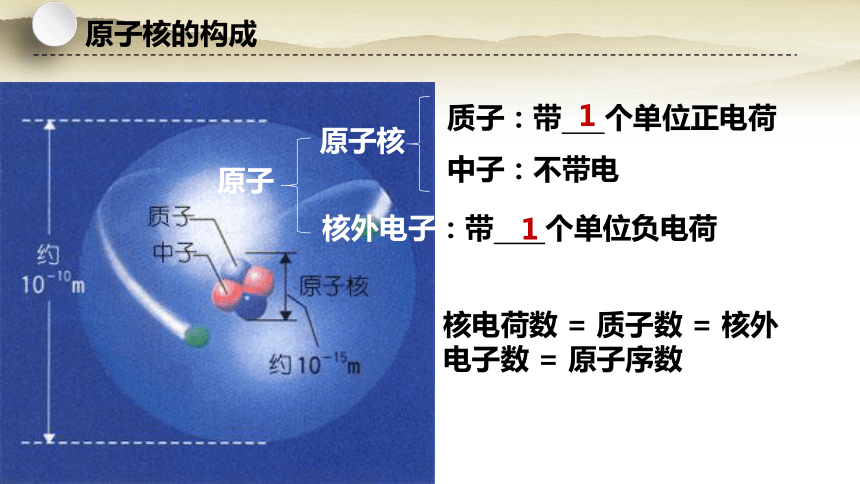
原子核的构成
原子
原子核
质子:带 个单位正电荷
中子:不带电
核外电子:带 个单位负电荷
1
1
核电荷数 = 质子数 = 核外电子数 = 原子序数
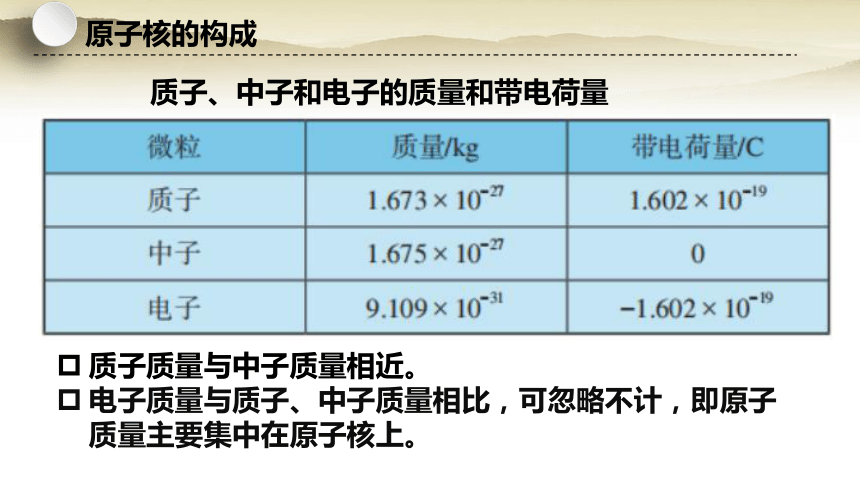
质子、中子和电子的质量和带电荷量
原子核的构成
质子质量与中子质量相近。
电子质量与质子、中子质量相比,可忽略不计,即原子质量主要集中在原子核上。
原子核的构成
1、定义:将原子核内所有的质子和中子的相对质量取整数加起来所得的数值。
质量数:
2、符号:A
3、质量数(A)=____________________
质子数(Z)+中子数(N)
≈相对原子质量(Ar)
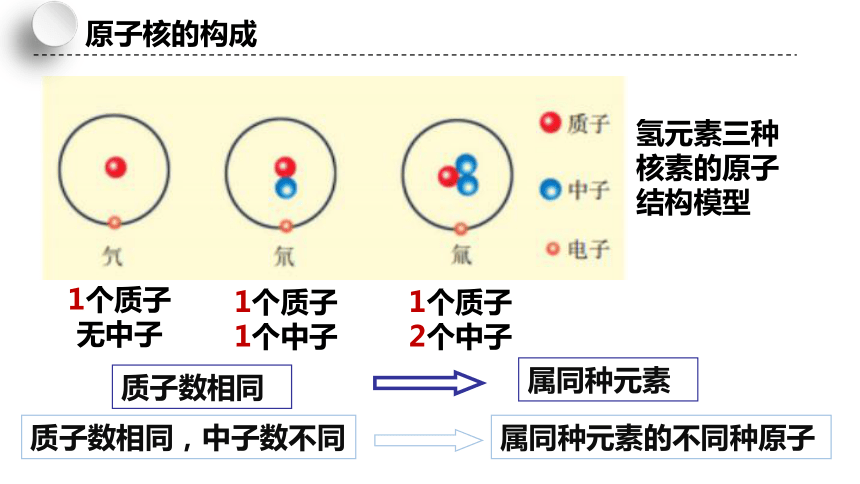
氢元素三种核素的原子结构模型
原子核的构成
1个质子
无中子
1个质子
1个中子
1个质子
2个中子
质子数相同
质子数相同,中子数不同
属同种元素
属同种元素的不同种原子
具有一定质子数和一定中子数的一种原子。
原子核的构成
核素
原子组成的表示方法
表示质子数为 ,质量数为 的碳原子,其中子数为 。
6
12
X
A
Z
——元素符号
质量数 ——
质子数——
C
12
6
6
表示质子数为 ,质量数为 的碳原子,其中子数为 。
6
14
C
14
6
8
原子核的构成
质子数
质子数
中子数
质子
质量
H
1
1
H
2
1
H
3
1
C
12
6
C
14
6
O
16
8
O
18
8
原子核的构成
H
1
1
H
2
1
H
3
1
俗称
重氢
超重氢
符号
H
D
T
氢
H2 和D2 是两种不同的单质,化学性质基本相同
质子数相同 核外电子数相同
化学性质几乎完全相同
中子数不同 物理性质不同 用途不同
原子核的构成
H2O和D2O 化学性质基本相同
D2用于核反应,并在化学和生物学的研究工作中作示踪原子。
①____在考古工作中用于测定文物的年代;
14C
原子核的构成
同位素的应用
② U用于制造原子弹、核发电;
③____ ___用于制造氢弹;
④放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
原子核的构成
①分子或原子:质子数=核电荷数=核外电子数
②阳离子Xn+:质子数=核电荷数=核外电子数+n
③阴离子Xn-:质子数=核电荷数=核外电子数-n
原子核的构成
中的质子数是____,中子数是_____,核外电子数是_____,质量数是_____。
16
18
18
34
现有下列基本微粒:
1H、2H、3H、1H+、234U、235U、238U、 、40K、40Ca、Cl2、14N、14C,请回答下列问题:
(1)在给出的微粒中,含有____种元素,属于氢元素的核素有____种,属于铀元素的核素有_____种,互为同位素的原子分别是_____________,_______________。
7
3
3
1H、2H、3H
234U、235U、238U
(2)质量数相等的微粒为________、__________、________(可不填满,也可补充)。
1H与1H+
40K与40Ca
14N与14C
强化巩固
(3)0.1 mol 中共含______mol中子,含_______个电子。
2.1
2.2NA
强化巩固
K L M N O P
1 2 3 4 5 6
电子层(用n表示)
电子层符号
离核距离
能量高低
近
远
低
高
原子核外电子排布
原子核外电子排布
电子在原子核外排布时,总是尽量先排在能量最低的电子层,然后由内向外依次排布在能量较高的电子层。
能量规律
即电子最先排K层,当K层排满后,再排L层等
原子核外电子排布
数量规律
01
02
03
各电子层最多能容纳的电子数为2n2
最外电子层最多只能容纳 8 个电子(K层为最外层时,最多只能容纳 2 个电子)
次外电子层最多只能容纳 18 个电子
电子层
该电子层上的电子数
粒子符号
原子核
核电荷数
原子核外电子排布
能量最高
决定元素的化学性质
请画出 Cl- 和 Na+ 结构示意图
原子核外电子排布
原子核外电子排布
稀有气体元素原子电子层排布
元素名称 元素符号 各电子层的电子数
1 2 3 4 5 6 最外层电子数
氦 2He 2 2
氖 10Ne 2 8 8
氩 18Ar 2 8 8 8
氪 36Kr 2 8 18 8 8
氙 54Xe 2 8 18 18 8 8
氡 86Rn 2 8 18 32 18 8 8
分析稀有气体的核外电子排布,结合其化学活动性,你发现了什么?
稀有气体元素原子中最外电子层都已经填满,形成了稳定的电子层结构。
原子容易失去电子或得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
原子核外电子排布
稳定结构
原子最外层有8个电子(He为2)处于稳定状态,既不容易失去电子又不容易得到电子,化学性质稳定。
(如He、Ne、Ar)
不稳定结构
(如易失电子的金属元素、易得电子的非金属元素)
在活泼金属单质与活泼非金属单质的反应中:
氧化镁的形成
原子核外电子排布
金属元素的原子失去电子,形成阳离子,在生成的化合物中呈现正化合价;非金属元素的原子得到电子,形成阴离子,在生成的化合物中呈现负化合价。
原子核外电子排布
元素的化学性质主要取决于原子的最外层电子排布,元素的化合价的数值也与原子的电子层结构特别是最外层电子数有关。
原子核外电子排布
1.金属元素原子最外层电子数一般 4,较易 电子,化合价常显_ _价,且正化合价=失电子数=最外层电子数。
2.非金属元素原子最外层电子数一般 4,通常
易 电子,化合价常显 价,且负化合价=-(得电子数)=最外层电子数-8。
小于
失去
正
大于或等于
得到
负
强化巩固
(1)电子层排布相同的是____。
(2)属于同种元素的是____。
(3)属于金属元素的是___。
(4)属于稀有气体元素的是__,稀有气体一般不参与化学反应的原因是
_____________________________________________________________
____________。
BC
AB
D
C
原子的最外电子层已达到8(或2)电子的稳定结构,既不易失去电子也不易得到电子
(5)写出D参加化学反应后所得离子的结构示意图_______。
10电子微粒
延时符
课堂小结
01
02
人类认识原子结构的历程
原子核的构成
延时符
课堂小结
03
04
原子核外电子排布
10电子微粒
课堂练习
D
1.提出原子结构模型的科学家,从时间的先后顺序来看,下列排列正确的是
A.汤姆生、玻尔、卢瑟福、道尔顿
B.汤姆生、玻尔、道尔顿、卢瑟福
C.卢瑟福、道尔顿、汤姆生、玻尔
D.道尔顿、汤姆生、卢瑟福、玻尔
课堂练习
B
2、YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,下列关于 的说法中不正确的是
A.质量数是89 B.中子数与质子数之差为50
C.核外电子数是39
课堂练习
C
A. B.
3.下列各原子结构示意图中所表示的核外电子排布正确的是
C. D.
课堂练习
4.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:___________。
O:
(2)某元素原子L层上的电子数为K层的一半:____________。
Li:
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数相同的离子:______________。
S2-:
(4)某元素原子的最外层电子数等于次外层电子数的2倍:__________。
C:
专题2 研究物质的基本方法
第三单元
人类对原子结构的认识
化学变化中的最小微粒是什么?
原子
阅读课本,梳理总结人类认识原子结构的历程
人类认识原子结构的历程
19世纪初,英国科学家道尔顿总结了一些元素形成化合物时的质量比例关系,提出了近代原子学说。
道尔顿和他的原子结构模型
坚实不可再分的实心球
人类认识原子结构的历程
1897年,汤姆生发现原子中存在电子,并用实验方法测出电子的质量不及氢原子质量的千分之一(后进一步确定为氢原子质量的1/1836)。
汤姆生发现电子,
提出原子结构模型
葡萄干面包式:平均分布着带正电荷的粒子和带负电的电子
人类认识原子结构的历程
1911年,卢瑟福用α粒子轰击金箔。
原子核带正电,电子在其周围高速运动,就像行星围绕太阳运转一样。
卢瑟福根据α粒子散射现象,提出带核的原子结构模型
有核模型或行星模型:带正电荷的核位于中心,质量主要集中在核上,电子沿不同轨道运转。
人类认识原子结构的历程
玻尔研究氢原子光谱,
提出他的原子结构模型
1913年,丹麦物理学家玻尔研究了氢原子的光谱后,根据量子力学的观点,提出了新的原子结构模型:
原子核外电子在一系列稳定的轨道上运动,这些轨道称为原子轨道。核外电子在原子轨道上运动时,既不放出能量,也不吸收能量。
玻尔模型:电子在一定轨道上绕核做高速运动。
人类认识原子结构的历程
原子核的构成
原子
原子核
质子:带 个单位正电荷
中子:不带电
核外电子:带 个单位负电荷
1
1
核电荷数 = 质子数 = 核外电子数 = 原子序数
质子、中子和电子的质量和带电荷量
原子核的构成
质子质量与中子质量相近。
电子质量与质子、中子质量相比,可忽略不计,即原子质量主要集中在原子核上。
原子核的构成
1、定义:将原子核内所有的质子和中子的相对质量取整数加起来所得的数值。
质量数:
2、符号:A
3、质量数(A)=____________________
质子数(Z)+中子数(N)
≈相对原子质量(Ar)
氢元素三种核素的原子结构模型
原子核的构成
1个质子
无中子
1个质子
1个中子
1个质子
2个中子
质子数相同
质子数相同,中子数不同
属同种元素
属同种元素的不同种原子
具有一定质子数和一定中子数的一种原子。
原子核的构成
核素
原子组成的表示方法
表示质子数为 ,质量数为 的碳原子,其中子数为 。
6
12
X
A
Z
——元素符号
质量数 ——
质子数——
C
12
6
6
表示质子数为 ,质量数为 的碳原子,其中子数为 。
6
14
C
14
6
8
原子核的构成
质子数
质子数
中子数
质子
质量
H
1
1
H
2
1
H
3
1
C
12
6
C
14
6
O
16
8
O
18
8
原子核的构成
H
1
1
H
2
1
H
3
1
俗称
重氢
超重氢
符号
H
D
T
氢
H2 和D2 是两种不同的单质,化学性质基本相同
质子数相同 核外电子数相同
化学性质几乎完全相同
中子数不同 物理性质不同 用途不同
原子核的构成
H2O和D2O 化学性质基本相同
D2用于核反应,并在化学和生物学的研究工作中作示踪原子。
①____在考古工作中用于测定文物的年代;
14C
原子核的构成
同位素的应用
② U用于制造原子弹、核发电;
③____ ___用于制造氢弹;
④放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
原子核的构成
①分子或原子:质子数=核电荷数=核外电子数
②阳离子Xn+:质子数=核电荷数=核外电子数+n
③阴离子Xn-:质子数=核电荷数=核外电子数-n
原子核的构成
中的质子数是____,中子数是_____,核外电子数是_____,质量数是_____。
16
18
18
34
现有下列基本微粒:
1H、2H、3H、1H+、234U、235U、238U、 、40K、40Ca、Cl2、14N、14C,请回答下列问题:
(1)在给出的微粒中,含有____种元素,属于氢元素的核素有____种,属于铀元素的核素有_____种,互为同位素的原子分别是_____________,_______________。
7
3
3
1H、2H、3H
234U、235U、238U
(2)质量数相等的微粒为________、__________、________(可不填满,也可补充)。
1H与1H+
40K与40Ca
14N与14C
强化巩固
(3)0.1 mol 中共含______mol中子,含_______个电子。
2.1
2.2NA
强化巩固
K L M N O P
1 2 3 4 5 6
电子层(用n表示)
电子层符号
离核距离
能量高低
近
远
低
高
原子核外电子排布
原子核外电子排布
电子在原子核外排布时,总是尽量先排在能量最低的电子层,然后由内向外依次排布在能量较高的电子层。
能量规律
即电子最先排K层,当K层排满后,再排L层等
原子核外电子排布
数量规律
01
02
03
各电子层最多能容纳的电子数为2n2
最外电子层最多只能容纳 8 个电子(K层为最外层时,最多只能容纳 2 个电子)
次外电子层最多只能容纳 18 个电子
电子层
该电子层上的电子数
粒子符号
原子核
核电荷数
原子核外电子排布
能量最高
决定元素的化学性质
请画出 Cl- 和 Na+ 结构示意图
原子核外电子排布
原子核外电子排布
稀有气体元素原子电子层排布
元素名称 元素符号 各电子层的电子数
1 2 3 4 5 6 最外层电子数
氦 2He 2 2
氖 10Ne 2 8 8
氩 18Ar 2 8 8 8
氪 36Kr 2 8 18 8 8
氙 54Xe 2 8 18 18 8 8
氡 86Rn 2 8 18 32 18 8 8
分析稀有气体的核外电子排布,结合其化学活动性,你发现了什么?
稀有气体元素原子中最外电子层都已经填满,形成了稳定的电子层结构。
原子容易失去电子或得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
原子核外电子排布
稳定结构
原子最外层有8个电子(He为2)处于稳定状态,既不容易失去电子又不容易得到电子,化学性质稳定。
(如He、Ne、Ar)
不稳定结构
(如易失电子的金属元素、易得电子的非金属元素)
在活泼金属单质与活泼非金属单质的反应中:
氧化镁的形成
原子核外电子排布
金属元素的原子失去电子,形成阳离子,在生成的化合物中呈现正化合价;非金属元素的原子得到电子,形成阴离子,在生成的化合物中呈现负化合价。
原子核外电子排布
元素的化学性质主要取决于原子的最外层电子排布,元素的化合价的数值也与原子的电子层结构特别是最外层电子数有关。
原子核外电子排布
1.金属元素原子最外层电子数一般 4,较易 电子,化合价常显_ _价,且正化合价=失电子数=最外层电子数。
2.非金属元素原子最外层电子数一般 4,通常
易 电子,化合价常显 价,且负化合价=-(得电子数)=最外层电子数-8。
小于
失去
正
大于或等于
得到
负
强化巩固
(1)电子层排布相同的是____。
(2)属于同种元素的是____。
(3)属于金属元素的是___。
(4)属于稀有气体元素的是__,稀有气体一般不参与化学反应的原因是
_____________________________________________________________
____________。
BC
AB
D
C
原子的最外电子层已达到8(或2)电子的稳定结构,既不易失去电子也不易得到电子
(5)写出D参加化学反应后所得离子的结构示意图_______。
10电子微粒
延时符
课堂小结
01
02
人类认识原子结构的历程
原子核的构成
延时符
课堂小结
03
04
原子核外电子排布
10电子微粒
课堂练习
D
1.提出原子结构模型的科学家,从时间的先后顺序来看,下列排列正确的是
A.汤姆生、玻尔、卢瑟福、道尔顿
B.汤姆生、玻尔、道尔顿、卢瑟福
C.卢瑟福、道尔顿、汤姆生、玻尔
D.道尔顿、汤姆生、卢瑟福、玻尔
课堂练习
B
2、YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,下列关于 的说法中不正确的是
A.质量数是89 B.中子数与质子数之差为50
C.核外电子数是39
课堂练习
C
A. B.
3.下列各原子结构示意图中所表示的核外电子排布正确的是
C. D.
课堂练习
4.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:___________。
O:
(2)某元素原子L层上的电子数为K层的一半:____________。
Li:
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数相同的离子:______________。
S2-:
(4)某元素原子的最外层电子数等于次外层电子数的2倍:__________。
C:
