专题3从海水中获得的化学物质3.3.2从海水中提取镁从海带中提取溴 课件(共27张PPT) 苏教版(2019)高中化学必修第一册
文档属性
| 名称 | 专题3从海水中获得的化学物质3.3.2从海水中提取镁从海带中提取溴 课件(共27张PPT) 苏教版(2019)高中化学必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 22:03:29 | ||
图片预览





文档简介
(共27张PPT)
第三单元 海洋化学资源的综合利用
第2课时 从海水中提取镁
从海带中提取碘
1.初步了解海洋化学资源的分布,了解从海水或海产品中提取镁、碘单质的基本原理和方法,能依据物质性质及其变化综合利用资源。
2.认识化学理论与技术在资源利用中发挥的积极作用,培养科学态度与社会责任的化学核心素养。
情景导入
一、从海水中提取镁和从海带中提取碘
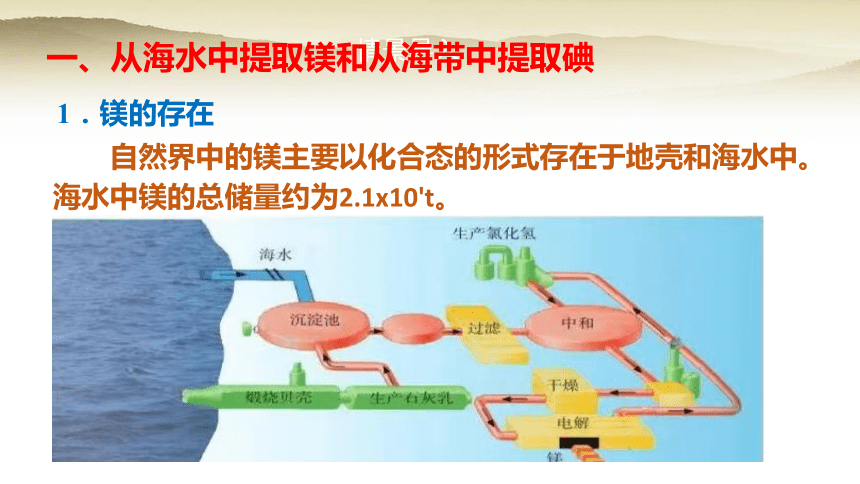
1.镁的存在
自然界中的镁主要以化合态的形式存在于地壳和海水中。海水中镁的总储量约为2.1x10't。
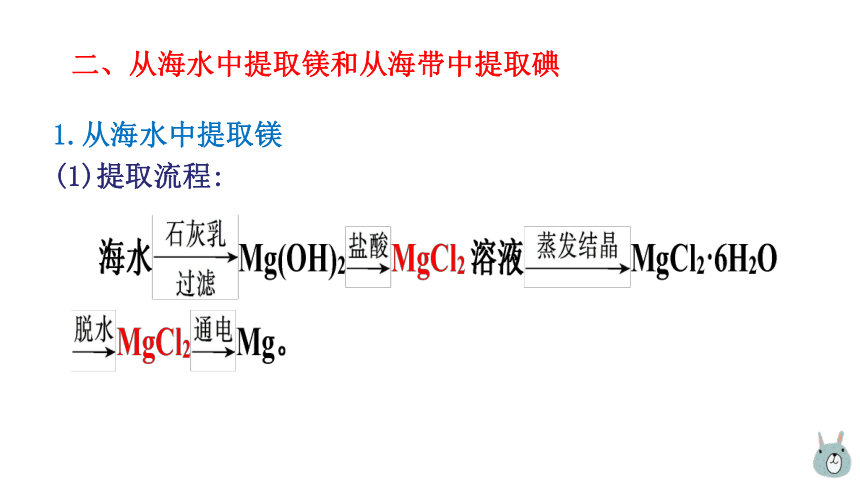
1.从海水中提取镁
(1)提取流程:
二、从海水中提取镁和从海带中提取碘
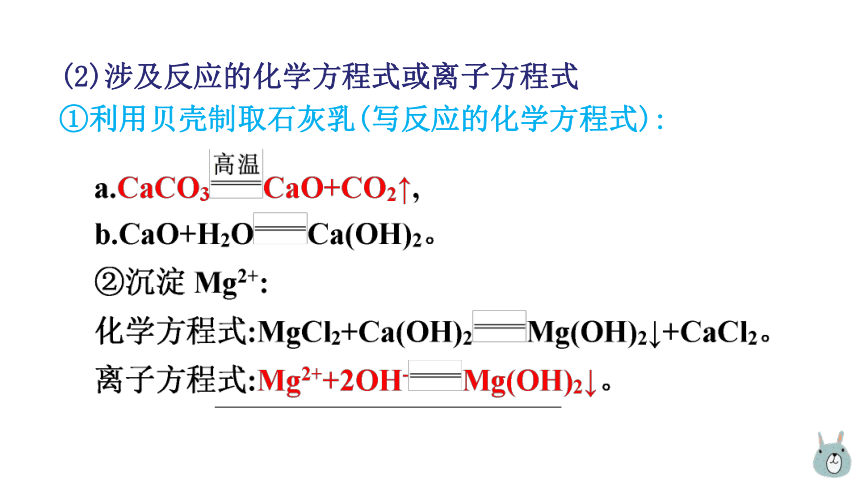
(2)涉及反应的化学方程式或离子方程式
①利用贝壳制取石灰乳(写反应的化学方程式):
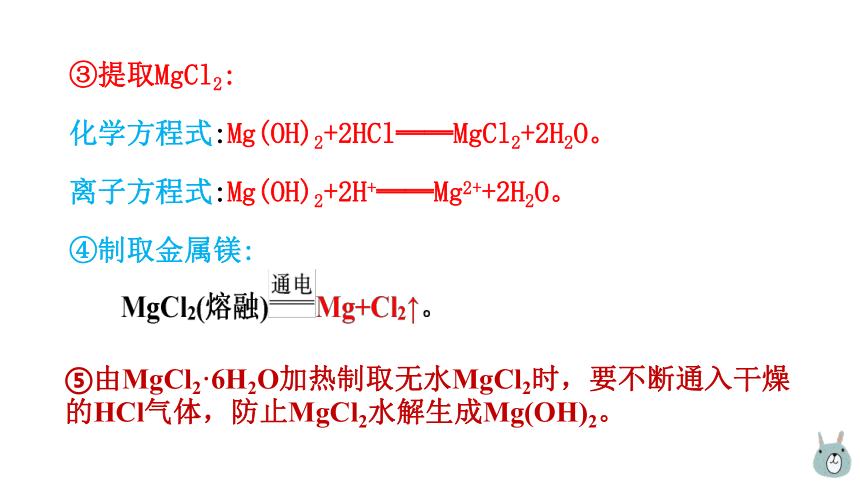
③提取MgCl2:
化学方程式:Mg(OH)2+2HCl══MgCl2+2H2O。
离子方程式:Mg(OH)2+2H+══Mg2++2H2O。
④制取金属镁:
⑤由MgCl2·6H2O加热制取无水MgCl2时,要不断通入干燥的HCl气体,防止MgCl2水解生成Mg(OH)2。
情景导入
三、镁的性质
1.镁的原子结构
镁的原子结构示意图为:
原子最外层有2个电子,在化学反应中容易失去最外层电子,形成镁离子。
2.镁的物理性质
银白色金属,密度较小,熔点较低,硬度较小,易传热、导电。
情景导入
3.镁的化学性质
镁是一种较活泼的金属,具有较强的还原性。可以与非金属单质、水、酸、盐以及某些氧化物反应.
(1)与N2反应
反应方程式:3Mg+N2 Mg3N2。
(2)与CO2反应
反应方程式:2Mg+CO2 2MgO+C。
现象:剧烈燃烧,发出耀眼的白光,生成白色物质并附有黑色固体。
(3)与稀硫酸反应:
离子方程式为 :Mg+2H+===Mg2++H2↑。
情景导入
四、镁的应用
镁是一种重要的金属材料,密度小,能与Cu、Al、Sn、Mn、Ti等金属形成合金,这些镁合金硬度和强度都较大。其应用有:
①镁合金制造火箭、导弹和飞机的部件等。
②氧化镁是优质的耐高温材料,其理由是熔点高达2 800 ℃。
1.从海带中提取碘的主要工艺
工业上不直接由海水提取碘,而是以具有富集碘能力的海藻(如海带等)为原料提取碘。工业上从海带中提取碘的生产过程如图:
向滤液中通入适量的氯气,使滤液中的碘离子转化为碘单质,则反应的离子方程式为2I-+Cl2══ I2+2Cl-。
五、从海带中提取碘
情景导入
2.加碘食盐中碘元素的检验
(1)实验步骤及证明方法:将加碘食盐溶解后加入白醋,然后将混合溶液滴在碘化钾淀粉试纸中央,观察试纸是否变蓝色。
(2)IO3-和I-反应的离子方程式:
IO3-+5I-+6H+===3I2+3H2O。
3.碘与人体健康
人体缺碘时会患甲状腺肿大,我国通过加碘食盐来补充碘元素,加碘食盐中添加的含碘物质一般是KIO3。
1.工业上通过电解熔融MgCl2得到金属镁,工业上能不能通过电解熔融MgO来获得金属镁
解析:不能。因为MgO的熔点高,熔融时耗费更多能源,增加生产成本。
2.镁在空气中燃烧只能生成MgO吗 镁着火时能用干冰灭火器灭火吗 为什么
解析:镁在空气中燃烧会得到MgO、Mg3N2的混合物。不能。镁可以在二氧化碳中燃烧,所以不能用干冰灭火器,可以用沙子盖灭。
即时理解
3.人体缺碘时容易患甲状腺肿大,我国从1994年开始推行全民食用加碘盐工程,对抑制碘缺乏病成效显著。加碘盐中碘是以游离态还是化合态的形式存在 主要成分是什么
解析:加碘盐中的碘主要以碘酸钾的形式存在,所以其为化合态。
经典例题
例1.工业上制取镁粉是将镁蒸气在某气体中冷却,下列可作冷却剂的是( )
A. CO2 B. 空气 C. H2O D. H2
【解析】Mg具有强还原性,可与CO2、O2、H2O(g)、N2反应。
D
例2海水的综合利用可以制备氯化钠和镁,其
流程如图所示:下列说法不正确的是( )
A. 检验母液中是否含氯离子应选用的试剂是
硝酸酸化的硝酸银溶液
B. 上述流程中的脱水过程属于分解反应
C. 上述流程中涉及的变化都属于化学变化
D. 上述流程中生成Mg(OH)2沉淀的离子方程式为Mg2++Ca(OH)2
===Mg(OH)2+Ca2+
C
【解析】用硝酸酸化的AgNO3溶液检验Cl-,A项正确MgCl2·6H2O脱水生成MgCl2和H2O,属于分解反应,B项正确;流程中的海水蒸发属于物理变化,C项错误;石灰乳属于浊液,氢氧化镁为沉淀,在离子反应中不拆,D项正确。
例3.镁在CO2含量较多的空气里燃烧的产物是( )
A. MgO B. MgO和C
C. MgO、Mg3N2 D. MgO、Mg3N2和C
【解析】镁能与氧气反应生成氧化镁,与氮气反应生成氮化镁,与CO2反应生成碳和氧化镁,因此镁在CO2含量较多的空气里燃烧的产物是MgO、Mg3N2和C。
C
例4.海藻中含有丰富的、以离子形式存在的
碘元素。如图是实验室从海藻里提取碘的
流程中的一部分。下列判断正确的是( )
A. 步骤①③的操作分别是过滤、萃取
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是四氯化碳或乙醇
D. 步骤④的操作是过滤
【解析】通过过滤除去海藻灰悬浊液中难溶性杂质而得到含有I-的溶液,向该溶液中通入Cl2将I-氧化为I2,经萃取、分液、蒸馏等操作后即得晶体I2,A正确、D错误;淀粉是用来检验是否有碘单质生成的,不能检验碘离子是否完全转化为碘单质,B错误;乙醇与水互溶,C错误。
A
例5.某同学为了验证海带中含有碘元素,拟进行如下实验,请完成相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中不会用到的实验仪器有________(填字母)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是____________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用________(填字母)。
A.浓硫酸 B.新制氯水 C.酸性高锰酸钾溶液 D.过氧化氢溶液
理由是________________________________________________。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加________溶液,如果________,则证明海带中含有碘元素。
【解析】(2)海带灼烧后的灰烬中含有可溶性碘盐和难溶固体物质。要得到含有I-的溶液,须将灰烬充分溶解,并过滤以除去残渣。(3)浓硫酸、新制氯水、酸性高锰酸钾溶液、过氧化氢溶液均能将碘离子氧化为单质碘。前三者会引入新杂质,而过氧化氢的还原产物为水,无其他物质生成,氧化剂最好选用过氧化氢。
【答案】(1)AGH (2)将灰烬转移到烧杯中,加适量蒸馏水,用玻璃棒充分搅拌,煮沸,过滤 (3)D 过氧化氢又称“绿色氧化剂”,其参加氧化还原反应时还原产物为水,无污染且不引入新的杂质 (4)淀粉 溶液显蓝色
1.初步了解海洋化学资源的分布,了解从海水或海产品中提取镁、碘单质的基本原理和方法,能依据物质性质及其变化综合利用资源。
2.从模型认知视角掌握了从海水中提取镁、碘单质的工艺流程。
3.学习了从实验探究角度掌握镁、碘及其化合物的性质。
课堂小结
随堂练习
1.海带中含有丰富的碘,有人设计如下步骤:
①将海带灼烧成灰,在灰中加水搅拌;②加四氯化碳充分振荡静置;③通入氯气;④过滤;⑤用分液法分离液体混合物。合理操作的先后顺序是( )
A.①②③④⑤ B.①④②③⑤
C.①②④③⑤ D.①④③②⑤
【解析】海带灼烧成灰后,有不溶性的物质,需经过滤,过滤之后,需通入适量氯气将I-氧化为I2,再萃取分液。
D
2.实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是( )
A. 称取5.0 g左右的干海带——托盘天平
B. 灼烧干海带至完全变成灰烬——坩埚
C. 过滤煮沸后的海带灰和水的混合物——漏斗
D. 用四氯化碳从氧化后的海带灰浸取液中提取碘——长颈漏斗
【解析】A项,称量固体用托盘天平,正确;B项,灼烧固体在坩埚中进行,正确;C项,过滤操作的主要仪器是漏斗,正确;D项,萃取需要在分液漏斗中进行,错误。
D
3.下列说法正确的是( )
A. 从海水中提取溴单质的过程中涉及氧化还原反应
B. 从海带中提取碘单质的过程中只涉及复分解反应
C. 从海水中提取镁单质的过程中涉及置换反应
D. 从海水中提取粗盐的过程中涉及化学反应
【解析】从海水中提取单质溴,通常是用氯气氧化溴离子为溴单质,然后鼓入热空气或水蒸气,使溴从溶液中挥发出来,冷凝后得到粗溴,涉及氧化还原反应,A项正确;从海带中提取单质碘,主要反应过程是I- I2,涉及氧化还原反应,不涉及复分解反应,B项错误;从海水中提取镁单质,通常将熟石灰加入海水沉淀池中,沉淀出氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解熔融状态的氯化镁制得金属镁,没有涉及置换反应,C项错误;海水蒸发制粗盐的过程是物理变化,D项错误。
A
4.海洋中有丰富的食品、矿产、能源、药物
和水产资源等,如图所示是海水化学资源利
用的部分过程。下列有关说法正确的是( )
A. 大量含氮、磷等元素的废水排入海洋,易引发赤潮
B. 反应③中加入盐酸,离子方程式为H++OH-===H2O
C. 在反应④⑤⑥中溴元素均被氧化
D. 反应①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的试剂顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
【解析】离子方程式中Mg(OH)2不能拆写,B项错误;反应⑤为Br2+SO2+2H2O===H2SO4+2HBr,溴元素被还原,C项错误;粗盐提纯的顺序中要注意两点:一是Na2CO3溶液在加入BaCl2溶液后加入,二是盐酸最后加入,D项错误。
A
5.检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2===I2+2H2O。下列对该反应的叙述不正确的是( )
A. I2为氧化产物
B. H2O2既作氧化剂又作还原剂
C. 氧化性强弱顺序为H2O2>I2
D. 生成1 mol I2时转移2 mol电子
【解析】 ,该反应中I2为氧化产物,H2O2作氧化剂,根据氧化性:氧化剂>氧化产物,所以氧化性:H2O2>I2;反应中每生成1 mol I2,转移2 mol电子。
B
6.海带是海洋中的一种海藻,海带中含有丰富的碘,是人类经常食用的一种补碘食物。某资料中有“海带中碘的检验”的选做实验,操作步骤如下:
①取3 g左右干海带,除去表面杂质,剪碎,用酒精润湿,放在坩埚中灼烧成灰,冷却;②将海带灰转移到小烧杯中加蒸馏水,搅拌,煮沸2~3 min,使可溶物质溶解,过滤;③向滤液中滴入几滴硫酸,再加入约1 mL 过氧化氢溶液,观察现象;
④取少量上述所得溶液,滴加几滴淀粉溶液,观察现象;⑤向③剩余的滤液中加入1 mL 四氯化碳,振荡静置,观察现象;⑥向加有四氯化碳的溶液中加入氢氧化钠溶液,充分振荡后,将混合液的下层液体放入指定的容器中。请回答下列问题:
(1)海带中碘元素是 (填“碘离子”“碘单质”或“碘酸盐”),步骤①中除去海带表面的杂质一般用刷子刷净,不用水清洗,原因是 。
(2)可说明海带中含有碘的现象有
。
(3)操作⑤叫做 ,操作⑥的目的是
。
【答案】(1)碘离子 防止碘元素的损失 (2)步骤④中加入淀粉溶液后变蓝,步骤⑤中下层液体呈紫红色 (3)萃取 回收四氯化碳
【解析】海带中碘元素以碘离子的形式存在,且易溶于水,为防止碘元素的损失,除去海带表面的杂质一般用刷子刷净,不用水清洗;实验中步骤④中加入淀粉溶液后变蓝;步骤⑤中下层液体呈紫红色可以说明海带中含有碘。操作⑤是萃取碘水中的碘,操作⑥是为了回收四氯化碳。
第三单元 海洋化学资源的综合利用
第2课时 从海水中提取镁
从海带中提取碘
1.初步了解海洋化学资源的分布,了解从海水或海产品中提取镁、碘单质的基本原理和方法,能依据物质性质及其变化综合利用资源。
2.认识化学理论与技术在资源利用中发挥的积极作用,培养科学态度与社会责任的化学核心素养。
情景导入
一、从海水中提取镁和从海带中提取碘
1.镁的存在
自然界中的镁主要以化合态的形式存在于地壳和海水中。海水中镁的总储量约为2.1x10't。
1.从海水中提取镁
(1)提取流程:
二、从海水中提取镁和从海带中提取碘
(2)涉及反应的化学方程式或离子方程式
①利用贝壳制取石灰乳(写反应的化学方程式):
③提取MgCl2:
化学方程式:Mg(OH)2+2HCl══MgCl2+2H2O。
离子方程式:Mg(OH)2+2H+══Mg2++2H2O。
④制取金属镁:
⑤由MgCl2·6H2O加热制取无水MgCl2时,要不断通入干燥的HCl气体,防止MgCl2水解生成Mg(OH)2。
情景导入
三、镁的性质
1.镁的原子结构
镁的原子结构示意图为:
原子最外层有2个电子,在化学反应中容易失去最外层电子,形成镁离子。
2.镁的物理性质
银白色金属,密度较小,熔点较低,硬度较小,易传热、导电。
情景导入
3.镁的化学性质
镁是一种较活泼的金属,具有较强的还原性。可以与非金属单质、水、酸、盐以及某些氧化物反应.
(1)与N2反应
反应方程式:3Mg+N2 Mg3N2。
(2)与CO2反应
反应方程式:2Mg+CO2 2MgO+C。
现象:剧烈燃烧,发出耀眼的白光,生成白色物质并附有黑色固体。
(3)与稀硫酸反应:
离子方程式为 :Mg+2H+===Mg2++H2↑。
情景导入
四、镁的应用
镁是一种重要的金属材料,密度小,能与Cu、Al、Sn、Mn、Ti等金属形成合金,这些镁合金硬度和强度都较大。其应用有:
①镁合金制造火箭、导弹和飞机的部件等。
②氧化镁是优质的耐高温材料,其理由是熔点高达2 800 ℃。
1.从海带中提取碘的主要工艺
工业上不直接由海水提取碘,而是以具有富集碘能力的海藻(如海带等)为原料提取碘。工业上从海带中提取碘的生产过程如图:
向滤液中通入适量的氯气,使滤液中的碘离子转化为碘单质,则反应的离子方程式为2I-+Cl2══ I2+2Cl-。
五、从海带中提取碘
情景导入
2.加碘食盐中碘元素的检验
(1)实验步骤及证明方法:将加碘食盐溶解后加入白醋,然后将混合溶液滴在碘化钾淀粉试纸中央,观察试纸是否变蓝色。
(2)IO3-和I-反应的离子方程式:
IO3-+5I-+6H+===3I2+3H2O。
3.碘与人体健康
人体缺碘时会患甲状腺肿大,我国通过加碘食盐来补充碘元素,加碘食盐中添加的含碘物质一般是KIO3。
1.工业上通过电解熔融MgCl2得到金属镁,工业上能不能通过电解熔融MgO来获得金属镁
解析:不能。因为MgO的熔点高,熔融时耗费更多能源,增加生产成本。
2.镁在空气中燃烧只能生成MgO吗 镁着火时能用干冰灭火器灭火吗 为什么
解析:镁在空气中燃烧会得到MgO、Mg3N2的混合物。不能。镁可以在二氧化碳中燃烧,所以不能用干冰灭火器,可以用沙子盖灭。
即时理解
3.人体缺碘时容易患甲状腺肿大,我国从1994年开始推行全民食用加碘盐工程,对抑制碘缺乏病成效显著。加碘盐中碘是以游离态还是化合态的形式存在 主要成分是什么
解析:加碘盐中的碘主要以碘酸钾的形式存在,所以其为化合态。
经典例题
例1.工业上制取镁粉是将镁蒸气在某气体中冷却,下列可作冷却剂的是( )
A. CO2 B. 空气 C. H2O D. H2
【解析】Mg具有强还原性,可与CO2、O2、H2O(g)、N2反应。
D
例2海水的综合利用可以制备氯化钠和镁,其
流程如图所示:下列说法不正确的是( )
A. 检验母液中是否含氯离子应选用的试剂是
硝酸酸化的硝酸银溶液
B. 上述流程中的脱水过程属于分解反应
C. 上述流程中涉及的变化都属于化学变化
D. 上述流程中生成Mg(OH)2沉淀的离子方程式为Mg2++Ca(OH)2
===Mg(OH)2+Ca2+
C
【解析】用硝酸酸化的AgNO3溶液检验Cl-,A项正确MgCl2·6H2O脱水生成MgCl2和H2O,属于分解反应,B项正确;流程中的海水蒸发属于物理变化,C项错误;石灰乳属于浊液,氢氧化镁为沉淀,在离子反应中不拆,D项正确。
例3.镁在CO2含量较多的空气里燃烧的产物是( )
A. MgO B. MgO和C
C. MgO、Mg3N2 D. MgO、Mg3N2和C
【解析】镁能与氧气反应生成氧化镁,与氮气反应生成氮化镁,与CO2反应生成碳和氧化镁,因此镁在CO2含量较多的空气里燃烧的产物是MgO、Mg3N2和C。
C
例4.海藻中含有丰富的、以离子形式存在的
碘元素。如图是实验室从海藻里提取碘的
流程中的一部分。下列判断正确的是( )
A. 步骤①③的操作分别是过滤、萃取
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是四氯化碳或乙醇
D. 步骤④的操作是过滤
【解析】通过过滤除去海藻灰悬浊液中难溶性杂质而得到含有I-的溶液,向该溶液中通入Cl2将I-氧化为I2,经萃取、分液、蒸馏等操作后即得晶体I2,A正确、D错误;淀粉是用来检验是否有碘单质生成的,不能检验碘离子是否完全转化为碘单质,B错误;乙醇与水互溶,C错误。
A
例5.某同学为了验证海带中含有碘元素,拟进行如下实验,请完成相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中不会用到的实验仪器有________(填字母)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是____________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用________(填字母)。
A.浓硫酸 B.新制氯水 C.酸性高锰酸钾溶液 D.过氧化氢溶液
理由是________________________________________________。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加________溶液,如果________,则证明海带中含有碘元素。
【解析】(2)海带灼烧后的灰烬中含有可溶性碘盐和难溶固体物质。要得到含有I-的溶液,须将灰烬充分溶解,并过滤以除去残渣。(3)浓硫酸、新制氯水、酸性高锰酸钾溶液、过氧化氢溶液均能将碘离子氧化为单质碘。前三者会引入新杂质,而过氧化氢的还原产物为水,无其他物质生成,氧化剂最好选用过氧化氢。
【答案】(1)AGH (2)将灰烬转移到烧杯中,加适量蒸馏水,用玻璃棒充分搅拌,煮沸,过滤 (3)D 过氧化氢又称“绿色氧化剂”,其参加氧化还原反应时还原产物为水,无污染且不引入新的杂质 (4)淀粉 溶液显蓝色
1.初步了解海洋化学资源的分布,了解从海水或海产品中提取镁、碘单质的基本原理和方法,能依据物质性质及其变化综合利用资源。
2.从模型认知视角掌握了从海水中提取镁、碘单质的工艺流程。
3.学习了从实验探究角度掌握镁、碘及其化合物的性质。
课堂小结
随堂练习
1.海带中含有丰富的碘,有人设计如下步骤:
①将海带灼烧成灰,在灰中加水搅拌;②加四氯化碳充分振荡静置;③通入氯气;④过滤;⑤用分液法分离液体混合物。合理操作的先后顺序是( )
A.①②③④⑤ B.①④②③⑤
C.①②④③⑤ D.①④③②⑤
【解析】海带灼烧成灰后,有不溶性的物质,需经过滤,过滤之后,需通入适量氯气将I-氧化为I2,再萃取分液。
D
2.实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是( )
A. 称取5.0 g左右的干海带——托盘天平
B. 灼烧干海带至完全变成灰烬——坩埚
C. 过滤煮沸后的海带灰和水的混合物——漏斗
D. 用四氯化碳从氧化后的海带灰浸取液中提取碘——长颈漏斗
【解析】A项,称量固体用托盘天平,正确;B项,灼烧固体在坩埚中进行,正确;C项,过滤操作的主要仪器是漏斗,正确;D项,萃取需要在分液漏斗中进行,错误。
D
3.下列说法正确的是( )
A. 从海水中提取溴单质的过程中涉及氧化还原反应
B. 从海带中提取碘单质的过程中只涉及复分解反应
C. 从海水中提取镁单质的过程中涉及置换反应
D. 从海水中提取粗盐的过程中涉及化学反应
【解析】从海水中提取单质溴,通常是用氯气氧化溴离子为溴单质,然后鼓入热空气或水蒸气,使溴从溶液中挥发出来,冷凝后得到粗溴,涉及氧化还原反应,A项正确;从海带中提取单质碘,主要反应过程是I- I2,涉及氧化还原反应,不涉及复分解反应,B项错误;从海水中提取镁单质,通常将熟石灰加入海水沉淀池中,沉淀出氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解熔融状态的氯化镁制得金属镁,没有涉及置换反应,C项错误;海水蒸发制粗盐的过程是物理变化,D项错误。
A
4.海洋中有丰富的食品、矿产、能源、药物
和水产资源等,如图所示是海水化学资源利
用的部分过程。下列有关说法正确的是( )
A. 大量含氮、磷等元素的废水排入海洋,易引发赤潮
B. 反应③中加入盐酸,离子方程式为H++OH-===H2O
C. 在反应④⑤⑥中溴元素均被氧化
D. 反应①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的试剂顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
【解析】离子方程式中Mg(OH)2不能拆写,B项错误;反应⑤为Br2+SO2+2H2O===H2SO4+2HBr,溴元素被还原,C项错误;粗盐提纯的顺序中要注意两点:一是Na2CO3溶液在加入BaCl2溶液后加入,二是盐酸最后加入,D项错误。
A
5.检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2===I2+2H2O。下列对该反应的叙述不正确的是( )
A. I2为氧化产物
B. H2O2既作氧化剂又作还原剂
C. 氧化性强弱顺序为H2O2>I2
D. 生成1 mol I2时转移2 mol电子
【解析】 ,该反应中I2为氧化产物,H2O2作氧化剂,根据氧化性:氧化剂>氧化产物,所以氧化性:H2O2>I2;反应中每生成1 mol I2,转移2 mol电子。
B
6.海带是海洋中的一种海藻,海带中含有丰富的碘,是人类经常食用的一种补碘食物。某资料中有“海带中碘的检验”的选做实验,操作步骤如下:
①取3 g左右干海带,除去表面杂质,剪碎,用酒精润湿,放在坩埚中灼烧成灰,冷却;②将海带灰转移到小烧杯中加蒸馏水,搅拌,煮沸2~3 min,使可溶物质溶解,过滤;③向滤液中滴入几滴硫酸,再加入约1 mL 过氧化氢溶液,观察现象;
④取少量上述所得溶液,滴加几滴淀粉溶液,观察现象;⑤向③剩余的滤液中加入1 mL 四氯化碳,振荡静置,观察现象;⑥向加有四氯化碳的溶液中加入氢氧化钠溶液,充分振荡后,将混合液的下层液体放入指定的容器中。请回答下列问题:
(1)海带中碘元素是 (填“碘离子”“碘单质”或“碘酸盐”),步骤①中除去海带表面的杂质一般用刷子刷净,不用水清洗,原因是 。
(2)可说明海带中含有碘的现象有
。
(3)操作⑤叫做 ,操作⑥的目的是
。
【答案】(1)碘离子 防止碘元素的损失 (2)步骤④中加入淀粉溶液后变蓝,步骤⑤中下层液体呈紫红色 (3)萃取 回收四氯化碳
【解析】海带中碘元素以碘离子的形式存在,且易溶于水,为防止碘元素的损失,除去海带表面的杂质一般用刷子刷净,不用水清洗;实验中步骤④中加入淀粉溶液后变蓝;步骤⑤中下层液体呈紫红色可以说明海带中含有碘。操作⑤是萃取碘水中的碘,操作⑥是为了回收四氯化碳。
