3.1《铁盐和亚铁盐》课件 (共31张PPT) 高中化学 人教版(2019) 必修 第一册
文档属性
| 名称 | 3.1《铁盐和亚铁盐》课件 (共31张PPT) 高中化学 人教版(2019) 必修 第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-06 19:55:32 | ||
图片预览









文档简介
(共31张PPT)
第三章 金属及其化合物
铁 盐 和 亚 铁 盐
学习目标:
1.知道Fe3+与Fe2+的检验方法
2.掌握Fe3+与Fe2+的相互转化
如何检验
与
铁盐
思考与讨论
亚铁盐
3
1、颜色
氯化亚铁溶液
氯化铁溶液
【一】如何检验Fe2+、Fe3+
3
2、加入氢氧化钠溶液---看生成物颜色
铁盐(FeCl3)中滴加氢氧化钠溶液
红褐色沉淀
Fe3++3OH-=Fe(OH)3 ↓
3
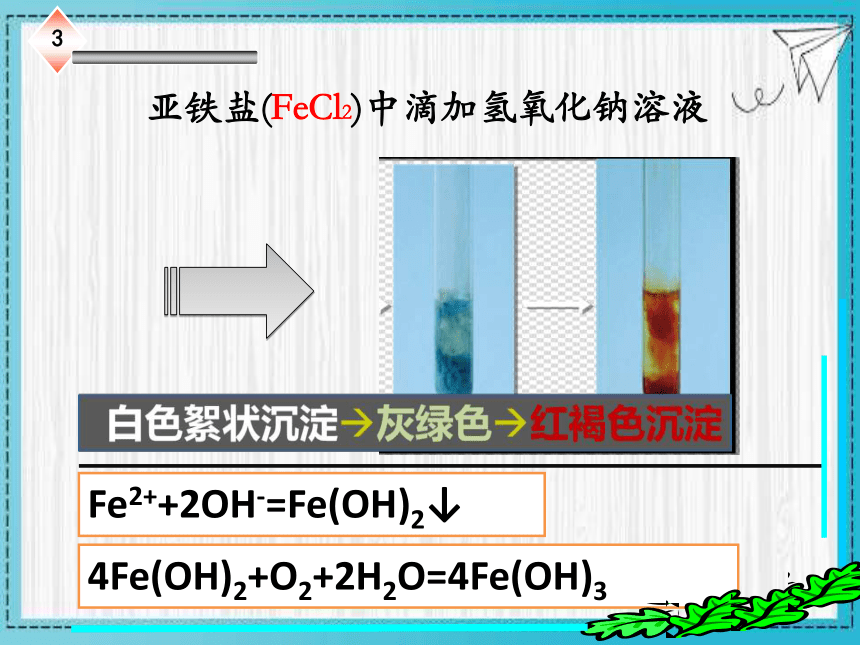
亚铁盐(FeCl2)中滴加氢氧化钠溶液
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
3
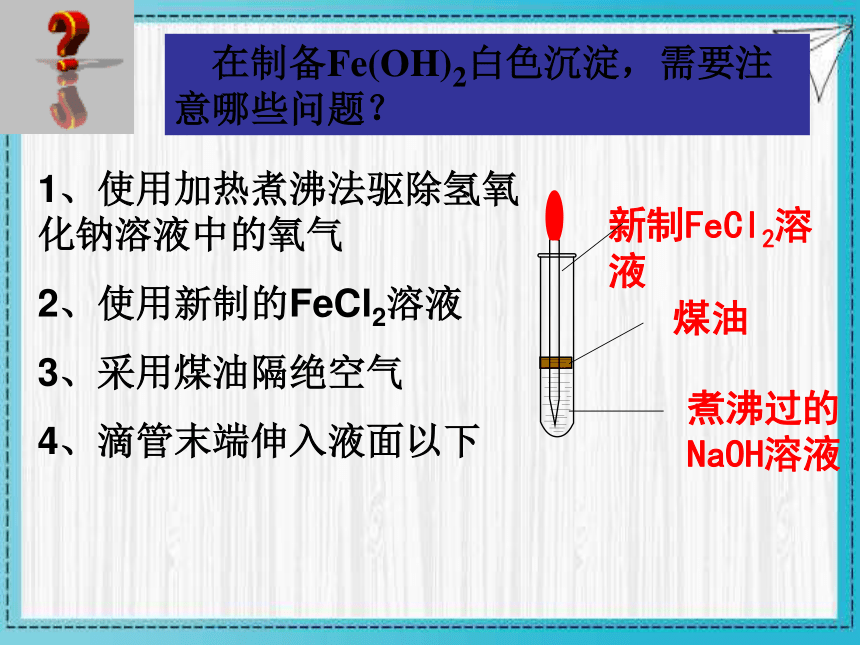
在制备Fe(OH)2白色沉淀,需要注意哪些问题?
1、使用加热煮沸法驱除氢氧化钠溶液中的氧气
2、使用新制的FeCl2溶液
3、采用煤油隔绝空气
4、滴管末端伸入液面以下
煤油
煮沸过的NaOH溶液
新制FeCl2溶液
思考:当铁盐和亚铁盐浓度很稀时,上述两种方法可否鉴别二者?
答案:实验才有说服性!
经过证明,无法鉴别
除了用上述两种方法进行判断之外,还有哪些检验Fe2+、Fe3+的方法呢?
思考
3
请同学们认真阅读课本 第61页实验3-10 内容,回答以下问题:
找出Fe3+检验的其他方法?现象是什么?
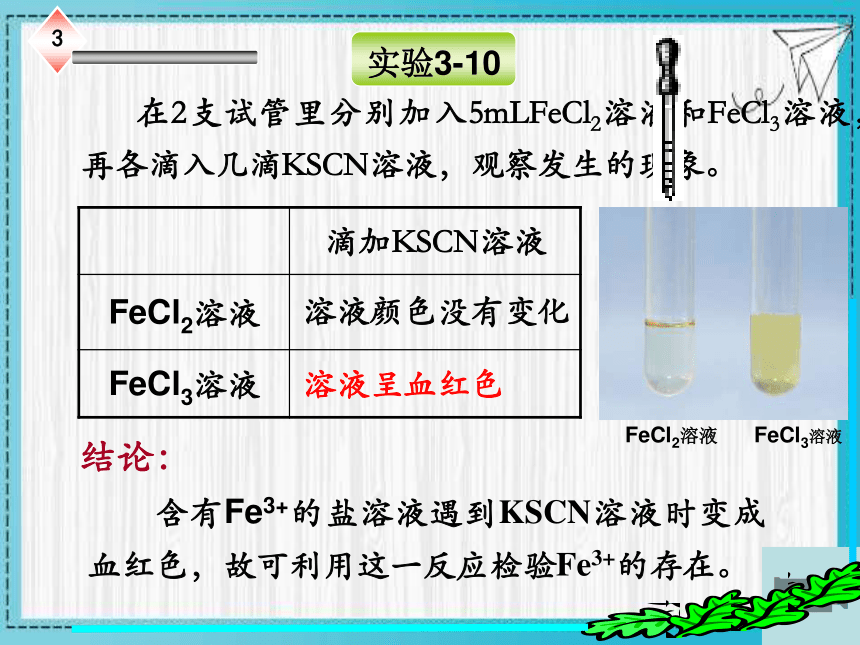
在2支试管里分别加入5mLFeCl2溶液和FeCl3溶液,再各滴入几滴KSCN溶液,观察发生的现象。
滴加KSCN溶液
FeCl2溶液
FeCl3溶液
溶液呈血红色
溶液颜色没有变化
含有Fe3+的盐溶液遇到KSCN溶液时变成血红色,故可利用这一反应检验Fe3+的存在。
结论:
FeCl2溶液
FeCl3溶液
实验3-10
3
真相1
Fe3+ + 3SCN Fe
3
-
影视片中一种道具血 由 Fe 与SCN 反应制得!
3+
-
3
(SCN)
Fe3+ + 3SCN Fe
3+
-
影视片中一种道具血 由 Fe 与SCN 反应制得!
3+
-
3
(1)溶液颜色:Fe 2+ Fe3+ .
Fe2+ 和Fe3+的鉴别方法:
浅绿色
黄色
红色
(2)碱液法:分别加入碱液(或氨水),生成 色沉淀的溶液中含有Fe3+,先生成 色沉淀,又迅速转变为 色,最后变为 的溶液中含有Fe2+
红褐
白
灰绿
红褐色
(3)KSCN法:滴入KSCN溶液,呈______ 的溶液中含有Fe 3+
(灵敏度高)
切开的苹果在空气中会生锈,你注意过吗 如果告诉你是铁引起的,请你分析原因?
苹果也会生锈
苹果中含有一种带有+2价铁元素
的酶,在空气中会被氧化,氧化后变成
黄色,就像铁生了锈一样.
苹果也会生锈
【二】铁盐与亚铁盐的相互转化
科学探究
理论分析
从化合价的角度分析铁盐和亚铁盐的性质
价态规律
当元素具有可变化合价时, 一般处于最高 价态时只具有氧化性,处于最低价态时只具有还原性,处于中间价态时既具有氧化性又具有还原性。
铁元素化合价(Fe):
0
+2
+3
↑
↓
↑
↓
铁盐有氧化性,与常见氧化剂相比氧化性如何?
亚铁盐两种性质都有,是平分秋色还是有所偏重?
分析结果
实验探究
1.实验原理
4.观察记录
2.设计方案
3. 论证评价
5.现象解释
6.得出结论
方案
实施
实 验 探 究 流 程
分6组进行实验
1-3组探究 Fe2+转化为Fe3+条件
4-6组探究 Fe3+转化为Fe2+条件
实验用品:
FeCl3、FeCl2、 硫氰化钾、铁粉、酸性KMnO4、H2O2、维生素C (抗氧化剂)、Cu、KI溶液。
研究课题一 Fe2+转化为Fe3+
讨论:
1.原理:
2.方案:
1-3组探究 Fe2+转化为Fe3+条件
(二).Fe2+和Fe3+ 的相互转化
探究课题二 Fe3+转化为Fe2+
讨论:
1.实验原理:
2.方案:
(二).Fe2+和Fe3+ 的相互转化
4-6组探究 Fe3+转化为Fe2+条件
探究实验 1-1 : Fe2+被 KMnO4氧化
实验 现象
紫色褪去
溶液变红色
5Fe2++MnO4-+8H+= 5Fe3++Mn2++4H2O
Fe3++3SCN-=Fe(SCN)3
反应原理
操作步骤
(1)将FeCl2滴入酸性KMnO4溶液中
(2)再向上述溶液中滴几滴KSCN
探究实验1-2Fe2+被 H2O2氧化
操作步骤 实验现象 反应原理
无明显变化
溶液立即变红
Fe3++3SCN-=Fe(SCN)3
2Fe2++H2O2+2H+=2Fe3++2H2O
(1)在FeCl2溶液中加几滴KSCN溶液
(2)再滴加几滴和H2O2
总结、Fe2+ → Fe3+ :
加入氧化剂:
O2、氯水、H2O2、酸性KMnO4溶液;
探究实验1-3: Fe3+被Fe还原
操作步骤 实验现象 反应原理
溶液不变红色
Fe+2Fe3+=3Fe2+
(1)取少量铁粉于试管
(2)向试管中加入1~2ml FeCl3溶液,振荡,滴入几滴KSCN溶液。
2FeCl3 + Fe ═ 3FeCl2
总结、Fe3+ → Fe2+ :
加入还原剂:
Fe、Cu、KI溶液
结论
Fe2+
Fe3+
加氧化剂如:
O2、Cl2、Br2、
浓H2SO4、H2O2
KMnO4、HNO3等
加还原剂如:
Fe、Cu、维生素C、I-、S2-、H2S等
3
1.为什么实验室在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?
答:防止Fe2+被氧化成Fe3+
Fe+2Fe3+=3Fe2+
硫酸亚铁溶液
3
【知识运用】
2.了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
2Fe3++Cu=2Fe2++Cu2+
2FeCl3 + Cu ═ 2FeCl2 + CuCl2
【知识运用】
3
资料一:茶水中含有鞣酸
资料二:鞣酸和铁离子生成的鞣酸铁是黑色沉淀,鞣酸亚铁是无色易溶于水的物质。
资料三:维生素C
3.根据提供的信息对茶水变色的魔术揭秘
【化学性质】显酸性,具有较强的还原性。
【治疗贫血】使难以吸收利用的三价铁还原成二价铁,促进人体对二价铁的吸收,有助于治疗缺铁性贫血。
【知识运用】
第三章 金属及其化合物
铁 盐 和 亚 铁 盐
学习目标:
1.知道Fe3+与Fe2+的检验方法
2.掌握Fe3+与Fe2+的相互转化
如何检验
与
铁盐
思考与讨论
亚铁盐
3
1、颜色
氯化亚铁溶液
氯化铁溶液
【一】如何检验Fe2+、Fe3+
3
2、加入氢氧化钠溶液---看生成物颜色
铁盐(FeCl3)中滴加氢氧化钠溶液
红褐色沉淀
Fe3++3OH-=Fe(OH)3 ↓
3
亚铁盐(FeCl2)中滴加氢氧化钠溶液
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
3
在制备Fe(OH)2白色沉淀,需要注意哪些问题?
1、使用加热煮沸法驱除氢氧化钠溶液中的氧气
2、使用新制的FeCl2溶液
3、采用煤油隔绝空气
4、滴管末端伸入液面以下
煤油
煮沸过的NaOH溶液
新制FeCl2溶液
思考:当铁盐和亚铁盐浓度很稀时,上述两种方法可否鉴别二者?
答案:实验才有说服性!
经过证明,无法鉴别
除了用上述两种方法进行判断之外,还有哪些检验Fe2+、Fe3+的方法呢?
思考
3
请同学们认真阅读课本 第61页实验3-10 内容,回答以下问题:
找出Fe3+检验的其他方法?现象是什么?
在2支试管里分别加入5mLFeCl2溶液和FeCl3溶液,再各滴入几滴KSCN溶液,观察发生的现象。
滴加KSCN溶液
FeCl2溶液
FeCl3溶液
溶液呈血红色
溶液颜色没有变化
含有Fe3+的盐溶液遇到KSCN溶液时变成血红色,故可利用这一反应检验Fe3+的存在。
结论:
FeCl2溶液
FeCl3溶液
实验3-10
3
真相1
Fe3+ + 3SCN Fe
3
-
影视片中一种道具血 由 Fe 与SCN 反应制得!
3+
-
3
(SCN)
Fe3+ + 3SCN Fe
3+
-
影视片中一种道具血 由 Fe 与SCN 反应制得!
3+
-
3
(1)溶液颜色:Fe 2+ Fe3+ .
Fe2+ 和Fe3+的鉴别方法:
浅绿色
黄色
红色
(2)碱液法:分别加入碱液(或氨水),生成 色沉淀的溶液中含有Fe3+,先生成 色沉淀,又迅速转变为 色,最后变为 的溶液中含有Fe2+
红褐
白
灰绿
红褐色
(3)KSCN法:滴入KSCN溶液,呈______ 的溶液中含有Fe 3+
(灵敏度高)
切开的苹果在空气中会生锈,你注意过吗 如果告诉你是铁引起的,请你分析原因?
苹果也会生锈
苹果中含有一种带有+2价铁元素
的酶,在空气中会被氧化,氧化后变成
黄色,就像铁生了锈一样.
苹果也会生锈
【二】铁盐与亚铁盐的相互转化
科学探究
理论分析
从化合价的角度分析铁盐和亚铁盐的性质
价态规律
当元素具有可变化合价时, 一般处于最高 价态时只具有氧化性,处于最低价态时只具有还原性,处于中间价态时既具有氧化性又具有还原性。
铁元素化合价(Fe):
0
+2
+3
↑
↓
↑
↓
铁盐有氧化性,与常见氧化剂相比氧化性如何?
亚铁盐两种性质都有,是平分秋色还是有所偏重?
分析结果
实验探究
1.实验原理
4.观察记录
2.设计方案
3. 论证评价
5.现象解释
6.得出结论
方案
实施
实 验 探 究 流 程
分6组进行实验
1-3组探究 Fe2+转化为Fe3+条件
4-6组探究 Fe3+转化为Fe2+条件
实验用品:
FeCl3、FeCl2、 硫氰化钾、铁粉、酸性KMnO4、H2O2、维生素C (抗氧化剂)、Cu、KI溶液。
研究课题一 Fe2+转化为Fe3+
讨论:
1.原理:
2.方案:
1-3组探究 Fe2+转化为Fe3+条件
(二).Fe2+和Fe3+ 的相互转化
探究课题二 Fe3+转化为Fe2+
讨论:
1.实验原理:
2.方案:
(二).Fe2+和Fe3+ 的相互转化
4-6组探究 Fe3+转化为Fe2+条件
探究实验 1-1 : Fe2+被 KMnO4氧化
实验 现象
紫色褪去
溶液变红色
5Fe2++MnO4-+8H+= 5Fe3++Mn2++4H2O
Fe3++3SCN-=Fe(SCN)3
反应原理
操作步骤
(1)将FeCl2滴入酸性KMnO4溶液中
(2)再向上述溶液中滴几滴KSCN
探究实验1-2Fe2+被 H2O2氧化
操作步骤 实验现象 反应原理
无明显变化
溶液立即变红
Fe3++3SCN-=Fe(SCN)3
2Fe2++H2O2+2H+=2Fe3++2H2O
(1)在FeCl2溶液中加几滴KSCN溶液
(2)再滴加几滴和H2O2
总结、Fe2+ → Fe3+ :
加入氧化剂:
O2、氯水、H2O2、酸性KMnO4溶液;
探究实验1-3: Fe3+被Fe还原
操作步骤 实验现象 反应原理
溶液不变红色
Fe+2Fe3+=3Fe2+
(1)取少量铁粉于试管
(2)向试管中加入1~2ml FeCl3溶液,振荡,滴入几滴KSCN溶液。
2FeCl3 + Fe ═ 3FeCl2
总结、Fe3+ → Fe2+ :
加入还原剂:
Fe、Cu、KI溶液
结论
Fe2+
Fe3+
加氧化剂如:
O2、Cl2、Br2、
浓H2SO4、H2O2
KMnO4、HNO3等
加还原剂如:
Fe、Cu、维生素C、I-、S2-、H2S等
3
1.为什么实验室在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?
答:防止Fe2+被氧化成Fe3+
Fe+2Fe3+=3Fe2+
硫酸亚铁溶液
3
【知识运用】
2.了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
2Fe3++Cu=2Fe2++Cu2+
2FeCl3 + Cu ═ 2FeCl2 + CuCl2
【知识运用】
3
资料一:茶水中含有鞣酸
资料二:鞣酸和铁离子生成的鞣酸铁是黑色沉淀,鞣酸亚铁是无色易溶于水的物质。
资料三:维生素C
3.根据提供的信息对茶水变色的魔术揭秘
【化学性质】显酸性,具有较强的还原性。
【治疗贫血】使难以吸收利用的三价铁还原成二价铁,促进人体对二价铁的吸收,有助于治疗缺铁性贫血。
【知识运用】
