新人教版必修1高中化学第四章 第四节 氨气公开课课件 (共14张PPT)
文档属性
| 名称 | 新人教版必修1高中化学第四章 第四节 氨气公开课课件 (共14张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 380.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-22 23:10:14 | ||
图片预览




文档简介
课件14张PPT。氨和铵盐 19世纪以前,农业上所需氮肥的来源主要来自有机物的副产品,如粪类。随着农业的发展,对氮肥的需求量在迅速增长。一些有远见的化学家指出:考虑到将来的粮食问题,为了使子孙后代免于饥饿,我们必须寄希望于实现大气固氮。因此将空气中丰富的氮固定下来并转化为可被利用的形式,在20世纪初成为一项受到众多科学家注目和关切的重大课题。
德国化学家哈伯在合成氨方面作出了巨大贡献,获得了1918年诺贝尔化学奖。N2+3H2 2NH3 纯净的氨气是一种 色,有 气味的气体,密度比空气 。氨 溶于水,常温下,1体积水大约可溶解700体积氨。氨易液化,液氨在汽化时要吸收大量的热,所以常用来作 。
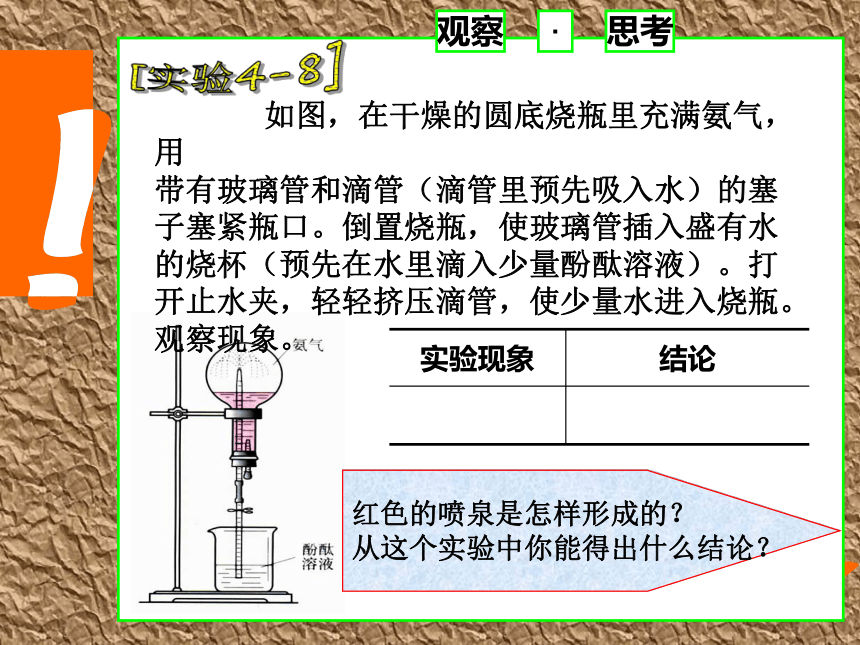
一、氨的性质1、氨气的物理性质无刺激性小极易制冷剂观察· 如图,在干燥的圆底烧瓶里充满氨气,用
带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯(预先在水里滴入少量酚酞溶液)。打开止水夹,轻轻挤压滴管,使少量水进入烧瓶。观察现象。 思考[实验4-8]红色的喷泉是怎样形成的?
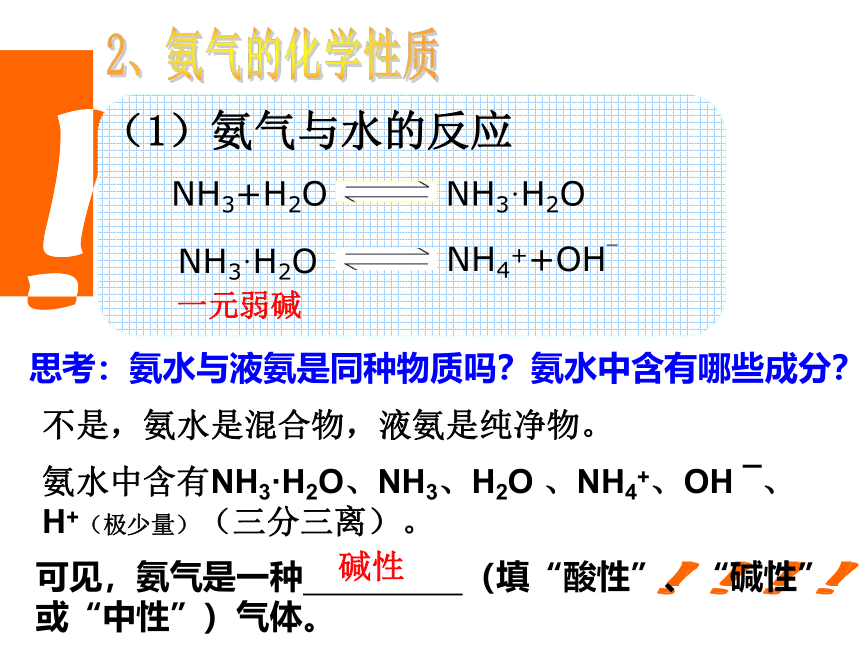
从这个实验中你能得出什么结论?(1)氨气与水的反应2、氨气的化学性质一元弱碱思考:氨水与液氨是同种物质吗?氨水中含有哪些成分?不是,氨水是混合物,液氨是纯净物。氨水中含有NH3·H2O、NH3、H2O 、NH4+、OH ˉ、H+(极少量)(三分三离)。
可见,氨气是一种 (填“酸性”、“碱性”或“中性”)气体。 碱性 思考:为什么蘸有浓氨水的玻璃棒和蘸有浓盐酸的玻璃棒不接触就能反应?NH3+HCl = NH4Cl产生大量白烟氨气是中学阶段涉及的唯一一种碱性气体。拓展·迁移(1)氨气与浓硫酸、浓硝酸能否发生反应?反应现象与氨气与浓盐酸反应的现象相同吗?为什么?
思考:浓硫酸是实验室常用的干燥剂,请问可以用来干燥氨气吗?你预测氨气还具有哪些化学性质?NH3-3(3)氨气具有还原性
4NH3+5O2 4NO+6H2O思考:这步化学反应有什么意义?你能写出实现以上转化的每一步化学方程式吗? 氯气有毒,化工厂常用浓氨水检验管道是否漏氯气。如氯气泄漏,会在管道周围产生大量白烟。你能写出该反应的化学方程式吗?思考与交流:3Cl2+8NH3===6NH4Cl+N2根据氨气的性质,你能总结它的用途吗?3、氨气的用途课堂练习1.下列关于氨的性质的叙述,错误的是( )
A.氨气极易溶于水
B.氨水呈碱性
C.NH3·H2O很稳定,受热不分解
D.氨气的密度比空气小
2.氨水呈弱碱性的原因是( )
A.通常状况下,氨气的溶解度较大
B.氨水中的NH3·H2O电离出少量的OH-
C.溶于水的氨气生成少量NH3·H2O全部电离生成OH-
D.氨气本身的碱性弱
CB3.下列各组离子中,能大量共存的是( )
A.Al3+、Cl-、OH-、K+
B.H+、Na+、NO3-、CO32-
C.NH4+、SO42-、K+、OH-
D.Na+、NH4+、Cl-、NO3-
4.有关氨气的性质的叙述中正确的是( )
A.氨不能在空气中燃烧,是因为O2不能将NH3氧化
B.氨水显碱性
C.氨气和酸相遇都能产生白色烟雾
D.在反应NH3+H+==NH4+中,氨失去电子被氧化
DB5.有关氨气的实验较多,下面对这些实验原理的分析中,正确的是( )
A.氨气极易溶于水,可以用来做喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.NH3·H2O受热易分解,实验室可以用加热浓氨水的方法来制备氨气
D.氨气液化时放出大量的热,因而,不能用氨来作
制冷剂AC谢谢!
德国化学家哈伯在合成氨方面作出了巨大贡献,获得了1918年诺贝尔化学奖。N2+3H2 2NH3 纯净的氨气是一种 色,有 气味的气体,密度比空气 。氨 溶于水,常温下,1体积水大约可溶解700体积氨。氨易液化,液氨在汽化时要吸收大量的热,所以常用来作 。
一、氨的性质1、氨气的物理性质无刺激性小极易制冷剂观察· 如图,在干燥的圆底烧瓶里充满氨气,用
带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯(预先在水里滴入少量酚酞溶液)。打开止水夹,轻轻挤压滴管,使少量水进入烧瓶。观察现象。 思考[实验4-8]红色的喷泉是怎样形成的?
从这个实验中你能得出什么结论?(1)氨气与水的反应2、氨气的化学性质一元弱碱思考:氨水与液氨是同种物质吗?氨水中含有哪些成分?不是,氨水是混合物,液氨是纯净物。氨水中含有NH3·H2O、NH3、H2O 、NH4+、OH ˉ、H+(极少量)(三分三离)。
可见,氨气是一种 (填“酸性”、“碱性”或“中性”)气体。 碱性 思考:为什么蘸有浓氨水的玻璃棒和蘸有浓盐酸的玻璃棒不接触就能反应?NH3+HCl = NH4Cl产生大量白烟氨气是中学阶段涉及的唯一一种碱性气体。拓展·迁移(1)氨气与浓硫酸、浓硝酸能否发生反应?反应现象与氨气与浓盐酸反应的现象相同吗?为什么?
思考:浓硫酸是实验室常用的干燥剂,请问可以用来干燥氨气吗?你预测氨气还具有哪些化学性质?NH3-3(3)氨气具有还原性
4NH3+5O2 4NO+6H2O思考:这步化学反应有什么意义?你能写出实现以上转化的每一步化学方程式吗? 氯气有毒,化工厂常用浓氨水检验管道是否漏氯气。如氯气泄漏,会在管道周围产生大量白烟。你能写出该反应的化学方程式吗?思考与交流:3Cl2+8NH3===6NH4Cl+N2根据氨气的性质,你能总结它的用途吗?3、氨气的用途课堂练习1.下列关于氨的性质的叙述,错误的是( )
A.氨气极易溶于水
B.氨水呈碱性
C.NH3·H2O很稳定,受热不分解
D.氨气的密度比空气小
2.氨水呈弱碱性的原因是( )
A.通常状况下,氨气的溶解度较大
B.氨水中的NH3·H2O电离出少量的OH-
C.溶于水的氨气生成少量NH3·H2O全部电离生成OH-
D.氨气本身的碱性弱
CB3.下列各组离子中,能大量共存的是( )
A.Al3+、Cl-、OH-、K+
B.H+、Na+、NO3-、CO32-
C.NH4+、SO42-、K+、OH-
D.Na+、NH4+、Cl-、NO3-
4.有关氨气的性质的叙述中正确的是( )
A.氨不能在空气中燃烧,是因为O2不能将NH3氧化
B.氨水显碱性
C.氨气和酸相遇都能产生白色烟雾
D.在反应NH3+H+==NH4+中,氨失去电子被氧化
DB5.有关氨气的实验较多,下面对这些实验原理的分析中,正确的是( )
A.氨气极易溶于水,可以用来做喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.NH3·H2O受热易分解,实验室可以用加热浓氨水的方法来制备氨气
D.氨气液化时放出大量的热,因而,不能用氨来作
制冷剂AC谢谢!
