1.2物质的酸碱性 第1课时(课件 14张PPT)
文档属性
| 名称 | 1.2物质的酸碱性 第1课时(课件 14张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-08-06 00:00:00 | ||
图片预览





文档简介
(共14张PPT)
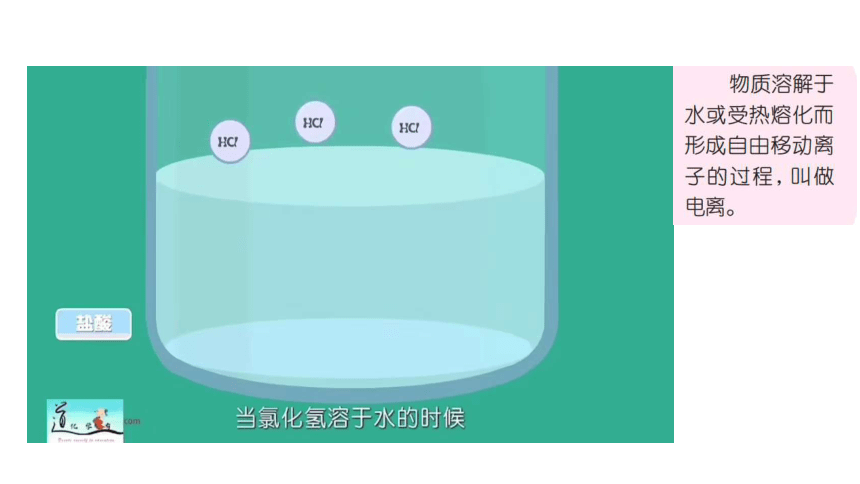
请你吃柠檬
1.2.1 物质的酸碱性
【核心概念】
2.物质的变化与化学反应 结构与功能
【学习内容与要求】
1.4 常见的化合物
从微观上理解酸和碱的概念;知道常见物质的酸碱性与酸、碱的关系;认识物质的结构决定其性质。
【教学目标】
1.科学观念:从微观上理解酸和碱的概念;
2.科学思维:通过观察电离方程式归纳酸和碱;知道常见物质的酸碱性与酸、碱的关系。
3.探究实践:会闻气味,学会收集资料、处理信息,通过观察、实验知道物质有酸性和碱性物质。
4.态度责任:通过一些探究活动,进一步认识与体验科学探究的过程,感受科学探究学习的快乐。
从微观上理解酸的概念
1.1 酸性物质
列举生活中常见的酸性物质
胃液
食醋
水果
酸
闻气味的正确操作用手轻轻扇动气流。
碳酸饮料
1.2 酸的概念
科学家研究证明,这些溶液会呈酸性是由于其中含有一类特殊的物质——酸
醋、胃液是不同的物质,为什么都具有酸性?
食醋含醋酸
胃液含盐酸
柠檬、柑橘等水果含柠檬酸
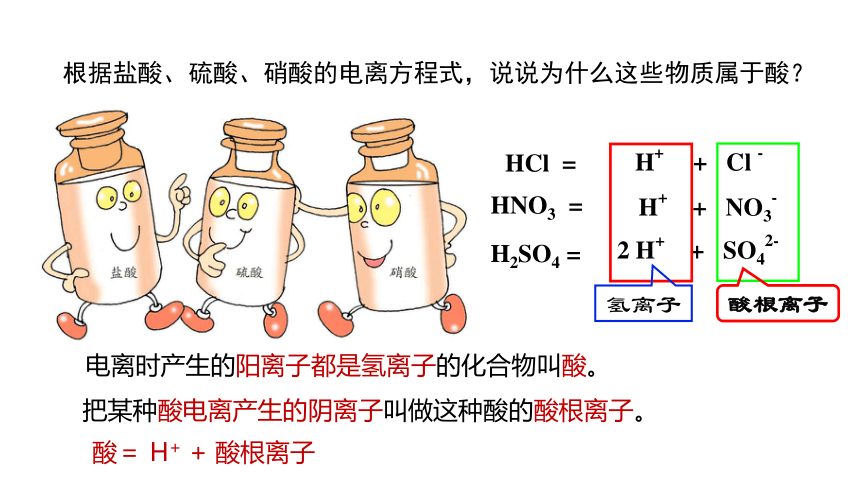
实验室常见的盐酸、硫酸和硝酸等都是酸。
H+ + Cl -
H+ + NO3-
2 H+ + SO42-
氢离子
HCl =
HNO3 =
H2SO4 =
酸根离子
根据盐酸、硫酸、硝酸的电离方程式,说说为什么这些物质属于酸?
电离时产生的阳离子都是氢离子的化合物叫酸。
把某种酸电离产生的阴离子叫做这种酸的酸根离子。
酸= H+ + 酸根离子
1.已知硫酸氢钠电离:NaHSO4 = Na++H++SO42-, 那么硫酸氢钠是不是一种酸?为什么?
不是,溶液中的阳离子不全是H+,还有Na+
2.酸与酸性物质的区别与联系。
③ 酸溶液显酸性,一定是酸性溶液。
④ 显酸性的溶液不一定属于酸溶液。
① 酸溶液是酸的水溶液。阳离子全部是H+。
② 酸性溶液是含H+的溶液。
NaHSO4 溶液是酸性溶液,不是酸溶液。
1.观察酸的电离,溶液显电性吗?为什么?
不显电性。正电荷总数等于负电荷总数。
H+ + Cl -
H+ + NO3-
2 H+ + SO42-
盐酸:
硝酸:
硫酸:
HCI =
HNO3 =
H2SO4 =
2.物质的酸性是由什么结构决定的?
酸性由氢离子( H+ )决定。
结构决定了物质的性质。
从微观上理解碱的概念
生活中我们还经常接触另一类物质——碱性物质,如石灰水、氨水等,它们都含有碱。
NaOH
Ca(OH)2
NH3 H2O
为什么说这些物质是碱呢?
2.1 碱性物质
2.2 碱的概念
写出氢氧化钠、氢氧化钙和氨水的电离产生的自由离子,归纳碱是怎样的一类物质?
= Na + + OH-
= Ca2+ + 2OH-
= NH4+ + OH-
氢氧根离子
氢氧化钠:
氢氧化钙:
氨水:
金属离子或NH4+
NaOH
Ca(OH)2
NH3·H2O
碱是电离时产生的阴离子都是氢氧根离子的化合物。
碱溶液一定显碱性;显碱性的溶液不一定属于碱的溶液。
碱性由氢氧根离子( OH- )决定。
请你吃柠檬
1.2.1 物质的酸碱性
【核心概念】
2.物质的变化与化学反应 结构与功能
【学习内容与要求】
1.4 常见的化合物
从微观上理解酸和碱的概念;知道常见物质的酸碱性与酸、碱的关系;认识物质的结构决定其性质。
【教学目标】
1.科学观念:从微观上理解酸和碱的概念;
2.科学思维:通过观察电离方程式归纳酸和碱;知道常见物质的酸碱性与酸、碱的关系。
3.探究实践:会闻气味,学会收集资料、处理信息,通过观察、实验知道物质有酸性和碱性物质。
4.态度责任:通过一些探究活动,进一步认识与体验科学探究的过程,感受科学探究学习的快乐。
从微观上理解酸的概念
1.1 酸性物质
列举生活中常见的酸性物质
胃液
食醋
水果
酸
闻气味的正确操作用手轻轻扇动气流。
碳酸饮料
1.2 酸的概念
科学家研究证明,这些溶液会呈酸性是由于其中含有一类特殊的物质——酸
醋、胃液是不同的物质,为什么都具有酸性?
食醋含醋酸
胃液含盐酸
柠檬、柑橘等水果含柠檬酸
实验室常见的盐酸、硫酸和硝酸等都是酸。
H+ + Cl -
H+ + NO3-
2 H+ + SO42-
氢离子
HCl =
HNO3 =
H2SO4 =
酸根离子
根据盐酸、硫酸、硝酸的电离方程式,说说为什么这些物质属于酸?
电离时产生的阳离子都是氢离子的化合物叫酸。
把某种酸电离产生的阴离子叫做这种酸的酸根离子。
酸= H+ + 酸根离子
1.已知硫酸氢钠电离:NaHSO4 = Na++H++SO42-, 那么硫酸氢钠是不是一种酸?为什么?
不是,溶液中的阳离子不全是H+,还有Na+
2.酸与酸性物质的区别与联系。
③ 酸溶液显酸性,一定是酸性溶液。
④ 显酸性的溶液不一定属于酸溶液。
① 酸溶液是酸的水溶液。阳离子全部是H+。
② 酸性溶液是含H+的溶液。
NaHSO4 溶液是酸性溶液,不是酸溶液。
1.观察酸的电离,溶液显电性吗?为什么?
不显电性。正电荷总数等于负电荷总数。
H+ + Cl -
H+ + NO3-
2 H+ + SO42-
盐酸:
硝酸:
硫酸:
HCI =
HNO3 =
H2SO4 =
2.物质的酸性是由什么结构决定的?
酸性由氢离子( H+ )决定。
结构决定了物质的性质。
从微观上理解碱的概念
生活中我们还经常接触另一类物质——碱性物质,如石灰水、氨水等,它们都含有碱。
NaOH
Ca(OH)2
NH3 H2O
为什么说这些物质是碱呢?
2.1 碱性物质
2.2 碱的概念
写出氢氧化钠、氢氧化钙和氨水的电离产生的自由离子,归纳碱是怎样的一类物质?
= Na + + OH-
= Ca2+ + 2OH-
= NH4+ + OH-
氢氧根离子
氢氧化钠:
氢氧化钙:
氨水:
金属离子或NH4+
NaOH
Ca(OH)2
NH3·H2O
碱是电离时产生的阴离子都是氢氧根离子的化合物。
碱溶液一定显碱性;显碱性的溶液不一定属于碱的溶液。
碱性由氢氧根离子( OH- )决定。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
