2.3 物质的量 过关练习 2025--2026学年上学期高中化学 必修第一册(人教版2019)
文档属性
| 名称 | 2.3 物质的量 过关练习 2025--2026学年上学期高中化学 必修第一册(人教版2019) |  | |
| 格式 | docx | ||
| 文件大小 | 543.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 09:53:51 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2.3 物质的量 过关练习 2025--2026学年上学期
高中化学 必修第一册(人教版2019)
一、单选题
1.下列说法正确的是
A.1mol O2的质量是32g/mol
B.阿伏加德罗常数的准确值就是6.02×1023
C.NaOH的摩尔质量是40g/mol
D.44g CO2所含氧原子的数目约为6.02×1023个
2.2015年10月,屠呦呦因发现青蒿素治疟疾的新疗法而获得诺贝尔生理学或医学奖,青蒿素的分子式为C15H22O5,其摩尔质量用M表示。下面关于青蒿素的说法正确的是
A.C15H22O5的摩尔质量为282g
B.1个C15H22O5分子的质量约为g
C.1molC15H22O5完全燃烧生成22molH2O
D.含有6.02×1023个碳原子的C15H22O5的物质的量为1mol
3.某种元素原子的质量是ag,12C的原子质量是bg,12C的相对原子质量是12,NA是阿伏加德罗常数的值,下列说法不正确的是
A.由已知信息可得 B.Wg该原子的物质的量一定是
C.Wg该原子中含有个该原子 D.该原子的摩尔质量是
4.下列叙述错误的个数是
① 摩尔是用来衡量微观粒子多少的一种物理量
② 2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍
③ 在同温同体积时,气体的物质的量越大,则压强越大
④ 两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤ HCl的摩尔质量是36.5
⑥ 在一定的温度和压强下,各种气体的摩尔体积相等
A.3 B.4 C.5 D.6
5.在标准状况下①6.72LC2H6 ②3.01×1023个NH3分子 ③13.6gH2S ④0.6molH2O,下列对这四种气体关系从大到小的表达正确的是
A.物质的量:③>①>④>② B.原子数:①>②>④>③
C.体积:④>②>③>① D.质量:④>③>①>②
6.设为阿伏加德罗常数的值,如果a g某气体的分子数为p,则b g该气在标准状况下的体积V(L)约为
A. B. C. D.
7.下列叙述正确的是
①标准状况下,和混合后,原子总数为
②若气体的体积为,则它一定处于标准状况下
③标准状况下,和的物质的量相同
④标准状况下,和的体积相同
⑤常温常压下,个二氧化碳分子的质量是
⑥相同温度下,同体积容器中,气体物质的物质的量越大,则压强越大
A.①②③④ B.①④⑤⑥ C.①③⑥ D.②⑤⑥
8.下列溶液中的物质的量浓度由大到小的顺序是
①100mL溶液
②200mL溶液
③100mLNaCl溶液
④500mL溶液
⑤1000mL氯水
A.③①②⑤④ B.④③①②⑤ C.②③①⑤④ D.④②③①⑤
9.化学实验室里有一瓶盐酸,上面的标签如图所示。下列说法正确的是
产品名称:盐酸 化学式:HCl 产品等级:分析纯 质量分数:36.5% 密度:1.2 g cm-3
A.该试剂瓶中的盐酸属于纯净物
B.配制100 mL 1.00 mol L-1的稀盐酸需该盐酸8 mL
C.该盐酸物质的量浓度为12 mol L-1
D.配制稀盐酸时,取用浓盐酸的量筒使用后应洗涤,并将洗涤液也注入容量瓶中
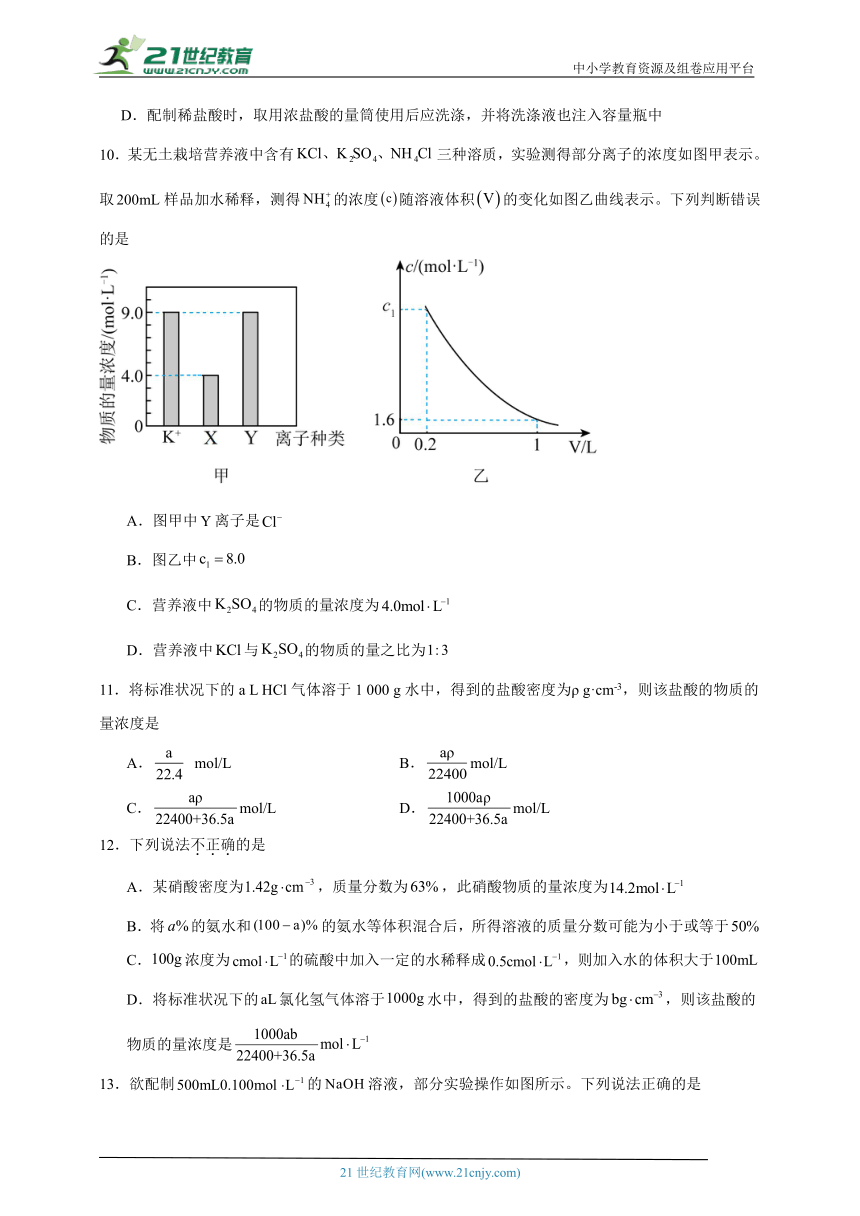
10.某无土栽培营养液中含有三种溶质,实验测得部分离子的浓度如图甲表示。取样品加水稀释,测得的浓度随溶液体积的变化如图乙曲线表示。下列判断错误的是
A.图甲中离子是
B.图乙中
C.营养液中的物质的量浓度为
D.营养液中与的物质的量之比为
11.将标准状况下的a L HCl气体溶于1 000 g水中,得到的盐酸密度为ρ g·cm-3,则该盐酸的物质的量浓度是
A. mol/L B.mol/L
C.mol/L D.mol/L
12.下列说法不正确的是
A.某硝酸密度为,质量分数为,此硝酸物质的量浓度为
B.将的氨水和的氨水等体积混合后,所得溶液的质量分数可能为小于或等于
C.浓度为的硫酸中加入一定的水稀释成,则加入水的体积大于
D.将标准状况下的氯化氢气体溶于水中,得到的盐酸的密度为,则该盐酸的物质的量浓度是
13.欲配制的溶液,部分实验操作如图所示。下列说法正确的是
A.上述实验操作步骤的正确顺序应为②①④③
B.完成步骤②后,无需等待可立即下一步操作
C.容量瓶用自来水、蒸馏水洗净,需干燥后才能使用
D.定容时,仰视容量瓶的刻度线,使配得的溶液浓度偏高
14.t ℃时,将a g HCl完全溶于水,得到V mL饱和溶液,该溶液的密度为,质量分数为w,其中含的物质的量为b mol。下列说法不正确的是
A.t ℃时,HCl的溶解度为 B.溶液中
C.溶质的质量分数 D.溶质的物质的量浓度
二、填空题
15.每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6:0210/23。外观与阿伏加德罗常数相似。
(1)分子数为个的物质的量约为 mol。
(2)标准状况下,的质量为 g。
(3)同温同压下,等体积的NO气体和气体中氧原子的个数之比为 。
(4)等质量的CO和中氧原子的个数之比为 。
(5)中含有b个氧原子,则阿伏加德罗常数的表达式为 。(用含a、b的式子表示)
(6)已知a g的A和b g的B恰好完全反应生成0.2mol的C和d g的D,则C的摩尔质量为 。(用含a、b、d的式子表示)
三、计算题
16.在标准状况下,由CO和CO2组成的混合气体8.96L,质量是12.8g。此混合物中:
(1)混合气体的平均摩尔质量是 。
(2)CO的体积分数是 。
(3)CO的质量分数是 。
(4)C和O的原子个数比 。
(5)CO和CO2的物质的量比是 。
(6)碳原子的物质的量是 。
(7)混合气体的密度 g/L(保留小数点后两位)。
17.常温下,在27.5g水中溶解12.5g CuSO4.5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
(1)该溶液的溶质的质量分数 。
(2)该溶液中CuSO4的物质的量浓度 。
(3)取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是 毫升。
四、解答题
18.实验室需使用的稀硫酸,现欲用质量分数为98%的浓硫酸(密度为)进行配制。回答下列问题:
(1)用表示该浓硫酸的溶质的物质的量浓度,则 。需用量筒量取98%的浓硫酸的体积为 mL。
(2)如图所示的仪器中,配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 、 (填仪器名称)。
A. B. C. D.
(3)在下列配制过程示意图中,错误的是 (填选项字母)。
(4)测定所配制的稀硫酸,发现其浓度大于,引起误差的原因可能是_______。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C B D B B A B A C D
题号 11 12 13 14
答案 D C A C
1.C
【详解】A.质量的单位是g而不是g/mol,故A错误;
B.阿伏加德罗常数的数值约等于6.02×1023,故B错误;
C.NaOH的摩尔质量是40g/mol,故C正确;
D.44g CO2所含氧原子的数目约为2×6.02×1023个,故D错误;
故选C。
2.B
【详解】A.摩尔质量的单位为g·mol-1,C15H22O5的摩尔质量为282 g·mol-1,A错误;
B.C15H22O5的摩尔质量为M,即NA个C15H22O5分子的质量约为M g,所以1个C15H22O5分子的质量约为g,B正确;
C.根据H原子守恒可知,1 mol C15H22O5完全燃烧生成11 mol H2O,C错误;
D.已知1mol C15H22O5中含有15mol碳原子,故含有6.02×1023个碳原子的物质的量约为1 mol,C15H22O5物质的量约为mol,D错误;
故答案为:B。
3.D
【详解】A.阿伏加德罗常数为12g12C含有的原子数,所以,A正确;
B.Wg该原子的物质的量为:=mol,B正确;
C.Wg该原子中含有原子个数==个,C正确;
D.摩尔质量:单位物质的量的物质所具有的质量,单位是g mol-1,根据摩尔质量概念可知,摩尔质量应为aNAg mol-1,D错误;
故答案为:D。
4.B
【详解】①摩尔是衡量微观粒子多少的物理量——物质的量的单位,①错误;
②摩尔质量是单位物质的量的物质所具有的质量,2 mol H2O的摩尔质量是1 mol H2O的摩尔质量相同,②错误;
③在同温同体积时,气体的物质的量越大,则单位体积内气体分子数就越多,气体的压强就越大,③正确;
④两种物质的物质的量相同,若它们的存在状态都不是气体,则它们在标准状况下的体积不相同,④错误;
⑤HCl的摩尔质量是36.5 g/mol,⑤错误;
⑥在一定的温度和压强下,气体分子之间距离相同,则各种气体的摩尔体积相等,⑥正确;
则上述说法中错误的是①②④⑤,共4个,故合理选项是B。
5.B
【分析】①6.72L C2H6物质的量为6.72L÷22.4L/mol=0.3mol;
②3.01×1023个HCl分子的物质的量为(3.01×1023) ÷(6.02×1023mol-1)=0.5mol;
③13.6g H2S的物质的量为13.6g÷34g/mol =0.4mol;
④0.6molH2O;
【详解】A.物质的量:④>②>③>①,A错误;
B.①②③④中原子的物质的量分别为0.3mol×8=2.4mol、0.5mol×4=2.0mol、0.3mol×3=1.2mol、0.6mol×3=1.8mol,则原子数:①>②>④>③,B正确;
C.标况下水为固态,体积最小,C错误;
D.①②③④的质量分别为0.3mol×30g/mol=9g、0.5mol×17g/mol=8.5g、13.6g、0.6mol×18g/mol=10.8g,则质量:③>④>①>②,D错误;
故选B。
6.A
【详解】a g某气体的分子数为p,则其摩尔质量为,所以b g气体在标准状况下的体积为;
故选A。
7.B
【详解】①标准状况下,和混合后,根据原子守恒,则原子总数为,故①正确;②若气体的体积为,则它不一定处于标准状况下,也可以处于标准状况下,故②错误;③标准状况下,HCl是气体,水是液体,和的物质的量不相同,故③错误;④和的物质的量都为0.5mol,根据阿伏伽德罗定律,则标准状况下,和的体积相同,故④正确;⑤常温常压下,个二氧化碳分子的物质的量为0.5mol,其质量是,故⑤正确;⑥根据同温同压下,压强之比等于物质的量之比,则相同温度下,同体积容器中,气体物质的物质的量越大,则压强越大,故⑥正确;因此①④⑤⑥正确,故B正确。
综上所述,答案为B。
8.A
【详解】氯离子的物质的量浓度与溶液体积大小无关,与溶质的浓度及化学式组成有关,①溶液中Cl-的浓度为:c(Cl-)=1.5mol/L×3=4.5mol/L;②溶液 中Cl-的浓度为:c(Cl-)=2mol/L×2=4mol/L;③NaCl溶液中Cl-的浓度为:c(Cl-)=5mol/L×1=5mol/L;④氯酸钙电离出氯酸根离子和钙离子,不存在氯离子;⑤氯水中部分氯气能与水反应生成HCl,则氯水中Cl-的浓度小于1mol/L,根据分析可知,溶液中Cl-浓度由大到小的顺序为:③①②⑤④,故选:A。
9.C
【详解】A.盐酸是氯化氢的水溶液,因此该试剂瓶中的盐酸属于混合物,故A错误;
B.,配制100 mL 1.00 mol L-1的稀盐酸需该盐酸,故B错误;
C.该盐酸物质的量浓度为,故C正确;
D.配制稀盐酸时,取用浓盐酸的量筒使用后不能洗涤,故D错误。
综上所述,答案为C。
10.D
【分析】根据图乙可知,营养液中的浓度为=8 mol/L;营养液中含有三种溶质,中都含有Cl-,则浓度:Cl->,故Y是Cl-,X为。
【详解】A.由分析可知,Y是Cl-,A项正确;
B.由分析可知,图乙中,B项正确;
C.由分析可知,X为,的浓度为4.0 mol/L,则营养液中的物质的量浓度为4.0 mol/L,C项正确;
D.营养液中的浓度为8 mol/L,则的浓度为8 mol/L,Y是Cl-,Cl-浓度为9 mol/L,则浓度为1 mol/L,由选项C可知,的物质的量浓度为4.0 mol/L,则营养液中与的物质的量之比为,D项错误;
答案选D。
11.D
【详解】标准状况下a L HCl气体的物质的量为:,所得盐酸的质量为:,盐酸的体积为:,盐酸物质的量浓度为:;
故选D。
12.C
【详解】A.该溶液中硝酸物质的量浓度,故A正确;
B.假设a设质量分数分别为a%与(100-a)%的氨水溶液的密度分别为xg/mL、yg/mL,假定体积为1mL,则a%氨水溶液的质量为:1mL×xg/mL=xg,溶质氨水的质量为xg×a%,(100-a)%的氨水溶液的质量为1mL×yg/mL=yg,溶质氨水的质量为:yg×(100-a)%,所以混合后氨水的质量分数为:,①当x=y时,,②当x>y时,氨水质量分数越大,密度越小,a<100-a,a<50,则,③当x100-a,a>50,则,因此所得溶液的质量分数可能为小于或等于50%,故B正确;
C.因硫酸溶液密度大于水,因此100g浓度为cmol L-1的硫酸的体积小于100mL,若要使浓度变为原来的一半,则所加水的体积需小于100mL,故C错误;
D.,故D正确;
答案选C。
13.A
【详解】A.由配制一定物质的量浓度溶液配制的步骤为计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶可知,配制氢氧化钠溶液的实验操作步骤的正确顺序应为②①④③,故A正确;
B.完成步骤②后,应待溶液冷却至室温时,再将溶液转移至容量瓶中,故B错误;
C.由稀释定律可知,容量瓶用自来水、蒸馏水洗净即可,不需干燥就能使用,故C错误;
D.定容时,仰视容量瓶的刻度线会使溶液的体积偏大,导致配得的氢氧化钠溶液的浓度偏低,故D错误;
故选A。
14.C
【详解】A.将a g HCl完全溶于水,得到V mL饱和溶液,设HCl溶解度为S,可得,求出溶解度为,A正确;
B.HCl是强电解质完全电离,=,B正确;
C.溶质的质量分数,C错误;
D.溶质的物质的量浓度,D正确;
故选C。
15.(1)1
(2)7.1
(3)1:2
(4)11∶14
(5)
(6)
【详解】(1)分子数为个的物质的量;
(2)标准状况下,的物质的量为,其质量为;
(3)同温同压下,体积之比等于物质的量之比,则等体积的NO气体和气体的物质的量为1:1,则氧原子的个数之比为1:2;
(4)根据可知,等质量的CO和的物质的量之比为11:7,则氧原子的个数之比为=11:14;
(5)中氧原子的物质的量为4a mol,氧原子个数为b,则;
(6)a g的A和b g的B恰好完全反应生成0.2mol的C和d g的D,根据质量守恒定律可知,生成C的质量为(a+b-d) g,则C的摩尔质量为。
16.(1)32g/mol
(2)75%
(3)65.625%
(4)4:5
(5)3:1
(6)0.4mol
(7)1.43
【分析】在标准状况下,由CO和CO2组成的混合气体8.96L,物质的是为=0.4mol,设CO的物质的量为x,则CO2的物质的量为(0.4-x),由此可建立如下等式:28x+44(0.4-x)=12.8,则x=0.3mol,0.4-x=0.1mol。
【详解】(1)混合气体的平均摩尔质量是=32g/mol。答案为:32g/mol;
(2)CO的体积分数是=75%。答案为:75%;
(3)CO的质量分数是=65.625%。答案为:65.625%;
(4)由分析可知,CO的物质的量为0.3mol,CO2的物质的量为0.1mol,则C和O的原子个数比0.4mol:0.5mol=4:5。答案为:4:5;
(5)CO和CO2的物质的量比是0.3mol:0.1mol=3:1。答案为:3:1;
(6)由分析可知,CO、CO2的物质的量共为0.4mol,则碳原子的物质的量是0.4mol。答案为:0.4mol;
(7)混合气体的密度为≈1.43g/L。答案为:1.43。
17. 20% 1.51mol/L 30.2
【分析】根据溶液的质量分数及物质的量浓度的表达式分析解答;根据溶液稀释过程中溶质保持不变的原理分析解答。
【详解】(1) 溶液中溶质的质量为,溶液的质量是27.5g+12.5g=40g,则该溶液的溶质的质量分数为,故答案为:20%;
(2) CuSO4·5H2O的摩尔质量是250 g/mol,所以12.5 g CuSO4·5H2O的物质的量是,溶液的体积为,则该溶液中CuSO4的物质的量浓度为,故答案为:1.51 mol/L;
(3) 在稀释过程中溶质是不变的,所以稀释后的溶液的体积是V==30.2 mL,故答案为:30.2。
18.(1) 18.4 13.6
(2) C 玻璃棒 胶头滴管
(3)AD
(4)AB
【分析】配制一定物质的量浓度的溶液使用的玻璃仪器有:量筒、烧杯、玻璃棒、500 mL容量瓶、胶头滴管;
【详解】(1)该浓硫酸的溶质的物质的量浓度,则;根据稀释前后硫酸的物质的量相等列式可得:18.4 mol/L × V L = 0.5 mol/L × 0.5 L,解得V = 0.0136 ,即需用量筒量取98%的浓硫酸的体积为13.6 mL;
(2)根据分析,如图所示的仪器中,配制溶液肯定不需要的是C.分液漏斗;还需用到的玻璃仪器有玻璃棒、胶头滴管;
(3)稀释浓硫酸应该是将浓硫酸缓缓加入到水中并不断搅拌,转移时,用玻璃棒引流,洗涤烧杯和玻璃棒,并将洗涤液转移到容量瓶中,定容时眼睛与刻度线相平,摇匀时左手摁住瓶塞,右手托起瓶底,上下颠倒摇匀,因此错误的是AD;故选AD;
(4)A.洗涤量筒会造成硫酸溶质偏多,所配制的稀硫酸浓度偏大,A符合;
B.定容时俯视容量瓶刻度线,加水加少,所配制的稀硫酸浓度偏大,B符合;
C.转移溶液后,未洗涤烧杯和玻璃棒,硫酸溶质偏少,所配制的稀硫酸浓度偏小,C不符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线,加水加多,所配制的稀硫酸浓度偏小,D不符合;
故选AB。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.3 物质的量 过关练习 2025--2026学年上学期
高中化学 必修第一册(人教版2019)
一、单选题
1.下列说法正确的是
A.1mol O2的质量是32g/mol
B.阿伏加德罗常数的准确值就是6.02×1023
C.NaOH的摩尔质量是40g/mol
D.44g CO2所含氧原子的数目约为6.02×1023个
2.2015年10月,屠呦呦因发现青蒿素治疟疾的新疗法而获得诺贝尔生理学或医学奖,青蒿素的分子式为C15H22O5,其摩尔质量用M表示。下面关于青蒿素的说法正确的是
A.C15H22O5的摩尔质量为282g
B.1个C15H22O5分子的质量约为g
C.1molC15H22O5完全燃烧生成22molH2O
D.含有6.02×1023个碳原子的C15H22O5的物质的量为1mol
3.某种元素原子的质量是ag,12C的原子质量是bg,12C的相对原子质量是12,NA是阿伏加德罗常数的值,下列说法不正确的是
A.由已知信息可得 B.Wg该原子的物质的量一定是
C.Wg该原子中含有个该原子 D.该原子的摩尔质量是
4.下列叙述错误的个数是
① 摩尔是用来衡量微观粒子多少的一种物理量
② 2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍
③ 在同温同体积时,气体的物质的量越大,则压强越大
④ 两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤ HCl的摩尔质量是36.5
⑥ 在一定的温度和压强下,各种气体的摩尔体积相等
A.3 B.4 C.5 D.6
5.在标准状况下①6.72LC2H6 ②3.01×1023个NH3分子 ③13.6gH2S ④0.6molH2O,下列对这四种气体关系从大到小的表达正确的是
A.物质的量:③>①>④>② B.原子数:①>②>④>③
C.体积:④>②>③>① D.质量:④>③>①>②
6.设为阿伏加德罗常数的值,如果a g某气体的分子数为p,则b g该气在标准状况下的体积V(L)约为
A. B. C. D.
7.下列叙述正确的是
①标准状况下,和混合后,原子总数为
②若气体的体积为,则它一定处于标准状况下
③标准状况下,和的物质的量相同
④标准状况下,和的体积相同
⑤常温常压下,个二氧化碳分子的质量是
⑥相同温度下,同体积容器中,气体物质的物质的量越大,则压强越大
A.①②③④ B.①④⑤⑥ C.①③⑥ D.②⑤⑥
8.下列溶液中的物质的量浓度由大到小的顺序是
①100mL溶液
②200mL溶液
③100mLNaCl溶液
④500mL溶液
⑤1000mL氯水
A.③①②⑤④ B.④③①②⑤ C.②③①⑤④ D.④②③①⑤
9.化学实验室里有一瓶盐酸,上面的标签如图所示。下列说法正确的是
产品名称:盐酸 化学式:HCl 产品等级:分析纯 质量分数:36.5% 密度:1.2 g cm-3
A.该试剂瓶中的盐酸属于纯净物
B.配制100 mL 1.00 mol L-1的稀盐酸需该盐酸8 mL
C.该盐酸物质的量浓度为12 mol L-1
D.配制稀盐酸时,取用浓盐酸的量筒使用后应洗涤,并将洗涤液也注入容量瓶中
10.某无土栽培营养液中含有三种溶质,实验测得部分离子的浓度如图甲表示。取样品加水稀释,测得的浓度随溶液体积的变化如图乙曲线表示。下列判断错误的是
A.图甲中离子是
B.图乙中
C.营养液中的物质的量浓度为
D.营养液中与的物质的量之比为
11.将标准状况下的a L HCl气体溶于1 000 g水中,得到的盐酸密度为ρ g·cm-3,则该盐酸的物质的量浓度是
A. mol/L B.mol/L
C.mol/L D.mol/L
12.下列说法不正确的是
A.某硝酸密度为,质量分数为,此硝酸物质的量浓度为
B.将的氨水和的氨水等体积混合后,所得溶液的质量分数可能为小于或等于
C.浓度为的硫酸中加入一定的水稀释成,则加入水的体积大于
D.将标准状况下的氯化氢气体溶于水中,得到的盐酸的密度为,则该盐酸的物质的量浓度是
13.欲配制的溶液,部分实验操作如图所示。下列说法正确的是
A.上述实验操作步骤的正确顺序应为②①④③
B.完成步骤②后,无需等待可立即下一步操作
C.容量瓶用自来水、蒸馏水洗净,需干燥后才能使用
D.定容时,仰视容量瓶的刻度线,使配得的溶液浓度偏高
14.t ℃时,将a g HCl完全溶于水,得到V mL饱和溶液,该溶液的密度为,质量分数为w,其中含的物质的量为b mol。下列说法不正确的是
A.t ℃时,HCl的溶解度为 B.溶液中
C.溶质的质量分数 D.溶质的物质的量浓度
二、填空题
15.每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6:0210/23。外观与阿伏加德罗常数相似。
(1)分子数为个的物质的量约为 mol。
(2)标准状况下,的质量为 g。
(3)同温同压下,等体积的NO气体和气体中氧原子的个数之比为 。
(4)等质量的CO和中氧原子的个数之比为 。
(5)中含有b个氧原子,则阿伏加德罗常数的表达式为 。(用含a、b的式子表示)
(6)已知a g的A和b g的B恰好完全反应生成0.2mol的C和d g的D,则C的摩尔质量为 。(用含a、b、d的式子表示)
三、计算题
16.在标准状况下,由CO和CO2组成的混合气体8.96L,质量是12.8g。此混合物中:
(1)混合气体的平均摩尔质量是 。
(2)CO的体积分数是 。
(3)CO的质量分数是 。
(4)C和O的原子个数比 。
(5)CO和CO2的物质的量比是 。
(6)碳原子的物质的量是 。
(7)混合气体的密度 g/L(保留小数点后两位)。
17.常温下,在27.5g水中溶解12.5g CuSO4.5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
(1)该溶液的溶质的质量分数 。
(2)该溶液中CuSO4的物质的量浓度 。
(3)取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是 毫升。
四、解答题
18.实验室需使用的稀硫酸,现欲用质量分数为98%的浓硫酸(密度为)进行配制。回答下列问题:
(1)用表示该浓硫酸的溶质的物质的量浓度,则 。需用量筒量取98%的浓硫酸的体积为 mL。
(2)如图所示的仪器中,配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 、 (填仪器名称)。
A. B. C. D.
(3)在下列配制过程示意图中,错误的是 (填选项字母)。
(4)测定所配制的稀硫酸,发现其浓度大于,引起误差的原因可能是_______。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C B D B B A B A C D
题号 11 12 13 14
答案 D C A C
1.C
【详解】A.质量的单位是g而不是g/mol,故A错误;
B.阿伏加德罗常数的数值约等于6.02×1023,故B错误;
C.NaOH的摩尔质量是40g/mol,故C正确;
D.44g CO2所含氧原子的数目约为2×6.02×1023个,故D错误;
故选C。
2.B
【详解】A.摩尔质量的单位为g·mol-1,C15H22O5的摩尔质量为282 g·mol-1,A错误;
B.C15H22O5的摩尔质量为M,即NA个C15H22O5分子的质量约为M g,所以1个C15H22O5分子的质量约为g,B正确;
C.根据H原子守恒可知,1 mol C15H22O5完全燃烧生成11 mol H2O,C错误;
D.已知1mol C15H22O5中含有15mol碳原子,故含有6.02×1023个碳原子的物质的量约为1 mol,C15H22O5物质的量约为mol,D错误;
故答案为:B。
3.D
【详解】A.阿伏加德罗常数为12g12C含有的原子数,所以,A正确;
B.Wg该原子的物质的量为:=mol,B正确;
C.Wg该原子中含有原子个数==个,C正确;
D.摩尔质量:单位物质的量的物质所具有的质量,单位是g mol-1,根据摩尔质量概念可知,摩尔质量应为aNAg mol-1,D错误;
故答案为:D。
4.B
【详解】①摩尔是衡量微观粒子多少的物理量——物质的量的单位,①错误;
②摩尔质量是单位物质的量的物质所具有的质量,2 mol H2O的摩尔质量是1 mol H2O的摩尔质量相同,②错误;
③在同温同体积时,气体的物质的量越大,则单位体积内气体分子数就越多,气体的压强就越大,③正确;
④两种物质的物质的量相同,若它们的存在状态都不是气体,则它们在标准状况下的体积不相同,④错误;
⑤HCl的摩尔质量是36.5 g/mol,⑤错误;
⑥在一定的温度和压强下,气体分子之间距离相同,则各种气体的摩尔体积相等,⑥正确;
则上述说法中错误的是①②④⑤,共4个,故合理选项是B。
5.B
【分析】①6.72L C2H6物质的量为6.72L÷22.4L/mol=0.3mol;
②3.01×1023个HCl分子的物质的量为(3.01×1023) ÷(6.02×1023mol-1)=0.5mol;
③13.6g H2S的物质的量为13.6g÷34g/mol =0.4mol;
④0.6molH2O;
【详解】A.物质的量:④>②>③>①,A错误;
B.①②③④中原子的物质的量分别为0.3mol×8=2.4mol、0.5mol×4=2.0mol、0.3mol×3=1.2mol、0.6mol×3=1.8mol,则原子数:①>②>④>③,B正确;
C.标况下水为固态,体积最小,C错误;
D.①②③④的质量分别为0.3mol×30g/mol=9g、0.5mol×17g/mol=8.5g、13.6g、0.6mol×18g/mol=10.8g,则质量:③>④>①>②,D错误;
故选B。
6.A
【详解】a g某气体的分子数为p,则其摩尔质量为,所以b g气体在标准状况下的体积为;
故选A。
7.B
【详解】①标准状况下,和混合后,根据原子守恒,则原子总数为,故①正确;②若气体的体积为,则它不一定处于标准状况下,也可以处于标准状况下,故②错误;③标准状况下,HCl是气体,水是液体,和的物质的量不相同,故③错误;④和的物质的量都为0.5mol,根据阿伏伽德罗定律,则标准状况下,和的体积相同,故④正确;⑤常温常压下,个二氧化碳分子的物质的量为0.5mol,其质量是,故⑤正确;⑥根据同温同压下,压强之比等于物质的量之比,则相同温度下,同体积容器中,气体物质的物质的量越大,则压强越大,故⑥正确;因此①④⑤⑥正确,故B正确。
综上所述,答案为B。
8.A
【详解】氯离子的物质的量浓度与溶液体积大小无关,与溶质的浓度及化学式组成有关,①溶液中Cl-的浓度为:c(Cl-)=1.5mol/L×3=4.5mol/L;②溶液 中Cl-的浓度为:c(Cl-)=2mol/L×2=4mol/L;③NaCl溶液中Cl-的浓度为:c(Cl-)=5mol/L×1=5mol/L;④氯酸钙电离出氯酸根离子和钙离子,不存在氯离子;⑤氯水中部分氯气能与水反应生成HCl,则氯水中Cl-的浓度小于1mol/L,根据分析可知,溶液中Cl-浓度由大到小的顺序为:③①②⑤④,故选:A。
9.C
【详解】A.盐酸是氯化氢的水溶液,因此该试剂瓶中的盐酸属于混合物,故A错误;
B.,配制100 mL 1.00 mol L-1的稀盐酸需该盐酸,故B错误;
C.该盐酸物质的量浓度为,故C正确;
D.配制稀盐酸时,取用浓盐酸的量筒使用后不能洗涤,故D错误。
综上所述,答案为C。
10.D
【分析】根据图乙可知,营养液中的浓度为=8 mol/L;营养液中含有三种溶质,中都含有Cl-,则浓度:Cl->,故Y是Cl-,X为。
【详解】A.由分析可知,Y是Cl-,A项正确;
B.由分析可知,图乙中,B项正确;
C.由分析可知,X为,的浓度为4.0 mol/L,则营养液中的物质的量浓度为4.0 mol/L,C项正确;
D.营养液中的浓度为8 mol/L,则的浓度为8 mol/L,Y是Cl-,Cl-浓度为9 mol/L,则浓度为1 mol/L,由选项C可知,的物质的量浓度为4.0 mol/L,则营养液中与的物质的量之比为,D项错误;
答案选D。
11.D
【详解】标准状况下a L HCl气体的物质的量为:,所得盐酸的质量为:,盐酸的体积为:,盐酸物质的量浓度为:;
故选D。
12.C
【详解】A.该溶液中硝酸物质的量浓度,故A正确;
B.假设a设质量分数分别为a%与(100-a)%的氨水溶液的密度分别为xg/mL、yg/mL,假定体积为1mL,则a%氨水溶液的质量为:1mL×xg/mL=xg,溶质氨水的质量为xg×a%,(100-a)%的氨水溶液的质量为1mL×yg/mL=yg,溶质氨水的质量为:yg×(100-a)%,所以混合后氨水的质量分数为:,①当x=y时,,②当x>y时,氨水质量分数越大,密度越小,a<100-a,a<50,则,③当x
C.因硫酸溶液密度大于水,因此100g浓度为cmol L-1的硫酸的体积小于100mL,若要使浓度变为原来的一半,则所加水的体积需小于100mL,故C错误;
D.,故D正确;
答案选C。
13.A
【详解】A.由配制一定物质的量浓度溶液配制的步骤为计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶可知,配制氢氧化钠溶液的实验操作步骤的正确顺序应为②①④③,故A正确;
B.完成步骤②后,应待溶液冷却至室温时,再将溶液转移至容量瓶中,故B错误;
C.由稀释定律可知,容量瓶用自来水、蒸馏水洗净即可,不需干燥就能使用,故C错误;
D.定容时,仰视容量瓶的刻度线会使溶液的体积偏大,导致配得的氢氧化钠溶液的浓度偏低,故D错误;
故选A。
14.C
【详解】A.将a g HCl完全溶于水,得到V mL饱和溶液,设HCl溶解度为S,可得,求出溶解度为,A正确;
B.HCl是强电解质完全电离,=,B正确;
C.溶质的质量分数,C错误;
D.溶质的物质的量浓度,D正确;
故选C。
15.(1)1
(2)7.1
(3)1:2
(4)11∶14
(5)
(6)
【详解】(1)分子数为个的物质的量;
(2)标准状况下,的物质的量为,其质量为;
(3)同温同压下,体积之比等于物质的量之比,则等体积的NO气体和气体的物质的量为1:1,则氧原子的个数之比为1:2;
(4)根据可知,等质量的CO和的物质的量之比为11:7,则氧原子的个数之比为=11:14;
(5)中氧原子的物质的量为4a mol,氧原子个数为b,则;
(6)a g的A和b g的B恰好完全反应生成0.2mol的C和d g的D,根据质量守恒定律可知,生成C的质量为(a+b-d) g,则C的摩尔质量为。
16.(1)32g/mol
(2)75%
(3)65.625%
(4)4:5
(5)3:1
(6)0.4mol
(7)1.43
【分析】在标准状况下,由CO和CO2组成的混合气体8.96L,物质的是为=0.4mol,设CO的物质的量为x,则CO2的物质的量为(0.4-x),由此可建立如下等式:28x+44(0.4-x)=12.8,则x=0.3mol,0.4-x=0.1mol。
【详解】(1)混合气体的平均摩尔质量是=32g/mol。答案为:32g/mol;
(2)CO的体积分数是=75%。答案为:75%;
(3)CO的质量分数是=65.625%。答案为:65.625%;
(4)由分析可知,CO的物质的量为0.3mol,CO2的物质的量为0.1mol,则C和O的原子个数比0.4mol:0.5mol=4:5。答案为:4:5;
(5)CO和CO2的物质的量比是0.3mol:0.1mol=3:1。答案为:3:1;
(6)由分析可知,CO、CO2的物质的量共为0.4mol,则碳原子的物质的量是0.4mol。答案为:0.4mol;
(7)混合气体的密度为≈1.43g/L。答案为:1.43。
17. 20% 1.51mol/L 30.2
【分析】根据溶液的质量分数及物质的量浓度的表达式分析解答;根据溶液稀释过程中溶质保持不变的原理分析解答。
【详解】(1) 溶液中溶质的质量为,溶液的质量是27.5g+12.5g=40g,则该溶液的溶质的质量分数为,故答案为:20%;
(2) CuSO4·5H2O的摩尔质量是250 g/mol,所以12.5 g CuSO4·5H2O的物质的量是,溶液的体积为,则该溶液中CuSO4的物质的量浓度为,故答案为:1.51 mol/L;
(3) 在稀释过程中溶质是不变的,所以稀释后的溶液的体积是V==30.2 mL,故答案为:30.2。
18.(1) 18.4 13.6
(2) C 玻璃棒 胶头滴管
(3)AD
(4)AB
【分析】配制一定物质的量浓度的溶液使用的玻璃仪器有:量筒、烧杯、玻璃棒、500 mL容量瓶、胶头滴管;
【详解】(1)该浓硫酸的溶质的物质的量浓度,则;根据稀释前后硫酸的物质的量相等列式可得:18.4 mol/L × V L = 0.5 mol/L × 0.5 L,解得V = 0.0136 ,即需用量筒量取98%的浓硫酸的体积为13.6 mL;
(2)根据分析,如图所示的仪器中,配制溶液肯定不需要的是C.分液漏斗;还需用到的玻璃仪器有玻璃棒、胶头滴管;
(3)稀释浓硫酸应该是将浓硫酸缓缓加入到水中并不断搅拌,转移时,用玻璃棒引流,洗涤烧杯和玻璃棒,并将洗涤液转移到容量瓶中,定容时眼睛与刻度线相平,摇匀时左手摁住瓶塞,右手托起瓶底,上下颠倒摇匀,因此错误的是AD;故选AD;
(4)A.洗涤量筒会造成硫酸溶质偏多,所配制的稀硫酸浓度偏大,A符合;
B.定容时俯视容量瓶刻度线,加水加少,所配制的稀硫酸浓度偏大,B符合;
C.转移溶液后,未洗涤烧杯和玻璃棒,硫酸溶质偏少,所配制的稀硫酸浓度偏小,C不符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线,加水加多,所配制的稀硫酸浓度偏小,D不符合;
故选AB。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
