第二章 海水中的重要元素——钠和氯 物质的量浓度 专项练 2025--2026学年上学期高中化学 必修第一册(人教版2019)
文档属性
| 名称 | 第二章 海水中的重要元素——钠和氯 物质的量浓度 专项练 2025--2026学年上学期高中化学 必修第一册(人教版2019) |  | |
| 格式 | docx | ||
| 文件大小 | 602.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 09:53:51 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
海水中的重要元素——钠和氯 物质的量浓度 专项练
2025--2026学年上学期高中化学 必修第一册(人教版2019)
一、单选题
1.下列有关0.1mol L-1NaOH溶液的叙述正确的是
A.1L该溶液中含有40g NaOH
B.100mL该溶液中OH-物质的量浓度为0.01mol L-1
C.在1g水中溶解4g NaOH即可配制得0.1mol L-1 NaOH溶液
D.往1mL该溶液中加入水稀释至10mL,所得NaOH溶液的浓度为0.01mol L-1
2.用8.4g的NaHCO3固体配成100mL溶液,所得溶液的物质的量浓度是
A.1.0mol·L-1 B.2.0mol·L-1 C.3.0mol·L-1 D.4.0mol·L-1
3.将10mL1.00mol·L-1的NaCl溶液与10mL2.00mol·L-1的CaCl2溶液相混合,则混合溶液中Cl-的物质的量浓度为多少(忽略混合前后溶液体积的变化)
A.2.0mol·L-1 B.2.5mol·L-1 C.3.0mol·L-1 D.3.5mol·L-1
4.配制 100 mL 1.0 mol/L NaOH 溶液,下列说法错误的是
A.选用规格为100 mL的容量瓶
B.实验所需 NaOH 固体的质量为 4.0g
C.将称取的 NaOH 固体直接放入容量瓶中加水溶解
D.定容时加水不慎超过了刻度线,需重新配制
5.配制溶液,部分实验操作如图所示:
下列说法正确的是
A.实验中需要的仪器有天平、480mL容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为②①③④
C.用托盘天平称量NaCl固体的质量为29.25g
D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
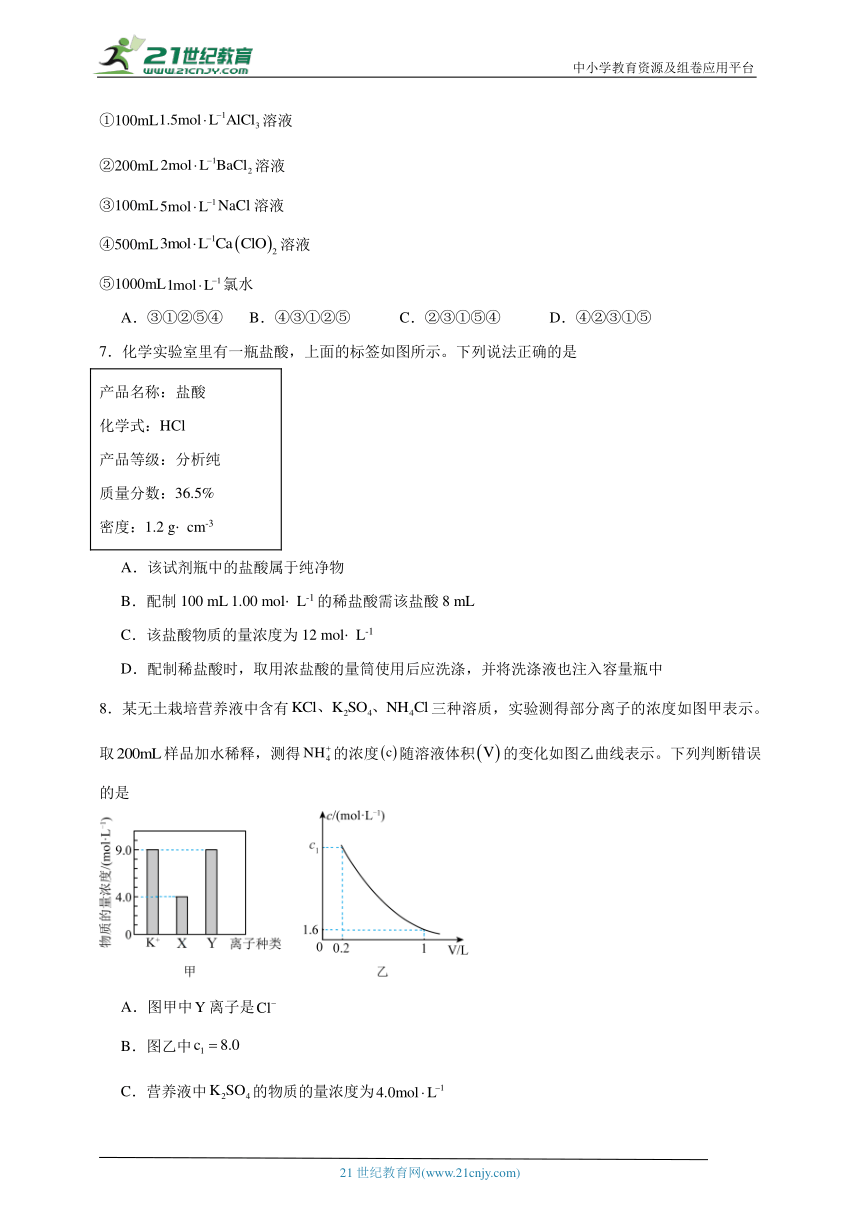
6.下列溶液中的物质的量浓度由大到小的顺序是
①100mL溶液
②200mL溶液
③100mLNaCl溶液
④500mL溶液
⑤1000mL氯水
A.③①②⑤④ B.④③①②⑤ C.②③①⑤④ D.④②③①⑤
7.化学实验室里有一瓶盐酸,上面的标签如图所示。下列说法正确的是
产品名称:盐酸 化学式:HCl 产品等级:分析纯 质量分数:36.5% 密度:1.2 g cm-3
A.该试剂瓶中的盐酸属于纯净物
B.配制100 mL 1.00 mol L-1的稀盐酸需该盐酸8 mL
C.该盐酸物质的量浓度为12 mol L-1
D.配制稀盐酸时,取用浓盐酸的量筒使用后应洗涤,并将洗涤液也注入容量瓶中
8.某无土栽培营养液中含有三种溶质,实验测得部分离子的浓度如图甲表示。取样品加水稀释,测得的浓度随溶液体积的变化如图乙曲线表示。下列判断错误的是
A.图甲中离子是
B.图乙中
C.营养液中的物质的量浓度为
D.营养液中与的物质的量之比为
9.如图所示是配制某物质的量浓度NaOH溶液的某些步骤。下列说法错误的是
A.图1:称量并溶解NaOH B.图2:转移洗涤液
C.图3:定容 D.图4:定容后反复上下颠倒摇匀
10.将标准状况下的aL HCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3 ,则该盐酸的物质的量浓度是
A. B.
C. D.
二、计算题
11.在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
(1)该混合液中,NaCl的物质的量为 mol, 含溶质MgCl2的质量为 g。
(2)该混合液中CaCl2的物质的量为 mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀 mol。
12.(1) 用14.2 g无水硫酸钠配制成500 mL溶液,溶质的物质的量浓度为 mol L-1.
(2)若从中取出50 mL,溶质的物质的量浓度为 mol L-1,溶质的质量为 g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为 mol L-1,的物质的量浓度为 mol L-1。
三、解答题
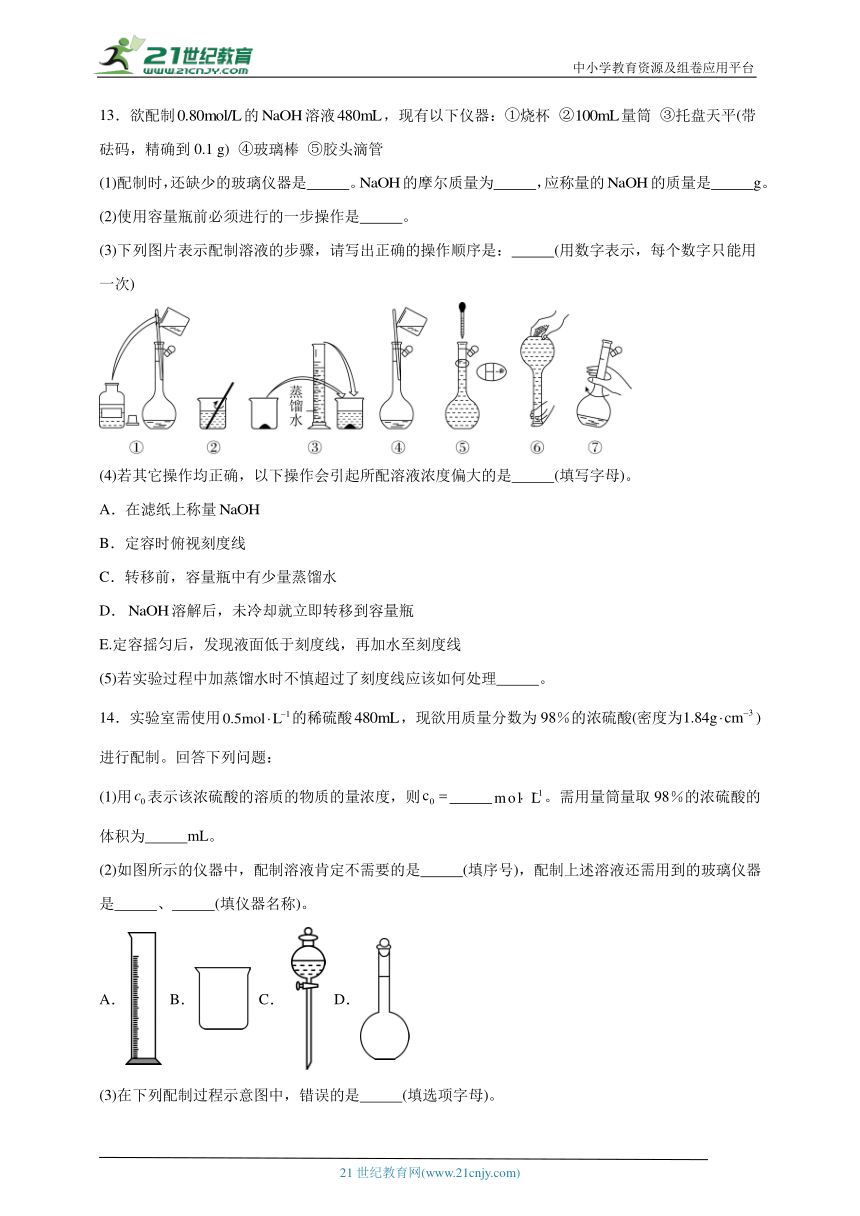
13.欲配制的溶液,现有以下仪器:①烧杯 ②量筒 ③托盘天平(带砝码,精确到0.1 g) ④玻璃棒 ⑤胶头滴管
(1)配制时,还缺少的玻璃仪器是 。的摩尔质量为 ,应称量的的质量是 g。
(2)使用容量瓶前必须进行的一步操作是 。
(3)下列图片表示配制溶液的步骤,请写出正确的操作顺序是: (用数字表示,每个数字只能用一次)
(4)若其它操作均正确,以下操作会引起所配溶液浓度偏大的是 (填写字母)。
A.在滤纸上称量
B.定容时俯视刻度线
C.转移前,容量瓶中有少量蒸馏水
D.溶解后,未冷却就立即转移到容量瓶
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线
(5)若实验过程中加蒸馏水时不慎超过了刻度线应该如何处理 。
14.实验室需使用的稀硫酸,现欲用质量分数为98%的浓硫酸(密度为)进行配制。回答下列问题:
(1)用表示该浓硫酸的溶质的物质的量浓度,则 。需用量筒量取98%的浓硫酸的体积为 mL。
(2)如图所示的仪器中,配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 、 (填仪器名称)。
A. B. C. D.
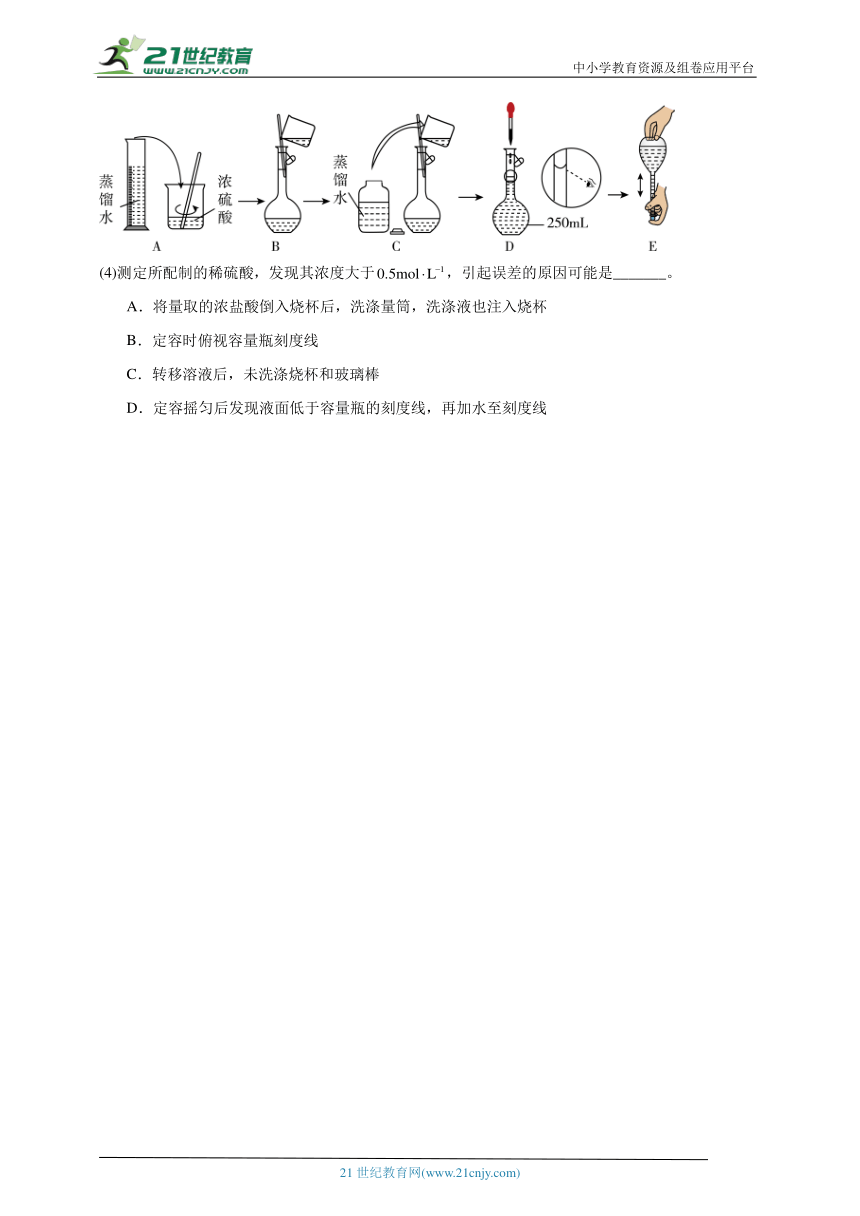
(3)在下列配制过程示意图中,错误的是 (填选项字母)。
(4)测定所配制的稀硫酸,发现其浓度大于,引起误差的原因可能是_______。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D A B C D A C D A A
1.D
【详解】A.1L 0.1mol L-1NaOH溶液中含氢氧化钠的质量为1L×0.1mol L-1×40g/mol=4g,故A错误;
B.氢氧化钠的强电解质,1个氢氧化钠电离出1个氢氧根离子,OH-物质的量浓度为0.1mol L-1,故B错误;
C.在1g水中溶解4g NaOH,溶液体积未知,不能求得浓度,故C错误;
D.氢氧化钠的强电解质,稀释10倍,浓度变为原来的 ,往1mL该溶液中加入水稀释至10mL,所得NaOH溶液的浓度为0.01mol L-1,故D正确;
故选D。
2.A
【详解】8.4g的NaHCO3固体配成100mL溶液,所得溶液的物质的量浓度是,故选A。
3.B
【详解】将10mL1.00mol·L-1的NaCl溶液与10mL2.00mol·L-1的CaCl2溶液相混合,则混合溶液中Cl-的物质的量浓度为,故选B。
4.C
【详解】A.配制 100 mL 1.0 mol/L NaOH 溶液,应选用100mL容量瓶,故A正确;
B.100 mL 1.0 mol/L NaOH 溶液,所含溶质的物质的量为0.1L×1.0mol/L=0.1mol,NaOH 固体的质量为0.1mol×40g/mol= 4.0g,故B正确;
C.容量瓶中不能进行固体溶解,故C错误;
D.定容时加水不慎超过了刻度线,只能重新配制,故D正确;
故选:C。
5.D
【分析】配制溶液,故需选用500mL的容量瓶,一定物质的量浓度溶液配制的操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作;
【详解】A.实验室中没有480mL容量瓶,故需选用500mL的容量瓶,则本实验中需要的仪器有天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管等,A错误;
B.根据配制溶液的步骤顺序:计算、称量、溶解、转移、洗涤、定容和摇匀等,故上述实验操作步骤的正确顺序为②①④③,B错误;
C.托盘天平只能精确到小数点后1位,故用托盘天平称量NaCl固体的质量为0.5L×1mol/L×58.5g/mol≈29.3g,C错误;
D.定容时,仰视容量瓶的刻度线,导致所配溶液体积偏大,即使配得的NaCl溶液浓度偏低,D正确;
故选D。
6.A
【详解】氯离子的物质的量浓度与溶液体积大小无关,与溶质的浓度及化学式组成有关,①溶液中Cl-的浓度为:c(Cl-)=1.5mol/L×3=4.5mol/L;②溶液 中Cl-的浓度为:c(Cl-)=2mol/L×2=4mol/L;③NaCl溶液中Cl-的浓度为:c(Cl-)=5mol/L×1=5mol/L;④氯酸钙电离出氯酸根离子和钙离子,不存在氯离子;⑤氯水中部分氯气能与水反应生成HCl,则氯水中Cl-的浓度小于1mol/L,根据分析可知,溶液中Cl-浓度由大到小的顺序为:③①②⑤④,故选:A。
7.C
【详解】A.盐酸是氯化氢的水溶液,因此该试剂瓶中的盐酸属于混合物,故A错误;
B.,配制100 mL 1.00 mol L-1的稀盐酸需该盐酸,故B错误;
C.该盐酸物质的量浓度为,故C正确;
D.配制稀盐酸时,取用浓盐酸的量筒使用后不能洗涤,故D错误。
综上所述,答案为C。
8.D
【分析】根据图乙可知,营养液中的浓度为=8 mol/L;营养液中含有三种溶质,中都含有Cl-,则浓度:Cl->,故Y是Cl-,X为。
【详解】A.由分析可知,Y是Cl-,A项正确;
B.由分析可知,图乙中,B项正确;
C.由分析可知,X为,的浓度为4.0 mol/L,则营养液中的物质的量浓度为4.0 mol/L,C项正确;
D.营养液中的浓度为8 mol/L,则的浓度为8 mol/L,Y是Cl-,Cl-浓度为9 mol/L,则浓度为1 mol/L,由选项C可知,的物质的量浓度为4.0 mol/L,则营养液中与的物质的量之比为,D项错误;
答案选D。
9.A
【详解】A.NaOH固体易潮解,不能用称量纸称量,A项错误;
B.洗涤液要转移到容量瓶中,转移过程要用玻璃棒引流,B项正确;
C.定容时加蒸馏水至刻度线以下1~2cm处,改用胶头滴管滴加至凹液面最低处与刻度线相切,C项正确;
D.定容后反复上下颠倒摇匀,D项正确;
故选A。
10.A
【详解】标准状况下的aL HCl(g)物质的量为,根据
,可得,故答案选A。
11. 0.4 19 0.2 0.2 1.2
【分析】(1)由图可知,c(Na+)=1.0mol/L,c(Mg2+)=0.5mol/L,结合n=cV、m=nM计算;
(2)结合电荷守恒计算c(Ca2+),结合n=cV、c=计算;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀。
【详解】(1)由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.4L×1.0mol/L=0.4mol;c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.4L×0.5mol/L×95g/mol=19.0g;
(2)由电荷守恒可知2c(Ca2+)+c(Na+)+2c(Mg2+)=c(Cl ),解得:2c(Ca2+)=3.0 1.0 0.5×2=1mol/L,c(Ca2+)=0.5mol/L,混合液中CaCl2的物质的量为:0.4L×0.5mol/L=0.2mol,该混合液加水稀释至体积为1L,稀释过程中溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为:c==0.2mol;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀,n(AgCl)=n(Cl )=3mol/L×0.4L=1.2mol。
12. 0.2 0.2 1.42 0.2 0.1
【详解】(1) 14.2 g无水硫酸钠的物质的量为=0.1mol,浓度为=0.2mol/L;
(2)溶液为均一稳定的分散系,从中取出50 mL,溶质的物质的量浓度也为0.2mol/L;溶质的质量为0.05L0.2mol/L142g/mol=1.42g;
(3)稀释过程中溶质的物质的量不变,所以所得溶液中Na+的物质的量浓度为=0.2mol/L;1molNa2SO4含有1molS,所以S的物质的量浓度为=0.1mol/L。
13.(1) 500容量瓶 40g/mol 16.0
(2)检验是否漏水
(3)③②④⑦①⑤⑥
(4)BD
(5)重新配制
【详解】(1)欲配制的溶液,实验步骤有:计算、称量、溶解并冷却、移液、洗涤、定容、摇匀,所以需要的仪器有烧杯 、托盘天平(带砝码) 、玻璃棒、胶头滴管和500容量瓶,所以缺少500容量瓶;的摩尔质量为40g/mol;由于选用500容量瓶,应称量的的质量是0.5L××40g/mol =16.0g。
(2)容量瓶在使用时需要颠倒摇匀,所以使用容量瓶前必须进行的一步操作是检验是否漏水;
(3)实验步骤有:计算、称量、溶解并冷却、移液、洗涤、定容、摇匀,正确的操作顺序是③②④⑦①⑤⑥。
(4)A.在滤纸上称量,部分氢氧化钠粘在滤纸上,使氢氧化钠质量偏小,所配溶液浓度偏小,故不选A;
B.定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏大,故选B;
C.转移前,容量瓶中有少量蒸馏水,对所配溶液浓度无影响,故不选C;
D.溶解后,未冷却就立即转移到容量瓶,溶液体积偏小,所配溶液浓度偏大,故选D;
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线,溶液体积偏大,所配溶液浓度偏小,故不选E;
选BD。
(5)若实验过程中加蒸馏水时不慎超过了刻度线应重新配制。
14.(1) 18.4 13.6
(2) C 玻璃棒 胶头滴管
(3)AD
(4)AB
【分析】配制一定物质的量浓度的溶液使用的玻璃仪器有:量筒、烧杯、玻璃棒、500 mL容量瓶、胶头滴管;
【详解】(1)该浓硫酸的溶质的物质的量浓度,则;根据稀释前后硫酸的物质的量相等列式可得:18.4 mol/L × V L = 0.5 mol/L × 0.5 L,解得V = 0.0136 ,即需用量筒量取98%的浓硫酸的体积为13.6 mL;
(2)根据分析,如图所示的仪器中,配制溶液肯定不需要的是C.分液漏斗;还需用到的玻璃仪器有玻璃棒、胶头滴管;
(3)稀释浓硫酸应该是将浓硫酸缓缓加入到水中并不断搅拌,转移时,用玻璃棒引流,洗涤烧杯和玻璃棒,并将洗涤液转移到容量瓶中,定容时眼睛与刻度线相平,摇匀时左手摁住瓶塞,右手托起瓶底,上下颠倒摇匀,因此错误的是AD;故选AD;
(4)A.洗涤量筒会造成硫酸溶质偏多,所配制的稀硫酸浓度偏大,A符合;
B.定容时俯视容量瓶刻度线,加水加少,所配制的稀硫酸浓度偏大,B符合;
C.转移溶液后,未洗涤烧杯和玻璃棒,硫酸溶质偏少,所配制的稀硫酸浓度偏小,C不符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线,加水加多,所配制的稀硫酸浓度偏小,D不符合;
故选AB。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
海水中的重要元素——钠和氯 物质的量浓度 专项练
2025--2026学年上学期高中化学 必修第一册(人教版2019)
一、单选题
1.下列有关0.1mol L-1NaOH溶液的叙述正确的是
A.1L该溶液中含有40g NaOH
B.100mL该溶液中OH-物质的量浓度为0.01mol L-1
C.在1g水中溶解4g NaOH即可配制得0.1mol L-1 NaOH溶液
D.往1mL该溶液中加入水稀释至10mL,所得NaOH溶液的浓度为0.01mol L-1
2.用8.4g的NaHCO3固体配成100mL溶液,所得溶液的物质的量浓度是
A.1.0mol·L-1 B.2.0mol·L-1 C.3.0mol·L-1 D.4.0mol·L-1
3.将10mL1.00mol·L-1的NaCl溶液与10mL2.00mol·L-1的CaCl2溶液相混合,则混合溶液中Cl-的物质的量浓度为多少(忽略混合前后溶液体积的变化)
A.2.0mol·L-1 B.2.5mol·L-1 C.3.0mol·L-1 D.3.5mol·L-1
4.配制 100 mL 1.0 mol/L NaOH 溶液,下列说法错误的是
A.选用规格为100 mL的容量瓶
B.实验所需 NaOH 固体的质量为 4.0g
C.将称取的 NaOH 固体直接放入容量瓶中加水溶解
D.定容时加水不慎超过了刻度线,需重新配制
5.配制溶液,部分实验操作如图所示:
下列说法正确的是
A.实验中需要的仪器有天平、480mL容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为②①③④
C.用托盘天平称量NaCl固体的质量为29.25g
D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
6.下列溶液中的物质的量浓度由大到小的顺序是
①100mL溶液
②200mL溶液
③100mLNaCl溶液
④500mL溶液
⑤1000mL氯水
A.③①②⑤④ B.④③①②⑤ C.②③①⑤④ D.④②③①⑤
7.化学实验室里有一瓶盐酸,上面的标签如图所示。下列说法正确的是
产品名称:盐酸 化学式:HCl 产品等级:分析纯 质量分数:36.5% 密度:1.2 g cm-3
A.该试剂瓶中的盐酸属于纯净物
B.配制100 mL 1.00 mol L-1的稀盐酸需该盐酸8 mL
C.该盐酸物质的量浓度为12 mol L-1
D.配制稀盐酸时,取用浓盐酸的量筒使用后应洗涤,并将洗涤液也注入容量瓶中
8.某无土栽培营养液中含有三种溶质,实验测得部分离子的浓度如图甲表示。取样品加水稀释,测得的浓度随溶液体积的变化如图乙曲线表示。下列判断错误的是
A.图甲中离子是
B.图乙中
C.营养液中的物质的量浓度为
D.营养液中与的物质的量之比为
9.如图所示是配制某物质的量浓度NaOH溶液的某些步骤。下列说法错误的是
A.图1:称量并溶解NaOH B.图2:转移洗涤液
C.图3:定容 D.图4:定容后反复上下颠倒摇匀
10.将标准状况下的aL HCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3 ,则该盐酸的物质的量浓度是
A. B.
C. D.
二、计算题
11.在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
(1)该混合液中,NaCl的物质的量为 mol, 含溶质MgCl2的质量为 g。
(2)该混合液中CaCl2的物质的量为 mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀 mol。
12.(1) 用14.2 g无水硫酸钠配制成500 mL溶液,溶质的物质的量浓度为 mol L-1.
(2)若从中取出50 mL,溶质的物质的量浓度为 mol L-1,溶质的质量为 g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为 mol L-1,的物质的量浓度为 mol L-1。
三、解答题
13.欲配制的溶液,现有以下仪器:①烧杯 ②量筒 ③托盘天平(带砝码,精确到0.1 g) ④玻璃棒 ⑤胶头滴管
(1)配制时,还缺少的玻璃仪器是 。的摩尔质量为 ,应称量的的质量是 g。
(2)使用容量瓶前必须进行的一步操作是 。
(3)下列图片表示配制溶液的步骤,请写出正确的操作顺序是: (用数字表示,每个数字只能用一次)
(4)若其它操作均正确,以下操作会引起所配溶液浓度偏大的是 (填写字母)。
A.在滤纸上称量
B.定容时俯视刻度线
C.转移前,容量瓶中有少量蒸馏水
D.溶解后,未冷却就立即转移到容量瓶
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线
(5)若实验过程中加蒸馏水时不慎超过了刻度线应该如何处理 。
14.实验室需使用的稀硫酸,现欲用质量分数为98%的浓硫酸(密度为)进行配制。回答下列问题:
(1)用表示该浓硫酸的溶质的物质的量浓度,则 。需用量筒量取98%的浓硫酸的体积为 mL。
(2)如图所示的仪器中,配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 、 (填仪器名称)。
A. B. C. D.
(3)在下列配制过程示意图中,错误的是 (填选项字母)。
(4)测定所配制的稀硫酸,发现其浓度大于,引起误差的原因可能是_______。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D A B C D A C D A A
1.D
【详解】A.1L 0.1mol L-1NaOH溶液中含氢氧化钠的质量为1L×0.1mol L-1×40g/mol=4g,故A错误;
B.氢氧化钠的强电解质,1个氢氧化钠电离出1个氢氧根离子,OH-物质的量浓度为0.1mol L-1,故B错误;
C.在1g水中溶解4g NaOH,溶液体积未知,不能求得浓度,故C错误;
D.氢氧化钠的强电解质,稀释10倍,浓度变为原来的 ,往1mL该溶液中加入水稀释至10mL,所得NaOH溶液的浓度为0.01mol L-1,故D正确;
故选D。
2.A
【详解】8.4g的NaHCO3固体配成100mL溶液,所得溶液的物质的量浓度是,故选A。
3.B
【详解】将10mL1.00mol·L-1的NaCl溶液与10mL2.00mol·L-1的CaCl2溶液相混合,则混合溶液中Cl-的物质的量浓度为,故选B。
4.C
【详解】A.配制 100 mL 1.0 mol/L NaOH 溶液,应选用100mL容量瓶,故A正确;
B.100 mL 1.0 mol/L NaOH 溶液,所含溶质的物质的量为0.1L×1.0mol/L=0.1mol,NaOH 固体的质量为0.1mol×40g/mol= 4.0g,故B正确;
C.容量瓶中不能进行固体溶解,故C错误;
D.定容时加水不慎超过了刻度线,只能重新配制,故D正确;
故选:C。
5.D
【分析】配制溶液,故需选用500mL的容量瓶,一定物质的量浓度溶液配制的操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作;
【详解】A.实验室中没有480mL容量瓶,故需选用500mL的容量瓶,则本实验中需要的仪器有天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管等,A错误;
B.根据配制溶液的步骤顺序:计算、称量、溶解、转移、洗涤、定容和摇匀等,故上述实验操作步骤的正确顺序为②①④③,B错误;
C.托盘天平只能精确到小数点后1位,故用托盘天平称量NaCl固体的质量为0.5L×1mol/L×58.5g/mol≈29.3g,C错误;
D.定容时,仰视容量瓶的刻度线,导致所配溶液体积偏大,即使配得的NaCl溶液浓度偏低,D正确;
故选D。
6.A
【详解】氯离子的物质的量浓度与溶液体积大小无关,与溶质的浓度及化学式组成有关,①溶液中Cl-的浓度为:c(Cl-)=1.5mol/L×3=4.5mol/L;②溶液 中Cl-的浓度为:c(Cl-)=2mol/L×2=4mol/L;③NaCl溶液中Cl-的浓度为:c(Cl-)=5mol/L×1=5mol/L;④氯酸钙电离出氯酸根离子和钙离子,不存在氯离子;⑤氯水中部分氯气能与水反应生成HCl,则氯水中Cl-的浓度小于1mol/L,根据分析可知,溶液中Cl-浓度由大到小的顺序为:③①②⑤④,故选:A。
7.C
【详解】A.盐酸是氯化氢的水溶液,因此该试剂瓶中的盐酸属于混合物,故A错误;
B.,配制100 mL 1.00 mol L-1的稀盐酸需该盐酸,故B错误;
C.该盐酸物质的量浓度为,故C正确;
D.配制稀盐酸时,取用浓盐酸的量筒使用后不能洗涤,故D错误。
综上所述,答案为C。
8.D
【分析】根据图乙可知,营养液中的浓度为=8 mol/L;营养液中含有三种溶质,中都含有Cl-,则浓度:Cl->,故Y是Cl-,X为。
【详解】A.由分析可知,Y是Cl-,A项正确;
B.由分析可知,图乙中,B项正确;
C.由分析可知,X为,的浓度为4.0 mol/L,则营养液中的物质的量浓度为4.0 mol/L,C项正确;
D.营养液中的浓度为8 mol/L,则的浓度为8 mol/L,Y是Cl-,Cl-浓度为9 mol/L,则浓度为1 mol/L,由选项C可知,的物质的量浓度为4.0 mol/L,则营养液中与的物质的量之比为,D项错误;
答案选D。
9.A
【详解】A.NaOH固体易潮解,不能用称量纸称量,A项错误;
B.洗涤液要转移到容量瓶中,转移过程要用玻璃棒引流,B项正确;
C.定容时加蒸馏水至刻度线以下1~2cm处,改用胶头滴管滴加至凹液面最低处与刻度线相切,C项正确;
D.定容后反复上下颠倒摇匀,D项正确;
故选A。
10.A
【详解】标准状况下的aL HCl(g)物质的量为,根据
,可得,故答案选A。
11. 0.4 19 0.2 0.2 1.2
【分析】(1)由图可知,c(Na+)=1.0mol/L,c(Mg2+)=0.5mol/L,结合n=cV、m=nM计算;
(2)结合电荷守恒计算c(Ca2+),结合n=cV、c=计算;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀。
【详解】(1)由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.4L×1.0mol/L=0.4mol;c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.4L×0.5mol/L×95g/mol=19.0g;
(2)由电荷守恒可知2c(Ca2+)+c(Na+)+2c(Mg2+)=c(Cl ),解得:2c(Ca2+)=3.0 1.0 0.5×2=1mol/L,c(Ca2+)=0.5mol/L,混合液中CaCl2的物质的量为:0.4L×0.5mol/L=0.2mol,该混合液加水稀释至体积为1L,稀释过程中溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为:c==0.2mol;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀,n(AgCl)=n(Cl )=3mol/L×0.4L=1.2mol。
12. 0.2 0.2 1.42 0.2 0.1
【详解】(1) 14.2 g无水硫酸钠的物质的量为=0.1mol,浓度为=0.2mol/L;
(2)溶液为均一稳定的分散系,从中取出50 mL,溶质的物质的量浓度也为0.2mol/L;溶质的质量为0.05L0.2mol/L142g/mol=1.42g;
(3)稀释过程中溶质的物质的量不变,所以所得溶液中Na+的物质的量浓度为=0.2mol/L;1molNa2SO4含有1molS,所以S的物质的量浓度为=0.1mol/L。
13.(1) 500容量瓶 40g/mol 16.0
(2)检验是否漏水
(3)③②④⑦①⑤⑥
(4)BD
(5)重新配制
【详解】(1)欲配制的溶液,实验步骤有:计算、称量、溶解并冷却、移液、洗涤、定容、摇匀,所以需要的仪器有烧杯 、托盘天平(带砝码) 、玻璃棒、胶头滴管和500容量瓶,所以缺少500容量瓶;的摩尔质量为40g/mol;由于选用500容量瓶,应称量的的质量是0.5L××40g/mol =16.0g。
(2)容量瓶在使用时需要颠倒摇匀,所以使用容量瓶前必须进行的一步操作是检验是否漏水;
(3)实验步骤有:计算、称量、溶解并冷却、移液、洗涤、定容、摇匀,正确的操作顺序是③②④⑦①⑤⑥。
(4)A.在滤纸上称量,部分氢氧化钠粘在滤纸上,使氢氧化钠质量偏小,所配溶液浓度偏小,故不选A;
B.定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏大,故选B;
C.转移前,容量瓶中有少量蒸馏水,对所配溶液浓度无影响,故不选C;
D.溶解后,未冷却就立即转移到容量瓶,溶液体积偏小,所配溶液浓度偏大,故选D;
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线,溶液体积偏大,所配溶液浓度偏小,故不选E;
选BD。
(5)若实验过程中加蒸馏水时不慎超过了刻度线应重新配制。
14.(1) 18.4 13.6
(2) C 玻璃棒 胶头滴管
(3)AD
(4)AB
【分析】配制一定物质的量浓度的溶液使用的玻璃仪器有:量筒、烧杯、玻璃棒、500 mL容量瓶、胶头滴管;
【详解】(1)该浓硫酸的溶质的物质的量浓度,则;根据稀释前后硫酸的物质的量相等列式可得:18.4 mol/L × V L = 0.5 mol/L × 0.5 L,解得V = 0.0136 ,即需用量筒量取98%的浓硫酸的体积为13.6 mL;
(2)根据分析,如图所示的仪器中,配制溶液肯定不需要的是C.分液漏斗;还需用到的玻璃仪器有玻璃棒、胶头滴管;
(3)稀释浓硫酸应该是将浓硫酸缓缓加入到水中并不断搅拌,转移时,用玻璃棒引流,洗涤烧杯和玻璃棒,并将洗涤液转移到容量瓶中,定容时眼睛与刻度线相平,摇匀时左手摁住瓶塞,右手托起瓶底,上下颠倒摇匀,因此错误的是AD;故选AD;
(4)A.洗涤量筒会造成硫酸溶质偏多,所配制的稀硫酸浓度偏大,A符合;
B.定容时俯视容量瓶刻度线,加水加少,所配制的稀硫酸浓度偏大,B符合;
C.转移溶液后,未洗涤烧杯和玻璃棒,硫酸溶质偏少,所配制的稀硫酸浓度偏小,C不符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线,加水加多,所配制的稀硫酸浓度偏小,D不符合;
故选AB。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
