湖南省新高考教学教研联盟暨长郡十二校2024-2025学年高二下学期期末联考化学试卷(含答案)
文档属性
| 名称 | 湖南省新高考教学教研联盟暨长郡十二校2024-2025学年高二下学期期末联考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 838.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 10:19:50 | ||
图片预览




文档简介
湖南省新高考教学教研联盟暨长郡二十校联盟2024-2025学年高二下学期7月期末化学试题
一、单选题
1.我国提出在2060年前完成“碳中和”的目标,下列有关低碳生活的说法错误的是
A.通过对二氧化碳液化进行海底封存,可以助力“碳中和”
B.大力开发利用化石能源有利于实现“碳中和”
C.低碳生活不意味着禁止使用所有燃料
D.在一定条件下将二氧化碳还原为甲酸,有利于实现“碳中和”
2.结构决定性质,性质决定用途。下列说法错误的是
A.碳酸钠可以与酸反应,可用作胃药
B.聚四氟乙烯耐化学腐蚀,可用于制作酸碱通用滴定管的旋塞
C.石墨烯是只有一个碳原子直径厚度的单层石墨,电阻率低,可用于动力电池
D.低温石英中,螺旋上升的硅氧四面体长链使其具有手性,可用作压电材料
3.下列化学用语表达正确的是
A.基态的价层电子排布图为
B.二甲基苯甲酰胺的结构简式:
C.的球棍模型:
D.的电子式:
4.下列离子方程式正确的是
A.向银氨溶液中通入:
B.溶于氢碘酸:
C.用醋酸和淀粉-KI溶液检验加碘盐中的:
D.向饱和溶液中通入过量:
5.对于配合物[Ni(NH2CH2CH2NH2)2Cl2]Cl,1个配离子中存在2个五元环状结构,其中Ni为+3价。下列说法正确的是
A.该配合物的配位数为6
B.1mol该有机物与足量的AgNO3溶液反应生成3molAgCl
C.NH2CH2CH2NH2中所有原子可能在一个平面上
D.NH2CH2CH2NH2、NH2CH2NH2、NH2-NH2均为有机物
6.下列实验操作、现象及结论均正确的是
选项 操作 现象 结论
A 将与NaOH溶液共热,冷却后,取出上层水溶液加入溶液 产生淡黄色沉淀 中含有溴原子
B 向溶液中滴入滴溶液,得到新制的悬浊液,然后加入0.5mL乙醛溶液,振荡后加热 产生砖红色沉淀 醛基具有还原性
C 向苯中滴加溴水 溴水褪色 苯发生了取代反应
D 将盐酸和反应后的气体通入苯酚钠溶液中 溶液变浑浊 碳酸的酸性比苯酚的酸性强
A.A B.B C.C D.D
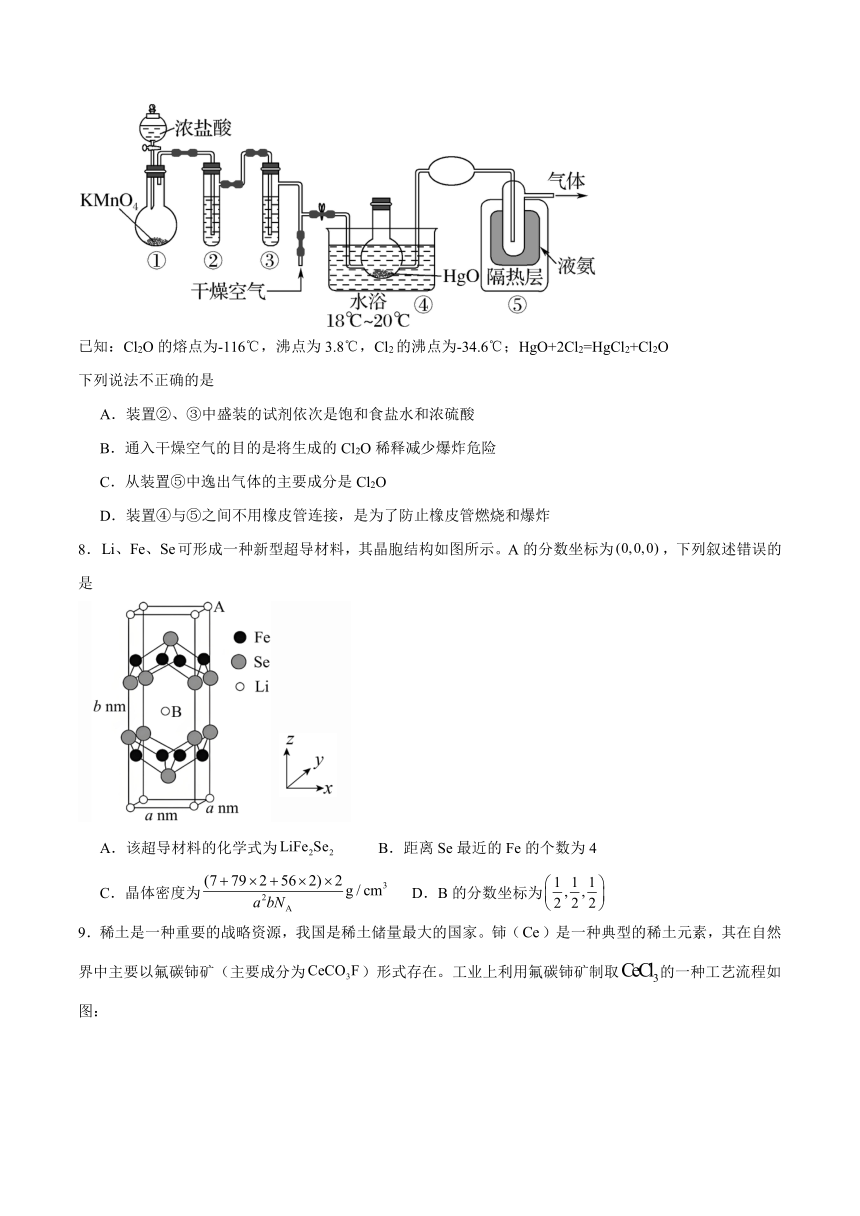
7.Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116℃,沸点为3.8℃,Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O
下列说法不正确的是
A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
8.可形成一种新型超导材料,其晶胞结构如图所示。A的分数坐标为,下列叙述错误的是
A.该超导材料的化学式为 B.距离Se最近的Fe的个数为4
C.晶体密度为 D.B的分数坐标为
9.稀土是一种重要的战略资源,我国是稀土储量最大的国家。铈()是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为)形式存在。工业上利用氟碳铈矿制取的一种工艺流程如图:
下列说法错误的是
A.焙烧过程中氧化剂与还原剂的物质的量之比为
B.通过操作Ⅱ(包含酸溶、蒸发结晶)即可得到纯净的
C.酸浸过程中用稀硫酸和双氧水替代盐酸可体现环境友好
D.中阴离子的空间构型为正四面体
10.华蟾素具有解毒、消肿、止痛的功能,用于治疗中、晚期肿瘤,慢性乙型肝炎等疾病,其结构简式如图所示。下列关于华蟾素的说法错误的是
A.华蟾素的分子式为 B.能与溶液反应生成
C.能使酸性溶液褪色 D.能够发生酯化反应、水解反应
11.实验小组探究SO2与Na2O2的反应。向盛有SO2的烧瓶中加入Na2O2固体,测得反应体系中O2含量的变化如图。
下列说法不正确的是
A.有O2生成推测发生了反应:2Na2O2 + 2SO2 = 2Na2SO3 + O2
B.bc段O2含量下降与反应O2 + 2Na2SO3 = 2Na2SO4有关
C.c点剩余固体中含有Na2SO3
D.实验过程中Na2O2仅体现氧化性
12.PEF材料是一种生物基聚酯材料(由可再生生物质资源,如玉米、甘蔗等提取原料制成的塑料材料),具有多种优越性能和广泛的应用前景。其一种转化过程如图。下列说法错误的是
A. B.上述转化的原子利用率小于
C.PEF中有三种官能团 D.与传统的石化塑料相比,PEF具有可降解、环保等优点
13.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。下列有关叙述正确的是
A.原子半径大小:
B.该化合物中Y原子不满足8电子稳定结构
C.键角大小:
D.元素W、X、Y、Z只可以组成分子晶体
14.卤化物的水解机理分亲核水解和亲电水解。发生亲核水解的结构条件:中心原子具有(带有部分正电荷)和空轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受中H的进攻。三氯化氮()能水解生成次氯酸和氨气,四氯化硅()遇水也可剧烈水解,其水解反应的机理如下图所示(“□”代表Si的3d轨道)。下列说法正确的是
A.和的中心原子上的价层电子对数目不相同
B.碳和硅同族,推测常温下可以水解为碳酸和氯化氢
C.发生亲电水解
D.上述过程中,有极性键的断裂和非极性键的形成
二、解答题
15.试用物质结构的相关知识解释以下问题:
(1)(俗称过氧化脲)常温下为白色晶体,易溶于水,其热分解温度为,在水溶液中会离解为过氧化氢和尿素,可用作漂白剂。
①是 (填“极性”或“非极性”)分子,其中氧原子的杂化轨道类型是 杂化。
②中碳原子的杂化轨道类型是 杂化;中C、的电负性大小关系为 (用原子符号由大到小排序),第一电离能的大小关系为 (用原子符号由大到小排序)。
(2)接近水的沸点的水蒸气,其相对分子质量的测定值比化学式计算出来的相对分子质量大一些,试解释原因: 。
(3)可与4-甲基咪唑()形成配合物。4-甲基咪唑中,1号氮原子的孤电子对因参与形成大键,电子云密度降低。已知分子中的大键可用符号表示,其中m代表参与形成大键的原子数(或轨道数),n代表参与形成大键的电子数(如苯分子中的大键可表示为)。
①4-甲基咪唑中的大键可表示为 。
②4-甲基咪唑中, (填“1”或“3”)号氮原子更容易与形成配位键。
(4)的熔点高于的熔点为,其原因是 。
16.苯甲酸(,其在水中的溶解度见表)具有广泛的用途,可用作食品防腐剂及有机合成的原料。回答下列问题:
温度/ 20 25 50 75 95
溶解度/g 0.17 0.35 0.95 2.2 6.8
I.粗苯甲酸的制备
实验室利用高锰酸钾溶液氧化甲苯(沸点为)制备苯甲酸(高锰酸钾自身转化为沉淀),实验装置如图(部分装置已略去)。
实验步骤:①在分水器中注入适量蒸馏水,将反应物加入三口烧瓶中混合,加热至沸腾,边搅拌边反应;②待反应完全后,停止加热,冷却片刻后拆除分水器;③向三口烧瓶中慢慢加入适量草酸溶液,搅拌一段时间;④适当加热,将反应后的混合液趁热过滤、洗涤,合并滤液,将滤液经冷却、浓盐酸酸化、减压过滤、洗涤、干燥等步骤后得到粗苯甲酸。
(1)仪器甲的名称是 。
(2)写出步骤①中三口烧瓶中发生反应的化学方程式: ;根据 (填现象)可以判断三口烧瓶中反应已经基本完成。
(3)实验步骤③中加入适量草酸溶液的目的是 ,该步骤所加草酸不宜过量,原因是 。
Ⅱ.粗苯甲酸的提纯
(4)操作I、Ⅱ、IV中均需使用的玻璃仪器有 。
(5)操作Ⅲ冷却结晶时为减少杂质被包裹,且得到较大的晶体颗粒便于分离,应 (填“缓慢”或“快速”)冷却。
(6)苯甲酸产品纯度测定:称取苯甲酸产品,配成苯甲酸的乙醇溶液,移取溶液,用的溶液进行滴定,消耗溶液的体积为。则苯甲酸产品的纯度为 (保留三位有效数字)。
17.铂钯精矿含等元素。一种从铂钯精矿中提取和Pd的工艺如下:
已知:“氯化溶解”后所得主要产物为,氯离子起配位作用;在煮沸下与水反应得到易溶于水的。
(1)“酸浸”时,需要将废铂钯精矿粉碎,粉碎的目的是 。
(2)在实验室进行“煅烧”时,下列仪器中需要用到的是 (填仪器名称)。
(3)金位于元素周期表的第六周期且与铜同族,则基态金原子的价层电子轨道表示式为 。
(4)已知是一元强酸,则“分金”过程发生反应的离子方程式是 。
(5)加入氨水的过程中,钯()的配合物发生变化的原因是 。
(6)X气体在碱性干燥条件下更易于收集,则X的化学式为 。
(7)“水合肼还原”过程中(水合肼)转化为,在反应器中有氯化铵生成,写出该过程的化学方程式: 。
18.非天然氨基酸AHPA是一种重要的药物中间体,其合成路线之一如下:
(1)A可由氧化得到,的化学名称是 。
(2)C的结构简式为 。
(3)D中手性碳原子的数目为 。
(4)D转化为E的第一步反应的反应类型为 。
(5)AHPA中酸性官能团的名称为 ,碱性官能团的名称为 。
(6)写出同时满足下列条件的AHPA的同分异构体的结构简式: 。
①含苯环且苯环上只有一个取代基;
②红外光谱显示含氧官能团只有—OH和;
③核磁共振氢谱显示有6组峰,峰面积比为4:2:2:2:2:1。
(7)参照上述合成路线,设计以苄醇()为主要原料制备的合成路线 (其他原料、试剂任选)。
参考答案
1.B
2.A
3.B
4.D
5.A
6.B
7.C
8.C
9.B
10.B
11.D
12.C
13.C
14.C
15.(1) 极性
(2)水分子之间形成氢键,即形成多聚水分子
(3) 3
(4)是离子晶体,熔沸点较高,是分子晶体,熔沸点较低
16.(1)球形冷凝管
(2) 当回流液不再出现油珠
(3) 将过量的KMnO4还原,防止在后续操作中将盐酸氧化 苯甲酸会溶于草酸,降低产率
(4)玻璃棒、烧杯
(5)缓慢
(6)99.0%
17.(1)增大固体接触面积,使反应快速充分
(2)坩埚、泥三角
(3)
(4)
(5)NH3与Pd2+的配位能力强于Cl-
(6)NH3
(7)
18.(1)羟基乙酸
(2)
(3)3
(4)消去反应
(5) 羧基 氨基
(6)
(7)
一、单选题
1.我国提出在2060年前完成“碳中和”的目标,下列有关低碳生活的说法错误的是
A.通过对二氧化碳液化进行海底封存,可以助力“碳中和”
B.大力开发利用化石能源有利于实现“碳中和”
C.低碳生活不意味着禁止使用所有燃料
D.在一定条件下将二氧化碳还原为甲酸,有利于实现“碳中和”
2.结构决定性质,性质决定用途。下列说法错误的是
A.碳酸钠可以与酸反应,可用作胃药
B.聚四氟乙烯耐化学腐蚀,可用于制作酸碱通用滴定管的旋塞
C.石墨烯是只有一个碳原子直径厚度的单层石墨,电阻率低,可用于动力电池
D.低温石英中,螺旋上升的硅氧四面体长链使其具有手性,可用作压电材料
3.下列化学用语表达正确的是
A.基态的价层电子排布图为
B.二甲基苯甲酰胺的结构简式:
C.的球棍模型:
D.的电子式:
4.下列离子方程式正确的是
A.向银氨溶液中通入:
B.溶于氢碘酸:
C.用醋酸和淀粉-KI溶液检验加碘盐中的:
D.向饱和溶液中通入过量:
5.对于配合物[Ni(NH2CH2CH2NH2)2Cl2]Cl,1个配离子中存在2个五元环状结构,其中Ni为+3价。下列说法正确的是
A.该配合物的配位数为6
B.1mol该有机物与足量的AgNO3溶液反应生成3molAgCl
C.NH2CH2CH2NH2中所有原子可能在一个平面上
D.NH2CH2CH2NH2、NH2CH2NH2、NH2-NH2均为有机物
6.下列实验操作、现象及结论均正确的是
选项 操作 现象 结论
A 将与NaOH溶液共热,冷却后,取出上层水溶液加入溶液 产生淡黄色沉淀 中含有溴原子
B 向溶液中滴入滴溶液,得到新制的悬浊液,然后加入0.5mL乙醛溶液,振荡后加热 产生砖红色沉淀 醛基具有还原性
C 向苯中滴加溴水 溴水褪色 苯发生了取代反应
D 将盐酸和反应后的气体通入苯酚钠溶液中 溶液变浑浊 碳酸的酸性比苯酚的酸性强
A.A B.B C.C D.D
7.Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116℃,沸点为3.8℃,Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O
下列说法不正确的是
A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
8.可形成一种新型超导材料,其晶胞结构如图所示。A的分数坐标为,下列叙述错误的是
A.该超导材料的化学式为 B.距离Se最近的Fe的个数为4
C.晶体密度为 D.B的分数坐标为
9.稀土是一种重要的战略资源,我国是稀土储量最大的国家。铈()是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为)形式存在。工业上利用氟碳铈矿制取的一种工艺流程如图:
下列说法错误的是
A.焙烧过程中氧化剂与还原剂的物质的量之比为
B.通过操作Ⅱ(包含酸溶、蒸发结晶)即可得到纯净的
C.酸浸过程中用稀硫酸和双氧水替代盐酸可体现环境友好
D.中阴离子的空间构型为正四面体
10.华蟾素具有解毒、消肿、止痛的功能,用于治疗中、晚期肿瘤,慢性乙型肝炎等疾病,其结构简式如图所示。下列关于华蟾素的说法错误的是
A.华蟾素的分子式为 B.能与溶液反应生成
C.能使酸性溶液褪色 D.能够发生酯化反应、水解反应
11.实验小组探究SO2与Na2O2的反应。向盛有SO2的烧瓶中加入Na2O2固体,测得反应体系中O2含量的变化如图。
下列说法不正确的是
A.有O2生成推测发生了反应:2Na2O2 + 2SO2 = 2Na2SO3 + O2
B.bc段O2含量下降与反应O2 + 2Na2SO3 = 2Na2SO4有关
C.c点剩余固体中含有Na2SO3
D.实验过程中Na2O2仅体现氧化性
12.PEF材料是一种生物基聚酯材料(由可再生生物质资源,如玉米、甘蔗等提取原料制成的塑料材料),具有多种优越性能和广泛的应用前景。其一种转化过程如图。下列说法错误的是
A. B.上述转化的原子利用率小于
C.PEF中有三种官能团 D.与传统的石化塑料相比,PEF具有可降解、环保等优点
13.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。下列有关叙述正确的是
A.原子半径大小:
B.该化合物中Y原子不满足8电子稳定结构
C.键角大小:
D.元素W、X、Y、Z只可以组成分子晶体
14.卤化物的水解机理分亲核水解和亲电水解。发生亲核水解的结构条件:中心原子具有(带有部分正电荷)和空轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受中H的进攻。三氯化氮()能水解生成次氯酸和氨气,四氯化硅()遇水也可剧烈水解,其水解反应的机理如下图所示(“□”代表Si的3d轨道)。下列说法正确的是
A.和的中心原子上的价层电子对数目不相同
B.碳和硅同族,推测常温下可以水解为碳酸和氯化氢
C.发生亲电水解
D.上述过程中,有极性键的断裂和非极性键的形成
二、解答题
15.试用物质结构的相关知识解释以下问题:
(1)(俗称过氧化脲)常温下为白色晶体,易溶于水,其热分解温度为,在水溶液中会离解为过氧化氢和尿素,可用作漂白剂。
①是 (填“极性”或“非极性”)分子,其中氧原子的杂化轨道类型是 杂化。
②中碳原子的杂化轨道类型是 杂化;中C、的电负性大小关系为 (用原子符号由大到小排序),第一电离能的大小关系为 (用原子符号由大到小排序)。
(2)接近水的沸点的水蒸气,其相对分子质量的测定值比化学式计算出来的相对分子质量大一些,试解释原因: 。
(3)可与4-甲基咪唑()形成配合物。4-甲基咪唑中,1号氮原子的孤电子对因参与形成大键,电子云密度降低。已知分子中的大键可用符号表示,其中m代表参与形成大键的原子数(或轨道数),n代表参与形成大键的电子数(如苯分子中的大键可表示为)。
①4-甲基咪唑中的大键可表示为 。
②4-甲基咪唑中, (填“1”或“3”)号氮原子更容易与形成配位键。
(4)的熔点高于的熔点为,其原因是 。
16.苯甲酸(,其在水中的溶解度见表)具有广泛的用途,可用作食品防腐剂及有机合成的原料。回答下列问题:
温度/ 20 25 50 75 95
溶解度/g 0.17 0.35 0.95 2.2 6.8
I.粗苯甲酸的制备
实验室利用高锰酸钾溶液氧化甲苯(沸点为)制备苯甲酸(高锰酸钾自身转化为沉淀),实验装置如图(部分装置已略去)。
实验步骤:①在分水器中注入适量蒸馏水,将反应物加入三口烧瓶中混合,加热至沸腾,边搅拌边反应;②待反应完全后,停止加热,冷却片刻后拆除分水器;③向三口烧瓶中慢慢加入适量草酸溶液,搅拌一段时间;④适当加热,将反应后的混合液趁热过滤、洗涤,合并滤液,将滤液经冷却、浓盐酸酸化、减压过滤、洗涤、干燥等步骤后得到粗苯甲酸。
(1)仪器甲的名称是 。
(2)写出步骤①中三口烧瓶中发生反应的化学方程式: ;根据 (填现象)可以判断三口烧瓶中反应已经基本完成。
(3)实验步骤③中加入适量草酸溶液的目的是 ,该步骤所加草酸不宜过量,原因是 。
Ⅱ.粗苯甲酸的提纯
(4)操作I、Ⅱ、IV中均需使用的玻璃仪器有 。
(5)操作Ⅲ冷却结晶时为减少杂质被包裹,且得到较大的晶体颗粒便于分离,应 (填“缓慢”或“快速”)冷却。
(6)苯甲酸产品纯度测定:称取苯甲酸产品,配成苯甲酸的乙醇溶液,移取溶液,用的溶液进行滴定,消耗溶液的体积为。则苯甲酸产品的纯度为 (保留三位有效数字)。
17.铂钯精矿含等元素。一种从铂钯精矿中提取和Pd的工艺如下:
已知:“氯化溶解”后所得主要产物为,氯离子起配位作用;在煮沸下与水反应得到易溶于水的。
(1)“酸浸”时,需要将废铂钯精矿粉碎,粉碎的目的是 。
(2)在实验室进行“煅烧”时,下列仪器中需要用到的是 (填仪器名称)。
(3)金位于元素周期表的第六周期且与铜同族,则基态金原子的价层电子轨道表示式为 。
(4)已知是一元强酸,则“分金”过程发生反应的离子方程式是 。
(5)加入氨水的过程中,钯()的配合物发生变化的原因是 。
(6)X气体在碱性干燥条件下更易于收集,则X的化学式为 。
(7)“水合肼还原”过程中(水合肼)转化为,在反应器中有氯化铵生成,写出该过程的化学方程式: 。
18.非天然氨基酸AHPA是一种重要的药物中间体,其合成路线之一如下:
(1)A可由氧化得到,的化学名称是 。
(2)C的结构简式为 。
(3)D中手性碳原子的数目为 。
(4)D转化为E的第一步反应的反应类型为 。
(5)AHPA中酸性官能团的名称为 ,碱性官能团的名称为 。
(6)写出同时满足下列条件的AHPA的同分异构体的结构简式: 。
①含苯环且苯环上只有一个取代基;
②红外光谱显示含氧官能团只有—OH和;
③核磁共振氢谱显示有6组峰,峰面积比为4:2:2:2:2:1。
(7)参照上述合成路线,设计以苄醇()为主要原料制备的合成路线 (其他原料、试剂任选)。
参考答案
1.B
2.A
3.B
4.D
5.A
6.B
7.C
8.C
9.B
10.B
11.D
12.C
13.C
14.C
15.(1) 极性
(2)水分子之间形成氢键,即形成多聚水分子
(3) 3
(4)是离子晶体,熔沸点较高,是分子晶体,熔沸点较低
16.(1)球形冷凝管
(2) 当回流液不再出现油珠
(3) 将过量的KMnO4还原,防止在后续操作中将盐酸氧化 苯甲酸会溶于草酸,降低产率
(4)玻璃棒、烧杯
(5)缓慢
(6)99.0%
17.(1)增大固体接触面积,使反应快速充分
(2)坩埚、泥三角
(3)
(4)
(5)NH3与Pd2+的配位能力强于Cl-
(6)NH3
(7)
18.(1)羟基乙酸
(2)
(3)3
(4)消去反应
(5) 羧基 氨基
(6)
(7)
同课章节目录
