专题8 化学反应与电能--2026版十年高考化学真题分类汇编
文档属性
| 名称 | 专题8 化学反应与电能--2026版十年高考化学真题分类汇编 |  | |
| 格式 | docx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 10:52:38 | ||
图片预览

文档简介
专题八 化学反应与电能
考点1 原电池原理及其应用
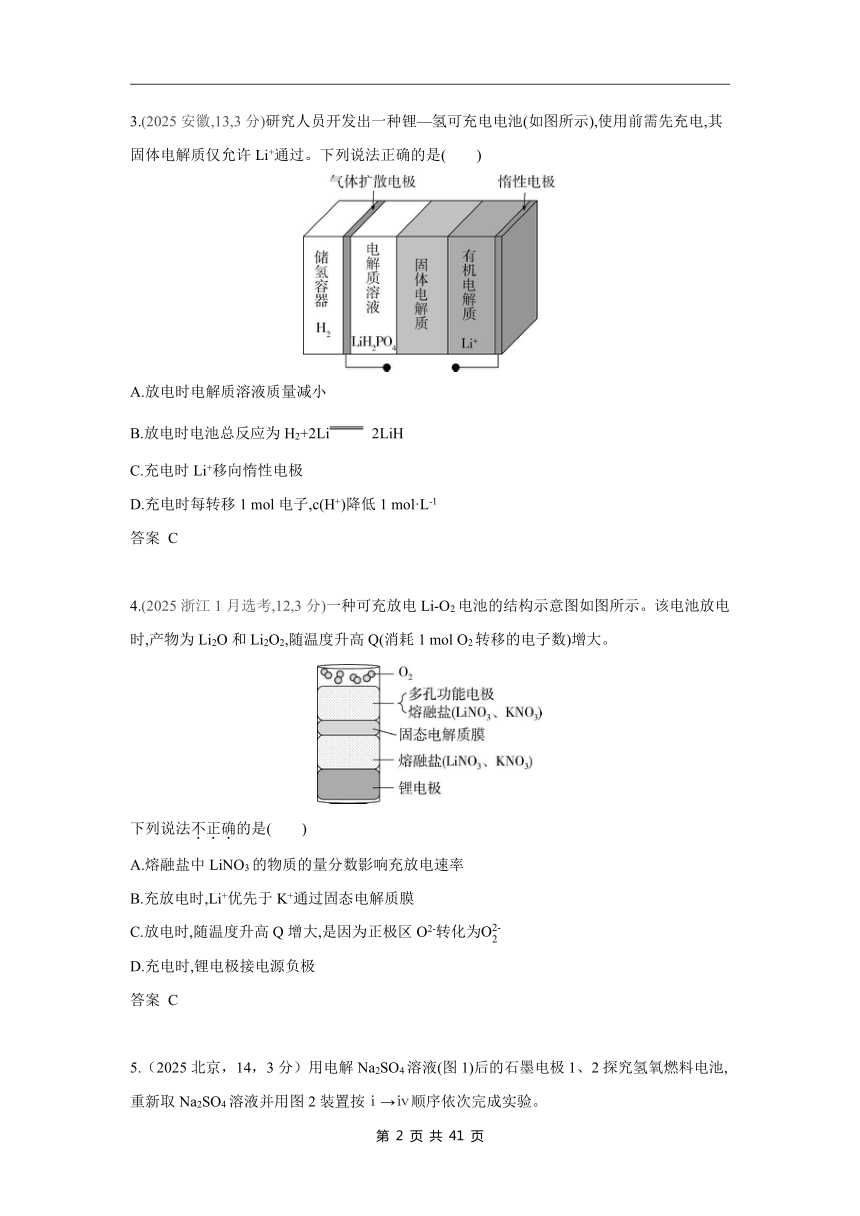
1.(双选)(2025山东,12,4分)全铁液流电池工作原理如图所示,两电极分别为石墨电极和负载铁的石墨电极。下列说法正确的是( )
A.隔膜为阳离子交换膜
B.放电时,a极为负极
C.充电时,隔膜两侧溶液Fe2+浓度均减小
D.理论上,Fe3+每减少1 mol,Fe2+总量相应增加2 mol
答案 BC
2.(2025黑、吉、辽、蒙,13,3分)一种基于Cu2O的储氯电池装置如图,放电过程中a、b极均增重。若将b极换成Ag/AgCl电极,b极仍增重。关于图中装置所示电池,下列说法错误的是( )
A.放电时Na+向b极迁移
B.该电池可用于海水脱盐
C.a极反应:Cu2O+2H2O+Cl--2e- Cu2(OH)3Cl+H+
D.若以Ag/AgCl电极代替a极,电池将失去储氯能力
答案 D
3.(2025安徽,13,3分)研究人员开发出一种锂—氢可充电电池(如图所示),使用前需先充电,其固体电解质仅允许Li+通过。下列说法正确的是( )
A.放电时电解质溶液质量减小
B.放电时电池总反应为H2+2Li 2LiH
C.充电时Li+移向惰性电极
D.充电时每转移1 mol电子,c(H+)降低1 mol·L-1
答案 C
4.(2025浙江1月选考,12,3分)一种可充放电Li-O2电池的结构示意图如图所示。该电池放电时,产物为Li2O和Li2O2,随温度升高Q(消耗1 mol O2转移的电子数)增大。
下列说法不正确的是( )
A.熔融盐中LiNO3的物质的量分数影响充放电速率
B.充放电时,Li+优先于K+通过固态电解质膜
C.放电时,随温度升高Q增大,是因为正极区O2-转化为
D.充电时,锂电极接电源负极
答案 C
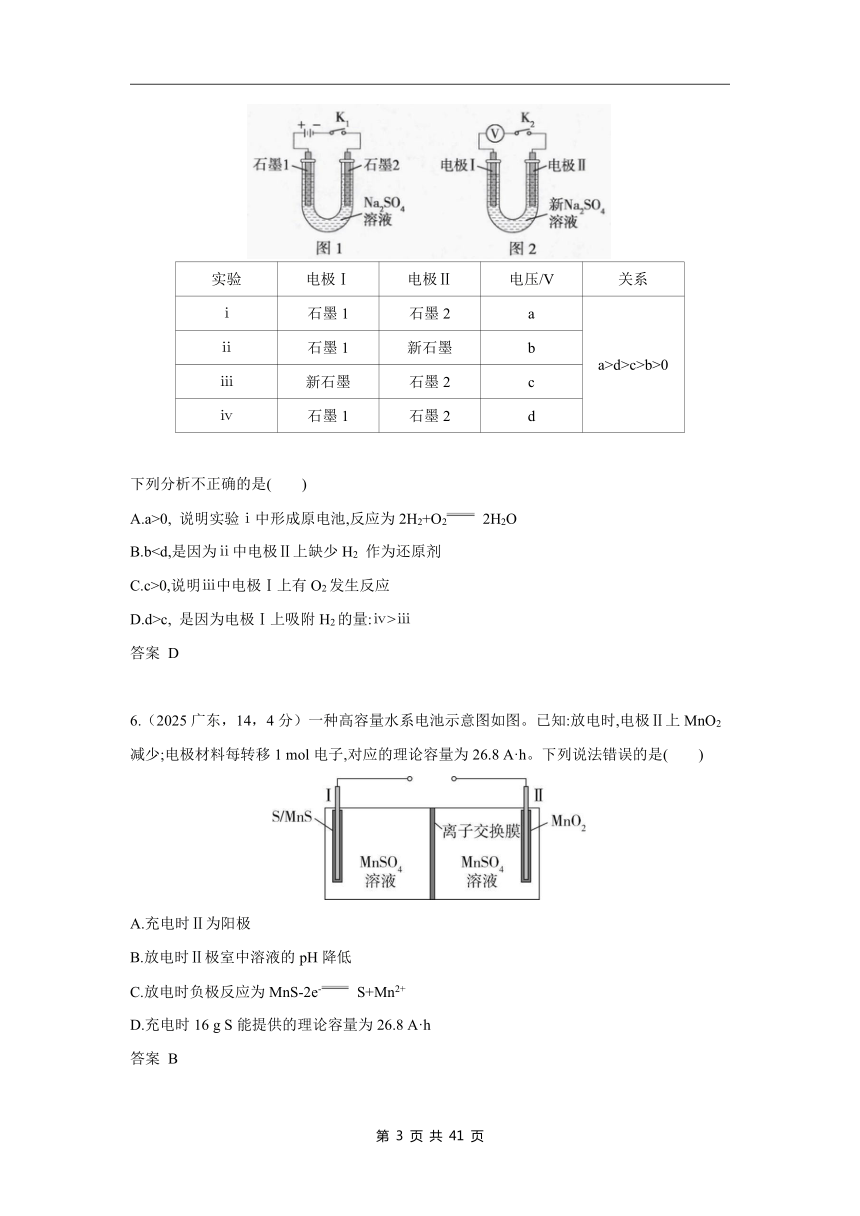
5.(2025北京,14,3分)用电解Na2SO4溶液(图1)后的石墨电极1、2探究氢氧燃料电池,重新取Na2SO4溶液并用图2装置按ⅰ→ⅳ顺序依次完成实验。
实验 电极Ⅰ 电极Ⅱ 电压/V 关系
ⅰ 石墨1 石墨2 a a>d>c>b>0
ⅱ 石墨1 新石墨 b
ⅲ 新石墨 石墨2 c
ⅳ 石墨1 石墨2 d
下列分析不正确的是( )
A.a>0, 说明实验ⅰ中形成原电池,反应为2H2+O2 2H2O
B.bC.c>0,说明ⅲ中电极Ⅰ上有O2发生反应
D.d>c, 是因为电极Ⅰ上吸附H2的量:ⅳ>ⅲ
答案 D
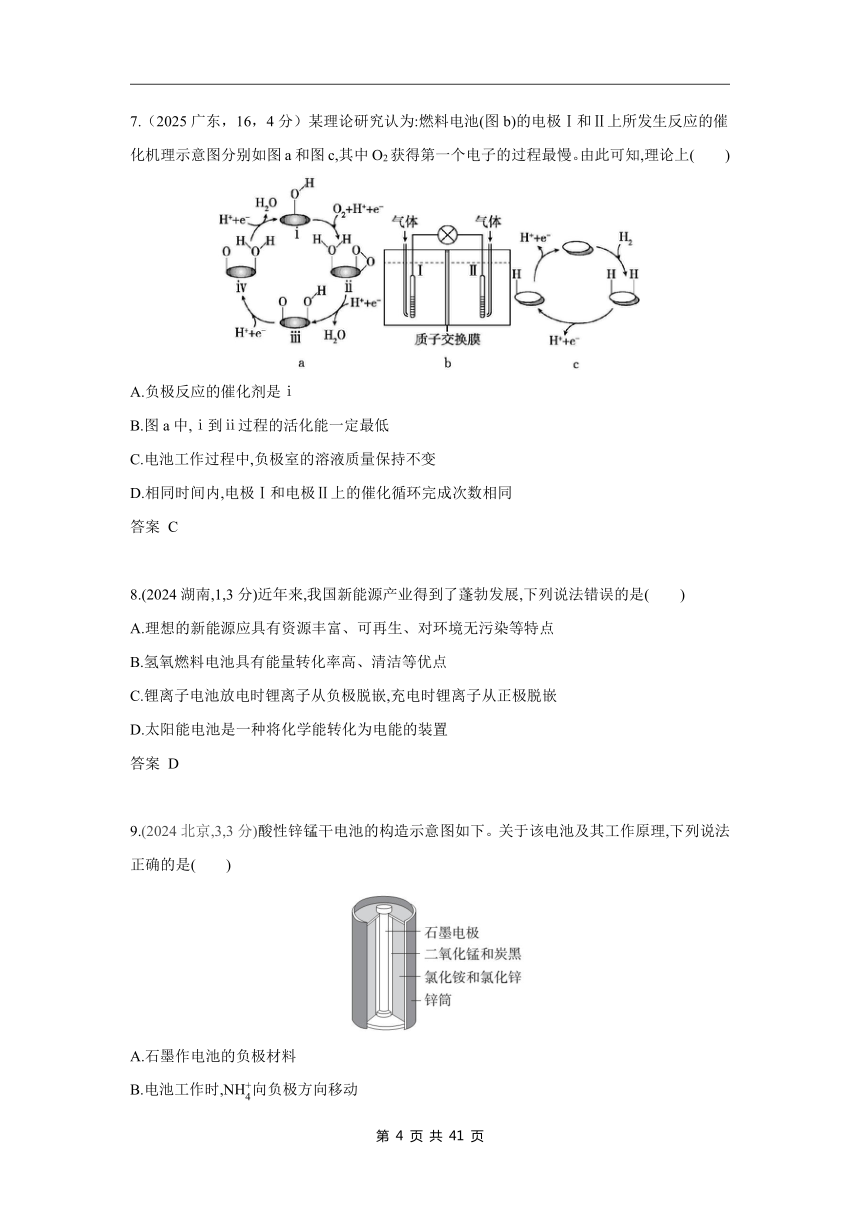
6.(2025广东,14,4分)一种高容量水系电池示意图如图。已知:放电时,电极Ⅱ上MnO2减少;电极材料每转移1 mol电子,对应的理论容量为26.8 A·h。下列说法错误的是( )
A.充电时Ⅱ为阳极
B.放电时Ⅱ极室中溶液的pH降低
C.放电时负极反应为MnS-2e- S+Mn2+
D.充电时16 g S能提供的理论容量为26.8 A·h
答案 B
7.(2025广东,16,4分)某理论研究认为:燃料电池(图b)的电极Ⅰ和Ⅱ上所发生反应的催化机理示意图分别如图a和图c,其中O2获得第一个电子的过程最慢。由此可知,理论上( )
A.负极反应的催化剂是ⅰ
B.图a中,ⅰ到ⅱ过程的活化能一定最低
C.电池工作过程中,负极室的溶液质量保持不变
D.相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同
答案 C
8.(2024湖南,1,3分)近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是( )
A.理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B.氢氧燃料电池具有能量转化率高、清洁等优点
C.锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D.太阳能电池是一种将化学能转化为电能的装置
答案 D
9.(2024北京,3,3分)酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是( )
A.石墨作电池的负极材料
B.电池工作时,N向负极方向移动
C.MnO2发生氧化反应
D.锌筒发生的电极反应为Zn-2e- Zn2+
答案 D
10.(2024江苏,8,3分)碱性锌锰电池的总反应为Zn+2MnO2+H2OZnO+2MnOOH,电池构造示意图如图所示。下列有关说法正确的是( )
A.电池工作时,MnO2发生氧化反应
B.电池工作时,OH-通过隔膜向正极移动
C.环境温度过低,不利于电池放电
D.反应中每生成1molMnOOH,转移电子数为2×6.02×1023
答案 C
11.(2024安徽,11,3分)我国学者研发出一种新型水系锌电池,其示意图如下。该电池分别以Zn-TCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn为电极,以ZnSO4和KI混合液为电解质溶液。下列说法错误的是( )
A.标注框内所示结构中存在共价键和配位键
B.电池总反应为+Zn Zn2++3I-
C.充电时,阴极被还原的Zn2+主要来自Zn-TCPP
D.放电时,消耗0.65 g Zn,理论上转移0.02 mol电子
答案 C
12.(2024全国甲,12,6分)科学家使用δ-MnO2研制了一种MnO2-Zn可充电电池(如图所示)。电池工作一段时间后,MnO2电极上检测到MnOOH和少量ZnMn2O4。下列叙述正确的是 ( )
A.充电时,Zn2+向阳极方向迁移
B.充电时,会发生反应Zn+2MnO2 ZnMn2O4
C.放电时,正极反应有MnO2+H2O+e- MnOOH+OH-
D.放电时,Zn电极质量减少0.65 g,MnO2电极生成了0.020 mol MnOOH
答案 C
13.(2024新课标,12,6分)一种可植入体内的微型电池工作原理如图所示,通过CuO催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)
电池工作时,下列叙述错误的是( )
A.电池总反应为2C6H12O6+O2 2C6H12O7
B.b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用
C.消耗18 mg葡萄糖,理论上a电极有0.4 mmol电子流入
D.两电极间血液中的Na+在电场驱动下的迁移方向为b→a
答案 C
(2024河北)阅读以下材料,完成14~15题。
我国科技工作者设计了如图所示的可充电Mg-CO2电池,以Mg(TFSI)2为电解质,电解液中加入1,3-丙二胺(PDA)以捕获CO2,使放电时CO2还原产物为MgC2O4。该设计克服了MgCO3导电性差和释放CO2能力差的障碍,同时改善了Mg2+的溶剂化环境,提高了电池充放电循环性能。
14.(2024河北,13,3分)下列说法错误的是( )
A.放电时,电池总反应为2CO2+Mg MgC2O4
B.充电时,多孔碳纳米管电极与电源正极连接
C.充电时,电子由Mg电极流向阳极,Mg2+向阴极迁移
D.放电时,每转移1 mol电子,理论上可转化1 mol CO2
答案 C
15.(2024河北,14,3分)对上述电池放电时CO2的捕获和转化过程开展了进一步研究,电极上CO2转化的三种可能反应路径及相对能量变化如图(*表示吸附态)。
下列说法错误的是( )
A.PDA捕获CO2的反应为+CO2
B.路径2是优先路径,速控步骤反应式为*C++e- *C2+
C.路径1、3经历不同的反应步骤但产物相同;路径2、3起始物相同但产物不同
D.三个路径速控步骤均涉及*C转化,路径2、3的速控步骤均伴有PDA再生
答案 D
16.(2023全国乙,12,6分)室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:
S8+e- ,+e- ,2Na+++2(1-)e- Na2Sx
下列叙述错误的是( )
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++S8+2e- Na2Sx
D.炭化纤维素纸的作用是增强硫电极导电性能
答案 A
17.(2023新课标,10,6分)一种以V2O5和Zn为电极、Zn(CF3SO3)2水溶液为电解质的电池,其示意图如下所示。放电时,Zn2+可插入V2O5层间形成ZnxV2O5·nH2O。下列说法错误的是( )
A.放电时V2O5为正极
B.放电时Zn2+由负极向正极迁移
C.充电总反应:xZn+V2O5+nH2O ZnxV2O5·nH2O
D.充电阳极反应:ZnxV2O5·nH2O-2xe- xZn2++V2O5+nH2O
答案 C
18.(2023山东,11,4分)(双选)利用热再生氨电池可实现CuSO4电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是( )
A.甲室Cu电极为正极
B.隔膜为阳离子膜
C.电池总反应为Cu2++4NH3 [Cu(NH3)4]2+
D.NH3扩散到乙室将对电池电动势产生影响
答案 CD
19.(2023辽宁,11,3分)某低成本储能电池原理如下图所示。下列说法正确的是( )
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧H+通过质子交换膜移向左侧
D.充电总反应:Pb+S+2Fe3+ PbSO4+2Fe2+
答案 B
20.(2022广东,16,4分)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:
NaTi2(PO4)3+2Na++2e- Na3Ti2(PO4)3
下列说法正确的是 ( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
答案 C
21.(2022湖南,8,3分)海水电池在海洋能源领域备受关注,一种锂—海水电池构造示意图如下。下列说法错误的是 ( )
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e- 2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂—海水电池属于一次电池
答案 B
22.(2022全国甲,10,6分)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以Zn(OH存在]。电池放电时,下列叙述错误的是 ( )
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的S通过隔膜向Ⅱ区迁移
C.MnO2电极反应:MnO2+4H++2e- Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+ Zn(OH+Mn2++2H2O
答案 A
23.(2022全国乙,12,6分)Li-O2电池比能量高,在汽车、航天等领域具有良好应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e- Li)和阳极反应(Li2O2+2h+ 2Li++O2)对电池进行充电。下列叙述错误的是 ( )
A.充电时,电池的总反应Li2O2 2Li+O2
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负极迁移
D.放电时,正极发生反应O2+2Li++2e- Li2O2
答案 C
24.(2022浙江1月选考,21,2分)pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag-AgCl电极)和另一Ag-AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是 ( )
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为AgCl(s)+e- Ag(s)+Cl-(0.1 mol·L-1)
B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化
C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH
D.pH计工作时,电能转化为化学能
答案 C
25.(2019海南单科,8,4分)(双选)微型银—锌电池可用作电子仪器的电源,其电极分别是Ag/Ag2O和Zn,电解质为KOH溶液,电池总反应为Ag2O+Zn+H2O 2Ag+Zn(OH)2,下列说法正确的是( )
A.电池工作过程中,KOH溶液浓度降低
B.电池工作过程中,电解液中OH-向负极迁移
C.负极发生反应Zn+2OH--2e- Zn(OH)2
D.正极发生反应Ag2O+2H++2e- Ag+H2O
答案 BC
27.(2017浙江11月选考,17,2分)金属(M)-空气电池的工作原理如图所示。下列说法不正确的是( )
A.金属M作电池负极
B.电解质是熔融的MO
C.正极的电极反应O2+4e-+2H2O 4OH-
D.电池反应2M+O2+2H2O 2M(OH)2
答案 B
28.(2016课标Ⅱ,11,6分)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e- Mg2+
B.正极反应式为Ag++e- Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O Mg(OH)2+H2↑
答案 B
29.(2016浙江理综,11,6分)金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O 4M(OH)n
已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属-空气电池,Al-空气电池的理论比能量最高
C.M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne- 4M(OH)n
D.在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
答案 C
30.(2015课标Ⅰ,11,6分)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2 6CO2+6H2O
答案 A
31.(2015江苏单科,10,2分)一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
A.反应 CH4+H2O 3H2+CO,每消耗1 mol CH4转移12 mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e- 2H2O
C.电池工作时,C向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e- 2C
答案 D
32.(2015天津理综,4,6分)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是 ( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(S)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
答案 C
33.(2014福建理综,11,6分)某原电池装置如图所示,电池总反应为2Ag+Cl2 2AgCl。下列说法正确的是( )
A.正极反应为AgCl+e- Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
答案 D
34.(2014北京理综,8,6分)下列电池工作时,O2在正极放电的是 ( )
A.锌锰电池 B.氢燃料电池 C.铅蓄电池 D.镍镉电池
答案 B
35.(2025北京,16,12分)铅酸电池是用途广泛并不断发展的化学电源。
(1)十九世纪,铅酸电池工作原理初步形成并延续至今。
铅酸电池工作原理:PbO2+Pb+2H2SO4 2PbSO4+2H2O。
①充电时,阴极发生的电极反应为 。
②放电时,产生a库仑电量,消耗H2SO4的物质的量为 mol。
已知:转移1 mol 电子所产生的电量为96 500库仑。
③35%~40% H2SO4溶液作为电解质溶液性质稳定、有较强的导电能力,S参与电极反应并有利于保持电压稳定。该体系中S不氧化Pb,S氧化性弱与其结构有关,S的空间结构是 。
④铅酸电池储存过程中,存在化学能的缓慢消耗:PbO2电极在H2SO4作用下产生的O2可将Pb电极氧化。O2氧化Pb发生反应的化学方程式为 。
(2)随着铅酸电池广泛应用,需要回收废旧电池材料,实现资源的再利用。回收过程中主要物质的转化关系示意图如下。
①将PbSO4等物质转化为Pb2+的过程中,步骤Ⅰ加入NaOH溶液的目的是___________________。
②步骤Ⅱ、Ⅲ中H2O2和K2S2O8作用分别是___________________________________________。
(3)铅酸电池使用过程中,负极因生成导电性差的大颗粒PbSO4,导致电极逐渐失活。通过向负极添加石墨、多孔碳等碳材料,可提高铅酸电池性能。碳材料的作用有 (填序号)。
a.增强负极导电性
b.增大负极材料比表面积,利于生成小颗粒PbSO4
c.碳材料作还原剂,使PbO2被还原
答案 (1)①PbSO4+2e- Pb+S ② ③四面体形
④2Pb+O2+2H2SO4 2PbSO4+2H2O
(2)①将难溶于酸的PbSO4转化为可溶于酸的Pb(OH)2,利于步骤Ⅱ中生成含Pb2+溶液
②H2O2作还原剂,K2S2O8作氧化剂 (3)ab
36.(2018天津理综,10,14分)CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为 (写离子符号);若所得溶液c(HC)∶c(C)=2∶1,溶液pH= 。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+CO2(g) 2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 C—H CO H—H
键能/kJ·mol-1 413 745 436 1 075
则该反应的ΔH= 。分别在V L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是 (填“A”或“B”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图1所示。此反应优选温度为900 ℃的原因是 。
图1
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
图2
电池的负极反应式: 。
电池的正极反应式:6O2+6e- 6
6CO2+6 3C2+6O2
反应过程中O2的作用是 。
该电池的总反应式: 。
答案 (14分)(1)C 10
(2)①+120 kJ·mol-1 B
②900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低
(3)Al-3e-Al3+(或2Al-6e-2Al3+) 催化剂
2Al+6CO2Al2(C2O4)3
考点2 电解原理及其应用
1.(2025河北,10,3分)科研工作者设计了一种用于废弃电极材料LixCoO2(x<1)再锂化的电化学装置,其示意图如下:
已知:参比电极的作用是确定LixCoO2再锂化为LiCoO2的最优条件,不干扰电极反应。下列说法正确的是( )
A.LixCoO2电极上发生的反应:LixCoO2+xe-+xLi+ LiCoO2
B.产生标准状况下5.6 L O2时,理论上可转化 mol的LixCoO2
C.再锂化过程中,S向LixCoO2电极迁移
D.电解过程中,阳极附近溶液pH升高
答案 B
2.(2025甘肃,12,3分)我国科研工作者设计了一种Mg-海水电池驱动海水(pH=8.2)电解系统(如下图),以新型MoNi/NiMoO4为催化剂(生长在泡沫镍电极上),在电池和电解池中同时产生氢气。下列关于该系统的说法错误的是( )
A.将催化剂生长在泡沫镍电极上可提高催化效率
B.在外电路中,电子从电极1流向电极4
C.电极3的反应为4OH--4e- 2H2O+O2↑
D.理论上,每通过2 mol电子,可产生1 mol H2
答案 D
3.(2025河南,12,3分)一种液流电解池在工作时可以实现海水淡化,并以LiCl形式回收含锂废弃物中的锂元素,其工作原理如图所示。
下列说法正确的是( )
A.Ⅱ为阳离子交换膜
B.电极a附近溶液的pH减小
C.电极b上发生的电极反应式为[Fe(CN)6]4-+e- [Fe(CN)6]3-
D.若海水用NaCl溶液模拟,则每脱除58.5 g NaCl,理论上可回收1 mol LiCl
答案 D
4.(2025陕晋青宁,13,3分)我国科研人员采用图示的电解池,由百里酚(TY)合成了百里醌(TQ)。电极b表面的主要反应历程见图(灰球表示电极表面催化剂)。下列说法错误的是( )
A.电解时,H+从右室向左室移动
B.电解总反应:TY+H2O TQ+2H2↑
C.以为原料,也可得到TQ
D.用18O标记电解液中的水,可得到
答案 D
5.(2025湖北,12,3分)某电池的正极材料为LiFePO4,负极材料为嵌锂石墨。利用人工智能筛选出的补锂试剂LiSO2CF3,能使失活的电池再生并延长寿命,且保持电池原结构。将LiSO2CF3注入电池后充电补锂,过程中[SO2CF3]-转化为气体离去。下列有关充电补锂的说法错误的是( )
A.[SO2CF3]-在阳极失去电子
B.生成气体中含有氟代烃
C.过程中铁元素的价态降低
D.[SO2CF3]-反应并离去是该电池保持原结构的原因
答案 C
6.(2025湖北,15,3分)某电化学制冷系统的装置如图所示。[Fe(H2O)6]3+和[Fe(H2O)6]2+在电极上发生相互转化,伴随着热量的吸收或释放,经由泵推动电解质溶液的循环流动(①→②→③→④→①)实现制冷。装置只通过热交换区域Ⅰ和Ⅱ与环境进行传热,其他区域绝热。下列描述错误的是( )
A.阴极反应为[Fe(H2O)6]3++e- [Fe(H2O)6]2+
B.已知②处的电解液温度比①处的低,可推断[Fe(H2O)6]2+比[Fe(H2O)6]3+稳定
C.多孔隔膜可以阻止阴极区和阳极区间的热交换
D.已知电子转移过程非常快,物质结构来不及改变。热效应主要来自电子转移后[Fe(H2O)6]2+和[Fe(H2O)6]3+离子结构的改变
答案 B
7.(2024黑、吉、辽,12,3分)“绿色零碳”氢能前景广阔。为解决传统电解水制“绿氢”阳极电势高、反应速率缓慢的问题,科技工作者设计耦合HCHO高效制H2的方法,装置如图所示。部分反应机理为 +H2。下列说法错误的是( )
A.相同电量下H2理论产量是传统电解水的1.5倍
B.阴极反应:2H2O+2e- 2OH-+H2↑
C.电解时OH-通过阴离子交换膜向b极方向移动
D.阳极反应:2HCHO-2e-+4OH- 2HCOO-+2H2O+H2↑
答案 A
8.(2024山东,13,4分)以不同材料修饰的Pt为电极,一定浓度的NaBr溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制H2和O2,装置如图所示。
下列说法错误的是( )
A.电极a连接电源负极
B.加入Y的目的是补充NaBr
C.电解总反应式为Br-+3H2O Br+3H2↑
D.催化阶段反应产物物质的量之比n(Z)∶n(Br-)=3∶2
答案 B
9.(2024贵州,11,3分)一种太阳能驱动环境处理的自循环光催化芬顿系统工作原理如图。光阳极发生反应:HC+H2OHC+2H++2e-,HC+H2OHC+H2O2。体系中H2O2与Mn(Ⅱ)/Mn(Ⅳ)发生反应产生的活性氧自由基可用于处理污水中的有机污染物。
下列说法错误的是( )
A.该芬顿系统能量转化形式为太阳能→电能→化学能
B.阴极反应式为O2+2H++2e-H2O2
C.光阳极每消耗1molH2O,体系中生成2molH2O2
D.H2O2在Mn(Ⅱ)/Mn(Ⅳ)的循环反应中表现出氧化性和还原性
答案 C
10.(2024湖南,10,3分)在KOH水溶液中,电化学方法合成高能物质K4C6N16时,伴随少量O2生成,电解原理如图所示,下列说法正确的是( )
A.电解时,OH-向Ni电极移动
B.生成C6的电极反应:2C3N8H4+8OH--4e- C6+8H2O
C.电解一段时间后,溶液pH升高
D.每生成1 mol H2的同时,生成0.5 mol K4C6N16
答案 B
11.(2024广东,16,4分)一种基于氯碱工艺的新型电解池如下图,可用于湿法冶铁的研究。电解过程中,下列说法不正确的是( )
A.阳极反应:2Cl--2e- Cl2↑
B.阴极区溶液中OH-浓度逐渐升高
C.理论上每消耗1 mol Fe2O3,阳极室溶液减少213 g
D.理论上每消耗1 mol Fe2O3,阴极室物质最多增加138 g
答案 C
12.(2023全国甲,12,6分)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应能提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是( )
A.析氢反应发生在IrOx-Ti电极上
B.Cl-从Cu电极迁移到IrOx-Ti电极
C.阴极发生的反应有:2CO2+12H++12e-C2H4+4H2O
D.每转移1 mol电子,阳极生成11.2 L气体(标准状况)
答案 C
13.(2023辽宁,7,3分)某无隔膜流动海水电解法制H2的装置如下图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是( )
A.b端电势高于a端电势
B.理论上转移2 mol e-生成4 g H2
C.电解后海水pH下降
D.阳极发生:Cl-+H2O-2e- HClO+H+
答案 D
14.(2023浙江1月选考,11,3分)在熔融盐体系中,通过电解TiO2和SiO2获得电池材料(TiSi),电解装置如图,下列说法正确的是( )
A.石墨电极为阴极,发生氧化反应
B.电极A的电极反应:8H++TiO2+SiO2+8e- TiSi+4H2O
C.该体系中,石墨优先于Cl-参与反应
D.电解时,阳离子向石墨电极移动
答案 C
15.(2022北京,13,3分)利用下图装置进行铁上电镀铜的实验探究。
装置 序号 电解质溶液 实验现象
① 0.1 mol·L-1 CuSO4+少量H2SO4溶液 阴极表面产生无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,电解液中有Fe2+
② 0.1 mol·L-1 CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验,电解液中无Fe元素
下列分析不正确的是 ( )
A.①中气体减少,推测是由于溶液中c(H+)减小,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应: Fe+2H+ Fe2++H2↑、Fe+Cu2+ Fe2++Cu
C.随阴极析出铜,推测②中溶液c(Cu2+)减小,Cu2++4NH3 [Cu(NH3)4]2+平衡逆向移动
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析出,镀层更致密
答案 C
16.(2022广东,10,2分)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中 ( )
A.阴极发生的反应为Mg-2e- Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
答案 C
17.(2022海南,9,4分)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如下。
下列有关说法正确的是 ( )
A.在b电极上,N2被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中O2-不断减少
答案 A
18.(2022河北,12,4分)(双选)科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置,工作原理示意图如下。
下列说法正确的是 ( )
A.电极b为阳极
B.隔膜为阴离子交换膜
C.生成气体M与N的物质的量之比为2∶1
D.反应器Ⅰ中反应的离子方程式为4[Fe(CN)6]3-+4OH- 4[Fe(CN)6]4-+O2↑+2H2O
答案 BD
19.(2022湖北,14,3分)含磷有机物应用广泛。电解法可实现由白磷直接制备Li[P(CN)2],过程如图所示(Me为甲基)。下列说法正确的是 ( )
A.生成1 mol Li[P(CN)2],理论上外电路需要转移2 mol电子
B.阴极上的电极反应为P4+8CN--4e- 4[P(CN)2]-
C.在电解过程中CN-向铂电极移动
D.电解产生的H2中的氢元素来自LiOH
答案 D
20.(2022山东,13,4分)(双选)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( )
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为LiCoO2+2H2O+e- Li++Co2++4OH-
D.若甲室Co2+减少200 mg,乙室Co2+增加300 mg,则此时已进行过溶液转移
答案 BD
21.(2022浙江1月选考,9,2分)下列说法正确的是 ( )
A.铁与碘反应易生成碘化铁
B.电解ZnSO4溶液可以得到Zn
C.用石灰沉淀富镁海水中的Mg2+,生成碳酸镁
D.SO2通入BaCl2溶液中生成BaSO3沉淀
答案 B
22.(2022浙江6月选考,21,2分)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是 ( )
A.电极A为阴极,发生还原反应
B.电极B的电极反应:2H2O+Mn2+-2e- MnO2+4H+
C.电解一段时间后溶液中Mn2+浓度保持不变
D.电解结束,可通过调节pH除去Mn2+,再加入Na2CO3溶液以获得Li2CO3
答案 C
23.(2017课标Ⅱ,11,6分)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是( )
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为:Al3++3e-Al
D.硫酸根离子在电解过程中向阳极移动
答案 C
24.(2015福建理综,11,6分)某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为:3CO2+18H+-18e- C3H8O+5H2O
答案 B
25.(2015四川理综,4,6分)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体。下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式:Cl-+2OH--2e- ClO-+H2O
C.阴极的电极反应式:2H2O+2e- H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+ N2↑+2CO2↑+5Cl-+H2O
答案 D
26.(2018课标Ⅱ,12,6分)我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,Cl向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-2C+C
D.充电时,正极反应为:Na++e-Na
答案 D
27.(2016课标Ⅲ,11,6分)锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O 2Zn(OH。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH--2e- Zn(OH
D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况)
答案 C 充电时为电解池,溶液中的阳离子向阴极移动,发生的反应为2Zn(OH 2Zn+O2↑+4OH-+2H2O,电解质溶液中c(OH-)增大,故A项、B项均错误;放电时负极反应为Zn+4OH--2e- Zn(OH,故C项正确;每消耗1 mol O2电路中通过4 mol电子,故D项错误。
28.(2016四川理综,5,6分)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:Li1-xCoO2+LixC6 LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe- xLi++C6
C.充电时,若转移1 mol e-,石墨(C6)电极将增重7x g
D.充电时,阳极的电极反应式为LiCoO2-xe- Li1-xCoO2+xLi+
答案 C
29.(2014课标Ⅱ,12,6分)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是 ( )
A.a为电池的正极
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
答案 C
30.(2014大纲全国,9,6分)下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法的是( )
A.放电时正极反应为:NiOOH+H2O+e- Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为:MH+OH- H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
答案 C
31.(2014上海单科,12,3分)如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中。下列分析正确的是( )
A.K1闭合,铁棒上发生的反应为2H++2e H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
答案 B
32.(2014广东理综,11,4分)某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )
A.电流方向:电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e- Cu
答案 A
33.(2014天津理综,6,6分)已知:
锂离子电池的总反应为:LixC+Li1-xCoO2 C+LiCoO2
锂硫电池的总反应为:2Li+S Li2S
有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.如图表示用锂离子电池给锂硫电池充电
答案 B
34.(2016天津理综,10,14分)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是 (至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: 。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l) B(l) ΔH1
O2(g)+B(l) A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g) H2O2(l)的ΔH 0(填“>”“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH- Fe+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色Fe,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
图1 图2
①电解一段时间后,c(OH-)降低的区域在 (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因: 。
答案 (共14分)(1)污染小 可再生 来源广 资源丰富 燃烧热值高(任写其中2个)
H2+2OH--2e- 2H2O
(2)< (3)ac
(4)光能转化为化学能
(5)①阳极室
②防止Na2FeO4与H2反应使产率降低
③M点:c(OH-)低,Na2FeO4稳定性差,且反应慢
N点:c(OH-)过高,铁电极上有Fe(OH)3(或Fe2O3)生成,使Na2FeO4产率降低
35.(2015山东理综,29,15分)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为 。铁渣中铁元素的化合价为 。在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2体积为1.344 L(标准状况),则钴氧化物的化学式为 。
答案 (1)LiOH 2Cl--2e-Cl2↑ B
(2)2Co(OH)3+S+4H+2Co2++S+5H2O
[或Co(OH)3+3H+Co3++3H2O,2Co3++S+H2O2Co2++S+2H+] +3 Co3O4
36.(2014山东理综,30,16分)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2C和AlC组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
答案 (1)负 4Al2C+3e- Al+7AlC H2
(2)3
(3)b、d 不能 Fe2O3+6H+ 2Fe3++3H2O、Fe+2Fe3+ 3Fe2+(或只写Fe+2Fe3+ 3Fe2+)
考点3 金属的腐蚀与防护
1.(2024广东,5,2分)我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是( )
A.钢铁外壳为负极
B.镶嵌的锌块可永久使用
C.该法为外加电流法
D.锌发生反应:Zn-2e- Zn2+
答案 D
2.(2024浙江6月选考,13,3分)金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。下图为两种对海水中钢闸门的防腐措施示意图:
图1 图2
下列说法正确的是( )
A.图1、图2中,阳极材料本身均失去电子
B.图2中,外加电压偏高时,钢闸门表面可发生反应:O2+4e-+2H2O 4OH-
C.图2中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D.图1、图2中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
答案 B
3.(2024浙江1月选考,13,3分)破损的镀锌铁皮在氨水中发生电化学腐蚀,生成[Zn(NH3)4]2+和H2。下列说法不正确的是( )
A.氨水浓度越大,腐蚀趋势越大
B.随着腐蚀的进行,溶液的pH变大
C.铁电极上的电极反应式为2NH3+2e- 2N+H2↑
D.每生成标准状况下224 mL H2,消耗0.010 mol Zn
答案 C
4.(2022广东,11,4分)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3% NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是 ( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
答案 D
5.(2022湖北,6,3分)下列实验装置(部分夹持装置略)或现象错误的是 ( )
A.滴入酚酞溶液 B.吸氧腐蚀
C.钠的燃烧 D.石蜡油的热分解
答案 C
6.(2020江苏,11,4分)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在下图所示的情境中,下列有关说法正确的是( )
A.阴极的电极反应式为Fe-2e-Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
答案 C
26.(2018课标Ⅲ,7,6分)化学与生活密切相关。下列说法错误的是( )
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
答案 A
7.(2025江苏,16,15分)海洋出水铁质文物表面有凝结物,研究其形成原理和脱氯方法对保护文物意义重大。
(1)文物出水清淤后,须尽快浸泡在稀NaOH或Na2CO3溶液中进行现场保护。
①玻璃中的SiO2能与NaOH反应生成 (填化学式),故不能使用带磨口玻璃塞的试剂瓶盛放NaOH溶液。
②文物浸泡在碱性溶液中比暴露在空气中能减缓吸氧腐蚀,其原因有___________________。
(2)文物表面凝结物种类受文物材质和海洋环境等因素的影响。
①无氧环境中,文物中的Fe与海水中的S在细菌作用下形成FeS等含铁凝结物。写出Fe与S反应生成FeS和Fe(OH)2的离子方程式: ___________________________________。
②有氧环境中,海水中的铁质文物表面形成FeOOH等凝结物。
(ⅰ)铁在盐水中腐蚀的可能原理如图所示。依据原理设计如下实验:向NaCl溶液中加入K3[Fe(CN)6]溶液(能与Fe2+形成蓝色沉淀)和酚酞,将混合液滴到生铁片上。预测该实验的现象为 ___________________________________________________________。
(ⅱ)铁的氢氧化物吸附某些阳离子形成带正电的胶粒,是凝结物富集Cl-的可能原因。该胶粒的形成过程中,参与的主要阳离子有 (填离子符号)。
为比较含氯FeOOH在NaOH溶液与蒸馏水中浸泡的脱氯效果,请补充实验方案:取一定量含氯FeOOH模拟样品,将其分为两等份, ,比较滴加AgNO3溶液体积[Ksp(AgCl)=1.8×10-10。实验须遵循节约试剂用量的原则,必须使用的试剂:蒸馏水、0.5 mol·L-1 NaOH溶液、0.5 mol·L-1 HNO3溶液、0.05 mol·L-1 AgNO3溶液]。
答案 (1)①Na2SiO3 ②碱性溶液中氧气浓度更低;碱性溶液中OH-浓度更大,氧气氧化性更弱(合理即可) (2)①4Fe+S+4H2O FeS+3Fe(OH)2+2OH- ②(ⅰ)液滴中部产生蓝色沉淀,液滴边缘变红 (ⅱ)Fe2+、Na+ (3)分别浸泡在等体积的蒸馏水和0.5 mol·L-1 NaOH溶液中,浸泡相同时间后过滤,向滤液中加入足量0.5 mol·L-1 HNO3溶液,用0.05 mol·L-1 AgNO3溶液滴定,至不再有白色沉淀产生
题型 新型电化学装置分析及相关计算
1.(2025江苏,8,3分)以稀H2SO4为电解质溶液的光解水装置如图所示,总反应为2H2O 2H2↑+O2↑。下列说法正确的是( )
A.电极a上发生氧化反应生成O2
B.H+通过质子交换膜从右室移向左室
C.光解前后,H2SO4溶液的pH不变
D.外电路每通过0.01 mol电子,电极b上产生0.01 mol H2
答案A
(
第
40
页 共
41
页
)
考点1 原电池原理及其应用
1.(双选)(2025山东,12,4分)全铁液流电池工作原理如图所示,两电极分别为石墨电极和负载铁的石墨电极。下列说法正确的是( )
A.隔膜为阳离子交换膜
B.放电时,a极为负极
C.充电时,隔膜两侧溶液Fe2+浓度均减小
D.理论上,Fe3+每减少1 mol,Fe2+总量相应增加2 mol
答案 BC
2.(2025黑、吉、辽、蒙,13,3分)一种基于Cu2O的储氯电池装置如图,放电过程中a、b极均增重。若将b极换成Ag/AgCl电极,b极仍增重。关于图中装置所示电池,下列说法错误的是( )
A.放电时Na+向b极迁移
B.该电池可用于海水脱盐
C.a极反应:Cu2O+2H2O+Cl--2e- Cu2(OH)3Cl+H+
D.若以Ag/AgCl电极代替a极,电池将失去储氯能力
答案 D
3.(2025安徽,13,3分)研究人员开发出一种锂—氢可充电电池(如图所示),使用前需先充电,其固体电解质仅允许Li+通过。下列说法正确的是( )
A.放电时电解质溶液质量减小
B.放电时电池总反应为H2+2Li 2LiH
C.充电时Li+移向惰性电极
D.充电时每转移1 mol电子,c(H+)降低1 mol·L-1
答案 C
4.(2025浙江1月选考,12,3分)一种可充放电Li-O2电池的结构示意图如图所示。该电池放电时,产物为Li2O和Li2O2,随温度升高Q(消耗1 mol O2转移的电子数)增大。
下列说法不正确的是( )
A.熔融盐中LiNO3的物质的量分数影响充放电速率
B.充放电时,Li+优先于K+通过固态电解质膜
C.放电时,随温度升高Q增大,是因为正极区O2-转化为
D.充电时,锂电极接电源负极
答案 C
5.(2025北京,14,3分)用电解Na2SO4溶液(图1)后的石墨电极1、2探究氢氧燃料电池,重新取Na2SO4溶液并用图2装置按ⅰ→ⅳ顺序依次完成实验。
实验 电极Ⅰ 电极Ⅱ 电压/V 关系
ⅰ 石墨1 石墨2 a a>d>c>b>0
ⅱ 石墨1 新石墨 b
ⅲ 新石墨 石墨2 c
ⅳ 石墨1 石墨2 d
下列分析不正确的是( )
A.a>0, 说明实验ⅰ中形成原电池,反应为2H2+O2 2H2O
B.b
D.d>c, 是因为电极Ⅰ上吸附H2的量:ⅳ>ⅲ
答案 D
6.(2025广东,14,4分)一种高容量水系电池示意图如图。已知:放电时,电极Ⅱ上MnO2减少;电极材料每转移1 mol电子,对应的理论容量为26.8 A·h。下列说法错误的是( )
A.充电时Ⅱ为阳极
B.放电时Ⅱ极室中溶液的pH降低
C.放电时负极反应为MnS-2e- S+Mn2+
D.充电时16 g S能提供的理论容量为26.8 A·h
答案 B
7.(2025广东,16,4分)某理论研究认为:燃料电池(图b)的电极Ⅰ和Ⅱ上所发生反应的催化机理示意图分别如图a和图c,其中O2获得第一个电子的过程最慢。由此可知,理论上( )
A.负极反应的催化剂是ⅰ
B.图a中,ⅰ到ⅱ过程的活化能一定最低
C.电池工作过程中,负极室的溶液质量保持不变
D.相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同
答案 C
8.(2024湖南,1,3分)近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是( )
A.理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B.氢氧燃料电池具有能量转化率高、清洁等优点
C.锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D.太阳能电池是一种将化学能转化为电能的装置
答案 D
9.(2024北京,3,3分)酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是( )
A.石墨作电池的负极材料
B.电池工作时,N向负极方向移动
C.MnO2发生氧化反应
D.锌筒发生的电极反应为Zn-2e- Zn2+
答案 D
10.(2024江苏,8,3分)碱性锌锰电池的总反应为Zn+2MnO2+H2OZnO+2MnOOH,电池构造示意图如图所示。下列有关说法正确的是( )
A.电池工作时,MnO2发生氧化反应
B.电池工作时,OH-通过隔膜向正极移动
C.环境温度过低,不利于电池放电
D.反应中每生成1molMnOOH,转移电子数为2×6.02×1023
答案 C
11.(2024安徽,11,3分)我国学者研发出一种新型水系锌电池,其示意图如下。该电池分别以Zn-TCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn为电极,以ZnSO4和KI混合液为电解质溶液。下列说法错误的是( )
A.标注框内所示结构中存在共价键和配位键
B.电池总反应为+Zn Zn2++3I-
C.充电时,阴极被还原的Zn2+主要来自Zn-TCPP
D.放电时,消耗0.65 g Zn,理论上转移0.02 mol电子
答案 C
12.(2024全国甲,12,6分)科学家使用δ-MnO2研制了一种MnO2-Zn可充电电池(如图所示)。电池工作一段时间后,MnO2电极上检测到MnOOH和少量ZnMn2O4。下列叙述正确的是 ( )
A.充电时,Zn2+向阳极方向迁移
B.充电时,会发生反应Zn+2MnO2 ZnMn2O4
C.放电时,正极反应有MnO2+H2O+e- MnOOH+OH-
D.放电时,Zn电极质量减少0.65 g,MnO2电极生成了0.020 mol MnOOH
答案 C
13.(2024新课标,12,6分)一种可植入体内的微型电池工作原理如图所示,通过CuO催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)
电池工作时,下列叙述错误的是( )
A.电池总反应为2C6H12O6+O2 2C6H12O7
B.b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用
C.消耗18 mg葡萄糖,理论上a电极有0.4 mmol电子流入
D.两电极间血液中的Na+在电场驱动下的迁移方向为b→a
答案 C
(2024河北)阅读以下材料,完成14~15题。
我国科技工作者设计了如图所示的可充电Mg-CO2电池,以Mg(TFSI)2为电解质,电解液中加入1,3-丙二胺(PDA)以捕获CO2,使放电时CO2还原产物为MgC2O4。该设计克服了MgCO3导电性差和释放CO2能力差的障碍,同时改善了Mg2+的溶剂化环境,提高了电池充放电循环性能。
14.(2024河北,13,3分)下列说法错误的是( )
A.放电时,电池总反应为2CO2+Mg MgC2O4
B.充电时,多孔碳纳米管电极与电源正极连接
C.充电时,电子由Mg电极流向阳极,Mg2+向阴极迁移
D.放电时,每转移1 mol电子,理论上可转化1 mol CO2
答案 C
15.(2024河北,14,3分)对上述电池放电时CO2的捕获和转化过程开展了进一步研究,电极上CO2转化的三种可能反应路径及相对能量变化如图(*表示吸附态)。
下列说法错误的是( )
A.PDA捕获CO2的反应为+CO2
B.路径2是优先路径,速控步骤反应式为*C++e- *C2+
C.路径1、3经历不同的反应步骤但产物相同;路径2、3起始物相同但产物不同
D.三个路径速控步骤均涉及*C转化,路径2、3的速控步骤均伴有PDA再生
答案 D
16.(2023全国乙,12,6分)室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:
S8+e- ,+e- ,2Na+++2(1-)e- Na2Sx
下列叙述错误的是( )
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++S8+2e- Na2Sx
D.炭化纤维素纸的作用是增强硫电极导电性能
答案 A
17.(2023新课标,10,6分)一种以V2O5和Zn为电极、Zn(CF3SO3)2水溶液为电解质的电池,其示意图如下所示。放电时,Zn2+可插入V2O5层间形成ZnxV2O5·nH2O。下列说法错误的是( )
A.放电时V2O5为正极
B.放电时Zn2+由负极向正极迁移
C.充电总反应:xZn+V2O5+nH2O ZnxV2O5·nH2O
D.充电阳极反应:ZnxV2O5·nH2O-2xe- xZn2++V2O5+nH2O
答案 C
18.(2023山东,11,4分)(双选)利用热再生氨电池可实现CuSO4电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是( )
A.甲室Cu电极为正极
B.隔膜为阳离子膜
C.电池总反应为Cu2++4NH3 [Cu(NH3)4]2+
D.NH3扩散到乙室将对电池电动势产生影响
答案 CD
19.(2023辽宁,11,3分)某低成本储能电池原理如下图所示。下列说法正确的是( )
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧H+通过质子交换膜移向左侧
D.充电总反应:Pb+S+2Fe3+ PbSO4+2Fe2+
答案 B
20.(2022广东,16,4分)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:
NaTi2(PO4)3+2Na++2e- Na3Ti2(PO4)3
下列说法正确的是 ( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
答案 C
21.(2022湖南,8,3分)海水电池在海洋能源领域备受关注,一种锂—海水电池构造示意图如下。下列说法错误的是 ( )
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e- 2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂—海水电池属于一次电池
答案 B
22.(2022全国甲,10,6分)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以Zn(OH存在]。电池放电时,下列叙述错误的是 ( )
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的S通过隔膜向Ⅱ区迁移
C.MnO2电极反应:MnO2+4H++2e- Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+ Zn(OH+Mn2++2H2O
答案 A
23.(2022全国乙,12,6分)Li-O2电池比能量高,在汽车、航天等领域具有良好应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e- Li)和阳极反应(Li2O2+2h+ 2Li++O2)对电池进行充电。下列叙述错误的是 ( )
A.充电时,电池的总反应Li2O2 2Li+O2
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负极迁移
D.放电时,正极发生反应O2+2Li++2e- Li2O2
答案 C
24.(2022浙江1月选考,21,2分)pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag-AgCl电极)和另一Ag-AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是 ( )
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为AgCl(s)+e- Ag(s)+Cl-(0.1 mol·L-1)
B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化
C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH
D.pH计工作时,电能转化为化学能
答案 C
25.(2019海南单科,8,4分)(双选)微型银—锌电池可用作电子仪器的电源,其电极分别是Ag/Ag2O和Zn,电解质为KOH溶液,电池总反应为Ag2O+Zn+H2O 2Ag+Zn(OH)2,下列说法正确的是( )
A.电池工作过程中,KOH溶液浓度降低
B.电池工作过程中,电解液中OH-向负极迁移
C.负极发生反应Zn+2OH--2e- Zn(OH)2
D.正极发生反应Ag2O+2H++2e- Ag+H2O
答案 BC
27.(2017浙江11月选考,17,2分)金属(M)-空气电池的工作原理如图所示。下列说法不正确的是( )
A.金属M作电池负极
B.电解质是熔融的MO
C.正极的电极反应O2+4e-+2H2O 4OH-
D.电池反应2M+O2+2H2O 2M(OH)2
答案 B
28.(2016课标Ⅱ,11,6分)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e- Mg2+
B.正极反应式为Ag++e- Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O Mg(OH)2+H2↑
答案 B
29.(2016浙江理综,11,6分)金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O 4M(OH)n
已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属-空气电池,Al-空气电池的理论比能量最高
C.M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne- 4M(OH)n
D.在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
答案 C
30.(2015课标Ⅰ,11,6分)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2 6CO2+6H2O
答案 A
31.(2015江苏单科,10,2分)一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
A.反应 CH4+H2O 3H2+CO,每消耗1 mol CH4转移12 mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e- 2H2O
C.电池工作时,C向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e- 2C
答案 D
32.(2015天津理综,4,6分)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是 ( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(S)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
答案 C
33.(2014福建理综,11,6分)某原电池装置如图所示,电池总反应为2Ag+Cl2 2AgCl。下列说法正确的是( )
A.正极反应为AgCl+e- Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
答案 D
34.(2014北京理综,8,6分)下列电池工作时,O2在正极放电的是 ( )
A.锌锰电池 B.氢燃料电池 C.铅蓄电池 D.镍镉电池
答案 B
35.(2025北京,16,12分)铅酸电池是用途广泛并不断发展的化学电源。
(1)十九世纪,铅酸电池工作原理初步形成并延续至今。
铅酸电池工作原理:PbO2+Pb+2H2SO4 2PbSO4+2H2O。
①充电时,阴极发生的电极反应为 。
②放电时,产生a库仑电量,消耗H2SO4的物质的量为 mol。
已知:转移1 mol 电子所产生的电量为96 500库仑。
③35%~40% H2SO4溶液作为电解质溶液性质稳定、有较强的导电能力,S参与电极反应并有利于保持电压稳定。该体系中S不氧化Pb,S氧化性弱与其结构有关,S的空间结构是 。
④铅酸电池储存过程中,存在化学能的缓慢消耗:PbO2电极在H2SO4作用下产生的O2可将Pb电极氧化。O2氧化Pb发生反应的化学方程式为 。
(2)随着铅酸电池广泛应用,需要回收废旧电池材料,实现资源的再利用。回收过程中主要物质的转化关系示意图如下。
①将PbSO4等物质转化为Pb2+的过程中,步骤Ⅰ加入NaOH溶液的目的是___________________。
②步骤Ⅱ、Ⅲ中H2O2和K2S2O8作用分别是___________________________________________。
(3)铅酸电池使用过程中,负极因生成导电性差的大颗粒PbSO4,导致电极逐渐失活。通过向负极添加石墨、多孔碳等碳材料,可提高铅酸电池性能。碳材料的作用有 (填序号)。
a.增强负极导电性
b.增大负极材料比表面积,利于生成小颗粒PbSO4
c.碳材料作还原剂,使PbO2被还原
答案 (1)①PbSO4+2e- Pb+S ② ③四面体形
④2Pb+O2+2H2SO4 2PbSO4+2H2O
(2)①将难溶于酸的PbSO4转化为可溶于酸的Pb(OH)2,利于步骤Ⅱ中生成含Pb2+溶液
②H2O2作还原剂,K2S2O8作氧化剂 (3)ab
36.(2018天津理综,10,14分)CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为 (写离子符号);若所得溶液c(HC)∶c(C)=2∶1,溶液pH= 。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+CO2(g) 2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 C—H CO H—H
键能/kJ·mol-1 413 745 436 1 075
则该反应的ΔH= 。分别在V L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是 (填“A”或“B”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图1所示。此反应优选温度为900 ℃的原因是 。
图1
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
图2
电池的负极反应式: 。
电池的正极反应式:6O2+6e- 6
6CO2+6 3C2+6O2
反应过程中O2的作用是 。
该电池的总反应式: 。
答案 (14分)(1)C 10
(2)①+120 kJ·mol-1 B
②900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低
(3)Al-3e-Al3+(或2Al-6e-2Al3+) 催化剂
2Al+6CO2Al2(C2O4)3
考点2 电解原理及其应用
1.(2025河北,10,3分)科研工作者设计了一种用于废弃电极材料LixCoO2(x<1)再锂化的电化学装置,其示意图如下:
已知:参比电极的作用是确定LixCoO2再锂化为LiCoO2的最优条件,不干扰电极反应。下列说法正确的是( )
A.LixCoO2电极上发生的反应:LixCoO2+xe-+xLi+ LiCoO2
B.产生标准状况下5.6 L O2时,理论上可转化 mol的LixCoO2
C.再锂化过程中,S向LixCoO2电极迁移
D.电解过程中,阳极附近溶液pH升高
答案 B
2.(2025甘肃,12,3分)我国科研工作者设计了一种Mg-海水电池驱动海水(pH=8.2)电解系统(如下图),以新型MoNi/NiMoO4为催化剂(生长在泡沫镍电极上),在电池和电解池中同时产生氢气。下列关于该系统的说法错误的是( )
A.将催化剂生长在泡沫镍电极上可提高催化效率
B.在外电路中,电子从电极1流向电极4
C.电极3的反应为4OH--4e- 2H2O+O2↑
D.理论上,每通过2 mol电子,可产生1 mol H2
答案 D
3.(2025河南,12,3分)一种液流电解池在工作时可以实现海水淡化,并以LiCl形式回收含锂废弃物中的锂元素,其工作原理如图所示。
下列说法正确的是( )
A.Ⅱ为阳离子交换膜
B.电极a附近溶液的pH减小
C.电极b上发生的电极反应式为[Fe(CN)6]4-+e- [Fe(CN)6]3-
D.若海水用NaCl溶液模拟,则每脱除58.5 g NaCl,理论上可回收1 mol LiCl
答案 D
4.(2025陕晋青宁,13,3分)我国科研人员采用图示的电解池,由百里酚(TY)合成了百里醌(TQ)。电极b表面的主要反应历程见图(灰球表示电极表面催化剂)。下列说法错误的是( )
A.电解时,H+从右室向左室移动
B.电解总反应:TY+H2O TQ+2H2↑
C.以为原料,也可得到TQ
D.用18O标记电解液中的水,可得到
答案 D
5.(2025湖北,12,3分)某电池的正极材料为LiFePO4,负极材料为嵌锂石墨。利用人工智能筛选出的补锂试剂LiSO2CF3,能使失活的电池再生并延长寿命,且保持电池原结构。将LiSO2CF3注入电池后充电补锂,过程中[SO2CF3]-转化为气体离去。下列有关充电补锂的说法错误的是( )
A.[SO2CF3]-在阳极失去电子
B.生成气体中含有氟代烃
C.过程中铁元素的价态降低
D.[SO2CF3]-反应并离去是该电池保持原结构的原因
答案 C
6.(2025湖北,15,3分)某电化学制冷系统的装置如图所示。[Fe(H2O)6]3+和[Fe(H2O)6]2+在电极上发生相互转化,伴随着热量的吸收或释放,经由泵推动电解质溶液的循环流动(①→②→③→④→①)实现制冷。装置只通过热交换区域Ⅰ和Ⅱ与环境进行传热,其他区域绝热。下列描述错误的是( )
A.阴极反应为[Fe(H2O)6]3++e- [Fe(H2O)6]2+
B.已知②处的电解液温度比①处的低,可推断[Fe(H2O)6]2+比[Fe(H2O)6]3+稳定
C.多孔隔膜可以阻止阴极区和阳极区间的热交换
D.已知电子转移过程非常快,物质结构来不及改变。热效应主要来自电子转移后[Fe(H2O)6]2+和[Fe(H2O)6]3+离子结构的改变
答案 B
7.(2024黑、吉、辽,12,3分)“绿色零碳”氢能前景广阔。为解决传统电解水制“绿氢”阳极电势高、反应速率缓慢的问题,科技工作者设计耦合HCHO高效制H2的方法,装置如图所示。部分反应机理为 +H2。下列说法错误的是( )
A.相同电量下H2理论产量是传统电解水的1.5倍
B.阴极反应:2H2O+2e- 2OH-+H2↑
C.电解时OH-通过阴离子交换膜向b极方向移动
D.阳极反应:2HCHO-2e-+4OH- 2HCOO-+2H2O+H2↑
答案 A
8.(2024山东,13,4分)以不同材料修饰的Pt为电极,一定浓度的NaBr溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制H2和O2,装置如图所示。
下列说法错误的是( )
A.电极a连接电源负极
B.加入Y的目的是补充NaBr
C.电解总反应式为Br-+3H2O Br+3H2↑
D.催化阶段反应产物物质的量之比n(Z)∶n(Br-)=3∶2
答案 B
9.(2024贵州,11,3分)一种太阳能驱动环境处理的自循环光催化芬顿系统工作原理如图。光阳极发生反应:HC+H2OHC+2H++2e-,HC+H2OHC+H2O2。体系中H2O2与Mn(Ⅱ)/Mn(Ⅳ)发生反应产生的活性氧自由基可用于处理污水中的有机污染物。
下列说法错误的是( )
A.该芬顿系统能量转化形式为太阳能→电能→化学能
B.阴极反应式为O2+2H++2e-H2O2
C.光阳极每消耗1molH2O,体系中生成2molH2O2
D.H2O2在Mn(Ⅱ)/Mn(Ⅳ)的循环反应中表现出氧化性和还原性
答案 C
10.(2024湖南,10,3分)在KOH水溶液中,电化学方法合成高能物质K4C6N16时,伴随少量O2生成,电解原理如图所示,下列说法正确的是( )
A.电解时,OH-向Ni电极移动
B.生成C6的电极反应:2C3N8H4+8OH--4e- C6+8H2O
C.电解一段时间后,溶液pH升高
D.每生成1 mol H2的同时,生成0.5 mol K4C6N16
答案 B
11.(2024广东,16,4分)一种基于氯碱工艺的新型电解池如下图,可用于湿法冶铁的研究。电解过程中,下列说法不正确的是( )
A.阳极反应:2Cl--2e- Cl2↑
B.阴极区溶液中OH-浓度逐渐升高
C.理论上每消耗1 mol Fe2O3,阳极室溶液减少213 g
D.理论上每消耗1 mol Fe2O3,阴极室物质最多增加138 g
答案 C
12.(2023全国甲,12,6分)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应能提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是( )
A.析氢反应发生在IrOx-Ti电极上
B.Cl-从Cu电极迁移到IrOx-Ti电极
C.阴极发生的反应有:2CO2+12H++12e-C2H4+4H2O
D.每转移1 mol电子,阳极生成11.2 L气体(标准状况)
答案 C
13.(2023辽宁,7,3分)某无隔膜流动海水电解法制H2的装置如下图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是( )
A.b端电势高于a端电势
B.理论上转移2 mol e-生成4 g H2
C.电解后海水pH下降
D.阳极发生:Cl-+H2O-2e- HClO+H+
答案 D
14.(2023浙江1月选考,11,3分)在熔融盐体系中,通过电解TiO2和SiO2获得电池材料(TiSi),电解装置如图,下列说法正确的是( )
A.石墨电极为阴极,发生氧化反应
B.电极A的电极反应:8H++TiO2+SiO2+8e- TiSi+4H2O
C.该体系中,石墨优先于Cl-参与反应
D.电解时,阳离子向石墨电极移动
答案 C
15.(2022北京,13,3分)利用下图装置进行铁上电镀铜的实验探究。
装置 序号 电解质溶液 实验现象
① 0.1 mol·L-1 CuSO4+少量H2SO4溶液 阴极表面产生无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,电解液中有Fe2+
② 0.1 mol·L-1 CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验,电解液中无Fe元素
下列分析不正确的是 ( )
A.①中气体减少,推测是由于溶液中c(H+)减小,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应: Fe+2H+ Fe2++H2↑、Fe+Cu2+ Fe2++Cu
C.随阴极析出铜,推测②中溶液c(Cu2+)减小,Cu2++4NH3 [Cu(NH3)4]2+平衡逆向移动
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析出,镀层更致密
答案 C
16.(2022广东,10,2分)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中 ( )
A.阴极发生的反应为Mg-2e- Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
答案 C
17.(2022海南,9,4分)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如下。
下列有关说法正确的是 ( )
A.在b电极上,N2被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中O2-不断减少
答案 A
18.(2022河北,12,4分)(双选)科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置,工作原理示意图如下。
下列说法正确的是 ( )
A.电极b为阳极
B.隔膜为阴离子交换膜
C.生成气体M与N的物质的量之比为2∶1
D.反应器Ⅰ中反应的离子方程式为4[Fe(CN)6]3-+4OH- 4[Fe(CN)6]4-+O2↑+2H2O
答案 BD
19.(2022湖北,14,3分)含磷有机物应用广泛。电解法可实现由白磷直接制备Li[P(CN)2],过程如图所示(Me为甲基)。下列说法正确的是 ( )
A.生成1 mol Li[P(CN)2],理论上外电路需要转移2 mol电子
B.阴极上的电极反应为P4+8CN--4e- 4[P(CN)2]-
C.在电解过程中CN-向铂电极移动
D.电解产生的H2中的氢元素来自LiOH
答案 D
20.(2022山东,13,4分)(双选)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( )
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为LiCoO2+2H2O+e- Li++Co2++4OH-
D.若甲室Co2+减少200 mg,乙室Co2+增加300 mg,则此时已进行过溶液转移
答案 BD
21.(2022浙江1月选考,9,2分)下列说法正确的是 ( )
A.铁与碘反应易生成碘化铁
B.电解ZnSO4溶液可以得到Zn
C.用石灰沉淀富镁海水中的Mg2+,生成碳酸镁
D.SO2通入BaCl2溶液中生成BaSO3沉淀
答案 B
22.(2022浙江6月选考,21,2分)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是 ( )
A.电极A为阴极,发生还原反应
B.电极B的电极反应:2H2O+Mn2+-2e- MnO2+4H+
C.电解一段时间后溶液中Mn2+浓度保持不变
D.电解结束,可通过调节pH除去Mn2+,再加入Na2CO3溶液以获得Li2CO3
答案 C
23.(2017课标Ⅱ,11,6分)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是( )
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为:Al3++3e-Al
D.硫酸根离子在电解过程中向阳极移动
答案 C
24.(2015福建理综,11,6分)某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为:3CO2+18H+-18e- C3H8O+5H2O
答案 B
25.(2015四川理综,4,6分)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体。下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式:Cl-+2OH--2e- ClO-+H2O
C.阴极的电极反应式:2H2O+2e- H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+ N2↑+2CO2↑+5Cl-+H2O
答案 D
26.(2018课标Ⅱ,12,6分)我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,Cl向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-2C+C
D.充电时,正极反应为:Na++e-Na
答案 D
27.(2016课标Ⅲ,11,6分)锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O 2Zn(OH。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH--2e- Zn(OH
D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况)
答案 C 充电时为电解池,溶液中的阳离子向阴极移动,发生的反应为2Zn(OH 2Zn+O2↑+4OH-+2H2O,电解质溶液中c(OH-)增大,故A项、B项均错误;放电时负极反应为Zn+4OH--2e- Zn(OH,故C项正确;每消耗1 mol O2电路中通过4 mol电子,故D项错误。
28.(2016四川理综,5,6分)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:Li1-xCoO2+LixC6 LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe- xLi++C6
C.充电时,若转移1 mol e-,石墨(C6)电极将增重7x g
D.充电时,阳极的电极反应式为LiCoO2-xe- Li1-xCoO2+xLi+
答案 C
29.(2014课标Ⅱ,12,6分)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是 ( )
A.a为电池的正极
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
答案 C
30.(2014大纲全国,9,6分)下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法的是( )
A.放电时正极反应为:NiOOH+H2O+e- Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为:MH+OH- H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
答案 C
31.(2014上海单科,12,3分)如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中。下列分析正确的是( )
A.K1闭合,铁棒上发生的反应为2H++2e H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
答案 B
32.(2014广东理综,11,4分)某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )
A.电流方向:电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e- Cu
答案 A
33.(2014天津理综,6,6分)已知:
锂离子电池的总反应为:LixC+Li1-xCoO2 C+LiCoO2
锂硫电池的总反应为:2Li+S Li2S
有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.如图表示用锂离子电池给锂硫电池充电
答案 B
34.(2016天津理综,10,14分)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是 (至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: 。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l) B(l) ΔH1
O2(g)+B(l) A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g) H2O2(l)的ΔH 0(填“>”“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH- Fe+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色Fe,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
图1 图2
①电解一段时间后,c(OH-)降低的区域在 (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因: 。
答案 (共14分)(1)污染小 可再生 来源广 资源丰富 燃烧热值高(任写其中2个)
H2+2OH--2e- 2H2O
(2)< (3)ac
(4)光能转化为化学能
(5)①阳极室
②防止Na2FeO4与H2反应使产率降低
③M点:c(OH-)低,Na2FeO4稳定性差,且反应慢
N点:c(OH-)过高,铁电极上有Fe(OH)3(或Fe2O3)生成,使Na2FeO4产率降低
35.(2015山东理综,29,15分)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为 。铁渣中铁元素的化合价为 。在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2体积为1.344 L(标准状况),则钴氧化物的化学式为 。
答案 (1)LiOH 2Cl--2e-Cl2↑ B
(2)2Co(OH)3+S+4H+2Co2++S+5H2O
[或Co(OH)3+3H+Co3++3H2O,2Co3++S+H2O2Co2++S+2H+] +3 Co3O4
36.(2014山东理综,30,16分)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2C和AlC组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
答案 (1)负 4Al2C+3e- Al+7AlC H2
(2)3
(3)b、d 不能 Fe2O3+6H+ 2Fe3++3H2O、Fe+2Fe3+ 3Fe2+(或只写Fe+2Fe3+ 3Fe2+)
考点3 金属的腐蚀与防护
1.(2024广东,5,2分)我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是( )
A.钢铁外壳为负极
B.镶嵌的锌块可永久使用
C.该法为外加电流法
D.锌发生反应:Zn-2e- Zn2+
答案 D
2.(2024浙江6月选考,13,3分)金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。下图为两种对海水中钢闸门的防腐措施示意图:
图1 图2
下列说法正确的是( )
A.图1、图2中,阳极材料本身均失去电子
B.图2中,外加电压偏高时,钢闸门表面可发生反应:O2+4e-+2H2O 4OH-
C.图2中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D.图1、图2中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
答案 B
3.(2024浙江1月选考,13,3分)破损的镀锌铁皮在氨水中发生电化学腐蚀,生成[Zn(NH3)4]2+和H2。下列说法不正确的是( )
A.氨水浓度越大,腐蚀趋势越大
B.随着腐蚀的进行,溶液的pH变大
C.铁电极上的电极反应式为2NH3+2e- 2N+H2↑
D.每生成标准状况下224 mL H2,消耗0.010 mol Zn
答案 C
4.(2022广东,11,4分)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3% NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是 ( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
答案 D
5.(2022湖北,6,3分)下列实验装置(部分夹持装置略)或现象错误的是 ( )
A.滴入酚酞溶液 B.吸氧腐蚀
C.钠的燃烧 D.石蜡油的热分解
答案 C
6.(2020江苏,11,4分)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在下图所示的情境中,下列有关说法正确的是( )
A.阴极的电极反应式为Fe-2e-Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
答案 C
26.(2018课标Ⅲ,7,6分)化学与生活密切相关。下列说法错误的是( )
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
答案 A
7.(2025江苏,16,15分)海洋出水铁质文物表面有凝结物,研究其形成原理和脱氯方法对保护文物意义重大。
(1)文物出水清淤后,须尽快浸泡在稀NaOH或Na2CO3溶液中进行现场保护。
①玻璃中的SiO2能与NaOH反应生成 (填化学式),故不能使用带磨口玻璃塞的试剂瓶盛放NaOH溶液。
②文物浸泡在碱性溶液中比暴露在空气中能减缓吸氧腐蚀,其原因有___________________。
(2)文物表面凝结物种类受文物材质和海洋环境等因素的影响。
①无氧环境中,文物中的Fe与海水中的S在细菌作用下形成FeS等含铁凝结物。写出Fe与S反应生成FeS和Fe(OH)2的离子方程式: ___________________________________。
②有氧环境中,海水中的铁质文物表面形成FeOOH等凝结物。
(ⅰ)铁在盐水中腐蚀的可能原理如图所示。依据原理设计如下实验:向NaCl溶液中加入K3[Fe(CN)6]溶液(能与Fe2+形成蓝色沉淀)和酚酞,将混合液滴到生铁片上。预测该实验的现象为 ___________________________________________________________。
(ⅱ)铁的氢氧化物吸附某些阳离子形成带正电的胶粒,是凝结物富集Cl-的可能原因。该胶粒的形成过程中,参与的主要阳离子有 (填离子符号)。
为比较含氯FeOOH在NaOH溶液与蒸馏水中浸泡的脱氯效果,请补充实验方案:取一定量含氯FeOOH模拟样品,将其分为两等份, ,比较滴加AgNO3溶液体积[Ksp(AgCl)=1.8×10-10。实验须遵循节约试剂用量的原则,必须使用的试剂:蒸馏水、0.5 mol·L-1 NaOH溶液、0.5 mol·L-1 HNO3溶液、0.05 mol·L-1 AgNO3溶液]。
答案 (1)①Na2SiO3 ②碱性溶液中氧气浓度更低;碱性溶液中OH-浓度更大,氧气氧化性更弱(合理即可) (2)①4Fe+S+4H2O FeS+3Fe(OH)2+2OH- ②(ⅰ)液滴中部产生蓝色沉淀,液滴边缘变红 (ⅱ)Fe2+、Na+ (3)分别浸泡在等体积的蒸馏水和0.5 mol·L-1 NaOH溶液中,浸泡相同时间后过滤,向滤液中加入足量0.5 mol·L-1 HNO3溶液,用0.05 mol·L-1 AgNO3溶液滴定,至不再有白色沉淀产生
题型 新型电化学装置分析及相关计算
1.(2025江苏,8,3分)以稀H2SO4为电解质溶液的光解水装置如图所示,总反应为2H2O 2H2↑+O2↑。下列说法正确的是( )
A.电极a上发生氧化反应生成O2
B.H+通过质子交换膜从右室移向左室
C.光解前后,H2SO4溶液的pH不变
D.外电路每通过0.01 mol电子,电极b上产生0.01 mol H2
答案A
(
第
40
页 共
41
页
)
同课章节目录
