专题10 弱电解质的电离平衡和溶液的酸碱性--2026版十年高考化学真题分类汇编
文档属性
| 名称 | 专题10 弱电解质的电离平衡和溶液的酸碱性--2026版十年高考化学真题分类汇编 |  | |
| 格式 | docx | ||
| 文件大小 | 916.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-07 10:52:38 | ||
图片预览



文档简介
专题十 弱电解质的电离平衡和溶液的酸碱性
考点1 弱电解质的电离平衡
1.(2025广东,12,4分)12.CuCl微溶于水,但在Cl-浓度较高的溶液中因形成[CuCl2]-和[CuCl3]2-而溶解,将适量CuCl完全溶于盐酸,得到含[CuCl2]-和[CuCl3]2-的溶液,下列叙述正确的是( )
A.加水稀释,[CuCl3]2-浓度一定下降
B.向溶液中加入少量NaCl固体,[CuCl2]-浓度一定上升
C.H[CuCl2]的电离方程式为H[CuCl2] H++Cu++2Cl-
D.体系中,c(Cu+)+c(H+)=c(Cl-)+c{[CuCl2]-}+c{[CuCl3]2-}+c(OH-)
答案 A
2.(2025浙江1月选考,15,3分)25 ℃时,H2CO3的电离常数=4.5×10-7,=4.7×10-11;Ksp(CaCO3)=3.4×10-9。
下列描述不正确的是( )
A.HC+H2OOH-+H2CO3,K=2.2×10-8
B.2HCH2CO3+C,K=1.0×10-4
C.HC+Ca2+CaCO3(s)+H+,K=1.4×10-2
D.NaHCO3溶液中,c(H+)+c(H2CO3)=c(OH-)+c(C),则c(H+)=
答案 D
3.(2024江苏,12,3分)室温下,通过下列实验探究SO2的性质。已知(H2SO3)=1.3×10-2,(H2SO3)=6.2×10-8。
实验1:将SO2气体通入水中,测得溶液pH=3。
实验2:将SO2气体通入0.1mol·L-1NaOH溶液中,当溶液pH=4时停止通气。
实验3:将SO2气体通入0.1mol·L-1酸性KMnO4溶液中,当溶液恰好褪色时停止通气。
下列说法正确的是( )
A.实验1所得溶液中:c(HS)+c(S)>c(H+)
B.实验2所得溶液中:c(S)>c(HS)
C.实验2所得溶液经蒸干、灼烧制得NaHSO3固体
D.实验3所得溶液中:c(S)>c(Mn2+)
答案 D
4.(2024山东,10,2分)常温下Ag(Ⅰ)-CH3COOH水溶液体系中存在反应:Ag++CH3COO- CH3COOAg(aq),平衡常数为K。已知初始浓度c0(Ag+)=c0(CH3COOH)=0.08 mol·L-1,所有含碳物种的摩尔分数与pH变化关系如图所示(忽略溶液体积变化)。
下列说法正确的是( )
A.线Ⅱ表示CH3COOH的变化情况
B.CH3COOH的电离平衡常数Ka=10-n
C.pH=n时,c(Ag+)= mol·L-1
D.pH=10时,c(Ag+)+c(CH3COOAg)=0.08 mol·L-1
答案 C
5.(2024贵州,12,3分)硼砂[Na2B4O5(OH)4·8H2O]水溶液常用于pH计的校准。硼砂水解生成等物质的量的B(OH)3(硼酸)和Na[B(OH)4](硼酸钠)。
已知:①25 ℃时,硼酸显酸性的原理
B(OH)3+2H2O H3O++
Ka=5.8×10-10;
②lg≈0.38。
下列说法正确的是( )
A.硼砂稀溶液中c(Na+)=c[B(OH)3]
B.硼酸水溶液中的H+主要来自水的电离
C.25 ℃时,0.01 mol·L-1硼酸水溶液的pH≈6.38
D.等浓度等体积的B(OH)3和Na[B(OH)4]溶液混合后,溶液显酸性
答案 B
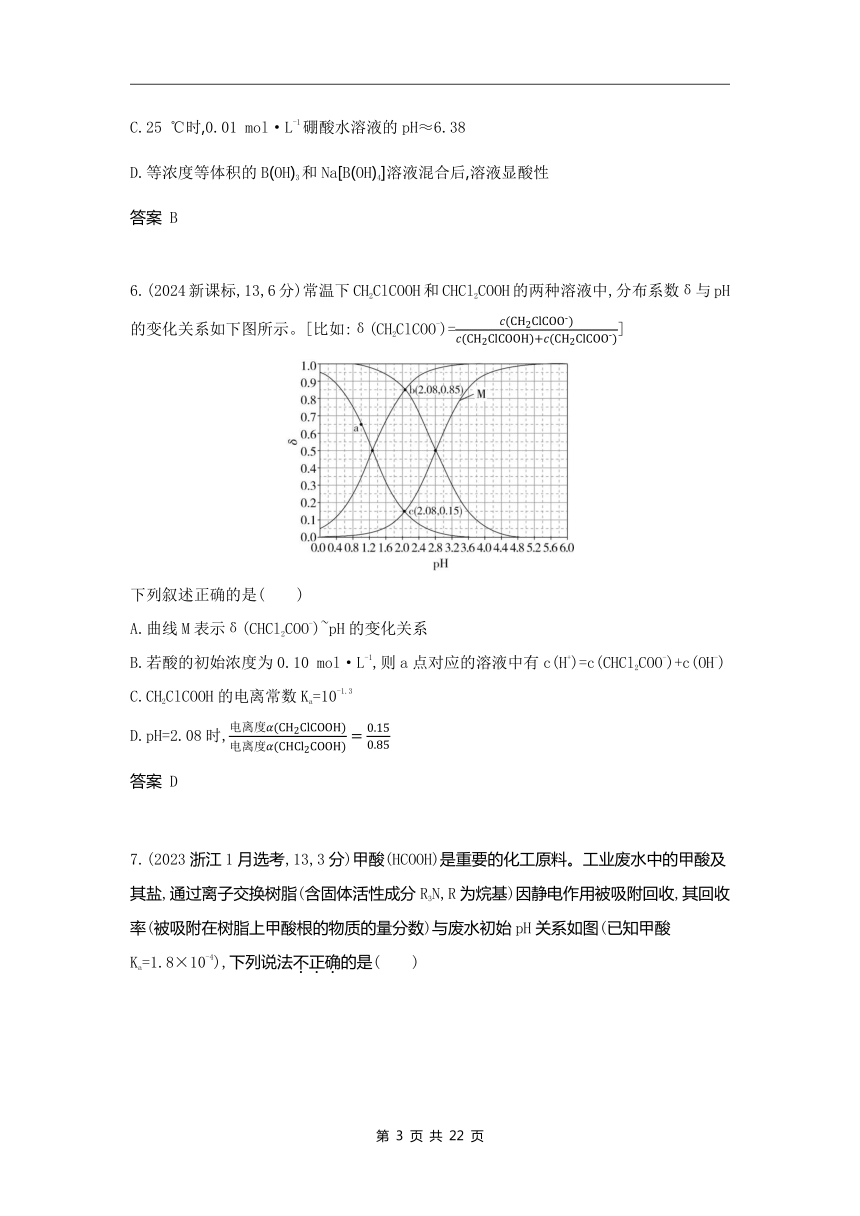
6.(2024新课标,13,6分)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如下图所示。[比如:δ(CH2ClCOO-)=]
下列叙述正确的是( )
A.曲线M表示δ(CHCl2COO-)~pH的变化关系
B.若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=c(CHCl2COO-)+c(OH-)
C.CH2ClCOOH的电离常数Ka=10-1.3
D.pH=2.08时,
答案 D
7.(2023浙江1月选考,13,3分)甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图(已知甲酸Ka=1.8×10-4),下列说法不正确的是( )
A.活性成分R3N在水中存在平衡:R3N+H2O R3NH++OH-
B.pH=5的废水中c(HCOO-)∶c(HCOOH)=18
C.废水初始pH<2.4,随pH下降,甲酸的电离被抑制,与R3NH+作用的HCOO-数目减少
D.废水初始pH>5,离子交换树脂活性成分主要以R3NH+形态存在
答案 D
8.(2022湖北,12,3分)根据酸碱质子理论,给出质子(H+)的物质是酸,给出质子的能力越强,酸性越强。已知:N2+NH3 N+N2H4 N2H4+CH3COOH N2+CH3COO-
下列酸性强弱顺序正确的是 ( )
A.N2>N2H4>N
B.N2>CH3COOH>N
C.NH3>N2H4>CH3COO-
D.CH3COOH>N2>N
答案 D
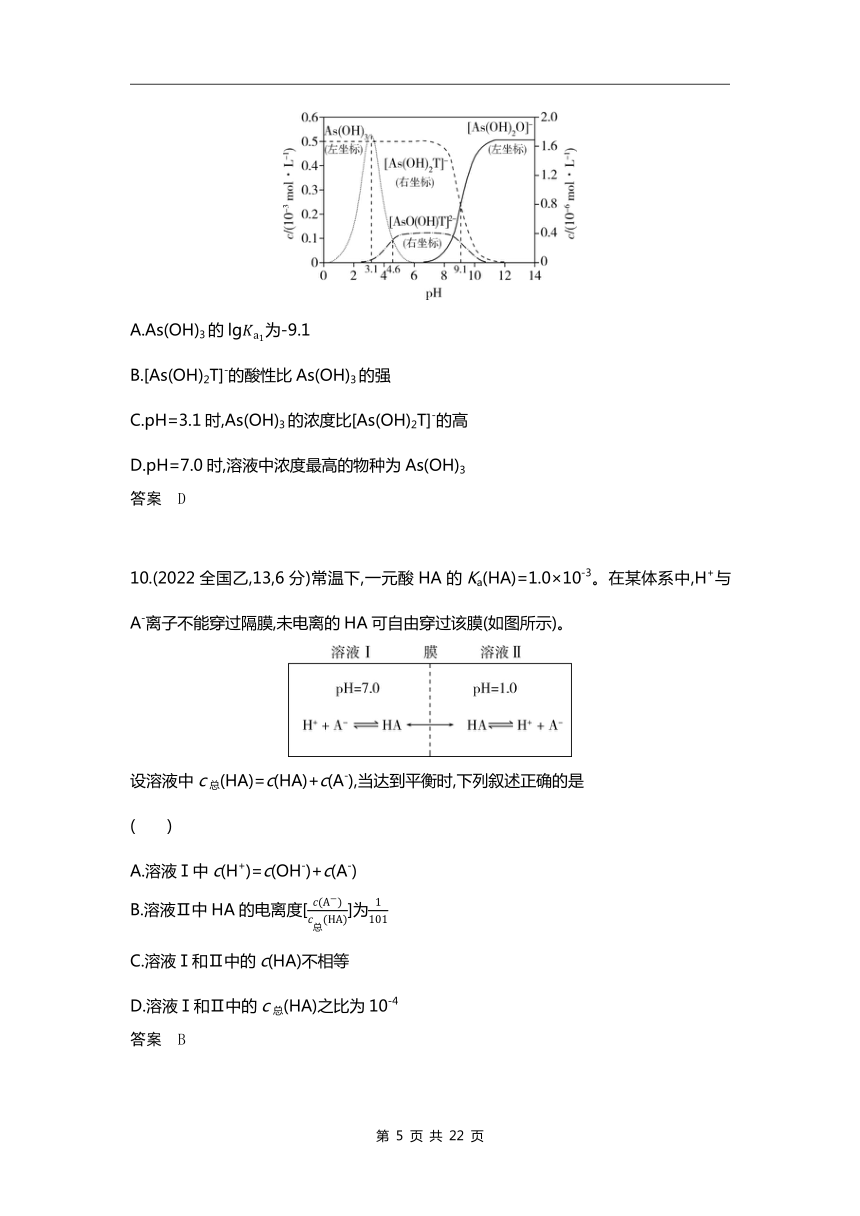
9.(2022湖北,15,3分)下图是亚砷酸As(OH)3和酒石酸(H2T,lg=-3.04,lg=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 mol·L-1,总T为1.0×10-3 mol·L-1)。下列说法错误的是( )
A.As(OH)3的lg为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高的物种为As(OH)3
答案 D
10.(2022全国乙,13,6分)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是 ( )
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
B.溶液Ⅱ中HA的电离度[]为
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
答案 B
11.(2022浙江6月选考,2,2分)下列物质属于强电解质的是 ( )
A.HCOOH B.Fe
C.Na2CO3 D.C2H2
答案 C
12.(2019天津理综,5,6分)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
答案 C
13.(2018天津理综,6,6分)LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2P)的变化如图1所示,H3PO4溶液中H2P的分布分数δ随pH的变化如图2所示[δ=]。
下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2P、HP和P
C.随c初始(H2P)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
答案 D
14.(2018浙江4月选考,18,2分)相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )
A.pH相等的两溶液中:c(CH3COO-)=c(Cl-)
B.分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同
C.相同浓度的两溶液,分别与金属镁反应,反应速率相同
D.相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中(忽略溶液体积变化):c(CH3COO-)=c(Cl-)
答案 A
15.(2017课标Ⅱ,12,6分)改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=]。下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
答案 D
16.(2016课标Ⅲ,13,6分)下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
答案 D
17.(2016天津理综,6,6分)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
答案 C
18.(2015课标Ⅰ,13,6分)浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示。下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则增大
答案 D
19.(2015浙江理综,12,6分)40 ℃,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是( )
A.在pH=9.0时,c(N)>c(HC)>c(NH2COO-)>c(C)
B.不同pH的溶液中存在关系:c(N)+c(H+)=2c(C)+c(HC)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
答案 C
20.(2014广东理综,12,4分)常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
答案 D
21.(2014山东理综,13,5分)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(N)=c(CH3COO-)
答案 D
22.(2014天津理综,5,6分)下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(S)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HC)=2c(C)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2)+c(C2)+c(H2C2O4)]
答案 A
23.(2024广东,19,14分)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1)酸催化下NaNO2与NH4Cl混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为
②反应a:N(aq)+N(aq) N2(g)+2H2O(l)
已知:
则反应a的ΔH= ΔH1-ΔH2-ΔH3+ΔH4 。
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测得体系的温度T随时间t的变化如图。据图可知,在该过程中, BD 。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
(2)在非水溶剂中,将CO2转化为化合物ⅱ(一种重要的电子化学品)的催化机理示意图如图所示,其中的催化剂有 AcOH 和 KI 。
(3)在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定了两种一元弱酸HX(X为A或B)在某非水溶剂中的Ka。
a.选择合适的指示剂HIn,Ka(HIn)=3.6×10-20;其钾盐为KIn。
b.向KIn溶液中加入HX,发生反应:In-+HX X-+HIn。KIn起始的物质的量为n0(KIn),加入HX的物质的量为n(HX),平衡时,测得c平(In-)/c平(HIn)随n(HX)/n0(KIn)的变化曲线如图。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算Ka(HA)(写出计算过程,结果保留两位有效数字)。
答案 根据=1.0时,=3.0,设n(HA)=n0(KIn)=1 mol,列三段式:
In- + HA A- + HIn
起始/mol 1 1 0 0
转化/mol 0.25 0.25 0.25 0.25
平衡/mol 0.75 0.75 0.25 0.25
K=,Ka(HA)=Ka(HIn)×=4.0×10-21
②在该溶剂中,Ka(HB) > Ka(HA);Ka(HB) > Ka(HIn)(填“>”“<”或“=”)。
24.(2017江苏单科,20,14分)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有C,其原因是 。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。
图1
图2
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 。
②H3AsO4第一步电离方程式H3AsO4 H2As+H+的电离常数为,则p= (p=-lg )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH=7.1时,吸附剂X表面不带电荷;pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图3所示。
图3
①在pH 7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是 。
②在pH 4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为
。提高吸附剂X对三价砷去除效果可采取的措施是 。
答案 (14分)(1)碱性溶液吸收了空气中的CO2
(2)①OH-+H3AsO3 H2As+H2O ②2.2
(3)①在pH 7~9之间,随pH升高H2As转变为HAs,吸附剂X表面所带负电荷增多,静电斥力增加
②在pH 4~7之间,吸附剂X表面带正电,五价砷主要以H2As和HAs阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷
25.(2015福建理综,23,15分)研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为
。
(2)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25 ℃,两种酸的电离平衡常数如下表。
H2SO3 1.3×10-2 6.3×10-8
H2CO3 4.2×10-7 5.6×10-11
①HS的电离平衡常数表达式K= 。
②0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
答案 (15分)(1)①
②C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O
(2)①0.043 ②5
(3)①或
②c(Na+)>c(S)>c(OH-)>c(HS)>c(H+)或[Na+]>[S]>[OH-]>[HS]>[H+]
③H2SO3+HC HS+CO2↑+H2O
考点2 溶液的酸碱性 酸碱中和滴定
1.(2025浙江1月选考,16,3分)蛋白质中N元素含量可按下列步骤测定:
下列说法不正确的是( )
A.步骤Ⅰ,须加入过量浓H2SO4,以确保N元素完全转化为N
B.步骤Ⅱ,浓NaOH溶液过量,有利于氨的蒸出
C.步骤Ⅲ,用定量、过量盐酸标准溶液吸收NH3,以甲基红(变色的pH范围:4.4~6.2)为指示剂,用NaOH标准溶液滴定,经计算可得N元素的含量
D.尿素[CO(NH2)2]样品、NaNO3样品的N元素含量均可按上述步骤测定
答案 D
2.(2024湖南,13,3分)常温下Ka(HCOOH)=1.8×10-4,向20 mL 0.10 mol·L-1 NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是( )
A.水的电离程度:MB.M点:2c(OH-)=c(Na+)+c(H+)
C.当V(HCOOH)=10 mL时,c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-)
D.N点:c(Na+)>c(HCOO-)>c(OH-)>c(H+)>c(HCOOH)
答案 D
(2023山东)阅读下列材料,完成3~5题。
一定条件下,乙酸酐[(CH3CO)2O]醇解反应[(CH3CO)2O+ROH CH3COOR+CH3COOH]可进行完全,利用此反应定量测定有机醇(ROH)中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐—苯溶液。
②量取一定体积乙酸酐—苯溶液置于锥形瓶中,加入m g ROH样品,充分反应后,加适量水使剩余乙酸酐完全水解:(CH3CO)2O+H2O 2CH3COOH。
③加指示剂并用c mol·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V1 mL。
④在相同条件下,量取相同体积的乙酸酐—苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用c mol·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V2 mL。
3.(2023山东,8,2分)对于上述实验,下列做法正确的是( )
A.进行容量瓶检漏时,倒置一次即可
B.滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点
C.滴定读数时,应单手持滴定管上端并保持其自然垂直
D.滴定读数时,应双手一上一下持滴定管
答案 C
4.(2023山东,9,2分)ROH样品中羟基含量(质量分数)计算正确的是( )
A.×100%
B.×100%
C.×100%
D.×100%
答案 A
5.(2023山东,10,2分)根据上述实验原理,下列说法正确的是( )
A.可以用乙酸代替乙酸酐进行上述实验
B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小
C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小
D.步骤④中,若加水量不足,将导致测定结果偏大
答案 B
6.(2023湖南,12,3分)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η[η=]的变化曲线如图所示。
下列说法错误的是( )
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)D.水的电离程度:a答案 D
7.(2022山东,6,2分)实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。下列说法错误的是 ( )
A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中
B.应选用配带塑料塞的容量瓶配制Na2CO3标准溶液
C.应选用烧杯而非称量纸称量Na2CO3固体
D.达到滴定终点时溶液显橙色
答案 A
8.(2022浙江1月选考,17,2分)已知25 ℃时二元酸H2A的=1.3×10-7,=7.1×10-15。下列说法正确的是 ( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
答案 B
9.(2022浙江6月选考,23,2分)25 ℃时,向20 mL浓度均为0.1 mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.1 mol·L-1的NaOH溶液(醋酸的Ka=1.8×10-5;用0.1 mol·L-1的NaOH溶液滴定20 mL等浓度的盐酸,滴定终点的pH突跃范围4.3~9.7)。下列说法不正确的是( )
A.恰好中和时,溶液呈碱性
B.滴加NaOH溶液至pH=4.3的过程中,发生反应的离子方程式为H++OH- H2O
C.滴定过程中,c(Cl-)=c(CH3COO-)+c(CH3COOH)
D.pH=7时,c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
答案 B
10.(2019浙江4月选考,21,2分)室温下,取20 mL 0.1 mol·L-1某二元酸H2A,滴加0.2 mol·L-1 NaOH溶液。
已知:H2A H++HA-,HA- H++A2-。下列说法不正确的是( )
A.0.1 mol·L-1 H2A溶液中有c(H+)-c(OH-)-c(A2-)=0.1 mol·L-1
B.当滴加至中性时,溶液中c(Na+)=c(HA-)+2c(A2-),用去NaOH溶液的体积小于10 mL
C.当用去NaOH溶液体积10 mL时,溶液的pH<7,此时溶液中有c(A2-)=c(H+)-c(OH-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA-)+2c(A2-)
答案 B
11.(2019课标Ⅰ,11,6分)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的=1.1×10-3,=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
答案 C
12.(2018浙江4月选考,23,2分)在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是( )
A.在a点的溶液中:c(Na+)>c(C)>c(Cl-)>c(OH-)>c(H+)
B.在b点的溶液中:2n(C)+n(HC)<0.001 mol
C.在c点的溶液pH<7,是因为此时HC的电离能力大于其水解能力
D.若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
答案 B
13.(2016课标Ⅰ,12,6分)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(N)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
答案 D
14.(2016北京理综,11,6分)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
答案 C
15.(2015山东理综,13,5分)室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是 ( )
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
答案 D
16.(2015广东理综,11,4分)一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案 C
17.(2015广东理综,12,4分)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1 NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
答案 B
18.(2015重庆理综,3,6分)下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)
答案 C
19.(2014海南单科,11,4分)室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
答案 B
20.(2014课标Ⅱ,11,6分)一定温度下,下列溶液的离子浓度关系式正确的是( )
pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
答案 D
(
第
15
页 共
23
页
)
考点1 弱电解质的电离平衡
1.(2025广东,12,4分)12.CuCl微溶于水,但在Cl-浓度较高的溶液中因形成[CuCl2]-和[CuCl3]2-而溶解,将适量CuCl完全溶于盐酸,得到含[CuCl2]-和[CuCl3]2-的溶液,下列叙述正确的是( )
A.加水稀释,[CuCl3]2-浓度一定下降
B.向溶液中加入少量NaCl固体,[CuCl2]-浓度一定上升
C.H[CuCl2]的电离方程式为H[CuCl2] H++Cu++2Cl-
D.体系中,c(Cu+)+c(H+)=c(Cl-)+c{[CuCl2]-}+c{[CuCl3]2-}+c(OH-)
答案 A
2.(2025浙江1月选考,15,3分)25 ℃时,H2CO3的电离常数=4.5×10-7,=4.7×10-11;Ksp(CaCO3)=3.4×10-9。
下列描述不正确的是( )
A.HC+H2OOH-+H2CO3,K=2.2×10-8
B.2HCH2CO3+C,K=1.0×10-4
C.HC+Ca2+CaCO3(s)+H+,K=1.4×10-2
D.NaHCO3溶液中,c(H+)+c(H2CO3)=c(OH-)+c(C),则c(H+)=
答案 D
3.(2024江苏,12,3分)室温下,通过下列实验探究SO2的性质。已知(H2SO3)=1.3×10-2,(H2SO3)=6.2×10-8。
实验1:将SO2气体通入水中,测得溶液pH=3。
实验2:将SO2气体通入0.1mol·L-1NaOH溶液中,当溶液pH=4时停止通气。
实验3:将SO2气体通入0.1mol·L-1酸性KMnO4溶液中,当溶液恰好褪色时停止通气。
下列说法正确的是( )
A.实验1所得溶液中:c(HS)+c(S)>c(H+)
B.实验2所得溶液中:c(S)>c(HS)
C.实验2所得溶液经蒸干、灼烧制得NaHSO3固体
D.实验3所得溶液中:c(S)>c(Mn2+)
答案 D
4.(2024山东,10,2分)常温下Ag(Ⅰ)-CH3COOH水溶液体系中存在反应:Ag++CH3COO- CH3COOAg(aq),平衡常数为K。已知初始浓度c0(Ag+)=c0(CH3COOH)=0.08 mol·L-1,所有含碳物种的摩尔分数与pH变化关系如图所示(忽略溶液体积变化)。
下列说法正确的是( )
A.线Ⅱ表示CH3COOH的变化情况
B.CH3COOH的电离平衡常数Ka=10-n
C.pH=n时,c(Ag+)= mol·L-1
D.pH=10时,c(Ag+)+c(CH3COOAg)=0.08 mol·L-1
答案 C
5.(2024贵州,12,3分)硼砂[Na2B4O5(OH)4·8H2O]水溶液常用于pH计的校准。硼砂水解生成等物质的量的B(OH)3(硼酸)和Na[B(OH)4](硼酸钠)。
已知:①25 ℃时,硼酸显酸性的原理
B(OH)3+2H2O H3O++
Ka=5.8×10-10;
②lg≈0.38。
下列说法正确的是( )
A.硼砂稀溶液中c(Na+)=c[B(OH)3]
B.硼酸水溶液中的H+主要来自水的电离
C.25 ℃时,0.01 mol·L-1硼酸水溶液的pH≈6.38
D.等浓度等体积的B(OH)3和Na[B(OH)4]溶液混合后,溶液显酸性
答案 B
6.(2024新课标,13,6分)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如下图所示。[比如:δ(CH2ClCOO-)=]
下列叙述正确的是( )
A.曲线M表示δ(CHCl2COO-)~pH的变化关系
B.若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=c(CHCl2COO-)+c(OH-)
C.CH2ClCOOH的电离常数Ka=10-1.3
D.pH=2.08时,
答案 D
7.(2023浙江1月选考,13,3分)甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图(已知甲酸Ka=1.8×10-4),下列说法不正确的是( )
A.活性成分R3N在水中存在平衡:R3N+H2O R3NH++OH-
B.pH=5的废水中c(HCOO-)∶c(HCOOH)=18
C.废水初始pH<2.4,随pH下降,甲酸的电离被抑制,与R3NH+作用的HCOO-数目减少
D.废水初始pH>5,离子交换树脂活性成分主要以R3NH+形态存在
答案 D
8.(2022湖北,12,3分)根据酸碱质子理论,给出质子(H+)的物质是酸,给出质子的能力越强,酸性越强。已知:N2+NH3 N+N2H4 N2H4+CH3COOH N2+CH3COO-
下列酸性强弱顺序正确的是 ( )
A.N2>N2H4>N
B.N2>CH3COOH>N
C.NH3>N2H4>CH3COO-
D.CH3COOH>N2>N
答案 D
9.(2022湖北,15,3分)下图是亚砷酸As(OH)3和酒石酸(H2T,lg=-3.04,lg=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 mol·L-1,总T为1.0×10-3 mol·L-1)。下列说法错误的是( )
A.As(OH)3的lg为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高的物种为As(OH)3
答案 D
10.(2022全国乙,13,6分)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是 ( )
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
B.溶液Ⅱ中HA的电离度[]为
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
答案 B
11.(2022浙江6月选考,2,2分)下列物质属于强电解质的是 ( )
A.HCOOH B.Fe
C.Na2CO3 D.C2H2
答案 C
12.(2019天津理综,5,6分)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
答案 C
13.(2018天津理综,6,6分)LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2P)的变化如图1所示,H3PO4溶液中H2P的分布分数δ随pH的变化如图2所示[δ=]。
下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2P、HP和P
C.随c初始(H2P)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
答案 D
14.(2018浙江4月选考,18,2分)相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )
A.pH相等的两溶液中:c(CH3COO-)=c(Cl-)
B.分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同
C.相同浓度的两溶液,分别与金属镁反应,反应速率相同
D.相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中(忽略溶液体积变化):c(CH3COO-)=c(Cl-)
答案 A
15.(2017课标Ⅱ,12,6分)改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=]。下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
答案 D
16.(2016课标Ⅲ,13,6分)下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
答案 D
17.(2016天津理综,6,6分)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
答案 C
18.(2015课标Ⅰ,13,6分)浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示。下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则增大
答案 D
19.(2015浙江理综,12,6分)40 ℃,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是( )
A.在pH=9.0时,c(N)>c(HC)>c(NH2COO-)>c(C)
B.不同pH的溶液中存在关系:c(N)+c(H+)=2c(C)+c(HC)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
答案 C
20.(2014广东理综,12,4分)常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
答案 D
21.(2014山东理综,13,5分)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(N)=c(CH3COO-)
答案 D
22.(2014天津理综,5,6分)下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(S)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HC)=2c(C)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2)+c(C2)+c(H2C2O4)]
答案 A
23.(2024广东,19,14分)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1)酸催化下NaNO2与NH4Cl混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为
②反应a:N(aq)+N(aq) N2(g)+2H2O(l)
已知:
则反应a的ΔH= ΔH1-ΔH2-ΔH3+ΔH4 。
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测得体系的温度T随时间t的变化如图。据图可知,在该过程中, BD 。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
(2)在非水溶剂中,将CO2转化为化合物ⅱ(一种重要的电子化学品)的催化机理示意图如图所示,其中的催化剂有 AcOH 和 KI 。
(3)在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定了两种一元弱酸HX(X为A或B)在某非水溶剂中的Ka。
a.选择合适的指示剂HIn,Ka(HIn)=3.6×10-20;其钾盐为KIn。
b.向KIn溶液中加入HX,发生反应:In-+HX X-+HIn。KIn起始的物质的量为n0(KIn),加入HX的物质的量为n(HX),平衡时,测得c平(In-)/c平(HIn)随n(HX)/n0(KIn)的变化曲线如图。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算Ka(HA)(写出计算过程,结果保留两位有效数字)。
答案 根据=1.0时,=3.0,设n(HA)=n0(KIn)=1 mol,列三段式:
In- + HA A- + HIn
起始/mol 1 1 0 0
转化/mol 0.25 0.25 0.25 0.25
平衡/mol 0.75 0.75 0.25 0.25
K=,Ka(HA)=Ka(HIn)×=4.0×10-21
②在该溶剂中,Ka(HB) > Ka(HA);Ka(HB) > Ka(HIn)(填“>”“<”或“=”)。
24.(2017江苏单科,20,14分)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有C,其原因是 。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。
图1
图2
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 。
②H3AsO4第一步电离方程式H3AsO4 H2As+H+的电离常数为,则p= (p=-lg )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH=7.1时,吸附剂X表面不带电荷;pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图3所示。
图3
①在pH 7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是 。
②在pH 4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为
。提高吸附剂X对三价砷去除效果可采取的措施是 。
答案 (14分)(1)碱性溶液吸收了空气中的CO2
(2)①OH-+H3AsO3 H2As+H2O ②2.2
(3)①在pH 7~9之间,随pH升高H2As转变为HAs,吸附剂X表面所带负电荷增多,静电斥力增加
②在pH 4~7之间,吸附剂X表面带正电,五价砷主要以H2As和HAs阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷
25.(2015福建理综,23,15分)研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为
。
(2)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25 ℃,两种酸的电离平衡常数如下表。
H2SO3 1.3×10-2 6.3×10-8
H2CO3 4.2×10-7 5.6×10-11
①HS的电离平衡常数表达式K= 。
②0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
答案 (15分)(1)①
②C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O
(2)①0.043 ②5
(3)①或
②c(Na+)>c(S)>c(OH-)>c(HS)>c(H+)或[Na+]>[S]>[OH-]>[HS]>[H+]
③H2SO3+HC HS+CO2↑+H2O
考点2 溶液的酸碱性 酸碱中和滴定
1.(2025浙江1月选考,16,3分)蛋白质中N元素含量可按下列步骤测定:
下列说法不正确的是( )
A.步骤Ⅰ,须加入过量浓H2SO4,以确保N元素完全转化为N
B.步骤Ⅱ,浓NaOH溶液过量,有利于氨的蒸出
C.步骤Ⅲ,用定量、过量盐酸标准溶液吸收NH3,以甲基红(变色的pH范围:4.4~6.2)为指示剂,用NaOH标准溶液滴定,经计算可得N元素的含量
D.尿素[CO(NH2)2]样品、NaNO3样品的N元素含量均可按上述步骤测定
答案 D
2.(2024湖南,13,3分)常温下Ka(HCOOH)=1.8×10-4,向20 mL 0.10 mol·L-1 NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是( )
A.水的电离程度:M
C.当V(HCOOH)=10 mL时,c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-)
D.N点:c(Na+)>c(HCOO-)>c(OH-)>c(H+)>c(HCOOH)
答案 D
(2023山东)阅读下列材料,完成3~5题。
一定条件下,乙酸酐[(CH3CO)2O]醇解反应[(CH3CO)2O+ROH CH3COOR+CH3COOH]可进行完全,利用此反应定量测定有机醇(ROH)中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐—苯溶液。
②量取一定体积乙酸酐—苯溶液置于锥形瓶中,加入m g ROH样品,充分反应后,加适量水使剩余乙酸酐完全水解:(CH3CO)2O+H2O 2CH3COOH。
③加指示剂并用c mol·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V1 mL。
④在相同条件下,量取相同体积的乙酸酐—苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用c mol·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V2 mL。
3.(2023山东,8,2分)对于上述实验,下列做法正确的是( )
A.进行容量瓶检漏时,倒置一次即可
B.滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点
C.滴定读数时,应单手持滴定管上端并保持其自然垂直
D.滴定读数时,应双手一上一下持滴定管
答案 C
4.(2023山东,9,2分)ROH样品中羟基含量(质量分数)计算正确的是( )
A.×100%
B.×100%
C.×100%
D.×100%
答案 A
5.(2023山东,10,2分)根据上述实验原理,下列说法正确的是( )
A.可以用乙酸代替乙酸酐进行上述实验
B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小
C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小
D.步骤④中,若加水量不足,将导致测定结果偏大
答案 B
6.(2023湖南,12,3分)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η[η=]的变化曲线如图所示。
下列说法错误的是( )
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)
7.(2022山东,6,2分)实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。下列说法错误的是 ( )
A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中
B.应选用配带塑料塞的容量瓶配制Na2CO3标准溶液
C.应选用烧杯而非称量纸称量Na2CO3固体
D.达到滴定终点时溶液显橙色
答案 A
8.(2022浙江1月选考,17,2分)已知25 ℃时二元酸H2A的=1.3×10-7,=7.1×10-15。下列说法正确的是 ( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
答案 B
9.(2022浙江6月选考,23,2分)25 ℃时,向20 mL浓度均为0.1 mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.1 mol·L-1的NaOH溶液(醋酸的Ka=1.8×10-5;用0.1 mol·L-1的NaOH溶液滴定20 mL等浓度的盐酸,滴定终点的pH突跃范围4.3~9.7)。下列说法不正确的是( )
A.恰好中和时,溶液呈碱性
B.滴加NaOH溶液至pH=4.3的过程中,发生反应的离子方程式为H++OH- H2O
C.滴定过程中,c(Cl-)=c(CH3COO-)+c(CH3COOH)
D.pH=7时,c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
答案 B
10.(2019浙江4月选考,21,2分)室温下,取20 mL 0.1 mol·L-1某二元酸H2A,滴加0.2 mol·L-1 NaOH溶液。
已知:H2A H++HA-,HA- H++A2-。下列说法不正确的是( )
A.0.1 mol·L-1 H2A溶液中有c(H+)-c(OH-)-c(A2-)=0.1 mol·L-1
B.当滴加至中性时,溶液中c(Na+)=c(HA-)+2c(A2-),用去NaOH溶液的体积小于10 mL
C.当用去NaOH溶液体积10 mL时,溶液的pH<7,此时溶液中有c(A2-)=c(H+)-c(OH-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA-)+2c(A2-)
答案 B
11.(2019课标Ⅰ,11,6分)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的=1.1×10-3,=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
答案 C
12.(2018浙江4月选考,23,2分)在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是( )
A.在a点的溶液中:c(Na+)>c(C)>c(Cl-)>c(OH-)>c(H+)
B.在b点的溶液中:2n(C)+n(HC)<0.001 mol
C.在c点的溶液pH<7,是因为此时HC的电离能力大于其水解能力
D.若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
答案 B
13.(2016课标Ⅰ,12,6分)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(N)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
答案 D
14.(2016北京理综,11,6分)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
答案 C
15.(2015山东理综,13,5分)室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是 ( )
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
答案 D
16.(2015广东理综,11,4分)一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案 C
17.(2015广东理综,12,4分)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1 NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
答案 B
18.(2015重庆理综,3,6分)下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)
答案 C
19.(2014海南单科,11,4分)室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
答案 B
20.(2014课标Ⅱ,11,6分)一定温度下,下列溶液的离子浓度关系式正确的是( )
pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
答案 D
(
第
15
页 共
23
页
)
同课章节目录
