专题7 化学反应的热效应--2026版十年高考化学真题分类汇编
文档属性
| 名称 | 专题7 化学反应的热效应--2026版十年高考化学真题分类汇编 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2026-02-06 00:00:00 | ||
图片预览


文档简介
专题七 化学反应的热效应
考点1 化学反应中的能量变化
1.(2024江苏,5,3分)催化剂有选择性,如C2H4与O2反应用Ag催化生成(环氧乙烷)。下列说法正确的是( )
A.豆科植物固氮过程中,固氮酶能提高该反应的活化能
B.C2H4与O2反应中,Ag催化能提高生成CH3CHO的选择性
C.H2O2制O2反应中,MnO2能加快化学反应速率
D.SO2与O2反应中,V2O5能减小该反应的焓变
答案 C
2.(2024北京,13,3分)苯在浓HNO3和浓H2SO4作用下,反应过程中能量变化示意图如下。下列说法不正确的是( )
A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B.X为苯的加成产物,Y为苯的取代产物
C.由苯得到M时,苯中的大π键没有变化
D.对于生成Y的反应,浓H2SO4作催化剂
答案 C
3.(2024贵州,14,3分)AgCN与CH3CH2Br可发生取代反应,反应过程中CN-的C原子和N原子均可进攻CH3CH2Br,分别生成腈(CH3CH2CN)和异腈(CH3CH2NC)两种产物。通过量子化学计算得到的反应历程及能量变化如图(TS为过渡态,Ⅰ、Ⅱ为后续物)。
由图示信息,下列说法错误的是( )
A.从CH3CH2Br生成CH3CH2CN和CH3CH2NC的反应都是放热反应
B.过渡态TS1是由CN-的C原子进攻CH3CH2Br的α-C而形成的
C.Ⅰ中“N--Ag”之间的作用力比Ⅱ中“C--Ag”之间的作用力弱
D.生成CH3CH2CN放热更多,低温时CH3CH2CN是主要产物
答案 D
4.(2024广东,11,4分)按下图装置进行实验。搅拌一段时间后,滴加浓盐酸。不同反应阶段的预期现象及其相应推理均合理的是( )
A.烧瓶壁会变冷,说明存在ΔH<0的反应
B.试纸会变蓝,说明有NH3生成,产氨过程熵增
C.滴加浓盐酸后,有白烟产生,说明有NH4Cl升华
D.实验过程中,气球会一直变大,说明体系压强增大
答案 B
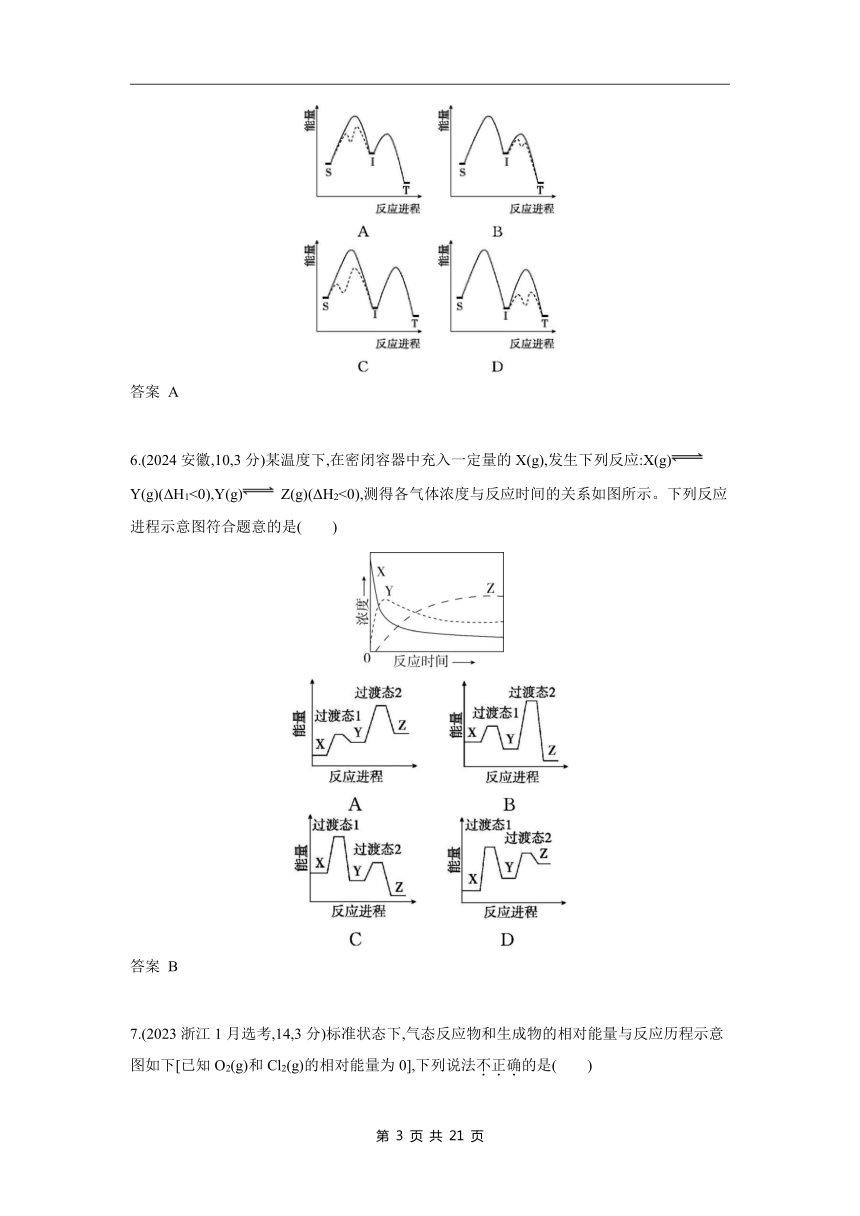
5.(2024广东,15,4分)对反应S(g) T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,c平(S)/c平(T)增大,c平(S)/c平(I)减小。基于以上事实,可能的反应历程示意图(—为无催化剂,----为有催化剂)为( )
答案 A
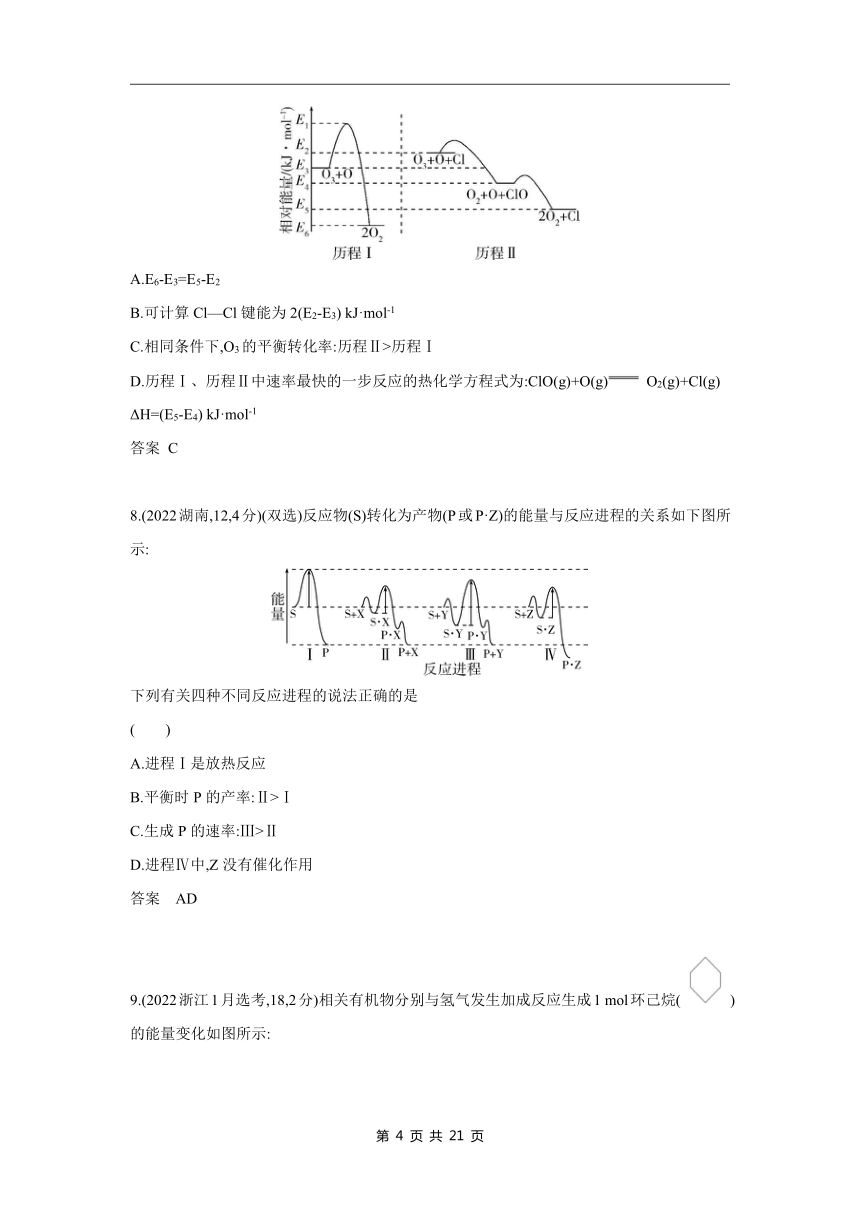
6.(2024安徽,10,3分)某温度下,在密闭容器中充入一定量的X(g),发生下列反应:X(g) Y(g)(ΔH1<0),Y(g) Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是( )
答案 B
7.(2023浙江1月选考,14,3分)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
答案 C
8.(2022湖南,12,4分)(双选)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:
下列有关四种不同反应进程的说法正确的是 ( )
A.进程Ⅰ是放热反应
B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
答案 AD
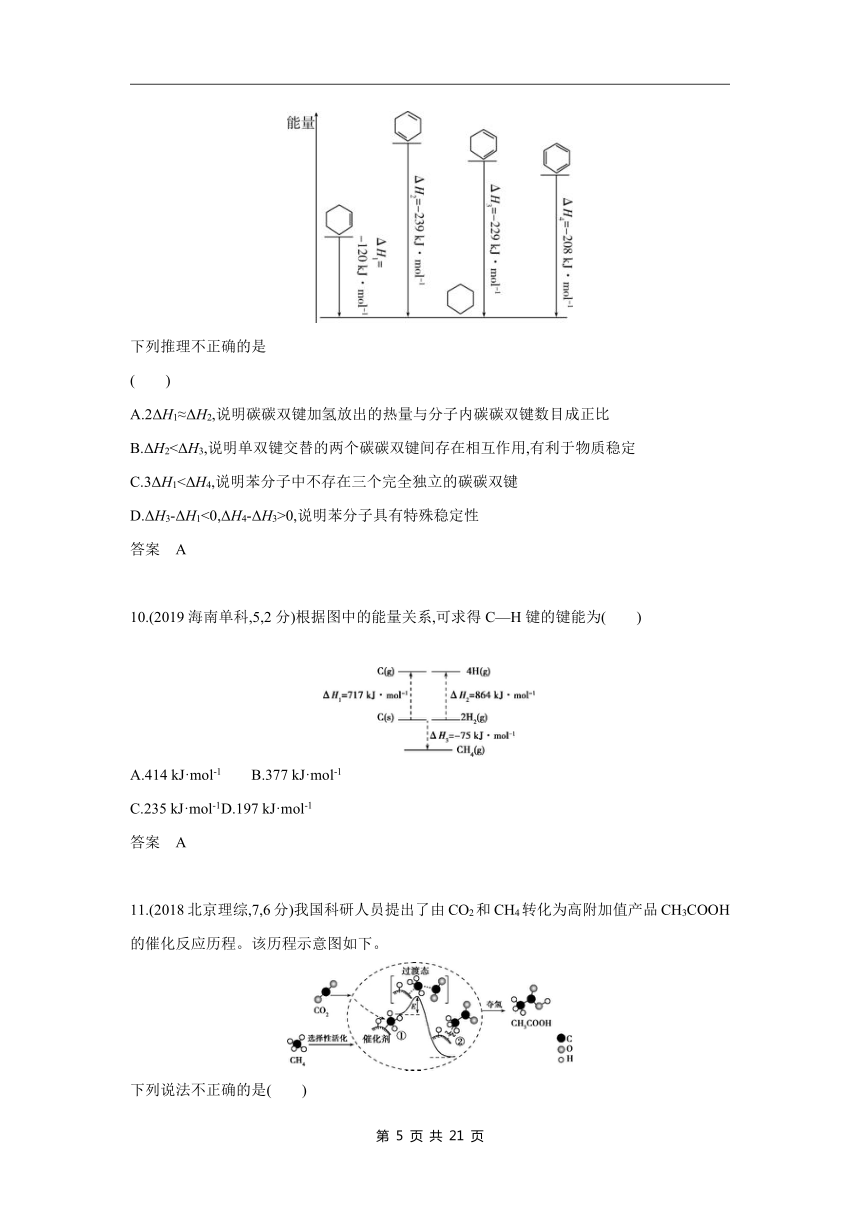
9.(2022浙江1月选考,18,2分)相关有机物分别与氢气发生加成反应生成1 mol环己烷()的能量变化如图所示:
下列推理不正确的是 ( )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
答案 A
10.(2019海南单科,5,2分)根据图中的能量关系,可求得C—H键的键能为( )
A.414 kJ·mol-1 B.377 kJ·mol-1
C.235 kJ·mol-1 D.197 kJ·mol-1
答案 A
11.(2018北京理综,7,6分)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
答案 D
12.(2018浙江4月选考,21,2分)氢卤酸的能量关系如图所示:
下列说法正确的是( )
A.已知HF气体溶于水放热,则HF的ΔH1<0
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则该条件下ΔH2=a kJ·mol-1
答案 D
13.(2018江苏单科,10,2分)下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
答案 C
14.(2016海南单科,6,2分)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g) 57CO2(g)+52H2O(l)
已知燃烧1 kg该化合物释放出热量3.8×104 kJ。油酸甘油酯的燃烧热ΔH为( )
A.3.8×104 kJ·mol-1 B.-3.8×104 kJ·mol-1
C.3.4×104 kJ·mol-1 D.-3.4×104 kJ·mol-1
答案 D
15.(2016海南单科,11,4分)由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是( )
A.由X→Y反应的ΔH=E5-E2
B.由X→Z反应的ΔH<0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
答案 BC
16.(2015江苏单科,4,2分)在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A.元素C的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C.在该反应条件下,Mg的还原性强于C的还原性
D.该反应中化学能全部转化为热能
答案 C
17.(2015北京理综,9,6分)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
答案 C
18.(2015海南单科,4,2分)已知丙烷的燃烧热ΔH=-2 215 kJ·mol-1。若一定量的丙烷完全燃烧后生成1.8 g水,则放出的热量约为( )
A.55 kJ B.220 kJ C.550 kJ D.1 108 kJ
答案 A
19.(2023全国甲,28,15分)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g) 2O3(g) K1 ΔH1=285 kJ·mol-1
②2CH4(g)+O2(g) 2CH3OH(l) K2 ΔH2=-329 kJ·mol-1
反应③CH4(g)+O3(g) CH3OH(l)+O2(g)的ΔH3= kJ·mol-1,平衡常数K3= (用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4 M++CH3OH,结果如下图所示。图中300 K的曲线是 (填“a”或“b”)。300 K、60 s时MO+的转化率为 (列出算式)。
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以CH4示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是 (填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线 (填“c”或“d”)。
(ⅲ)MO+与CH2D2反应,氘代甲醇的产量CH2DOD CHD2OH(填“>”“=”或“<”)。若MO+与CHD3反应,生成的氘代甲醇有 种。
答案 (1)-307
(2)b 1-10-0.1
(3)(ⅰ)Ⅰ (ⅱ)c (ⅲ)< 2
20.(2022浙江6月选考,27,4分)联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:CaCO3(s) CaO(s)+CO2(g) ΔH=1.8×102 kJ·mol-1,石灰石分解需要的能量由焦炭燃烧提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧生成CO2,其热量有效利用率为50%。石灰窑中产生的富含CO2的窑气通入氨的氯化钠饱和溶液中,40%的CO2最终转化为纯碱。已知:焦炭的热值为30 kJ·g-1(假设焦炭不含杂质)。
请回答:
(1)每完全分解100 kg石灰石(含CaCO3 90%,杂质不参与反应),需要投料 kg焦炭。
(2)每生产106 kg纯碱,同时可获得 kg CaO(列式计算)。
答案 (1)10.8
(2)70
由(1)计算可知参与反应的CaCO3和焦炭的物质的量之比为1∶1,因此
m(CaO)==70 kg
21.[2014北京理综,26(3)]NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)N2O4(g) ΔH1
2NO2(g)N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。
②N2O4与O2、H2O化合的化学方程式是 。
答案 (3)①A ②2N2O4+O2+2H2O4HNO3
考点2 热化学方程式的书写 盖斯定律的应用
1.(2025浙江1月选考,11,3分)下列说法正确的是 ( )
A.常温常压下H2(g)和O2(g)混合无明显现象,则反应2H2(g)+O2(g)2H2O(l)在该条件下不自发
B.3H2(g)+N2(g)2NH3(g) ΔH<0,升高温度,平衡逆移,则反应的平衡常数减小
C.CO(g)+H2(g)C(s)+H2O(g) ΔH<0,则正反应的活化能大于逆反应的活化能
D.Na(s)+Cl2(g)NaCl(s) ΔH<0,Na+(g)+Cl-(g)NaCl(s) ΔH<0,则Na(s)+Cl2(g)Na+(g)+Cl-(g) ΔH<0
答案 B
2.(2025北京,11,3分)为理解离子化合物溶解过程的能量变化,可设想NaCl固体溶于水的过程分两步实现,示意图如下。
下列说法不正确的是( )
A.NaCl固体溶解是吸热过程
B.根据盖斯定律可知:a+b=4
C.根据各微粒的状态,可判断a>0,b>0
D.溶解过程的能量变化,与NaCl固体和NaCl溶液中微粒间作用力的强弱有关
答案 C
3.(2022江苏,6,3分)周期表中ⅣA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6(H2SiF6在水中完全电离为H+和Si);1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅—锗。我国古代就掌握了青铜(铜—锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。下列化学反应表示正确的是 ( )
A.SiO2与HF溶液反应:SiO2+6HF 2H++Si+2H2O
B.高温下H2还原GeS2:GeS2+H2 Ge+2H2S
C.铅蓄电池放电时的正极反应:Pb-2e-+S PbSO4
D.甲烷的燃烧:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH=890.3 kJ·mol-1
答案 A
4.(2022浙江6月选考,18,2分)标准状态下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/kJ·mol-1 249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g) H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·mol-1。下列说法不正确的是 ( )
A.H2的键能为436 kJ·mol-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOOD.H2O(g)+O(g) H2O2(g) ΔH=-143 kJ·mol-1
答案 C
5.(2016江苏单科,8,2分)通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)2H2(g)+O2(g) ΔH1=571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)CO(g)+H2(g) ΔH2=131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH3=206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)C(s)+2H2(g)的ΔH=74.8 kJ·mol-1
答案 D
6.(2015重庆理综,6,6分)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1
已知:碳的燃烧热ΔH1=a kJ·mol-1
S(s)+2K(s)K2S(s) ΔH2=b kJ·mol-1
2K(s)+N2(g)+3O2(g)2KNO3(s) ΔH3=c kJ·mol-1
则x为( )
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
答案 A
7.(2014江苏单科,10,2分)已知:C(s)+O2(g) CO2(g) ΔH1
CO2(g)+C(s) 2CO(g) ΔH2
2CO(g)+O2(g) 2CO2(g) ΔH3
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s) 3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
答案 C
8.(2014重庆理综,6,6分)已知:
C(s)+H2O(g) CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-220 kJ·mol-1
H—H、OO和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( )
A.-332 B.-118 C.+350 D.+130
答案 D
9.(2020浙江7月选考,29,10分)研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。
相关的主要化学反应有:
Ⅰ C2H6(g) C2H4(g)+H2(g) ΔH1=136 kJ·mol-1
Ⅱ C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol-1
Ⅲ C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH3
Ⅳ CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=41 kJ·mol-1
已知:298 K时,相关物质的相对能量(如下图)。
可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。
例如:H2O(g) H2O(l) ΔH=-286 kJ·mol-1-(-242 kJ·mol-1)=-44 kJ·mol-1。
请回答:
(1)①根据相关物质的相对能量计算ΔH3= kJ·mol-1。
②下列描述正确的是 。
A.升高温度反应Ⅰ的平衡常数增大
B.加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D.恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:【C2H6(g)+CO2(g)】→【C2H4(g)+H2(g)+CO2(g)】→【C2H4(g)+CO(g)+H2O(g)】,且第二步速率较慢(反应活化能为210 kJ·mol-1)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从【C2H6(g)+CO2(g)】的能量-477 kJ·mol-1开始(如下图)。
(2)①CO2和C2H6按物质的量1∶1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
催化剂 转化率C2H6/% 转化率CO2/% 产率C2H4/%
催化剂X 19.0 37.6 3.3
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是 ,判断依据是
。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773 K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是 。
答案 (1)①430 ②AD
③
(2)①CO C2H4的产率低,说明催化剂X有利于提高反应Ⅲ速率
②选择性膜吸附C2H4,促进反应Ⅱ平衡正向移动
10.(2015福建理综,24,15分)无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
物质 SiCl4 AlCl3 FeCl3 FeCl2
沸点/℃ 57.6 180(升华) 300(升华) 1 023
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 。
③已知:Al2O3(s)+3C(s) 2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1
2AlCl3(g) 2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 。
④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为 。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。
答案 (1)Al3++3H2O Al(OH)3+3H+
(2)①防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率
②铁或Fe ③Al2O3(s)+3C(s)+3Cl2(g) 2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1
④NaCl、NaClO、Na2CO3 ⑤除去FeCl3,提高AlCl3纯度
11.(2015四川理综,11,16分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O 15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH=-1 648 kJ/mol
C(s)+O2(g) CO2(g) ΔH=-393 kJ/mol
2Fe(s)+2C(s)+3O2(g) 2FeCO3(s) ΔH=-1 480 kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2 Fe+2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
答案 (1)Fe2O3+6H+ 2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+
(4)4FeCO3(s)+O2(g) 2Fe2O3(s)+4CO2(g) ΔH=-260 kJ/mol
(5)FeS2+4Li++4e- Fe+2Li2S或FeS2+4e- Fe+2S2-
(6)0.011 8ab-0.646c或-
考点3反应历程图像分析
1.(2025山东,9,2分)用肼(N2H4)的水溶液处理核冷却系统内壁上的铁氧化物时,通常加入少量CuSO4,反应原理如图所示。下列说法正确的是( )
A.N2是还原反应的产物
B.还原性:N2H4C.处理后溶液的pH增大
D.图示反应过程中起催化作用的是Cu2+
答案C
2.(2025江苏,10,3分)CO2与N通过电催化反应生成CO(NH2)2,可能的反应机理如图所示(图中吸附在催化剂表面的物种用“*”标注)。下列说法正确的是( )
A.过程Ⅱ和过程Ⅲ都有极性共价键形成
B.过程Ⅱ中N发生了氧化反应
C.电催化CO2与N生成CO(NH2)2的反应方程式:CO2+2N+18H+ CO(NH2)2+7H2O
D.常温常压、无催化剂条件下,CO2与NH3·H2O反应可生产CO(NH2)2
答案A
3.(2025浙江1月选考,14,3分)化合物A在一定条件下可转变为酚E及少量副产物,该反应的主要途径如下:
下列说法不正确的是( )
A.H+为该反应的催化剂
B.化合物A的一溴代物有7种
C.步骤Ⅲ,苯基迁移能力强于甲基
D.化合物E可发生氧化、加成和取代反应
答案B
4.(2025河南,10,3分)在催化剂a或催化剂b作用下,丙烷发生脱氢反应制备丙烯,总反应的化学方程式为CH3CH2CH3(g)CH3CHCH2(g)+H2(g),反应进程中的相对能量变化如图所示(*表示吸附态,*CH3CHCH2+2*H CH3CHCH2(g)+H2(g)中部分进程已省略)。
下列说法正确的是( )
A.总反应是放热反应
B.两种不同催化剂作用下总反应的化学平衡常数不同
C.和催化剂b相比,丙烷被催化剂a吸附得到的吸附态更稳定
D.①转化为②的进程中,决速步骤为*CH3CH2CH3 *CH3CHCH3+*H
答案 C
5.(2025北京,10,3分)乙烯、醋酸和氧气在钯(Pd)催化下高效合成醋酸乙烯酯()的过程示意图如下。
下列说法不正确的是( )
A.①中反应为4CH3COOH+O2+2Pd 2Pd(CH3COO)2+2H2O
B.②中生成的过程中,有σ键断裂与形成
C.生成总反应的原子利用率为100%
D.Pd催化剂通过参与反应改变反应历程,提高反应速率
答案 C
6.(2025河北,12,3分)氮化镓(GaN)是一种重要的半导体材料,广泛应用于光电信息材料等领域,可利用反应Ga2O3(s)+2NH3(g) 2GaN(s)+3H2O(g)制备。反应历程(TS代表过渡态)如下:
下列说法错误的是( )
A.反应ⅰ是吸热过程
B.反应ⅱ中H2O(g)脱去步骤的活化能为2.69 eV
C.反应ⅲ包含2个基元反应
D.总反应的速控步包含在反应ⅱ中
答案 D
7.(2025河南,13,3分)在MoS2负载的Rh-Fe催化剂作用下,CH4可在室温下高效转化为CH3COOH,其可能的反应机理如图所示。
下列说法错误的是( )
A.该反应的原子利用率为100%
B.每消耗1 mol O2可生成1 mol CH3COOH
C.反应过程中,Rh和Fe的化合价均发生变化
D.若以CD4为原料,用H2O吸收产物可得到CD3COOH
答案B
(
第
21
页 共
21
页
)
考点1 化学反应中的能量变化
1.(2024江苏,5,3分)催化剂有选择性,如C2H4与O2反应用Ag催化生成(环氧乙烷)。下列说法正确的是( )
A.豆科植物固氮过程中,固氮酶能提高该反应的活化能
B.C2H4与O2反应中,Ag催化能提高生成CH3CHO的选择性
C.H2O2制O2反应中,MnO2能加快化学反应速率
D.SO2与O2反应中,V2O5能减小该反应的焓变
答案 C
2.(2024北京,13,3分)苯在浓HNO3和浓H2SO4作用下,反应过程中能量变化示意图如下。下列说法不正确的是( )
A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B.X为苯的加成产物,Y为苯的取代产物
C.由苯得到M时,苯中的大π键没有变化
D.对于生成Y的反应,浓H2SO4作催化剂
答案 C
3.(2024贵州,14,3分)AgCN与CH3CH2Br可发生取代反应,反应过程中CN-的C原子和N原子均可进攻CH3CH2Br,分别生成腈(CH3CH2CN)和异腈(CH3CH2NC)两种产物。通过量子化学计算得到的反应历程及能量变化如图(TS为过渡态,Ⅰ、Ⅱ为后续物)。
由图示信息,下列说法错误的是( )
A.从CH3CH2Br生成CH3CH2CN和CH3CH2NC的反应都是放热反应
B.过渡态TS1是由CN-的C原子进攻CH3CH2Br的α-C而形成的
C.Ⅰ中“N--Ag”之间的作用力比Ⅱ中“C--Ag”之间的作用力弱
D.生成CH3CH2CN放热更多,低温时CH3CH2CN是主要产物
答案 D
4.(2024广东,11,4分)按下图装置进行实验。搅拌一段时间后,滴加浓盐酸。不同反应阶段的预期现象及其相应推理均合理的是( )
A.烧瓶壁会变冷,说明存在ΔH<0的反应
B.试纸会变蓝,说明有NH3生成,产氨过程熵增
C.滴加浓盐酸后,有白烟产生,说明有NH4Cl升华
D.实验过程中,气球会一直变大,说明体系压强增大
答案 B
5.(2024广东,15,4分)对反应S(g) T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,c平(S)/c平(T)增大,c平(S)/c平(I)减小。基于以上事实,可能的反应历程示意图(—为无催化剂,----为有催化剂)为( )
答案 A
6.(2024安徽,10,3分)某温度下,在密闭容器中充入一定量的X(g),发生下列反应:X(g) Y(g)(ΔH1<0),Y(g) Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是( )
答案 B
7.(2023浙江1月选考,14,3分)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
答案 C
8.(2022湖南,12,4分)(双选)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:
下列有关四种不同反应进程的说法正确的是 ( )
A.进程Ⅰ是放热反应
B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
答案 AD
9.(2022浙江1月选考,18,2分)相关有机物分别与氢气发生加成反应生成1 mol环己烷()的能量变化如图所示:
下列推理不正确的是 ( )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
答案 A
10.(2019海南单科,5,2分)根据图中的能量关系,可求得C—H键的键能为( )
A.414 kJ·mol-1 B.377 kJ·mol-1
C.235 kJ·mol-1 D.197 kJ·mol-1
答案 A
11.(2018北京理综,7,6分)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
答案 D
12.(2018浙江4月选考,21,2分)氢卤酸的能量关系如图所示:
下列说法正确的是( )
A.已知HF气体溶于水放热,则HF的ΔH1<0
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则该条件下ΔH2=a kJ·mol-1
答案 D
13.(2018江苏单科,10,2分)下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
答案 C
14.(2016海南单科,6,2分)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g) 57CO2(g)+52H2O(l)
已知燃烧1 kg该化合物释放出热量3.8×104 kJ。油酸甘油酯的燃烧热ΔH为( )
A.3.8×104 kJ·mol-1 B.-3.8×104 kJ·mol-1
C.3.4×104 kJ·mol-1 D.-3.4×104 kJ·mol-1
答案 D
15.(2016海南单科,11,4分)由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是( )
A.由X→Y反应的ΔH=E5-E2
B.由X→Z反应的ΔH<0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
答案 BC
16.(2015江苏单科,4,2分)在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A.元素C的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C.在该反应条件下,Mg的还原性强于C的还原性
D.该反应中化学能全部转化为热能
答案 C
17.(2015北京理综,9,6分)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
答案 C
18.(2015海南单科,4,2分)已知丙烷的燃烧热ΔH=-2 215 kJ·mol-1。若一定量的丙烷完全燃烧后生成1.8 g水,则放出的热量约为( )
A.55 kJ B.220 kJ C.550 kJ D.1 108 kJ
答案 A
19.(2023全国甲,28,15分)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g) 2O3(g) K1 ΔH1=285 kJ·mol-1
②2CH4(g)+O2(g) 2CH3OH(l) K2 ΔH2=-329 kJ·mol-1
反应③CH4(g)+O3(g) CH3OH(l)+O2(g)的ΔH3= kJ·mol-1,平衡常数K3= (用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4 M++CH3OH,结果如下图所示。图中300 K的曲线是 (填“a”或“b”)。300 K、60 s时MO+的转化率为 (列出算式)。
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以CH4示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是 (填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线 (填“c”或“d”)。
(ⅲ)MO+与CH2D2反应,氘代甲醇的产量CH2DOD CHD2OH(填“>”“=”或“<”)。若MO+与CHD3反应,生成的氘代甲醇有 种。
答案 (1)-307
(2)b 1-10-0.1
(3)(ⅰ)Ⅰ (ⅱ)c (ⅲ)< 2
20.(2022浙江6月选考,27,4分)联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:CaCO3(s) CaO(s)+CO2(g) ΔH=1.8×102 kJ·mol-1,石灰石分解需要的能量由焦炭燃烧提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧生成CO2,其热量有效利用率为50%。石灰窑中产生的富含CO2的窑气通入氨的氯化钠饱和溶液中,40%的CO2最终转化为纯碱。已知:焦炭的热值为30 kJ·g-1(假设焦炭不含杂质)。
请回答:
(1)每完全分解100 kg石灰石(含CaCO3 90%,杂质不参与反应),需要投料 kg焦炭。
(2)每生产106 kg纯碱,同时可获得 kg CaO(列式计算)。
答案 (1)10.8
(2)70
由(1)计算可知参与反应的CaCO3和焦炭的物质的量之比为1∶1,因此
m(CaO)==70 kg
21.[2014北京理综,26(3)]NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)N2O4(g) ΔH1
2NO2(g)N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。
②N2O4与O2、H2O化合的化学方程式是 。
答案 (3)①A ②2N2O4+O2+2H2O4HNO3
考点2 热化学方程式的书写 盖斯定律的应用
1.(2025浙江1月选考,11,3分)下列说法正确的是 ( )
A.常温常压下H2(g)和O2(g)混合无明显现象,则反应2H2(g)+O2(g)2H2O(l)在该条件下不自发
B.3H2(g)+N2(g)2NH3(g) ΔH<0,升高温度,平衡逆移,则反应的平衡常数减小
C.CO(g)+H2(g)C(s)+H2O(g) ΔH<0,则正反应的活化能大于逆反应的活化能
D.Na(s)+Cl2(g)NaCl(s) ΔH<0,Na+(g)+Cl-(g)NaCl(s) ΔH<0,则Na(s)+Cl2(g)Na+(g)+Cl-(g) ΔH<0
答案 B
2.(2025北京,11,3分)为理解离子化合物溶解过程的能量变化,可设想NaCl固体溶于水的过程分两步实现,示意图如下。
下列说法不正确的是( )
A.NaCl固体溶解是吸热过程
B.根据盖斯定律可知:a+b=4
C.根据各微粒的状态,可判断a>0,b>0
D.溶解过程的能量变化,与NaCl固体和NaCl溶液中微粒间作用力的强弱有关
答案 C
3.(2022江苏,6,3分)周期表中ⅣA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6(H2SiF6在水中完全电离为H+和Si);1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅—锗。我国古代就掌握了青铜(铜—锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。下列化学反应表示正确的是 ( )
A.SiO2与HF溶液反应:SiO2+6HF 2H++Si+2H2O
B.高温下H2还原GeS2:GeS2+H2 Ge+2H2S
C.铅蓄电池放电时的正极反应:Pb-2e-+S PbSO4
D.甲烷的燃烧:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH=890.3 kJ·mol-1
答案 A
4.(2022浙江6月选考,18,2分)标准状态下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/kJ·mol-1 249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g) H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·mol-1。下列说法不正确的是 ( )
A.H2的键能为436 kJ·mol-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOO
答案 C
5.(2016江苏单科,8,2分)通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)2H2(g)+O2(g) ΔH1=571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)CO(g)+H2(g) ΔH2=131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH3=206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)C(s)+2H2(g)的ΔH=74.8 kJ·mol-1
答案 D
6.(2015重庆理综,6,6分)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1
已知:碳的燃烧热ΔH1=a kJ·mol-1
S(s)+2K(s)K2S(s) ΔH2=b kJ·mol-1
2K(s)+N2(g)+3O2(g)2KNO3(s) ΔH3=c kJ·mol-1
则x为( )
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
答案 A
7.(2014江苏单科,10,2分)已知:C(s)+O2(g) CO2(g) ΔH1
CO2(g)+C(s) 2CO(g) ΔH2
2CO(g)+O2(g) 2CO2(g) ΔH3
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s) 3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
答案 C
8.(2014重庆理综,6,6分)已知:
C(s)+H2O(g) CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-220 kJ·mol-1
H—H、OO和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( )
A.-332 B.-118 C.+350 D.+130
答案 D
9.(2020浙江7月选考,29,10分)研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。
相关的主要化学反应有:
Ⅰ C2H6(g) C2H4(g)+H2(g) ΔH1=136 kJ·mol-1
Ⅱ C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol-1
Ⅲ C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH3
Ⅳ CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=41 kJ·mol-1
已知:298 K时,相关物质的相对能量(如下图)。
可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。
例如:H2O(g) H2O(l) ΔH=-286 kJ·mol-1-(-242 kJ·mol-1)=-44 kJ·mol-1。
请回答:
(1)①根据相关物质的相对能量计算ΔH3= kJ·mol-1。
②下列描述正确的是 。
A.升高温度反应Ⅰ的平衡常数增大
B.加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D.恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:【C2H6(g)+CO2(g)】→【C2H4(g)+H2(g)+CO2(g)】→【C2H4(g)+CO(g)+H2O(g)】,且第二步速率较慢(反应活化能为210 kJ·mol-1)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从【C2H6(g)+CO2(g)】的能量-477 kJ·mol-1开始(如下图)。
(2)①CO2和C2H6按物质的量1∶1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
催化剂 转化率C2H6/% 转化率CO2/% 产率C2H4/%
催化剂X 19.0 37.6 3.3
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是 ,判断依据是
。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773 K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是 。
答案 (1)①430 ②AD
③
(2)①CO C2H4的产率低,说明催化剂X有利于提高反应Ⅲ速率
②选择性膜吸附C2H4,促进反应Ⅱ平衡正向移动
10.(2015福建理综,24,15分)无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
物质 SiCl4 AlCl3 FeCl3 FeCl2
沸点/℃ 57.6 180(升华) 300(升华) 1 023
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 。
③已知:Al2O3(s)+3C(s) 2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1
2AlCl3(g) 2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 。
④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为 。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。
答案 (1)Al3++3H2O Al(OH)3+3H+
(2)①防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率
②铁或Fe ③Al2O3(s)+3C(s)+3Cl2(g) 2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1
④NaCl、NaClO、Na2CO3 ⑤除去FeCl3,提高AlCl3纯度
11.(2015四川理综,11,16分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O 15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH=-1 648 kJ/mol
C(s)+O2(g) CO2(g) ΔH=-393 kJ/mol
2Fe(s)+2C(s)+3O2(g) 2FeCO3(s) ΔH=-1 480 kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2 Fe+2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
答案 (1)Fe2O3+6H+ 2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+
(4)4FeCO3(s)+O2(g) 2Fe2O3(s)+4CO2(g) ΔH=-260 kJ/mol
(5)FeS2+4Li++4e- Fe+2Li2S或FeS2+4e- Fe+2S2-
(6)0.011 8ab-0.646c或-
考点3反应历程图像分析
1.(2025山东,9,2分)用肼(N2H4)的水溶液处理核冷却系统内壁上的铁氧化物时,通常加入少量CuSO4,反应原理如图所示。下列说法正确的是( )
A.N2是还原反应的产物
B.还原性:N2H4
D.图示反应过程中起催化作用的是Cu2+
答案C
2.(2025江苏,10,3分)CO2与N通过电催化反应生成CO(NH2)2,可能的反应机理如图所示(图中吸附在催化剂表面的物种用“*”标注)。下列说法正确的是( )
A.过程Ⅱ和过程Ⅲ都有极性共价键形成
B.过程Ⅱ中N发生了氧化反应
C.电催化CO2与N生成CO(NH2)2的反应方程式:CO2+2N+18H+ CO(NH2)2+7H2O
D.常温常压、无催化剂条件下,CO2与NH3·H2O反应可生产CO(NH2)2
答案A
3.(2025浙江1月选考,14,3分)化合物A在一定条件下可转变为酚E及少量副产物,该反应的主要途径如下:
下列说法不正确的是( )
A.H+为该反应的催化剂
B.化合物A的一溴代物有7种
C.步骤Ⅲ,苯基迁移能力强于甲基
D.化合物E可发生氧化、加成和取代反应
答案B
4.(2025河南,10,3分)在催化剂a或催化剂b作用下,丙烷发生脱氢反应制备丙烯,总反应的化学方程式为CH3CH2CH3(g)CH3CHCH2(g)+H2(g),反应进程中的相对能量变化如图所示(*表示吸附态,*CH3CHCH2+2*H CH3CHCH2(g)+H2(g)中部分进程已省略)。
下列说法正确的是( )
A.总反应是放热反应
B.两种不同催化剂作用下总反应的化学平衡常数不同
C.和催化剂b相比,丙烷被催化剂a吸附得到的吸附态更稳定
D.①转化为②的进程中,决速步骤为*CH3CH2CH3 *CH3CHCH3+*H
答案 C
5.(2025北京,10,3分)乙烯、醋酸和氧气在钯(Pd)催化下高效合成醋酸乙烯酯()的过程示意图如下。
下列说法不正确的是( )
A.①中反应为4CH3COOH+O2+2Pd 2Pd(CH3COO)2+2H2O
B.②中生成的过程中,有σ键断裂与形成
C.生成总反应的原子利用率为100%
D.Pd催化剂通过参与反应改变反应历程,提高反应速率
答案 C
6.(2025河北,12,3分)氮化镓(GaN)是一种重要的半导体材料,广泛应用于光电信息材料等领域,可利用反应Ga2O3(s)+2NH3(g) 2GaN(s)+3H2O(g)制备。反应历程(TS代表过渡态)如下:
下列说法错误的是( )
A.反应ⅰ是吸热过程
B.反应ⅱ中H2O(g)脱去步骤的活化能为2.69 eV
C.反应ⅲ包含2个基元反应
D.总反应的速控步包含在反应ⅱ中
答案 D
7.(2025河南,13,3分)在MoS2负载的Rh-Fe催化剂作用下,CH4可在室温下高效转化为CH3COOH,其可能的反应机理如图所示。
下列说法错误的是( )
A.该反应的原子利用率为100%
B.每消耗1 mol O2可生成1 mol CH3COOH
C.反应过程中,Rh和Fe的化合价均发生变化
D.若以CD4为原料,用H2O吸收产物可得到CD3COOH
答案B
(
第
21
页 共
21
页
)
同课章节目录
