安徽省黄山市2024-2025学年高一下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 安徽省黄山市2024-2025学年高一下学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 855.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-08 22:12:13 | ||
图片预览


文档简介
2024—2025学年度第二学期期末质量检测高一化学试题
(考试时间:75分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Fe-56
Cu-64 Ba-137 Ce-140
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。)
1.下列说法正确的是
A.单质硅是将太阳能转化为电能的常用材料
B.医用酒精的浓度通常为95%
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
2.下列有关合理用药的说法正确的是
A.一次忘记服药,下次可以增加一倍剂量服用
B.非处方药的包装上印有“OTC”标识
C.长期服用阿司匹林可预防某些疾病,没有副作用
D.每日早、中、晚三次与每隔8小时一次,服药效果相同
3.下列不符合环境保护和绿色化学理念的是
A.用银作催化剂,乙烯和氧气反应制取环氧乙烷,原子利用率100%
B.400时,在催化剂作用下NH3 与NO反应生成N2和H2O
C.用铜和浓硝酸反应制取Cu(NO3)2
D.制CuSO4时,先将Cu氧化成CuO后再与稀硫酸反应
4.已知某化学反应A2(g)+2B2(g)=2AB2(g),反应过程中的能量变化如图所示,下列说法正确的是
A.该反应的进行一定需要加热
B.生成2molAB2(g),放出热量(E1-E2)kJ
C.1molA2(g)和2molB2(g)的总能量低于2molAB2(g)的能量
D.该反应断开化学键吸收的总能量小于形成化学键放出的总能量
5.图1是铜锌原电池示意图,图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示
A.c(H+) B.m(Cu电极) C.c(SO) D.c(Zn2+)
6.某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,
发生化学反应,在其他条件相同时,测得实验数据如下
表:
压强/(×105Pa) 温度/℃ NO达到所列转化率需要时间/s
50% 90% 98%
1.0 30 12 250 2830
90 25 510 5760
8.0 30 0.2 3.9 36
90 0.6 7.9 74
根据表中数据,下列说法正确的是
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.若进入反应塔的混合气体为amol,反应速率以v=Δn/Δt表示,则在8.0×105Pa、30℃
条件下转化率从50%增至90%时段NO的反应速率为mol/s
D.在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
7.某温度下,在2L恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。下列说法正确的是
A.该反应的化学方程式为X+3Y2Z
B.2min时,X的转化率为30%
C.2min时,以表示的反应速率为
D.2min后,正、逆反应均不再进行,体系中的物质的量均不再变化
8.新己烷是常见的燃料添加剂、有机溶剂,其结构简式如下图。下列关于该物质的说法错误的是
A.分子式为C6H14
B.可发生取代、氧化反应
C.新己烷的的同分异构体有4种
D.一氯代物有4种
9.下列实验现象因发生加成反应而产生的是
A.试管内壁上有油状 液滴 B.溴的四氯化碳溶液褪色 C.酸性高锰酸钾溶液褪色 D.右侧试管有无色油状液体生成
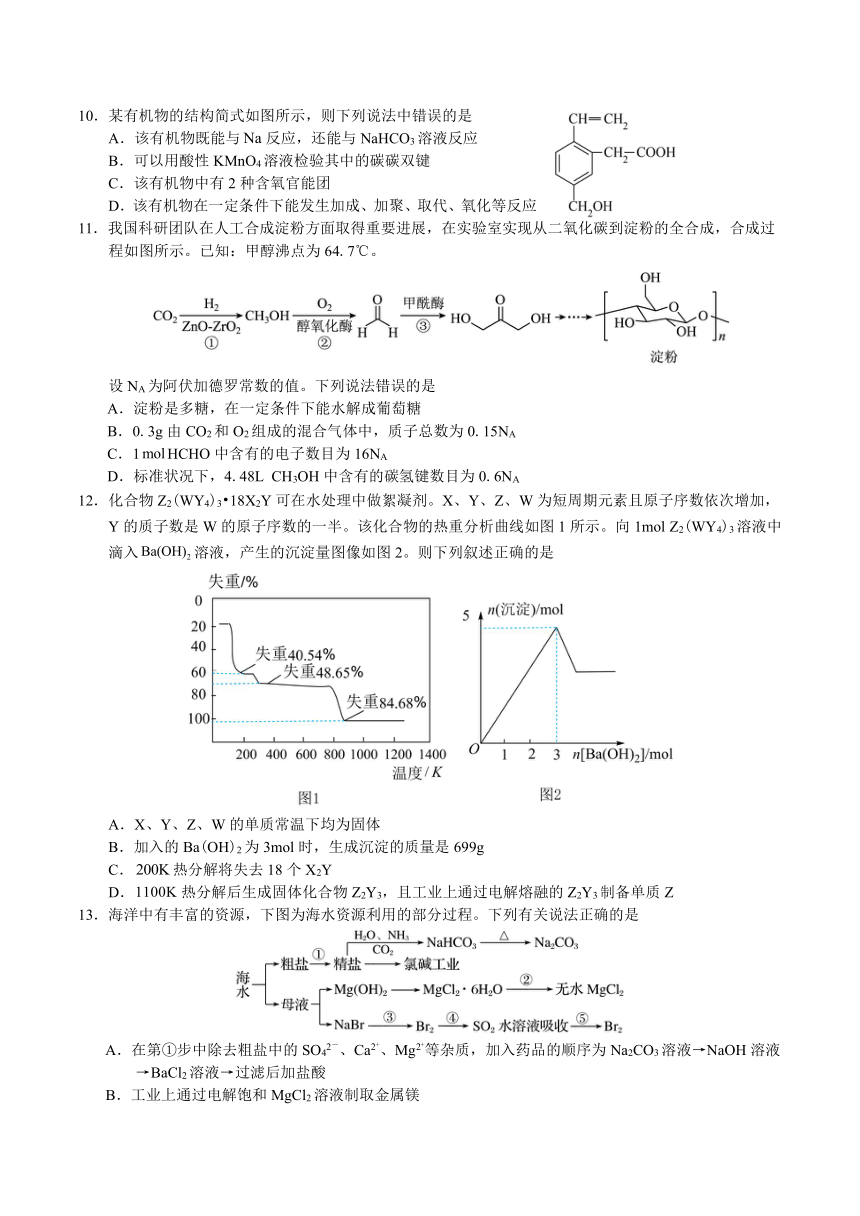
10.某有机物的结构简式如图所示,则下列说法中错误的是
A.该有机物既能与反应,还能与NaHCO3溶液反应
B.可以用酸性KMnO4溶液检验其中的碳碳双键
C.该有机物中有2种含氧官能团
D.该有机物在一定条件下能发生加成、加聚、取代、氧化等反应
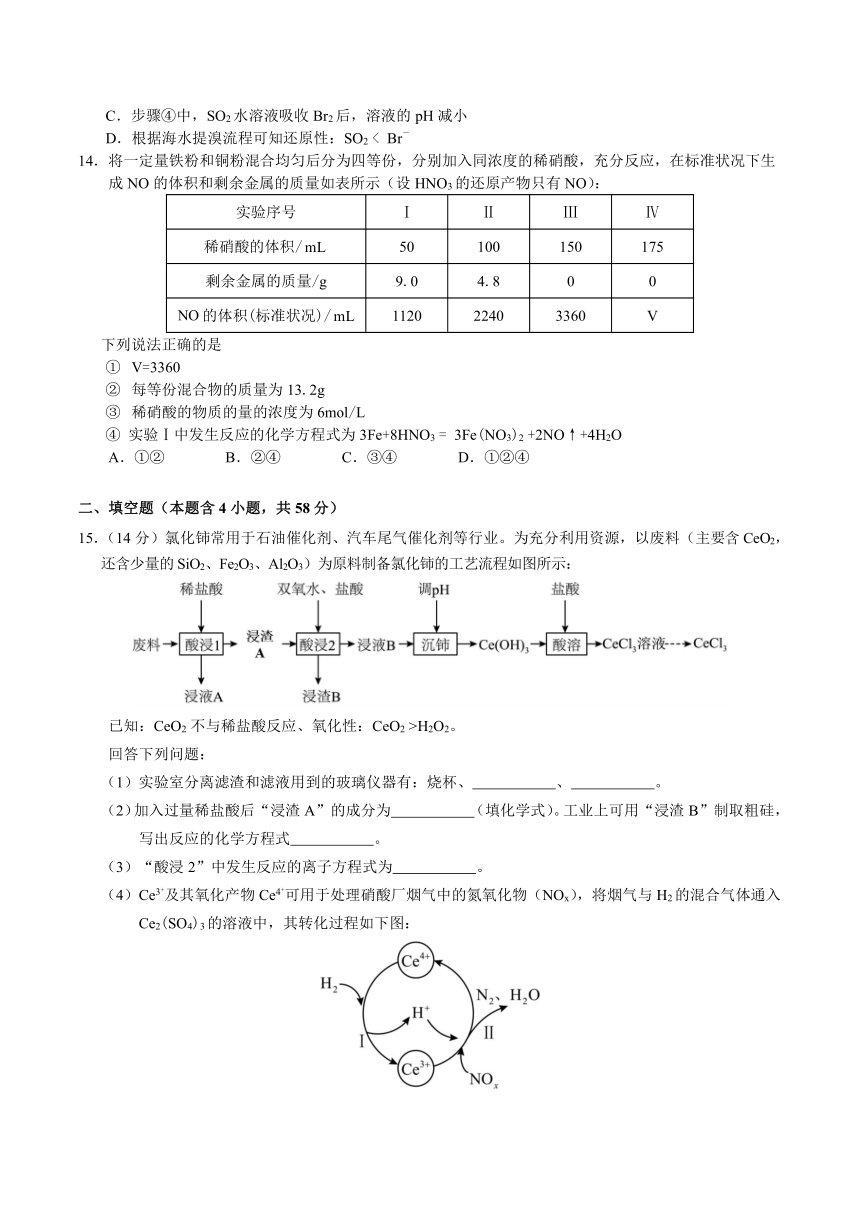
11.我国科研团队在人工合成淀粉方面取得重要进展,在实验室实现从二氧化碳到淀粉的全合成,合成过程如图所示。已知:甲醇沸点为64.7℃。
设NA为阿伏加德罗常数的值。下列说法错误的是
A.淀粉是多糖,在一定条件下能水解成葡萄糖
B.0.3g由CO2和O2组成的混合气体中,质子总数为0.15NA
C.1HCHO中含有的电子数目为16NA
D.标准状况下,4.48L CH3OH中含有的碳氢键数目为0.6NA
12.化合物Z2(WY4)3 18X2Y可在水处理中做絮凝剂。X、Y、Z、W为短周期元素且原子序数依次增加,Y的质子数是W的原子序数的一半。该化合物的热重分析曲线如图1所示。向1mol Z2(WY4)3溶液中滴入溶液,产生的沉淀量图像如图2。则下列叙述正确的是
A.X、Y、Z、W的单质常温下均为固体
B.加入的Ba(OH)2为3mol时,生成沉淀的质量是699g
C.热分解将失去18个X2Y
D.热分解后生成固体化合物Z2Y3,且工业上通过电解熔融的Z2Y3制备单质Z
13.海洋中有丰富的资源,下图为海水资源利用的部分过程。下列有关说法正确的是
A.在第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入药品的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.工业上通过电解饱和MgCl2溶液制取金属镁
C.步骤④中,SO2水溶液吸收Br2后,溶液的pH减小
D.根据海水提溴流程可知还原性:SO2 < Br-
14.将一定量铁粉和铜粉混合均匀后分为四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如表所示(设HNO3的还原产物只有NO):
实验序号 Ⅰ Ⅱ Ⅲ Ⅳ
稀硝酸的体积/ 50 100 150 175
剩余金属的质量/g 9.0 4.8 0 0
的体积(标准状况)/ 1120 2240 3360 V
下列说法正确的是
① V=3360
② 每等份混合物的质量为13.2g
③ 稀硝酸的物质的量的浓度为6mol/L
④ 实验Ⅰ中发生反应的化学方程式为3Fe+8HNO3 = 3Fe(NO3)2 +2NO↑+4H2O
A.①② B.②④ C.③④ D.①②④
二、填空题(本题含4小题,共58分)
15.(14分)氯化铈常用于石油催化剂、汽车尾气催化剂等行业。为充分利用资源,以废料(主要含CeO2,还含少量的SiO2、Fe2O3、Al2O3)为原料制备氯化铈的工艺流程如图所示:
已知:CeO2 不与稀盐酸反应、氧化性:CeO2 H2O2。
回答下列问题:
(1)实验室分离滤渣和滤液用到的玻璃仪器有:烧杯、 、 。
(2)加入过量稀盐酸后“浸渣A”的成分为 (填化学式)。工业上可用“浸渣B”制取粗硅,写出反应的化学方程式 。
(3)“酸浸2”中发生反应的离子方程式为 。
(4)Ce3+及其氧化产物Ce4+可用于处理硝酸厂烟气中的氮氧化物(NOx),将烟气与H2的混合气体通入Ce2(SO4)3的溶液中,其转化过程如下图:
该处理过程中可减少下列哪些环境问题的产生 (填序号)。
①酸雨 ②光化学烟雾 ③白色污染
(5)取a g CeO2,经铝热反应得到b g Ce,该铝热反应的化学方程式为 ,反应中铈的产率为 (用含a、b的代数式表示)。
16.(15分)在工业上为了减少燃煤产生的硫氧化物(主要是)对空气的污染,人们往往向燃煤中掺入一定量的生石灰,以达到脱硫效果。某研究小组在实验室设计如图装置来除去模拟烟气中的硫氧化物(SO2),并检验硫氧化物的去除效果。试回答下列问题:
注:该实验温度下CO2不与生石灰反应。
Ⅰ.利用装置A制备模拟烟气。
(1)装置A中发生反应的化学方程式为 。
(2)检查模拟烟气的气体,先通过盛有无水硫酸铜的球型干燥管检验水,再选用下图 装置进行检验模拟烟气中的CO2和SO2。
写出SO2与酸性KMnO4溶液反应的离子方程式 。
Ⅱ.吸收模拟烟气中的硫氧化物并检验硫氧化物的去除效果。
(3)按照气体由左向右流动,装置的连接顺序为A→ → → →D。
(4)可通过观察装置C中 (填现象),来调控通入反应气体的比例。
(5)装置E所装的药品为 (填名称),装置B中发生反应的化学方程式 。
(6)证明该实验中硫氧化物被完全去除的现象为 。
17.(15分)氮是一种地球上含量丰富的元素,氮及其化合物在生产、生活中起着重要的作用,试回答:
(1)工业合成氨的反应是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂1 mol相应化学键需要的能量如下:
化学键
能量 436 kJ 391 kJ 946 kJ
若反应生成2 mol NH3,可 (填“吸收”或“放出”)热量 kJ;实验室模拟工业合成氨,在容积为2 L的密闭容器内充入2 mol N2和4mol H2,10分钟时测得 NH3的浓度为1mol/L ,则0~10min内,用H2的浓度变化表示的化学反应速率为 , 此时N2的转化率为 。
(2)汽车尾气中含有的NO是造成城市空气污染的主要因素之一,通过NO传感器可监测汽车尾气中NO含量,其工作原理如图所示:
Pt电极为 (填“正极”或“负极”),NiO电极上发生的电极反应式为 。
(3)一种新型催化剂能使NO和CO发生反应。为探究温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如下三组实验。
实验编号 T(℃) NO初始浓度(mol/L) CO初始浓度(mol/L) 催化剂的比表面积(m2/g)
Ⅰ 280 82
Ⅱ 280 b 124
Ⅲ 350 a 82
① b = 。
② 设置Ⅰ、Ⅲ组的实验目的是 。
③ 恒温恒容条件下,能说明该反应已达到平衡状态的是 。
a.容器内的压强保持不变
b.容器内各气体的物质的量之比为2:2:2:1
c.V逆(CO2)=V正(NO)
d.容器内混合气体密度不再改变
18.(14分)化合物G(丙酸异丙酯)可用作食品香料。现可通过下列转化制取(部分反应条件略去):
(1)工业上,A可由石蜡油在催化剂加热条件下获得,该方法为 。
(2)写出B→C的化学方程式 ,该反应类型为 。
(3)A→E是加成反应,写出该反应的化学方程式 。
(4)D中官能团的名称为 ,写出D+F→G的化学方程式 。
(5)关于F的说法正确的是 。
a. F和B互为同系物
b. 1mol F与足量金属钠反应可产生11.2L气体(标准状况下)
c. F催化氧化可生成醛
d. 相同物质的量的A和F充分燃烧后,耗氧量相同
(6)写出满足下列条件的G的同分异构体 (写结构简式)。
①能与NaHCO3溶液反应放出CO2 ②有3种不同化学环境的氢
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A B C C A C A D B B D D C B
二、非选择题(共4小题,58分)
15.(14分,除标注外每空2分)
(1)漏斗(1分) 玻璃棒 (1分)
(2)SiO2、CeO2
(3)
(4) ①②
(5)
16.(15分,除标注外每空2分)
(1)
(2) 甲
(3) C→E→B
(4) 两导管产生气泡的速率
(5) 无水氯化钙/五氧化二磷(1分) 2CaO+2SO2+O2=2CaSO4
(6) D中品红溶液颜色不变浅
17.(15分,除标注外每空2分)
(1) 放出(1分) 92kJ 0.15 mol/(L·min) 50%
(2) 正(1分) NO-2e-+ O2-= NO2
(3) ①5.8×10-3 (1分) ②探究温度对化学反应速率的影响 ③ac
18.(14分,除标注外每空2分)
(1)(催化)裂解(填“热分解法”也给分)
(2) 2CH3CH2CH2OH+O2 2CH3CH2CHO+2H2O 氧化反应(1分)
(3) CH3CH=CH2+HBr CH3CHBrCH3
(4) 羧基(1分) CH3CH2COOH+CH3CH(OH)CH3 CH3CH2COOCH(CH3)2+H2O
(5) bd
(6) (CH3)3CCH2COOH
(考试时间:75分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Fe-56
Cu-64 Ba-137 Ce-140
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。)
1.下列说法正确的是
A.单质硅是将太阳能转化为电能的常用材料
B.医用酒精的浓度通常为95%
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
2.下列有关合理用药的说法正确的是
A.一次忘记服药,下次可以增加一倍剂量服用
B.非处方药的包装上印有“OTC”标识
C.长期服用阿司匹林可预防某些疾病,没有副作用
D.每日早、中、晚三次与每隔8小时一次,服药效果相同
3.下列不符合环境保护和绿色化学理念的是
A.用银作催化剂,乙烯和氧气反应制取环氧乙烷,原子利用率100%
B.400时,在催化剂作用下NH3 与NO反应生成N2和H2O
C.用铜和浓硝酸反应制取Cu(NO3)2
D.制CuSO4时,先将Cu氧化成CuO后再与稀硫酸反应
4.已知某化学反应A2(g)+2B2(g)=2AB2(g),反应过程中的能量变化如图所示,下列说法正确的是
A.该反应的进行一定需要加热
B.生成2molAB2(g),放出热量(E1-E2)kJ
C.1molA2(g)和2molB2(g)的总能量低于2molAB2(g)的能量
D.该反应断开化学键吸收的总能量小于形成化学键放出的总能量
5.图1是铜锌原电池示意图,图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示
A.c(H+) B.m(Cu电极) C.c(SO) D.c(Zn2+)
6.某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,
发生化学反应,在其他条件相同时,测得实验数据如下
表:
压强/(×105Pa) 温度/℃ NO达到所列转化率需要时间/s
50% 90% 98%
1.0 30 12 250 2830
90 25 510 5760
8.0 30 0.2 3.9 36
90 0.6 7.9 74
根据表中数据,下列说法正确的是
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.若进入反应塔的混合气体为amol,反应速率以v=Δn/Δt表示,则在8.0×105Pa、30℃
条件下转化率从50%增至90%时段NO的反应速率为mol/s
D.在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
7.某温度下,在2L恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。下列说法正确的是
A.该反应的化学方程式为X+3Y2Z
B.2min时,X的转化率为30%
C.2min时,以表示的反应速率为
D.2min后,正、逆反应均不再进行,体系中的物质的量均不再变化
8.新己烷是常见的燃料添加剂、有机溶剂,其结构简式如下图。下列关于该物质的说法错误的是
A.分子式为C6H14
B.可发生取代、氧化反应
C.新己烷的的同分异构体有4种
D.一氯代物有4种
9.下列实验现象因发生加成反应而产生的是
A.试管内壁上有油状 液滴 B.溴的四氯化碳溶液褪色 C.酸性高锰酸钾溶液褪色 D.右侧试管有无色油状液体生成
10.某有机物的结构简式如图所示,则下列说法中错误的是
A.该有机物既能与反应,还能与NaHCO3溶液反应
B.可以用酸性KMnO4溶液检验其中的碳碳双键
C.该有机物中有2种含氧官能团
D.该有机物在一定条件下能发生加成、加聚、取代、氧化等反应
11.我国科研团队在人工合成淀粉方面取得重要进展,在实验室实现从二氧化碳到淀粉的全合成,合成过程如图所示。已知:甲醇沸点为64.7℃。
设NA为阿伏加德罗常数的值。下列说法错误的是
A.淀粉是多糖,在一定条件下能水解成葡萄糖
B.0.3g由CO2和O2组成的混合气体中,质子总数为0.15NA
C.1HCHO中含有的电子数目为16NA
D.标准状况下,4.48L CH3OH中含有的碳氢键数目为0.6NA
12.化合物Z2(WY4)3 18X2Y可在水处理中做絮凝剂。X、Y、Z、W为短周期元素且原子序数依次增加,Y的质子数是W的原子序数的一半。该化合物的热重分析曲线如图1所示。向1mol Z2(WY4)3溶液中滴入溶液,产生的沉淀量图像如图2。则下列叙述正确的是
A.X、Y、Z、W的单质常温下均为固体
B.加入的Ba(OH)2为3mol时,生成沉淀的质量是699g
C.热分解将失去18个X2Y
D.热分解后生成固体化合物Z2Y3,且工业上通过电解熔融的Z2Y3制备单质Z
13.海洋中有丰富的资源,下图为海水资源利用的部分过程。下列有关说法正确的是
A.在第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入药品的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.工业上通过电解饱和MgCl2溶液制取金属镁
C.步骤④中,SO2水溶液吸收Br2后,溶液的pH减小
D.根据海水提溴流程可知还原性:SO2 < Br-
14.将一定量铁粉和铜粉混合均匀后分为四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如表所示(设HNO3的还原产物只有NO):
实验序号 Ⅰ Ⅱ Ⅲ Ⅳ
稀硝酸的体积/ 50 100 150 175
剩余金属的质量/g 9.0 4.8 0 0
的体积(标准状况)/ 1120 2240 3360 V
下列说法正确的是
① V=3360
② 每等份混合物的质量为13.2g
③ 稀硝酸的物质的量的浓度为6mol/L
④ 实验Ⅰ中发生反应的化学方程式为3Fe+8HNO3 = 3Fe(NO3)2 +2NO↑+4H2O
A.①② B.②④ C.③④ D.①②④
二、填空题(本题含4小题,共58分)
15.(14分)氯化铈常用于石油催化剂、汽车尾气催化剂等行业。为充分利用资源,以废料(主要含CeO2,还含少量的SiO2、Fe2O3、Al2O3)为原料制备氯化铈的工艺流程如图所示:
已知:CeO2 不与稀盐酸反应、氧化性:CeO2 H2O2。
回答下列问题:
(1)实验室分离滤渣和滤液用到的玻璃仪器有:烧杯、 、 。
(2)加入过量稀盐酸后“浸渣A”的成分为 (填化学式)。工业上可用“浸渣B”制取粗硅,写出反应的化学方程式 。
(3)“酸浸2”中发生反应的离子方程式为 。
(4)Ce3+及其氧化产物Ce4+可用于处理硝酸厂烟气中的氮氧化物(NOx),将烟气与H2的混合气体通入Ce2(SO4)3的溶液中,其转化过程如下图:
该处理过程中可减少下列哪些环境问题的产生 (填序号)。
①酸雨 ②光化学烟雾 ③白色污染
(5)取a g CeO2,经铝热反应得到b g Ce,该铝热反应的化学方程式为 ,反应中铈的产率为 (用含a、b的代数式表示)。
16.(15分)在工业上为了减少燃煤产生的硫氧化物(主要是)对空气的污染,人们往往向燃煤中掺入一定量的生石灰,以达到脱硫效果。某研究小组在实验室设计如图装置来除去模拟烟气中的硫氧化物(SO2),并检验硫氧化物的去除效果。试回答下列问题:
注:该实验温度下CO2不与生石灰反应。
Ⅰ.利用装置A制备模拟烟气。
(1)装置A中发生反应的化学方程式为 。
(2)检查模拟烟气的气体,先通过盛有无水硫酸铜的球型干燥管检验水,再选用下图 装置进行检验模拟烟气中的CO2和SO2。
写出SO2与酸性KMnO4溶液反应的离子方程式 。
Ⅱ.吸收模拟烟气中的硫氧化物并检验硫氧化物的去除效果。
(3)按照气体由左向右流动,装置的连接顺序为A→ → → →D。
(4)可通过观察装置C中 (填现象),来调控通入反应气体的比例。
(5)装置E所装的药品为 (填名称),装置B中发生反应的化学方程式 。
(6)证明该实验中硫氧化物被完全去除的现象为 。
17.(15分)氮是一种地球上含量丰富的元素,氮及其化合物在生产、生活中起着重要的作用,试回答:
(1)工业合成氨的反应是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂1 mol相应化学键需要的能量如下:
化学键
能量 436 kJ 391 kJ 946 kJ
若反应生成2 mol NH3,可 (填“吸收”或“放出”)热量 kJ;实验室模拟工业合成氨,在容积为2 L的密闭容器内充入2 mol N2和4mol H2,10分钟时测得 NH3的浓度为1mol/L ,则0~10min内,用H2的浓度变化表示的化学反应速率为 , 此时N2的转化率为 。
(2)汽车尾气中含有的NO是造成城市空气污染的主要因素之一,通过NO传感器可监测汽车尾气中NO含量,其工作原理如图所示:
Pt电极为 (填“正极”或“负极”),NiO电极上发生的电极反应式为 。
(3)一种新型催化剂能使NO和CO发生反应。为探究温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如下三组实验。
实验编号 T(℃) NO初始浓度(mol/L) CO初始浓度(mol/L) 催化剂的比表面积(m2/g)
Ⅰ 280 82
Ⅱ 280 b 124
Ⅲ 350 a 82
① b = 。
② 设置Ⅰ、Ⅲ组的实验目的是 。
③ 恒温恒容条件下,能说明该反应已达到平衡状态的是 。
a.容器内的压强保持不变
b.容器内各气体的物质的量之比为2:2:2:1
c.V逆(CO2)=V正(NO)
d.容器内混合气体密度不再改变
18.(14分)化合物G(丙酸异丙酯)可用作食品香料。现可通过下列转化制取(部分反应条件略去):
(1)工业上,A可由石蜡油在催化剂加热条件下获得,该方法为 。
(2)写出B→C的化学方程式 ,该反应类型为 。
(3)A→E是加成反应,写出该反应的化学方程式 。
(4)D中官能团的名称为 ,写出D+F→G的化学方程式 。
(5)关于F的说法正确的是 。
a. F和B互为同系物
b. 1mol F与足量金属钠反应可产生11.2L气体(标准状况下)
c. F催化氧化可生成醛
d. 相同物质的量的A和F充分燃烧后,耗氧量相同
(6)写出满足下列条件的G的同分异构体 (写结构简式)。
①能与NaHCO3溶液反应放出CO2 ②有3种不同化学环境的氢
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A B C C A C A D B B D D C B
二、非选择题(共4小题,58分)
15.(14分,除标注外每空2分)
(1)漏斗(1分) 玻璃棒 (1分)
(2)SiO2、CeO2
(3)
(4) ①②
(5)
16.(15分,除标注外每空2分)
(1)
(2) 甲
(3) C→E→B
(4) 两导管产生气泡的速率
(5) 无水氯化钙/五氧化二磷(1分) 2CaO+2SO2+O2=2CaSO4
(6) D中品红溶液颜色不变浅
17.(15分,除标注外每空2分)
(1) 放出(1分) 92kJ 0.15 mol/(L·min) 50%
(2) 正(1分) NO-2e-+ O2-= NO2
(3) ①5.8×10-3 (1分) ②探究温度对化学反应速率的影响 ③ac
18.(14分,除标注外每空2分)
(1)(催化)裂解(填“热分解法”也给分)
(2) 2CH3CH2CH2OH+O2 2CH3CH2CHO+2H2O 氧化反应(1分)
(3) CH3CH=CH2+HBr CH3CHBrCH3
(4) 羧基(1分) CH3CH2COOH+CH3CH(OH)CH3 CH3CH2COOCH(CH3)2+H2O
(5) bd
(6) (CH3)3CCH2COOH
同课章节目录
