【高二】【化学】2025【秋】开学第一课之爱上化学课【课件45张】
文档属性
| 名称 | 【高二】【化学】2025【秋】开学第一课之爱上化学课【课件45张】 |
|
|
| 格式 | pptx | ||
| 文件大小 | 14.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-10 00:00:00 | ||
图片预览







文档简介
(共45张PPT)
蜕变高一
绽放高二
收拾心情 整装待发
你都干了啥
收拾心情 整装待发
旅游
学
钓鱼
游戏
收拾心情 整装待发
醒醒吧
我们高二了
序言
高一
物质的量
高二
选必修一
经历过必修一物质的量摧残后,我们即将迎来新的挑战——化学反应原理。
收拾心情 整装待发
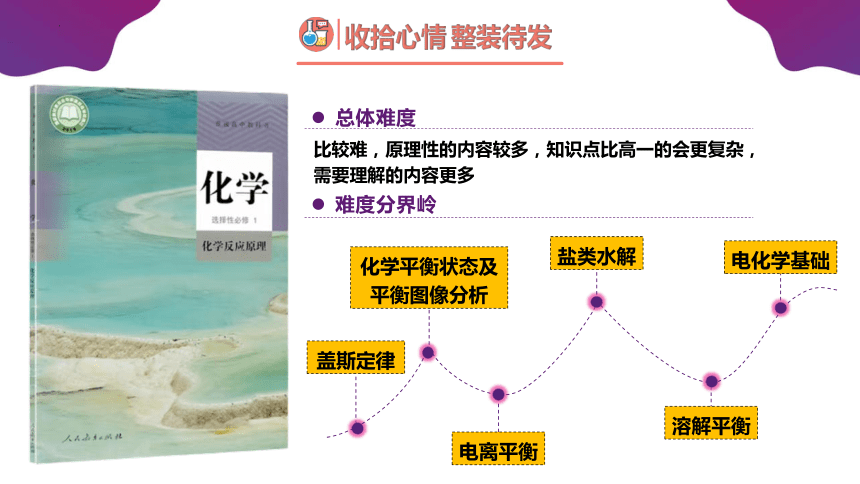
收拾心情 整装待发
比较难,原理性的内容较多,知识点比高一的会更复杂,需要理解的内容更多
总体难度
难度分界岭
化学平衡状态及平衡图像分析
盖斯定律
溶解平衡
电化学基础
盐类水解
电离平衡
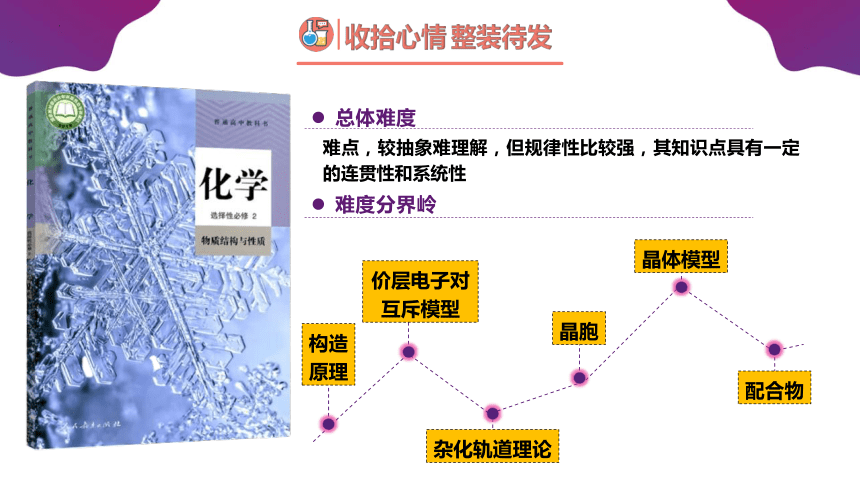
收拾心情 整装待发
难点,较抽象难理解,但规律性比较强,其知识点具有一定的连贯性和系统性
总体难度
难度分界岭
构造
原理
价层电子对互斥模型
杂化轨道理论
晶胞
晶体模型
配合物
收拾心情 整装待发
总体难度
难度分界岭
有机化学入门最难,其规律性更强,一旦摸准了规律,学起来还是比无机轻松些的,有机化学里物质多、结构比较复杂,学时要按照体系来,烷烃,烯烃,卤代烃,醇和酚,醛和酮,羧酸,酯,记住它们的结构和官能团的特性,记住结构决定性质,一半的有机就已经可以掌握了
烃
同分异构
卤代烃
等效氢
醇和酚
波普分析
醛和酮
羧酸
酯
高聚物
实验
复习周期:课后复习、单元复习、章节复习
复习方法:复述、默写、找联系
多记忆:基本概念和原理,化学方程式以及其他知识
通览课本;
课前预习:精读新课内容,标记不懂, 做课本上的练习;
带着疑问、难点,听课
课本为主线, 吃透课本;
课前预读、 课后细读、经常选读(边读边思考)
认真、 细致地观察老师的演示实验, 对实验所用的仪器、药品、装置以及实验原理、步骤、现象和注意事项,都必须弄清、记熟
学习建议
预习标记
复习记忆
吃透课本
重视实验
艾宾浩斯遗忘曲线
学习建议
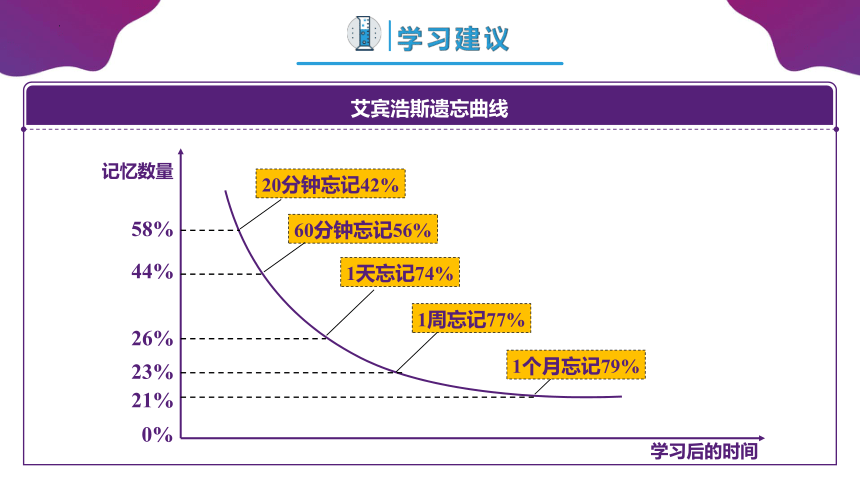
0%
21%
23%
26%
44%
58%
记忆数量
20分钟忘记42%
60分钟忘记56%
1天忘记74%
学习后的时间
1周忘记77%
1个月忘记79%
一切由
开始
从
实现
第一节 反应热
第1课时
化学反应的热效应
第一章
新课第一课时
从宏观和微观两个视角认识反应热
2
反应热的概念及中和反应反应热的测定原理
1
本节重点
本节难点
木炭在空气里燃烧
木炭在氧气里燃烧
木炭在液氧里燃烧
化学反应中的能量变化是以物质变化为基础的,能量变化的多少与参加反应的物质种类和多少密切相关。与研究化学反应中的物质变化一样,研究化学反应中的能量变化同样具有重要意义。
那么,如何定量描述化学反应中释放或者吸收的热量呢?
体系(系统)
反应热及其测定
研究反应热时,需要明确体系和环境
示例:盐酸与NaOH溶液的反应
试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系
被研究的物质系统
环境
盛溶液的试管和溶液之外的空气等看作环境
因温度不同而在体系与环境之间交换或传递的能量
热量
与体系相互影响的其他部分
一些说明
反应热及其测定
化学反应的热效应(反应热)
热量
化学反应的热效应
(反应热)
反应前后体系的温度相等
体系
环境
一些说明
等温条件下,化学反应体系向环境释放或从环境吸收的热量
反应热及其测定
许多反应热可以通过量热计直接测定
一些说明
反应热的测定工具
例如,盐酸与NaOH溶液反应的过程中会放出热量,导致体系与环境之间的温度产生差异。
在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热
c:比热容
m:体系的质量
t1、t2:反应前和反应后体系的温度
Q:放出的热量
Q = c · m ·(t2-t1)
反应热的计算公式
为了保证HCl被完全中和
中和反应反应热的测定
实验探究
反应热及其测定
实验测量
用量筒量取50 mL 0.50 mol/L盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
步骤一
用另一个量筒量取50 mL 0.55 mol/L NaOH溶液①,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
步骤二
测量项目一 反应物温度的
中和反应反应热的测定
实验探究
反应热及其测定
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
步骤三
步骤四
重复上述步骤( 1)至步骤(2)两次。
测量项目二 反应后体系温度
实验测量
目的是减少误差
中和反应反应热的测定
实验探究
反应热及其测定
数据处理
取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度( t1)。计算温度差( t2-t1),将数据填入下表。
实验次数 反应物的温度/℃ 反应前体系的温度/℃ 反应后体系的温度/℃ 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ ( t2-t1)/℃
1
2
3
中和反应反应热的测定
实验探究
反应热及其测定
数据处理
为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:
① 50 mL 0.50 mol/L 盐酸的质量 m1=50 g, 50 mL 0.55 mol/L NaOH 溶液的质量m2=50 g;
②反应后生成的溶液的比热容c=4.18 J/(g· ℃ ), 50 mL 0.50 mol/L盐酸与 50 mL 0.55 mol/L NaOH溶液发生中和反应时放出的热量为:(m1+m2)· c· (t2-t1)=_________________
③生成1 mol H2O时放出的热量为______________。
取三次测量所得温度差的平均值作为计算依据。
根据温度差和比热容等计算反应热。
多次计算求平均值以减小实验误差
中和反应反应热的测定
实验探究
反应热及其测定
注意事项
01
准确测量酸、碱溶液的初始温度及反应后溶液的最高温度。酸、碱溶液应当用稀溶液,且配好后要充分冷却至室温才能使用
02
该实验中只用一个温度计,每次测量完温度后,必须用水洗净并用滤纸擦干后再使用
03
在测量反应混合液的温度时要随时读取温度值,并记录最高温度值。
在上述过程中,提高测定反应热准确度的措施有哪些?
A
使用比较精确的温度计读出温度变化
B
需要保温装置,保证反应过程中,不与外界发生热交换
C
搅拌器搅拌,保证溶液温度均匀
D
……
中和反应反应热的测定
实验探究
反应热及其测定
实验测量
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
中和反应反应热
中和反应反应热是反应热的一种!!!
【例1】为了测定酸碱反应的中和热,计算时至少需要的数据是( )
①酸溶液的浓度和体积
②碱溶液的浓度和体积
③比热容
④反应后溶液的质量(单位:kg)
⑤生成水的物质的量
⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥ B.①③④⑤
C.③④⑤⑥ D.全部
C
化学反应为什么会产生反应热?
体系
内能改变
产生
反应热
内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响
在科学研究和生产实践中,化学反应通常是在等压条件下进行的。为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为 H)。
化学反应为什么会产生反应热?
等压
体系
内能改变
产生
反应热
反应热
(焓变)
研究表明,等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,用符号ΔH表示
化学反应中焓的变化
宏观分析
反应物具有的总能量高
生成物具有的总能量低
化学
反应
向环境
释放能量
放热反应
∑H (反应物)> ∑H(生成物)
根据规定,当反应体系放热时其焓减小,Δ H为负值,即Δ H< 0
图示
H < 0
当反应体系吸热时其焓增大,Δ H为正值,即Δ H>0
化学反应中焓的变化
宏观分析
生成物具有的总能量高
反应物具有的总能量低
化学
反应
从环境
吸收能量
吸热反应
∑H (反应物) < ∑H(生成物)
图示
H > 0
化学反应为什么会产生反应热?
等压
体系
内能改变
产生
反应热
反应热
(焓变)
研究表明,等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,用符号ΔH表示
H= H生成物- H反应物
单位: kJ/mol 或 kJ mol-1
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
436 kJ/mol
键能:25 ℃和101 kPa下,断开1 mol 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
度来讨论反应热的实质
图示
焓(H)
H2= 436 kJ/mol
H2(g)
2H(g)
H1=+436 kJ/mol
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
度来讨论反应热的实质
H2(g) + Cl2(g) 2HCl(g) H=?
释放431 kJ/mol×2 mol=862 kJ
H= 183 kJ/mol
吸收436 kJ + 243 kJ=679 kJ
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
度来讨论反应热的实质
图示
吸收能量679 kJ
释放能量862 kJ
反应热
H= 183 kJ/mol
化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
实验测得与理论分析的数据接近,说明了什么?
H= 183 kJ/mol
键能估算
实验测得
H= 184.6 kJ/mol
H2(g) + Cl2(g) 2HCl(g) H=?
实验测得与理论分析的数据
化学反应中焓的变化
焓变估算
反应物
生成物
化学反应
键断裂
键生成
原子重新组合
吸收能量
放出能量
吸收能量 > 释放能量 吸热反应
吸收能量 < 释放能量 放热反应
H(估算)=∑E (反应物键能)-∑E (生成物键能)
【例1】依据信息估算2 mol H2(g) 和1 mol O2(g) 反应生成2 mol H2O(g) 的反应热 H=?
H(估算)= ∑E (反应物键能)-∑E (生成物键能)
=2×436 kJ/mol+498 kJ/mol-4×463.4 kJ/mol
= 483.6 kJ/mol
2H2(g) + O2(g) 2H2O(g) H=?
2H2
O2
4H
2O
2H2O
1 mol H2(g)中的H-H键断裂吸收436 kJ能量
1 mol O2(g)中的化学键断裂吸收498 kJ能量
形成H2O(g)中1 mol H-O键释放463.4 kJ能量
基元反应、过渡态理论及活化能
基元反应
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,往往要经过多个反应步骤才能实现。每一步反应都称为基元反应。
过渡态理论
过渡态理论认为,反应物分子并不只是通过简单碰撞直接形成产物,而是必须要经过一个过渡状态,并且达到这个过渡状态需要一定的活化能。
1.下列说法正确的是( )
A.吸热反应使环境的温度升高
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为负值
D.需要加热才能发生的反应一定是吸热反应
C
2.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A.该反应每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B放出a kJ能量
B
3.SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)===SF6(g)的反应热ΔH为( )
A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.+430 kJ·mol-1
B
4.将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
B
5.下表是部分化学键的键能数据:
(1)已知1 mol白磷燃烧生成P4O10(s)的反应热ΔH=-2 982 kJ·mol-1,白磷(P4)、P4O6、P4O10结构如图所示,则上表中x=________。
(2)0.5 mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为________ kJ。
化学键 P—P P—O O==O P==O
键能/(kJ·mol-1) 198 360 498 x
585
819
大鹿化学工作室
THANKS
谢谢聆听
蜕变高一
绽放高二
收拾心情 整装待发
你都干了啥
收拾心情 整装待发
旅游
学
钓鱼
游戏
收拾心情 整装待发
醒醒吧
我们高二了
序言
高一
物质的量
高二
选必修一
经历过必修一物质的量摧残后,我们即将迎来新的挑战——化学反应原理。
收拾心情 整装待发
收拾心情 整装待发
比较难,原理性的内容较多,知识点比高一的会更复杂,需要理解的内容更多
总体难度
难度分界岭
化学平衡状态及平衡图像分析
盖斯定律
溶解平衡
电化学基础
盐类水解
电离平衡
收拾心情 整装待发
难点,较抽象难理解,但规律性比较强,其知识点具有一定的连贯性和系统性
总体难度
难度分界岭
构造
原理
价层电子对互斥模型
杂化轨道理论
晶胞
晶体模型
配合物
收拾心情 整装待发
总体难度
难度分界岭
有机化学入门最难,其规律性更强,一旦摸准了规律,学起来还是比无机轻松些的,有机化学里物质多、结构比较复杂,学时要按照体系来,烷烃,烯烃,卤代烃,醇和酚,醛和酮,羧酸,酯,记住它们的结构和官能团的特性,记住结构决定性质,一半的有机就已经可以掌握了
烃
同分异构
卤代烃
等效氢
醇和酚
波普分析
醛和酮
羧酸
酯
高聚物
实验
复习周期:课后复习、单元复习、章节复习
复习方法:复述、默写、找联系
多记忆:基本概念和原理,化学方程式以及其他知识
通览课本;
课前预习:精读新课内容,标记不懂, 做课本上的练习;
带着疑问、难点,听课
课本为主线, 吃透课本;
课前预读、 课后细读、经常选读(边读边思考)
认真、 细致地观察老师的演示实验, 对实验所用的仪器、药品、装置以及实验原理、步骤、现象和注意事项,都必须弄清、记熟
学习建议
预习标记
复习记忆
吃透课本
重视实验
艾宾浩斯遗忘曲线
学习建议
0%
21%
23%
26%
44%
58%
记忆数量
20分钟忘记42%
60分钟忘记56%
1天忘记74%
学习后的时间
1周忘记77%
1个月忘记79%
一切由
开始
从
实现
第一节 反应热
第1课时
化学反应的热效应
第一章
新课第一课时
从宏观和微观两个视角认识反应热
2
反应热的概念及中和反应反应热的测定原理
1
本节重点
本节难点
木炭在空气里燃烧
木炭在氧气里燃烧
木炭在液氧里燃烧
化学反应中的能量变化是以物质变化为基础的,能量变化的多少与参加反应的物质种类和多少密切相关。与研究化学反应中的物质变化一样,研究化学反应中的能量变化同样具有重要意义。
那么,如何定量描述化学反应中释放或者吸收的热量呢?
体系(系统)
反应热及其测定
研究反应热时,需要明确体系和环境
示例:盐酸与NaOH溶液的反应
试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系
被研究的物质系统
环境
盛溶液的试管和溶液之外的空气等看作环境
因温度不同而在体系与环境之间交换或传递的能量
热量
与体系相互影响的其他部分
一些说明
反应热及其测定
化学反应的热效应(反应热)
热量
化学反应的热效应
(反应热)
反应前后体系的温度相等
体系
环境
一些说明
等温条件下,化学反应体系向环境释放或从环境吸收的热量
反应热及其测定
许多反应热可以通过量热计直接测定
一些说明
反应热的测定工具
例如,盐酸与NaOH溶液反应的过程中会放出热量,导致体系与环境之间的温度产生差异。
在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热
c:比热容
m:体系的质量
t1、t2:反应前和反应后体系的温度
Q:放出的热量
Q = c · m ·(t2-t1)
反应热的计算公式
为了保证HCl被完全中和
中和反应反应热的测定
实验探究
反应热及其测定
实验测量
用量筒量取50 mL 0.50 mol/L盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
步骤一
用另一个量筒量取50 mL 0.55 mol/L NaOH溶液①,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
步骤二
测量项目一 反应物温度的
中和反应反应热的测定
实验探究
反应热及其测定
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
步骤三
步骤四
重复上述步骤( 1)至步骤(2)两次。
测量项目二 反应后体系温度
实验测量
目的是减少误差
中和反应反应热的测定
实验探究
反应热及其测定
数据处理
取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度( t1)。计算温度差( t2-t1),将数据填入下表。
实验次数 反应物的温度/℃ 反应前体系的温度/℃ 反应后体系的温度/℃ 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ ( t2-t1)/℃
1
2
3
中和反应反应热的测定
实验探究
反应热及其测定
数据处理
为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:
① 50 mL 0.50 mol/L 盐酸的质量 m1=50 g, 50 mL 0.55 mol/L NaOH 溶液的质量m2=50 g;
②反应后生成的溶液的比热容c=4.18 J/(g· ℃ ), 50 mL 0.50 mol/L盐酸与 50 mL 0.55 mol/L NaOH溶液发生中和反应时放出的热量为:(m1+m2)· c· (t2-t1)=_________________
③生成1 mol H2O时放出的热量为______________。
取三次测量所得温度差的平均值作为计算依据。
根据温度差和比热容等计算反应热。
多次计算求平均值以减小实验误差
中和反应反应热的测定
实验探究
反应热及其测定
注意事项
01
准确测量酸、碱溶液的初始温度及反应后溶液的最高温度。酸、碱溶液应当用稀溶液,且配好后要充分冷却至室温才能使用
02
该实验中只用一个温度计,每次测量完温度后,必须用水洗净并用滤纸擦干后再使用
03
在测量反应混合液的温度时要随时读取温度值,并记录最高温度值。
在上述过程中,提高测定反应热准确度的措施有哪些?
A
使用比较精确的温度计读出温度变化
B
需要保温装置,保证反应过程中,不与外界发生热交换
C
搅拌器搅拌,保证溶液温度均匀
D
……
中和反应反应热的测定
实验探究
反应热及其测定
实验测量
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
中和反应反应热
中和反应反应热是反应热的一种!!!
【例1】为了测定酸碱反应的中和热,计算时至少需要的数据是( )
①酸溶液的浓度和体积
②碱溶液的浓度和体积
③比热容
④反应后溶液的质量(单位:kg)
⑤生成水的物质的量
⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥ B.①③④⑤
C.③④⑤⑥ D.全部
C
化学反应为什么会产生反应热?
体系
内能改变
产生
反应热
内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响
在科学研究和生产实践中,化学反应通常是在等压条件下进行的。为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为 H)。
化学反应为什么会产生反应热?
等压
体系
内能改变
产生
反应热
反应热
(焓变)
研究表明,等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,用符号ΔH表示
化学反应中焓的变化
宏观分析
反应物具有的总能量高
生成物具有的总能量低
化学
反应
向环境
释放能量
放热反应
∑H (反应物)> ∑H(生成物)
根据规定,当反应体系放热时其焓减小,Δ H为负值,即Δ H< 0
图示
H < 0
当反应体系吸热时其焓增大,Δ H为正值,即Δ H>0
化学反应中焓的变化
宏观分析
生成物具有的总能量高
反应物具有的总能量低
化学
反应
从环境
吸收能量
吸热反应
∑H (反应物) < ∑H(生成物)
图示
H > 0
化学反应为什么会产生反应热?
等压
体系
内能改变
产生
反应热
反应热
(焓变)
研究表明,等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,用符号ΔH表示
H= H生成物- H反应物
单位: kJ/mol 或 kJ mol-1
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
436 kJ/mol
键能:25 ℃和101 kPa下,断开1 mol 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
度来讨论反应热的实质
图示
焓(H)
H2= 436 kJ/mol
H2(g)
2H(g)
H1=+436 kJ/mol
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
度来讨论反应热的实质
H2(g) + Cl2(g) 2HCl(g) H=?
释放431 kJ/mol×2 mol=862 kJ
H= 183 kJ/mol
吸收436 kJ + 243 kJ=679 kJ
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
度来讨论反应热的实质
图示
吸收能量679 kJ
释放能量862 kJ
反应热
H= 183 kJ/mol
化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
实验测得与理论分析的数据接近,说明了什么?
H= 183 kJ/mol
键能估算
实验测得
H= 184.6 kJ/mol
H2(g) + Cl2(g) 2HCl(g) H=?
实验测得与理论分析的数据
化学反应中焓的变化
焓变估算
反应物
生成物
化学反应
键断裂
键生成
原子重新组合
吸收能量
放出能量
吸收能量 > 释放能量 吸热反应
吸收能量 < 释放能量 放热反应
H(估算)=∑E (反应物键能)-∑E (生成物键能)
【例1】依据信息估算2 mol H2(g) 和1 mol O2(g) 反应生成2 mol H2O(g) 的反应热 H=?
H(估算)= ∑E (反应物键能)-∑E (生成物键能)
=2×436 kJ/mol+498 kJ/mol-4×463.4 kJ/mol
= 483.6 kJ/mol
2H2(g) + O2(g) 2H2O(g) H=?
2H2
O2
4H
2O
2H2O
1 mol H2(g)中的H-H键断裂吸收436 kJ能量
1 mol O2(g)中的化学键断裂吸收498 kJ能量
形成H2O(g)中1 mol H-O键释放463.4 kJ能量
基元反应、过渡态理论及活化能
基元反应
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,往往要经过多个反应步骤才能实现。每一步反应都称为基元反应。
过渡态理论
过渡态理论认为,反应物分子并不只是通过简单碰撞直接形成产物,而是必须要经过一个过渡状态,并且达到这个过渡状态需要一定的活化能。
1.下列说法正确的是( )
A.吸热反应使环境的温度升高
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为负值
D.需要加热才能发生的反应一定是吸热反应
C
2.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A.该反应每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B放出a kJ能量
B
3.SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)===SF6(g)的反应热ΔH为( )
A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.+430 kJ·mol-1
B
4.将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
B
5.下表是部分化学键的键能数据:
(1)已知1 mol白磷燃烧生成P4O10(s)的反应热ΔH=-2 982 kJ·mol-1,白磷(P4)、P4O6、P4O10结构如图所示,则上表中x=________。
(2)0.5 mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为________ kJ。
化学键 P—P P—O O==O P==O
键能/(kJ·mol-1) 198 360 498 x
585
819
大鹿化学工作室
THANKS
谢谢聆听
同课章节目录
