辽宁省鞍山市2024-2025学年高一下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 辽宁省鞍山市2024-2025学年高一下学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 925.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:21:32 | ||
图片预览


文档简介
辽宁省鞍山市2024-2025学年高一下学期期末考试 化学试卷
一、单选题
1.化学与生活密切相关,下列能量主要转化形式描述错误的是
天然气烧开水 烟花的燃放
A.化学能转化为热能 B.化学能转化为光能和热能
电磁炉炒菜 风力发电
C.电能转化为化学能 D.风能转化为电能
A.A B.B C.C D.D
2.“绿水青山就是金山银山”,化学与环境密切相关。下列说法正确的是
A.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,这些颗粒分散在空气中都会形成胶体
B.元素C、N、S的氧化物会使雨水的,我们把的雨水称之为酸雨
C.为了减少煤燃烧废气中的含量,可以在燃煤中加入适量的石灰石
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
3.营养物质是维持人类生命活动的必备物质,下列关于营养物质说法错误的是
A.油脂分为植物油脂和动物油脂,它们在室温下呈现不同形态,是首要的供能物质
B.淀粉是混合物,属于糖类,在人体内经过转化形成葡萄糖,为人体组织提供能量
C.人体中维生素种类繁多,大多依靠从食物中获取,对人类健康有至关重要的作用
D.蛋白质是构成细胞的基本物质,是人类必需的营养物质
4.与一定浓度的反应,生成、、、和水,当和的物质的量之比为时,则反应中起酸性作用的与被还原的的物质的量之比为
A. B. C. D.
5.CuS与浓硫酸共热,生成有刺激性气味的气体:,下列说法正确的是(已知CuS不溶于稀硫酸)
A.该反应的变价元素有2种
B.浓硫酸中硫元素全部降价,体现了氧化性
C.每转移6mol电子,则产生标准状况下89.6L的SO2
D.192g的CuS与4mol浓硫酸充分反应,生成的CuSO4为1mol
6.水煤气变换反应是放热反应,在双功能催化剂(能吸附不同粒子)催化下的反应过程示意 图如下下列说法正确的是
A.过 程I 中有非极性共价键断裂
B.过程Ⅱ和过程Ⅲ均为放热过程
C.该反应的化学方程式为CO+ H2O=CO2+H2
D.该反应中反应物的总能量小于生成物总能量
7.在反应中,下列表示该反应速率最快的是
A. B.
C. D.
8.往一容积为2L的恒容密闭容器中通入2molCO2和6molH2,一定温度下发生反应:,下列达到化学平衡状态时的是
A.容器内气体压强不再发生改变 B.正、逆反应速率相等且均为零
C.气体密度不再发生改变 D.
9.下列关于烷烃的说法不正确的是
A.烷烃的分子式可用通式表示
B.戊烷存在三种同分异构体
C.中三个碳原子处于一条直线上
D.与互为同系物
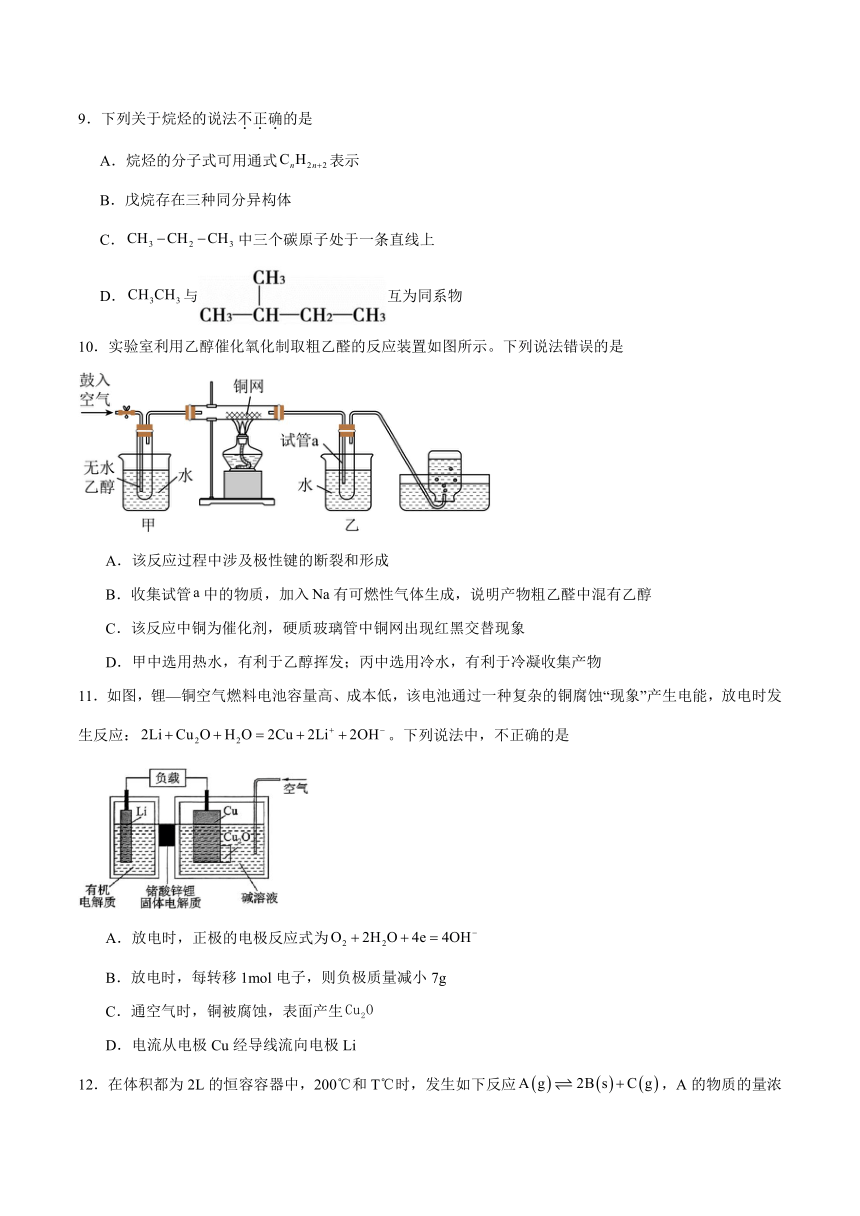
10.实验室利用乙醇催化氧化制取粗乙醛的反应装置如图所示。下列说法错误的是
A.该反应过程中涉及极性键的断裂和形成
B.收集试管中的物质,加入有可燃性气体生成,说明产物粗乙醛中混有乙醇
C.该反应中铜为催化剂,硬质玻璃管中铜网出现红黑交替现象
D.甲中选用热水,有利于乙醇挥发;丙中选用冷水,有利于冷凝收集产物
11.如图,锂—铜空气燃料电池容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电能,放电时发生反应:。下列说法中,不正确的是
A.放电时,正极的电极反应式为
B.放电时,每转移1mol电子,则负极质量减小7g
C.通空气时,铜被腐蚀,表面产生
D.电流从电极Cu经导线流向电极Li
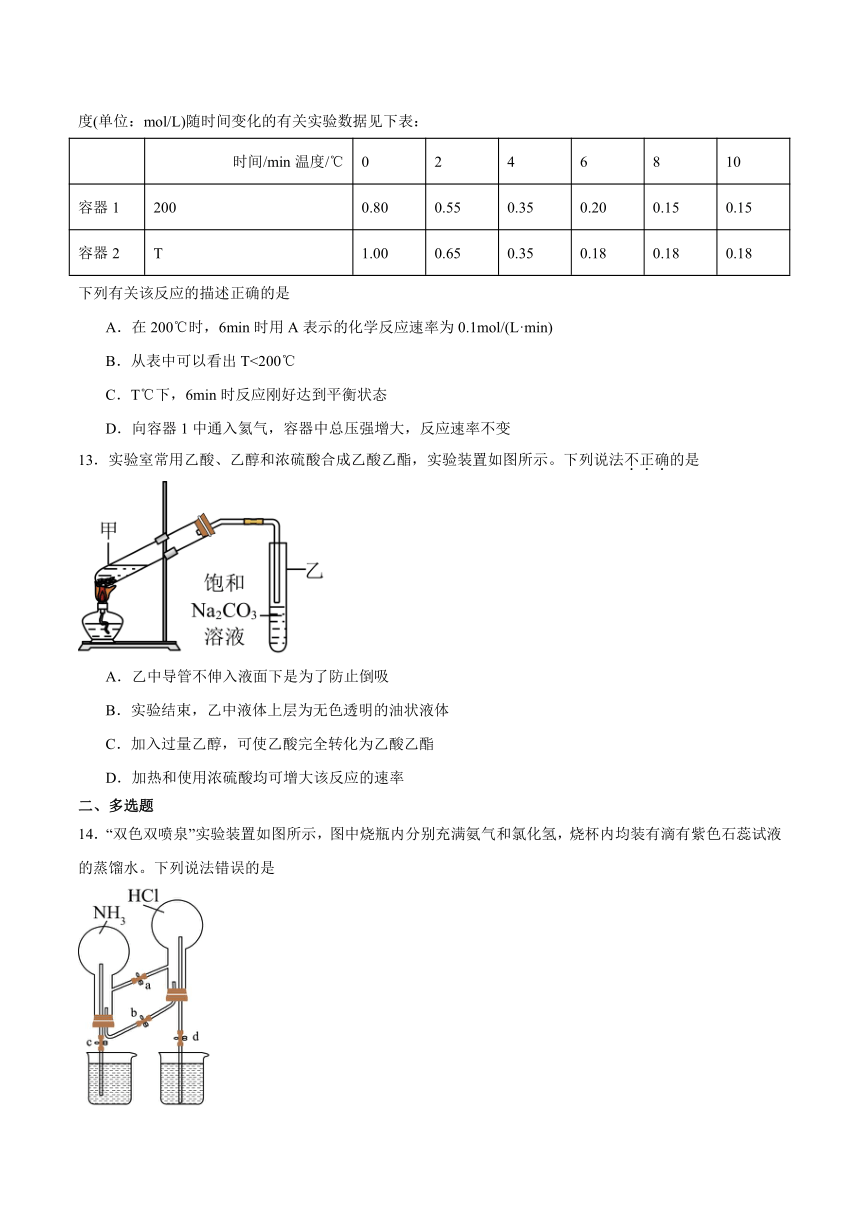
12.在体积都为2L的恒容容器中,200℃和T℃时,发生如下反应,A的物质的量浓度(单位:mol/L)随时间变化的有关实验数据见下表:
时间/min温度/℃ 0 2 4 6 8 10
容器1 200 0.80 0.55 0.35 0.20 0.15 0.15
容器2 T 1.00 0.65 0.35 0.18 0.18 0.18
下列有关该反应的描述正确的是
A.在200℃时,6min时用A表示的化学反应速率为0.1mol/(L·min)
B.从表中可以看出T<200℃
C.T℃下,6min时反应刚好达到平衡状态
D.向容器1中通入氦气,容器中总压强增大,反应速率不变
13.实验室常用乙酸、乙醇和浓硫酸合成乙酸乙酯,实验装置如图所示。下列说法不正确的是
A.乙中导管不伸入液面下是为了防止倒吸
B.实验结束,乙中液体上层为无色透明的油状液体
C.加入过量乙醇,可使乙酸完全转化为乙酸乙酯
D.加热和使用浓硫酸均可增大该反应的速率
二、多选题
14.“双色双喷泉”实验装置如图所示,图中烧瓶内分别充满氨气和氯化氢,烧杯内均装有滴有紫色石蕊试液的蒸馏水。下列说法错误的是
A.在实验室中,不能通过直接加热氯化铵来制备氨气
B.在实验室中制备干燥的氨气和氯化氢时,均可选用无水氯化钙作干燥剂
C.同时打开止水夹a、c、d,左侧形成蓝色喷泉,右侧形成红色喷泉
D.同时打开止水夹a、c、d,左侧形成红色喷泉,右侧形成蓝色喷泉
三、解答题
15.氮、硫及其化合物的“价—类”二维图如图所示。
请回答下列问题:
(1)生活中使用的天然气中往往添加少量 (填上述物质的化学式),用于警示天然气泄露,保障使用安全。
(2)以为原料制备硝酸,第一步反应的化学方程式为 ;生产中用的水溶液吸收少量ⅰ,发生反应的离子方程式为 。
(3)常温下,在上述物质中选择试剂 可除去铁制品表面的铜镀层。
(4)研究发现,空气中少量的也能参与硫酸型酸雨的形成,反应过程如下:
① ② ③
在上述过程中的作用,与在下列变化中的作用不相同的是 (填序号)。
a.潮湿的氯气通过盛有浓的洗气瓶
b.硫化氢通入浓中
c.蔗糖水解实验中加入稀硫酸
d.向盐酸中加入浓硫酸产生白雾
(5)向含的溶液中通入(标准状况下),硫元素恰好被氧化为价,则的化学式可能为 (填序号),反应的离子方程式为 。
a. b. c.
16.碳及其化合物种类繁多,用途广泛,根据要求,回答下列问题:
(1)碳在氧气或臭氧中燃烧的能量变化如图所示:
试判断:16g全部转化为需 (填“吸收”或“放出”)热量 kJ。
(2)用二氧化碳和丙烷()为原料可制备丙烯().一定温度下向2L恒容密闭容器中通入4mol和3mol,发生反应:,测得的物质的量随时间的变化如表所示。
t/min 0 5 10 15 20
3 2.1 1.5 1.2 1.2
①0~5min内的平均生成速率为 。
②达平衡时CO2的转化率为 。
③平衡时与初始时容器内压强的比值为 (保留两位小数)。
(3)甲烷(CH4)-空气燃料电池是一种高效能、轻污染的车载电池,其工作原理如图:
①图中左侧电极为电源 极,该电极的电极反应式为 。
②当电池消耗甲烷2.4g时,消耗的O2的体积为 L(标准状况下)。
17.海洋是一座资源的宝库,下图是利用海洋资源生产卤素单质的工艺流程。
已知氧化性:
(1)实验室灼烧海带时使用的仪器有 、泥三角、三脚架、酒精灯等,步骤Ⅱ的操作名称为 。
(2)步骤Ⅲ中需要严格控制Cl2的用量,原因是 。
(3)若步骤Ⅲ加H2O2的酸性溶液氧化I-,则其离子方程式为 。
(4)步骤Ⅴ中,从海水提取的粗盐中主要含、、等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为 (填标号)。
a.①②③④ b.②③④① c.③②④① d.②④③①
(5)步骤Ⅵ中,用SO2吸收Br2的离子方程式为 。
(6)提取Br2的流程中,两次通入Cl2的目的是富集浓缩溴。若最终获得240gBr2,理论上需消耗标准状况下Cl2的体积为 。
18.某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平。A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题:
(1)写出C、D的结构简式:C ,D 。
(2)写出①、②、④三步反应的化学方程式,并注明反应类型:
① ,反应类型 。
② ,反应类型 。
④ ,反应类型 。
(3)G的相对分子质量是A的两倍,则与A互为同系物的G的同分异构体有 种。
题号 1 2 3 4 5 6 7 8 9 10
答案 C C A A C C B A C B
题号 11 12 13 14
答案 A D C BD
15.(1)
(2)
(3)浓硝酸(硝酸、均可)
(4)
(5)
16.(1) 放出 40.4
(2) 0.09 mol L-1 min-1 45% 1.26
(3) 负极 6.72L
17.(1) 坩埚 过滤
(2)防止过量的Cl2将I2氧化为
(3)
(4)bd
(5)
(6)67.2L
18.(1)
(2) 加成反应 加成反应 加聚反应
(3)3
一、单选题
1.化学与生活密切相关,下列能量主要转化形式描述错误的是
天然气烧开水 烟花的燃放
A.化学能转化为热能 B.化学能转化为光能和热能
电磁炉炒菜 风力发电
C.电能转化为化学能 D.风能转化为电能
A.A B.B C.C D.D
2.“绿水青山就是金山银山”,化学与环境密切相关。下列说法正确的是
A.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,这些颗粒分散在空气中都会形成胶体
B.元素C、N、S的氧化物会使雨水的,我们把的雨水称之为酸雨
C.为了减少煤燃烧废气中的含量,可以在燃煤中加入适量的石灰石
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
3.营养物质是维持人类生命活动的必备物质,下列关于营养物质说法错误的是
A.油脂分为植物油脂和动物油脂,它们在室温下呈现不同形态,是首要的供能物质
B.淀粉是混合物,属于糖类,在人体内经过转化形成葡萄糖,为人体组织提供能量
C.人体中维生素种类繁多,大多依靠从食物中获取,对人类健康有至关重要的作用
D.蛋白质是构成细胞的基本物质,是人类必需的营养物质
4.与一定浓度的反应,生成、、、和水,当和的物质的量之比为时,则反应中起酸性作用的与被还原的的物质的量之比为
A. B. C. D.
5.CuS与浓硫酸共热,生成有刺激性气味的气体:,下列说法正确的是(已知CuS不溶于稀硫酸)
A.该反应的变价元素有2种
B.浓硫酸中硫元素全部降价,体现了氧化性
C.每转移6mol电子,则产生标准状况下89.6L的SO2
D.192g的CuS与4mol浓硫酸充分反应,生成的CuSO4为1mol
6.水煤气变换反应是放热反应,在双功能催化剂(能吸附不同粒子)催化下的反应过程示意 图如下下列说法正确的是
A.过 程I 中有非极性共价键断裂
B.过程Ⅱ和过程Ⅲ均为放热过程
C.该反应的化学方程式为CO+ H2O=CO2+H2
D.该反应中反应物的总能量小于生成物总能量
7.在反应中,下列表示该反应速率最快的是
A. B.
C. D.
8.往一容积为2L的恒容密闭容器中通入2molCO2和6molH2,一定温度下发生反应:,下列达到化学平衡状态时的是
A.容器内气体压强不再发生改变 B.正、逆反应速率相等且均为零
C.气体密度不再发生改变 D.
9.下列关于烷烃的说法不正确的是
A.烷烃的分子式可用通式表示
B.戊烷存在三种同分异构体
C.中三个碳原子处于一条直线上
D.与互为同系物
10.实验室利用乙醇催化氧化制取粗乙醛的反应装置如图所示。下列说法错误的是
A.该反应过程中涉及极性键的断裂和形成
B.收集试管中的物质,加入有可燃性气体生成,说明产物粗乙醛中混有乙醇
C.该反应中铜为催化剂,硬质玻璃管中铜网出现红黑交替现象
D.甲中选用热水,有利于乙醇挥发;丙中选用冷水,有利于冷凝收集产物
11.如图,锂—铜空气燃料电池容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电能,放电时发生反应:。下列说法中,不正确的是
A.放电时,正极的电极反应式为
B.放电时,每转移1mol电子,则负极质量减小7g
C.通空气时,铜被腐蚀,表面产生
D.电流从电极Cu经导线流向电极Li
12.在体积都为2L的恒容容器中,200℃和T℃时,发生如下反应,A的物质的量浓度(单位:mol/L)随时间变化的有关实验数据见下表:
时间/min温度/℃ 0 2 4 6 8 10
容器1 200 0.80 0.55 0.35 0.20 0.15 0.15
容器2 T 1.00 0.65 0.35 0.18 0.18 0.18
下列有关该反应的描述正确的是
A.在200℃时,6min时用A表示的化学反应速率为0.1mol/(L·min)
B.从表中可以看出T<200℃
C.T℃下,6min时反应刚好达到平衡状态
D.向容器1中通入氦气,容器中总压强增大,反应速率不变
13.实验室常用乙酸、乙醇和浓硫酸合成乙酸乙酯,实验装置如图所示。下列说法不正确的是
A.乙中导管不伸入液面下是为了防止倒吸
B.实验结束,乙中液体上层为无色透明的油状液体
C.加入过量乙醇,可使乙酸完全转化为乙酸乙酯
D.加热和使用浓硫酸均可增大该反应的速率
二、多选题
14.“双色双喷泉”实验装置如图所示,图中烧瓶内分别充满氨气和氯化氢,烧杯内均装有滴有紫色石蕊试液的蒸馏水。下列说法错误的是
A.在实验室中,不能通过直接加热氯化铵来制备氨气
B.在实验室中制备干燥的氨气和氯化氢时,均可选用无水氯化钙作干燥剂
C.同时打开止水夹a、c、d,左侧形成蓝色喷泉,右侧形成红色喷泉
D.同时打开止水夹a、c、d,左侧形成红色喷泉,右侧形成蓝色喷泉
三、解答题
15.氮、硫及其化合物的“价—类”二维图如图所示。
请回答下列问题:
(1)生活中使用的天然气中往往添加少量 (填上述物质的化学式),用于警示天然气泄露,保障使用安全。
(2)以为原料制备硝酸,第一步反应的化学方程式为 ;生产中用的水溶液吸收少量ⅰ,发生反应的离子方程式为 。
(3)常温下,在上述物质中选择试剂 可除去铁制品表面的铜镀层。
(4)研究发现,空气中少量的也能参与硫酸型酸雨的形成,反应过程如下:
① ② ③
在上述过程中的作用,与在下列变化中的作用不相同的是 (填序号)。
a.潮湿的氯气通过盛有浓的洗气瓶
b.硫化氢通入浓中
c.蔗糖水解实验中加入稀硫酸
d.向盐酸中加入浓硫酸产生白雾
(5)向含的溶液中通入(标准状况下),硫元素恰好被氧化为价,则的化学式可能为 (填序号),反应的离子方程式为 。
a. b. c.
16.碳及其化合物种类繁多,用途广泛,根据要求,回答下列问题:
(1)碳在氧气或臭氧中燃烧的能量变化如图所示:
试判断:16g全部转化为需 (填“吸收”或“放出”)热量 kJ。
(2)用二氧化碳和丙烷()为原料可制备丙烯().一定温度下向2L恒容密闭容器中通入4mol和3mol,发生反应:,测得的物质的量随时间的变化如表所示。
t/min 0 5 10 15 20
3 2.1 1.5 1.2 1.2
①0~5min内的平均生成速率为 。
②达平衡时CO2的转化率为 。
③平衡时与初始时容器内压强的比值为 (保留两位小数)。
(3)甲烷(CH4)-空气燃料电池是一种高效能、轻污染的车载电池,其工作原理如图:
①图中左侧电极为电源 极,该电极的电极反应式为 。
②当电池消耗甲烷2.4g时,消耗的O2的体积为 L(标准状况下)。
17.海洋是一座资源的宝库,下图是利用海洋资源生产卤素单质的工艺流程。
已知氧化性:
(1)实验室灼烧海带时使用的仪器有 、泥三角、三脚架、酒精灯等,步骤Ⅱ的操作名称为 。
(2)步骤Ⅲ中需要严格控制Cl2的用量,原因是 。
(3)若步骤Ⅲ加H2O2的酸性溶液氧化I-,则其离子方程式为 。
(4)步骤Ⅴ中,从海水提取的粗盐中主要含、、等杂质离子,除去这些离子可加入的试剂有①盐酸②BaCl2溶液③Na2CO3溶液④NaOH溶液,加入试剂的正确顺序为 (填标号)。
a.①②③④ b.②③④① c.③②④① d.②④③①
(5)步骤Ⅵ中,用SO2吸收Br2的离子方程式为 。
(6)提取Br2的流程中,两次通入Cl2的目的是富集浓缩溴。若最终获得240gBr2,理论上需消耗标准状况下Cl2的体积为 。
18.某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平。A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题:
(1)写出C、D的结构简式:C ,D 。
(2)写出①、②、④三步反应的化学方程式,并注明反应类型:
① ,反应类型 。
② ,反应类型 。
④ ,反应类型 。
(3)G的相对分子质量是A的两倍,则与A互为同系物的G的同分异构体有 种。
题号 1 2 3 4 5 6 7 8 9 10
答案 C C A A C C B A C B
题号 11 12 13 14
答案 A D C BD
15.(1)
(2)
(3)浓硝酸(硝酸、均可)
(4)
(5)
16.(1) 放出 40.4
(2) 0.09 mol L-1 min-1 45% 1.26
(3) 负极 6.72L
17.(1) 坩埚 过滤
(2)防止过量的Cl2将I2氧化为
(3)
(4)bd
(5)
(6)67.2L
18.(1)
(2) 加成反应 加成反应 加聚反应
(3)3
同课章节目录
