江西省宜春市部分重点中学2024-2025学年高一下学期7月联考化学试卷(含答案)
文档属性
| 名称 | 江西省宜春市部分重点中学2024-2025学年高一下学期7月联考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:25:14 | ||
图片预览



文档简介
湖北省宜春市部分重点中学2024-2025学年高一下学期7月份联考
化学试卷
一、单选题
1.“天宫空间站”的建设展示了我国在航天技术方面的自主创新能力。下列对“天宫空间站”所用材料的认识错误的是
A.制造舱体外壳框架所用材料——铝合金属于金属材料
B.空间站的舷窗玻璃所用材料——熔融二氧化硅玻璃属于无机非金属材料
C.航天员所穿舱内工作服所用材料——康纶航天纤维属于有机高分子材料
D.空间站的太阳能电池板所用材料——柔性三结砷化镓属于金属材料
2.下列化学用语书写正确的是
A.的结构示意图 B.的电子式:
C.乙酸的球棍模型: D.淀粉的分子式:
3.合理的工业设计和能源利用是实现可持续发展、减少环境污染的关键手段。下列有关说法错误的是
A.用可降解的淀粉基塑料代替聚乙烯塑料,可以减少“白色污染”
B.燃煤脱硫不仅能减少酸雨,也有利于减缓温室效应和消除光化学污染
C.工业合成氯乙烷采用加成反应比采用取代反应更符合“绿色化学”理念
D.我国科学家利用和首次人工合成淀粉,该研究对缓解粮食危机具有重要意义
4.下列各项操作中,产生“先沉淀,然后沉淀又溶解”现象的是
A.向溶液中逐渐通入过量气体
B.向溶液中逐滴加入过量的稀硫酸
C.向溶液中逐滴加入过量溶液
D.向饱和溶液中逐渐通入过量气体
5.下列指定反应的离子方程式书写正确的是
A.向溶液中通入少量:
B.无水酒精与金属钠反应:
C.向水玻璃中通入过量:
D.少量铁与稀硝酸反应:
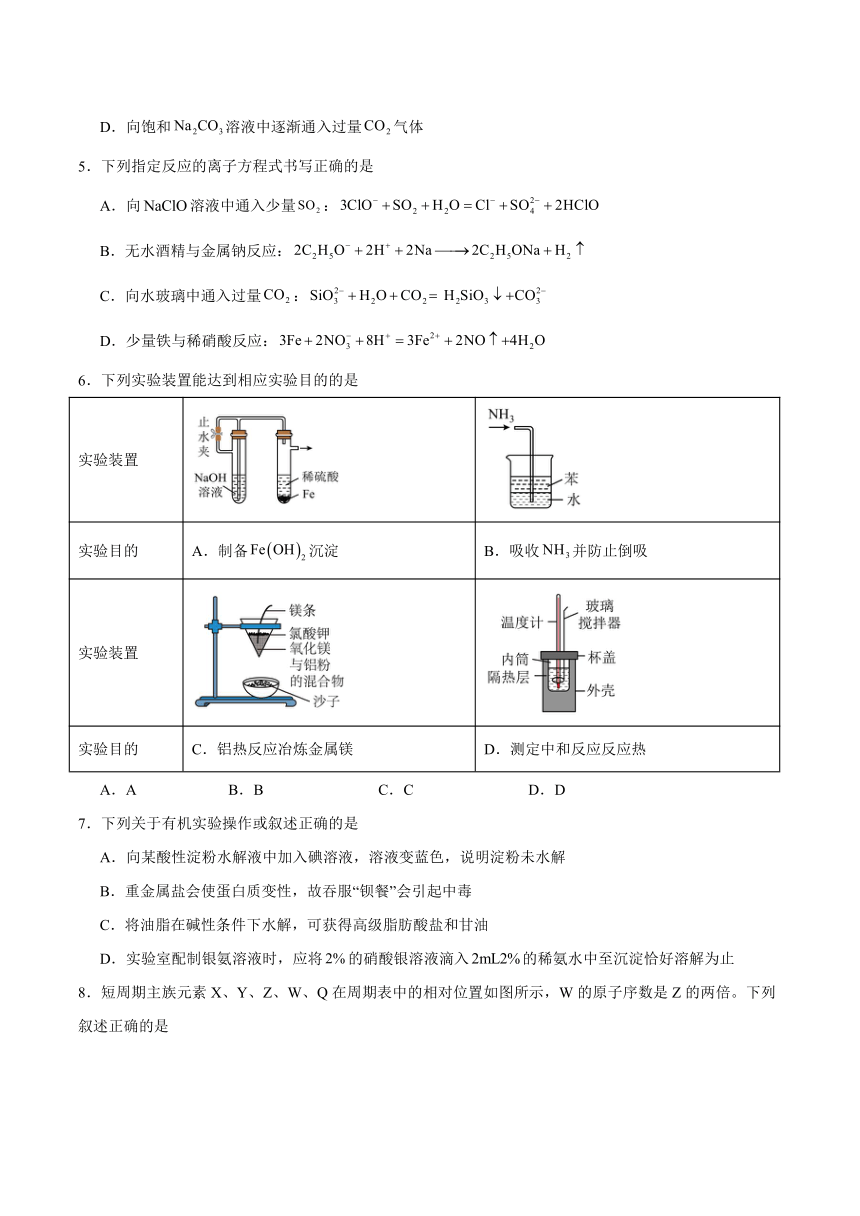
6.下列实验装置能达到相应实验目的的是
实验装置
实验目的 A.制备沉淀 B.吸收并防止倒吸
实验装置
实验目的 C.铝热反应冶炼金属镁 D.测定中和反应反应热
A.A B.B C.C D.D
7.下列关于有机实验操作或叙述正确的是
A.向某酸性淀粉水解液中加入碘溶液,溶液变蓝色,说明淀粉未水解
B.重金属盐会使蛋白质变性,故吞服“钡餐”会引起中毒
C.将油脂在碱性条件下水解,可获得高级脂肪酸盐和甘油
D.实验室配制银氨溶液时,应将的硝酸银溶液滴入的稀氨水中至沉淀恰好溶解为止
8.短周期主族元素X、Y、Z、W、Q在周期表中的相对位置如图所示,W的原子序数是Z的两倍。下列叙述正确的是
A.简单离子半径:
B.氢化物的稳定性一定有:
C.化合物为四面体结构且只有一种结构
D.与的水溶液反应并使其褪色,体现了的漂白性
9.抗坏血酸(即维生素C)能被氧化为脱氢抗坏血酸而发挥抗氧化作用(如图所示),是水果罐头中常用的抗氧化剂。已知抗坏血酸的酸性比醋酸强,下列说法正确的是
A.抗坏血酸和脱氢抗坏血酸中所含官能团种类完全相同
B.抗坏血酸在催化剂和加热条件下可被氧化
C.抗坏血酸能与反应,不能与反应
D.脱氢抗坏血酸已不具备抗氧化作用,不能再发生氧化反应
10.一种空气()燃料电池的工作原理如图所示(质子交换膜只允许通过),该电池工作时,下列说法错误的是
A.与普通石墨棒相比,采用多孔石墨棒作电极材料可增大气体的吸收效率
B.负极的电极反应式为
C.电解液中的从右向左移动
D.若产生,消耗的的物质的量为
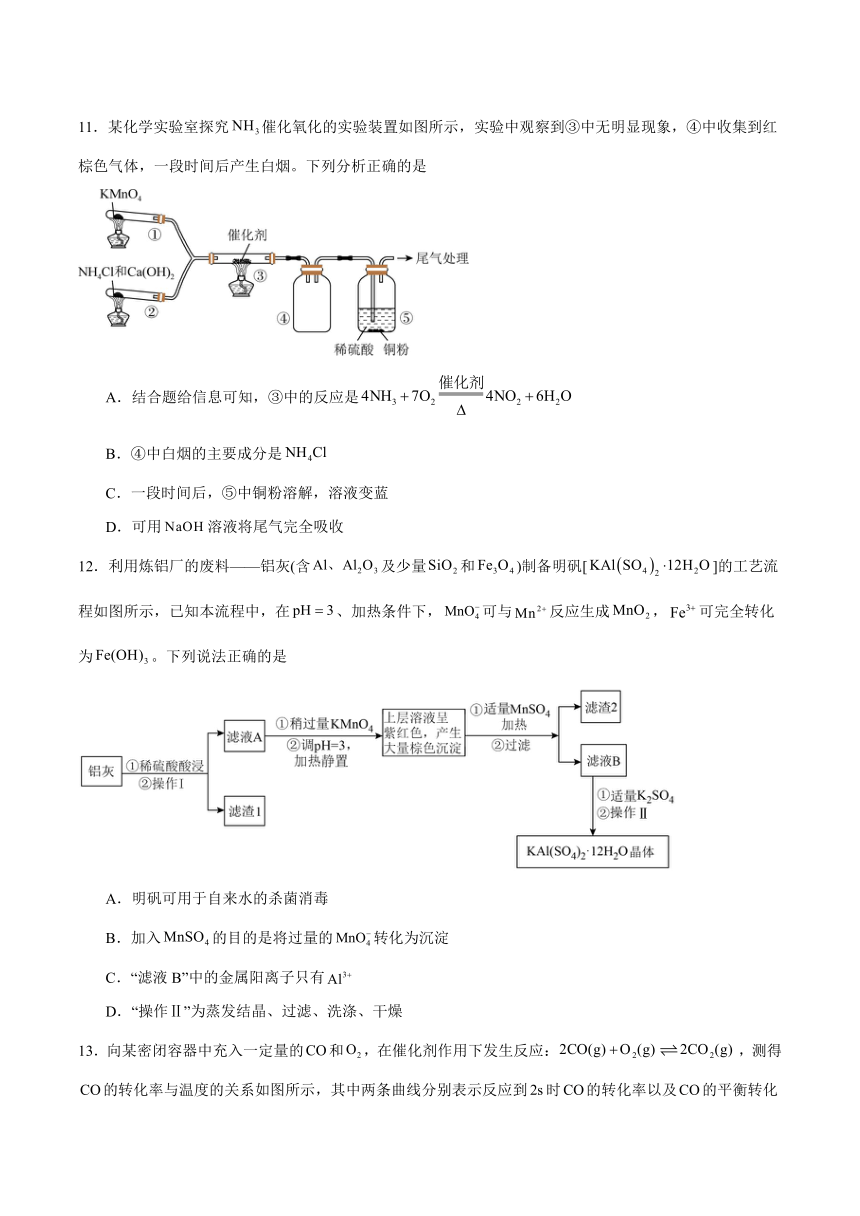
11.某化学实验室探究催化氧化的实验装置如图所示,实验中观察到③中无明显现象,④中收集到红棕色气体,一段时间后产生白烟。下列分析正确的是
A.结合题给信息可知,③中的反应是
B.④中白烟的主要成分是
C.一段时间后,⑤中铜粉溶解,溶液变蓝
D.可用溶液将尾气完全吸收
12.利用炼铝厂的废料——铝灰(含及少量和)制备明矾[]的工艺流程如图所示,已知本流程中,在、加热条件下,可与反应生成,可完全转化为。下列说法正确的是
A.明矾可用于自来水的杀菌消毒
B.加入的目的是将过量的转化为沉淀
C.“滤液B”中的金属阳离子只有
D.“操作Ⅱ”为蒸发结晶、过滤、洗涤、干燥
13.向某密闭容器中充入一定量的和,在催化剂作用下发生反应:,测得的转化率与温度的关系如图所示,其中两条曲线分别表示反应到时的转化率以及的平衡转化率。下列说法正确的是
A.曲线Ⅰ表示反应到时的转化率
B.反应温度为时,后,容器中的物质的量不再增加
C.在反应温度低于时,延长反应时间不能缩小图中阴影部分的面积
D.若时,测得容器中和的浓度相等,则的转化率为
14.利用铁及其氧化物循环制氢的原理如图所示。下列说法正确的是
已知:①流程中的为生成或消耗、生成或消耗时的能量变化;
②通入反应器Ⅰ中的和的物质的量之比为;
③除铁及其化合物为固态,其余物质均为气态。
A.反应器Ⅱ中反应的热化学方程式为
B.反应器Ⅲ中生成,需要消耗
C.以生成为基准,上述流程总反应的焓变
D.在反应器Ⅰ中通入含和的混合气体充分反应,理论上可在反应器Ⅱ中获得
二、解答题
15.某化学兴趣小组在实验室进行葡萄糖(化学式:)燃烧热的测定。实验室测定有机物的燃烧热常用弹式量热计(装置结构如图所示),实验原理:间接法测定水吸收的热量即为物质燃烧释放的热量(忽略装置吸收的热量)。实验步骤如下:
①称取葡萄糖样品制成质量为的压片;
②将压片放入样品盘,密封氧弹(氧弹体积为);
③向氧弹中充入30个大气压的氧气(过量);
④向量热计中注入,然后记录初始温度;
⑤用电火花引发燃烧反应并立即打开小孔M中的仪器;
⑥记录终了温度,重复实验三次。
回答下列问题:
(1)小孔M中插入的仪器是 。制作氧弹的材料选用钢而不选用聚四氟乙烯,理由是 (写一点即可)。
(2)制作的葡萄糖压片太松,压片容易脱落,太紧容易造成的结果是 。
(3)步骤③中充入过量氧气的原因是 。
(4)步骤⑥中记录的“终了温度”是变化过程中温度的 (填“最高值”或“稳定值”)。
(5)弹式量热计若无绝热外套,测得的燃烧热比实际数值 (填“偏大”或“偏小”)。
(6)三次实验测得的量热计中水温的平均变化量为,已知:水的比热容,根据所测数据写出葡萄糖燃烧的热化学方程式: 。
16.聚丙烯酸乙酯()因其优异的生物降解性和环境友好性,正成为替代传统塑料的理想选择。以正丁烷为原料合成聚丙烯酸乙酯的线路图如下,已知A可用作植物生长调节剂,C是A的同系物,反应①、②均属于烃的裂解。
回答下列问题:
(1)A的结构简式为 ,中所含官能团的名称为 。
(2)写出反应的化学方程式: 。
(3)写出反应③的化学方程式: ,中的所有碳原子 (填“一定”或“不一定”)共平面。
(4)已知D能与溶液反应,且D的分子式为,写出B与D反应生成E的化学方程式: 。
(5)由E生成聚丙烯酸乙酯的反应类型为 。
(6)若C与在一定条件下发生类似的反应生成M,则M的结构有 种。
17.氢能是清洁能源的重要组成部分,强化制氢、储氢等各个环节的技术研发具有积极的现实意义。回答下列问题:
Ⅰ.工业上可利用甲烷水蒸气转化法生产氢气,涉及的反应如下:
ⅰ. ;
ⅱ. 。
(1)已知反应:的,则 。
(2)若在恒温、恒压的密闭容器中只发生反应ⅰ,下列条件能说明反应ⅰ达到平衡状态的是___________(填字母)。
A.反应吸收的热量达到
B.单位时间内消耗和的物质的量之比为
C.容器内气体的平均密度不再改变
D.键断裂的同时有键断裂
Ⅱ.甲醇水蒸气重整制氢的原理为 。
(3)已知部分化学键键能(气态分子中化学键解离成气态原子所吸收的能量)如下表,则 。
化学键
键能 351 745 413 464 436
(4)某课题组探究催化剂(X代表制催化剂时反应保留时长为)对甲醇水蒸气重整制氢反应的最佳催化效果,在相同时间内,不同温度时,向刚性容器中充入和,测定的转化率()如图1所示:
①内,甲醇的转化率随温度升高而升高的原因是 (图中各点均未达到平衡状态);最佳催化剂中的X为 h。
②M点时用表示在内的平均反应速率为 (用含t的式子表示)。
Ⅲ.铁酸锌()循环分解水制氢、储氢的原理如图2所示。
(5)反应①中, (填“作氧化剂”“作还原剂”或“既是氧化剂又是还原剂”);写出反应③的化学方程式: 。
18.氯化亚铜()是一种重要的铜盐产品,主要用于颜料工业、有机合成催化剂等领域。某学习小组用海绵铜(主要成分是和)制取氯化亚铜的流程如下:
已知:①难溶于水和乙醇,易溶于浓度较大的体系;
②在潮湿的空气中易被氧化生成碱式盐[]。
回答下列问题:
(1)“溶解”过程中为加快反应速率,可采取的措施是 (写一条即可)。
(2)“溶解”过程中会产生无色气体,写出产生的离子方程式: 。
(3)“还原”过程的实验装置如图所示:
仪器a中盛装略过量的溶液和适量的溶液,仪器a的名称为 ,制备氯化亚铜的离子方程式为 。仪器a中的溶液不能过量的原因是 。
(4)在“酸洗”时,可选用的酸为 (填“稀硝酸”或“稀硫酸”),其理由是 。
(5)“酸洗”后又“醇洗”的目的是 。
题号 1 2 3 4 5 6 7 8 9 10
答案 D C B B A D C C B C
题号 11 12 13 14
答案 C B B D
15.(1) 玻璃搅拌器 钢的导热性好,使物质燃烧产生的热量能及时传递给水
(2)样品压片太紧会导致样品燃烧不充分,使实验结果不准确
(3)保证氧气过量,使葡萄糖充分燃烧
(4)最高值
(5)偏大
(6)
16.(1) 醛基、碳碳双键
(2)
(3) 一定
(4)
(5)加聚反应或加成聚合反应
(6)2
17.(1)
(2)CD
(3)
(4) 其他条件相同,温度升高,反应速率增大,相同时间内甲醇转化率越大 6
(5) 既是氧化剂又是还原剂
18.(1)将海绵铜打磨成粉末或适当升高反应温度、搅拌等
(2)
(3) 分液漏斗 过量会使浓度过大,使生成的与反应而溶解,导致产率降低
(4) 稀硫酸 稀硫酸不会氧化或会被稀硝酸氧化
(5)去除残留的水分和杂质,提高干燥效率
化学试卷
一、单选题
1.“天宫空间站”的建设展示了我国在航天技术方面的自主创新能力。下列对“天宫空间站”所用材料的认识错误的是
A.制造舱体外壳框架所用材料——铝合金属于金属材料
B.空间站的舷窗玻璃所用材料——熔融二氧化硅玻璃属于无机非金属材料
C.航天员所穿舱内工作服所用材料——康纶航天纤维属于有机高分子材料
D.空间站的太阳能电池板所用材料——柔性三结砷化镓属于金属材料
2.下列化学用语书写正确的是
A.的结构示意图 B.的电子式:
C.乙酸的球棍模型: D.淀粉的分子式:
3.合理的工业设计和能源利用是实现可持续发展、减少环境污染的关键手段。下列有关说法错误的是
A.用可降解的淀粉基塑料代替聚乙烯塑料,可以减少“白色污染”
B.燃煤脱硫不仅能减少酸雨,也有利于减缓温室效应和消除光化学污染
C.工业合成氯乙烷采用加成反应比采用取代反应更符合“绿色化学”理念
D.我国科学家利用和首次人工合成淀粉,该研究对缓解粮食危机具有重要意义
4.下列各项操作中,产生“先沉淀,然后沉淀又溶解”现象的是
A.向溶液中逐渐通入过量气体
B.向溶液中逐滴加入过量的稀硫酸
C.向溶液中逐滴加入过量溶液
D.向饱和溶液中逐渐通入过量气体
5.下列指定反应的离子方程式书写正确的是
A.向溶液中通入少量:
B.无水酒精与金属钠反应:
C.向水玻璃中通入过量:
D.少量铁与稀硝酸反应:
6.下列实验装置能达到相应实验目的的是
实验装置
实验目的 A.制备沉淀 B.吸收并防止倒吸
实验装置
实验目的 C.铝热反应冶炼金属镁 D.测定中和反应反应热
A.A B.B C.C D.D
7.下列关于有机实验操作或叙述正确的是
A.向某酸性淀粉水解液中加入碘溶液,溶液变蓝色,说明淀粉未水解
B.重金属盐会使蛋白质变性,故吞服“钡餐”会引起中毒
C.将油脂在碱性条件下水解,可获得高级脂肪酸盐和甘油
D.实验室配制银氨溶液时,应将的硝酸银溶液滴入的稀氨水中至沉淀恰好溶解为止
8.短周期主族元素X、Y、Z、W、Q在周期表中的相对位置如图所示,W的原子序数是Z的两倍。下列叙述正确的是
A.简单离子半径:
B.氢化物的稳定性一定有:
C.化合物为四面体结构且只有一种结构
D.与的水溶液反应并使其褪色,体现了的漂白性
9.抗坏血酸(即维生素C)能被氧化为脱氢抗坏血酸而发挥抗氧化作用(如图所示),是水果罐头中常用的抗氧化剂。已知抗坏血酸的酸性比醋酸强,下列说法正确的是
A.抗坏血酸和脱氢抗坏血酸中所含官能团种类完全相同
B.抗坏血酸在催化剂和加热条件下可被氧化
C.抗坏血酸能与反应,不能与反应
D.脱氢抗坏血酸已不具备抗氧化作用,不能再发生氧化反应
10.一种空气()燃料电池的工作原理如图所示(质子交换膜只允许通过),该电池工作时,下列说法错误的是
A.与普通石墨棒相比,采用多孔石墨棒作电极材料可增大气体的吸收效率
B.负极的电极反应式为
C.电解液中的从右向左移动
D.若产生,消耗的的物质的量为
11.某化学实验室探究催化氧化的实验装置如图所示,实验中观察到③中无明显现象,④中收集到红棕色气体,一段时间后产生白烟。下列分析正确的是
A.结合题给信息可知,③中的反应是
B.④中白烟的主要成分是
C.一段时间后,⑤中铜粉溶解,溶液变蓝
D.可用溶液将尾气完全吸收
12.利用炼铝厂的废料——铝灰(含及少量和)制备明矾[]的工艺流程如图所示,已知本流程中,在、加热条件下,可与反应生成,可完全转化为。下列说法正确的是
A.明矾可用于自来水的杀菌消毒
B.加入的目的是将过量的转化为沉淀
C.“滤液B”中的金属阳离子只有
D.“操作Ⅱ”为蒸发结晶、过滤、洗涤、干燥
13.向某密闭容器中充入一定量的和,在催化剂作用下发生反应:,测得的转化率与温度的关系如图所示,其中两条曲线分别表示反应到时的转化率以及的平衡转化率。下列说法正确的是
A.曲线Ⅰ表示反应到时的转化率
B.反应温度为时,后,容器中的物质的量不再增加
C.在反应温度低于时,延长反应时间不能缩小图中阴影部分的面积
D.若时,测得容器中和的浓度相等,则的转化率为
14.利用铁及其氧化物循环制氢的原理如图所示。下列说法正确的是
已知:①流程中的为生成或消耗、生成或消耗时的能量变化;
②通入反应器Ⅰ中的和的物质的量之比为;
③除铁及其化合物为固态,其余物质均为气态。
A.反应器Ⅱ中反应的热化学方程式为
B.反应器Ⅲ中生成,需要消耗
C.以生成为基准,上述流程总反应的焓变
D.在反应器Ⅰ中通入含和的混合气体充分反应,理论上可在反应器Ⅱ中获得
二、解答题
15.某化学兴趣小组在实验室进行葡萄糖(化学式:)燃烧热的测定。实验室测定有机物的燃烧热常用弹式量热计(装置结构如图所示),实验原理:间接法测定水吸收的热量即为物质燃烧释放的热量(忽略装置吸收的热量)。实验步骤如下:
①称取葡萄糖样品制成质量为的压片;
②将压片放入样品盘,密封氧弹(氧弹体积为);
③向氧弹中充入30个大气压的氧气(过量);
④向量热计中注入,然后记录初始温度;
⑤用电火花引发燃烧反应并立即打开小孔M中的仪器;
⑥记录终了温度,重复实验三次。
回答下列问题:
(1)小孔M中插入的仪器是 。制作氧弹的材料选用钢而不选用聚四氟乙烯,理由是 (写一点即可)。
(2)制作的葡萄糖压片太松,压片容易脱落,太紧容易造成的结果是 。
(3)步骤③中充入过量氧气的原因是 。
(4)步骤⑥中记录的“终了温度”是变化过程中温度的 (填“最高值”或“稳定值”)。
(5)弹式量热计若无绝热外套,测得的燃烧热比实际数值 (填“偏大”或“偏小”)。
(6)三次实验测得的量热计中水温的平均变化量为,已知:水的比热容,根据所测数据写出葡萄糖燃烧的热化学方程式: 。
16.聚丙烯酸乙酯()因其优异的生物降解性和环境友好性,正成为替代传统塑料的理想选择。以正丁烷为原料合成聚丙烯酸乙酯的线路图如下,已知A可用作植物生长调节剂,C是A的同系物,反应①、②均属于烃的裂解。
回答下列问题:
(1)A的结构简式为 ,中所含官能团的名称为 。
(2)写出反应的化学方程式: 。
(3)写出反应③的化学方程式: ,中的所有碳原子 (填“一定”或“不一定”)共平面。
(4)已知D能与溶液反应,且D的分子式为,写出B与D反应生成E的化学方程式: 。
(5)由E生成聚丙烯酸乙酯的反应类型为 。
(6)若C与在一定条件下发生类似的反应生成M,则M的结构有 种。
17.氢能是清洁能源的重要组成部分,强化制氢、储氢等各个环节的技术研发具有积极的现实意义。回答下列问题:
Ⅰ.工业上可利用甲烷水蒸气转化法生产氢气,涉及的反应如下:
ⅰ. ;
ⅱ. 。
(1)已知反应:的,则 。
(2)若在恒温、恒压的密闭容器中只发生反应ⅰ,下列条件能说明反应ⅰ达到平衡状态的是___________(填字母)。
A.反应吸收的热量达到
B.单位时间内消耗和的物质的量之比为
C.容器内气体的平均密度不再改变
D.键断裂的同时有键断裂
Ⅱ.甲醇水蒸气重整制氢的原理为 。
(3)已知部分化学键键能(气态分子中化学键解离成气态原子所吸收的能量)如下表,则 。
化学键
键能 351 745 413 464 436
(4)某课题组探究催化剂(X代表制催化剂时反应保留时长为)对甲醇水蒸气重整制氢反应的最佳催化效果,在相同时间内,不同温度时,向刚性容器中充入和,测定的转化率()如图1所示:
①内,甲醇的转化率随温度升高而升高的原因是 (图中各点均未达到平衡状态);最佳催化剂中的X为 h。
②M点时用表示在内的平均反应速率为 (用含t的式子表示)。
Ⅲ.铁酸锌()循环分解水制氢、储氢的原理如图2所示。
(5)反应①中, (填“作氧化剂”“作还原剂”或“既是氧化剂又是还原剂”);写出反应③的化学方程式: 。
18.氯化亚铜()是一种重要的铜盐产品,主要用于颜料工业、有机合成催化剂等领域。某学习小组用海绵铜(主要成分是和)制取氯化亚铜的流程如下:
已知:①难溶于水和乙醇,易溶于浓度较大的体系;
②在潮湿的空气中易被氧化生成碱式盐[]。
回答下列问题:
(1)“溶解”过程中为加快反应速率,可采取的措施是 (写一条即可)。
(2)“溶解”过程中会产生无色气体,写出产生的离子方程式: 。
(3)“还原”过程的实验装置如图所示:
仪器a中盛装略过量的溶液和适量的溶液,仪器a的名称为 ,制备氯化亚铜的离子方程式为 。仪器a中的溶液不能过量的原因是 。
(4)在“酸洗”时,可选用的酸为 (填“稀硝酸”或“稀硫酸”),其理由是 。
(5)“酸洗”后又“醇洗”的目的是 。
题号 1 2 3 4 5 6 7 8 9 10
答案 D C B B A D C C B C
题号 11 12 13 14
答案 C B B D
15.(1) 玻璃搅拌器 钢的导热性好,使物质燃烧产生的热量能及时传递给水
(2)样品压片太紧会导致样品燃烧不充分,使实验结果不准确
(3)保证氧气过量,使葡萄糖充分燃烧
(4)最高值
(5)偏大
(6)
16.(1) 醛基、碳碳双键
(2)
(3) 一定
(4)
(5)加聚反应或加成聚合反应
(6)2
17.(1)
(2)CD
(3)
(4) 其他条件相同,温度升高,反应速率增大,相同时间内甲醇转化率越大 6
(5) 既是氧化剂又是还原剂
18.(1)将海绵铜打磨成粉末或适当升高反应温度、搅拌等
(2)
(3) 分液漏斗 过量会使浓度过大,使生成的与反应而溶解,导致产率降低
(4) 稀硫酸 稀硫酸不会氧化或会被稀硝酸氧化
(5)去除残留的水分和杂质,提高干燥效率
同课章节目录
