苏教版高中化学选择性必修2专题4分子空间结构与物质性质4.2配合物的形成和应用课件(共44张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修2专题4分子空间结构与物质性质4.2配合物的形成和应用课件(共44张PPT) |
|
|
| 格式 | ppt | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:00:00 | ||
图片预览








文档简介
(共44张PPT)
专题4 分子空间结构与物质性质
第二单元 配合物的形成和应用
学 习 目 标
1、理解配位键的形成和表示方式。
2、了解配合物的概念,能说明简单配合物的成键情况。
3、能分析配合物离子的空间构型。
维尔纳与配合物
19世纪末期,德国化学家发现一系列令人难以回答的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不同的物质。为了解释上述情况,化学家曾提出各种假说,但都未能成功。直到1893年,瑞士化学家维尔纳(A.Werner)在总结前人研究的基础上,首次提出了配合物等概念,并成功解释了很多配合物的性质 ,维尔纳也被称为“配位化学之父”,并因此获得了1913年的诺贝尔化学奖。
【实验1】向试管中加入2 mL5%的硫酸铜溶液,再逐滴加入浓氨水,边滴边振荡,观察实验现象。
【实验2】取5%的氯化铜溶液、5%的硝酸铜溶液各2 mL,分别逐滴加入浓氨水,观察实验现象。
天蓝色溶液
蓝色絮状沉淀
深蓝色溶液
【实验1、2现象】
①先有蓝色絮状沉淀生成:
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
②后沉淀溶解,形成深蓝色溶液:
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
在水溶液中,Cu2+与NH3分子是如何结合在一起的呢?
中心离子
有空轨道
配体有孤电子对
NH3(N):提供孤电子对
Cu2+:提供空轨道
2+
Cu
NH3
H3N
NH3
NH3
[Cu(NH3)4]2+ 的结构简式为:
配位键的存在是配合物与其它物质最本质的区别
一、配合物的形成
1、 定义
【例】[Cu(NH3)4] SO4、Fe(SCN)3 、Fe(CO)5 、Na3[AlF6]、[Ag(NH3)2]OH
由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物简称配合物。
2、形成条件
(1) 中心原子(或离子)必须存在空轨道。
(2) 配位体具有提供孤电子对的原子。
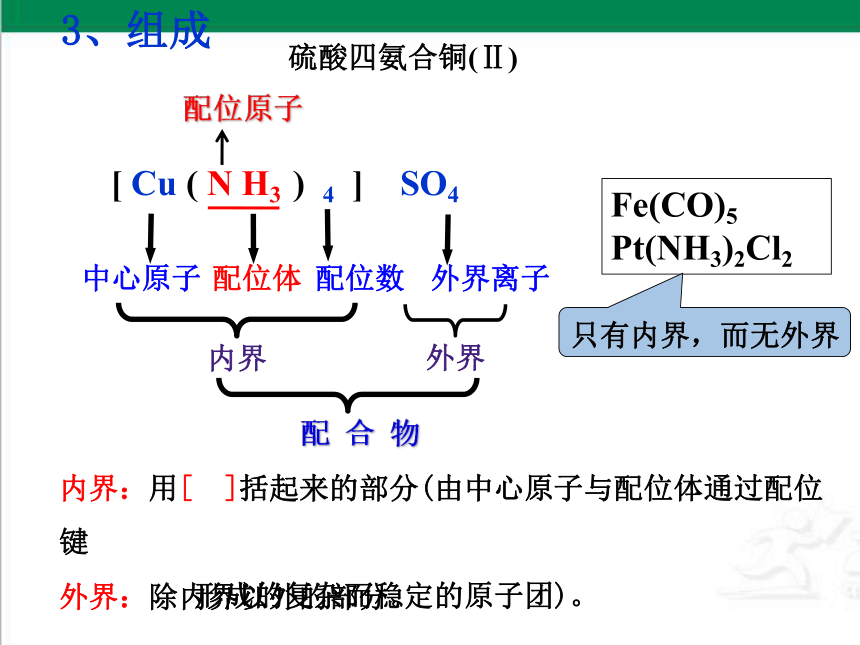
[ Cu ( N H3 ) 4 ] SO4
中心原子
配位体
配位数
外界离子
内界
外界
配 合 物
硫酸四氨合铜(Ⅱ)
3、组成
内界:用[ ]括起来的部分(由中心原子与配位体通过配位键
形成的复杂而稳定的原子团)。
外界:除内界以外的部分。
Fe(CO)5
Pt(NH3)2Cl2
只有内界,而无外界
配位原子
中心原子:
通常是过渡元素阳离子或原子,如:Fe3+、Fe2+、
Cu2+、Zn2+、Ag+、Ni;
少数主族元素阳离子,如:Al3+;
少数是非金属元素,如:Si、I。
配位原子:
具有孤电子对的原子,如:N、O、F、 Cl、S等。
配位体:
含孤电子对的分子或离子,如:F-、Cl-、 Br-、I-、
OH-、CN-、H2O、NH3、CO等。
在Fe3+、Cu2+、Zn2+、Ag+、H2O、NH3、F-、CN-、CO中,哪些可以作为中心原子?哪些可以作为配位体?
中心原子:Fe3+、Cu2+、Zn2+、Ag+
配位体:H2O、NH3、CO、F-、CN-、Cl-
配位数:
直接与中心原子相连的配位体个数。
一般为2、4、6、8,最常见为4、6。
中心原子(离子) 配位数
Ag+
2
Cu2+
4
Al3+
Fe3+
Fe2+
6
Zn2+
配合物 内界 外界 中心原子(离子) 配位体 配位
数
[Ag(NH3)2]OH
K4[Fe(CN)6]
Na3[AlF6]
Ni(CO)4
[Co(NH3)5Cl]Cl2
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]4-
K+
Fe2+
CN-
6
6
[AlF6]3-
Na+
Al3+
F-
Ni(CO)4
无
Ni
CO
4
[Co(NH3)5Cl]2+
Cl-
Co3+
Cl- NH3
6
(1)配合物整体(包括内界和外界)应显电中性;
外界离子所带电荷总数 = 配位离子的电荷数。
(4) 对于具有内外界的配合物,中心原子和配位体通过配位
键结合,一般内界很难电离;内外界之间以离子键结合,
一般外界在水溶液中完全电离。
[Cu(NH3)4]SO4= [Cu(NH3)4]2++SO42-
(3)配合物的内界不仅可为阳离子、阴离子,还可以是中性分子。
(2)一个中心原子(离子)可同时结合多种配位体。
【注意】
[Ag(NH3)2]OH= [Ag(NH3)2]++OH-
现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将这两种配合物区别开。
【实验方案】
1、称取相同物质的量的两种晶体,分别配成溶液。
2、向两种溶液中加入足量的AgNO3溶液。
3、静置,过滤。
4、洗涤沉淀,干燥。
5、称量。
【结论】所得固体质量多的即为[Co(NH3)6]Cl3,
所得固体质量少的即为[Co(NH3)5Cl]Cl2 。
[Co(NH3)6]Cl3=[Co(NH3)6]3++3Cl-
[Co(NH3)5Cl]Cl2=[Co(NH3)5Cl]2++2Cl-
[Ag(NH3) 2]+
[Zn(NH3) 4] 2+
[Fe(SCN) 6] 3-
[Co(NH3)5H2O] 3+
4、配合物的简单命名(自右向左)
六硫氰酸根合铁(Ⅲ)离子
五氨·一水合钴(Ⅲ)离子
a. 配位离子的命名
配位数→配位体名称→合→中心离子(中心离子化合价)
二氨合银(Ⅰ)离子
四氨合锌(Ⅱ)离子
多种配位体时:阴离子在前,中性分子在后,不同的配位体间用圆点分开
了解
b. 配位阳离子配合物:
某酸(化)→ 配位数→配位体名称→ 合→中心离子(中心离子化合价)
[Cu(NH3)4] SO4
[CoCl2(NH3)3(H2O)]Cl
硫酸四氨合铜(Ⅱ)
氯化二氯·三氨·一水合钴(Ⅲ)
c. 配位阴离子配合物:
配位数→配位体名称→ 合→ 中心离子 (中心离子化合价)→ 酸→某
K3[Fe(CN)6]
K[PtCl3(NH3)]
[Pt(NH3)6][PtCl4]
Na3[AlF6]
六氰合铁(Ⅲ)酸钾
三氯·一氨合铂(Ⅱ)酸钾
四氯合铂(Ⅱ)酸六氨合铂(Ⅱ)
六氟合铝(Ⅲ)酸钠
B
尝试用球棍搭出Pt(NH3)2Cl2的结构模型
5、配合物的异构现象
(2)产生异构现象原因
①含有_ ____或_________ 配位体;
②配位体_____________不同。
两种
两种以上
空间排列方式
(1)定义
配合物化学组成相同,但原子间连接方式或空间
排列方式不同而引起配合物结构性质不同的现象。
(3)分类
(4)异构体的性质
顺、反异构体在颜色、极性、溶解性、活性
等方面都有差异。
相邻
对角
配合物离子的空间构型
[Ag(NH3)2] + [Zn(NH3)4] 2+ [Ni(CN)4] 2- [AlF6] 3-
4
配位数
2
4
6
6、配合物离子的空间构型
配合物离子的空间构型指的是配位体围绕着中心原子排布的几何构型。
配合物的中心原子、配位体的种类和数目的不同,可以形成不同空间构型的配合物。
配位数 空间构型 结构示意图 实例
2 直线形 [Ag(NH3)2]+
[Ag(CN)2]-
4 正四面体 [ZnCl4]2-
[Cd(CN)4]2-
[CoCl4]2-
[Cd(NH3)4]2+
4 平面正方形 [PtCl4]2-
[Ni(CN)4]2-
[Cu(NH3)4]2+
6 八面体 [AlF6]3-
[SiF6]2-
[Fe(CN)6]3-
配合物性质(了解):
具有一定的稳定性,配位键越强,配合物越稳定。过渡金属配合物远比主族金属易形成配合物。
1、检验金属离子、分离物质、定量测定物质的组成。
【实验1】银氨溶液——检验醛基
①配制过程
AgNO3溶液 _____ ____________
②反应现象:先_____________,后_________
③滴加葡萄糖后加热现象:有银镜生成
AgOH
[Ag(NH3)2]OH
产生白色沉淀
沉淀溶解
二、配合物的应用
①过程:含Fe3+的溶液 溶液变为_____
②反应:_________________________________
血红色
Fe3++3SCN- Fe(SCN)3
【实验2】检验Fe3+
2、在生产中的应用:配合物用于染色、电镀、硬水
软化、金属冶炼等领域。
例如,提取Au的原理为
4Au+8CN-+2H2O+O2===4[Au(CN)2]-+4OH-
再用Zn还原成单质金:
Zn+2[Au(CN)2]-===2Au+[Zn(CN)4]2-。
炼金废水中含有CN-,当H+与CN-结合生成HCN,毒性更强,可导致鱼类等水生物死亡,因此不能任意排放。
做助熔剂
2 Al2O3(熔融)==4 Al+3 O2↑
电解
加冰晶石Na3[AlF6]降低熔点
课本P111~113页
(1)配合物在生命体中的作用
(2)药物中的配合物
(3)配合物与生物固氮
Mo
Fe
S
固氮酶中Fe—Mo中心结构示意图
叶绿素结构示意图
3、在尖端研究领域中的应用:生命科学、抗癌药物、催化剂研制、激光材料、超导材料等。
在生命体中、医药、配合物与生物固氮、生产生活等中都有很重要的应用。
血红素(Fe2+ )结构示意图
血红素(Fe2+ )结构示意图
CO中毒原因
人体内血红蛋白是Fe2+卟林配合物, Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+能生成更稳定的配合物。发生CO中毒事故,应首先将病人移至通风处,必要时送医院抢救。
小结:配合物对物质性质的影响与应用
增强
深蓝色
Fe(OH)3
Mg2+
太阳
化学
Fe2+
Zn2+
小结:
一、配合物的形成条件
配体要提供孤对电子
中心原子提供空轨道
二、配合物的结构
中心原子
配位体
配位数
外界离子
内界
外界
1、由配位键形成的离子[Pt(NH3) 6]2+和[PtCl4]2-中,
两个中心离子铂的化合价是( )
A. 都是 + 8 B. 都是 + 6
C. 都是 + 4 D. 都是 + 2
2、配合物[Co(NH3) 4 (H2O) 2](SO4)3的内界是 ,
外界是 ,配位体是 ,配位原子
是 ,中心原子的配位数是 。
D
[Co(NH3) 4 (H2O) 2]6+
SO42-
N和O
6
NH3和H2O
3、配合物PtCl 4 ·2NH3的水溶液不导电,加入硝酸银
溶液也不产沉淀,滴加强碱也无氨气放出,所以它
的化学式是 。
PtCl 4 (NH3) 2
水溶液不导电说明PtCl 4 ·2NH3没有电离出离子,加入AgNO3溶液无沉淀产生,进一步说明溶液中无Cl-;加碱无NH3生成,说明NH3与Pt结合的很牢固,故Pt、 NH3 、Cl-均在内界。
4、0.01 mol氯化铬(CrCl 3 ·6H2O)在水溶液中用过量
的硝酸银溶液处理,产生0.02 mol AgCl沉淀,此氯
化铬最可能是( )
A. [Cr(H2O) 6 ]Cl3
B. [CrCl(H2O) 5 ]Cl2 ·H2O
C .[CrCl2(H2O) 4 ]Cl ·H2O
D .[CrCl3(H2O) 3 ]·3H2O
B
0.01 molCrCl 3 ·6H2O与硝酸银反应,产生0.02 mol AgCl沉淀,说明有2个Cl-在外界
5、下列常见化合物的溶液中,滴入足量氨水最后仍为
澄清溶液的是( )
A. 硫酸镁 B. 氯化铁
C. 硝酸银 D. 氯化铜
CD
D.Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2+ + 2OH- + 4H2O
Mg(OH)2
Fe(OH)3
AgOH
Cu(OH)2
C.AgOH + 2NH3·H2O = [Ag(NH3)2]+ + OH- + 2H2O
6、[Cu(NH3)4]2+中含有____个配位键,______个σ键,N原子的杂化方式为______。请画出该配合物离子的结构示意图,要求用箭头表示出配位键。
答案:4 16 sp3
解析:每个NH3中有3个σ键,每个N原子与Cu2+形成1个配位键(σ键),σ键总数为16。
专题4 分子空间结构与物质性质
第二单元 配合物的形成和应用
学 习 目 标
1、理解配位键的形成和表示方式。
2、了解配合物的概念,能说明简单配合物的成键情况。
3、能分析配合物离子的空间构型。
维尔纳与配合物
19世纪末期,德国化学家发现一系列令人难以回答的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不同的物质。为了解释上述情况,化学家曾提出各种假说,但都未能成功。直到1893年,瑞士化学家维尔纳(A.Werner)在总结前人研究的基础上,首次提出了配合物等概念,并成功解释了很多配合物的性质 ,维尔纳也被称为“配位化学之父”,并因此获得了1913年的诺贝尔化学奖。
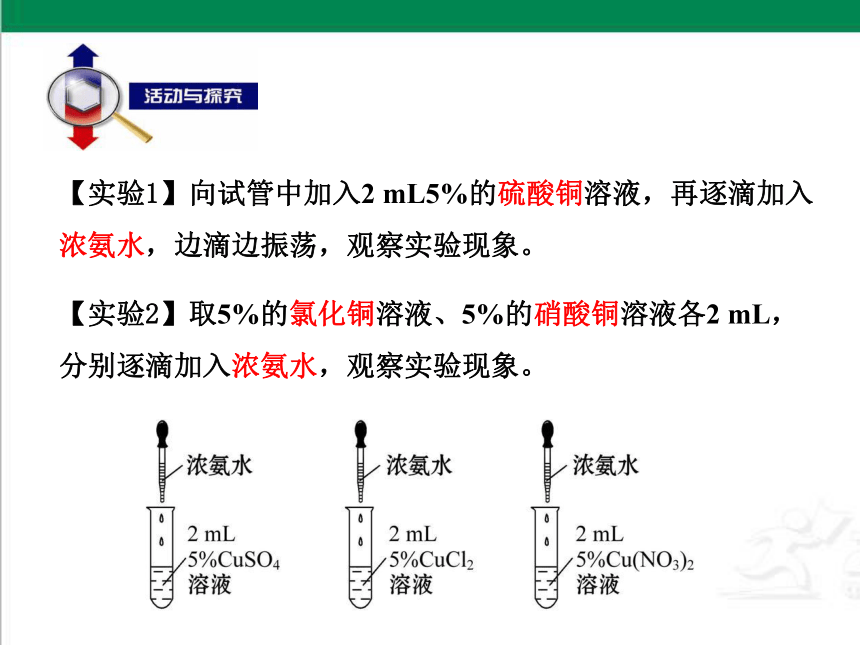
【实验1】向试管中加入2 mL5%的硫酸铜溶液,再逐滴加入浓氨水,边滴边振荡,观察实验现象。
【实验2】取5%的氯化铜溶液、5%的硝酸铜溶液各2 mL,分别逐滴加入浓氨水,观察实验现象。
天蓝色溶液
蓝色絮状沉淀
深蓝色溶液
【实验1、2现象】
①先有蓝色絮状沉淀生成:
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
②后沉淀溶解,形成深蓝色溶液:
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
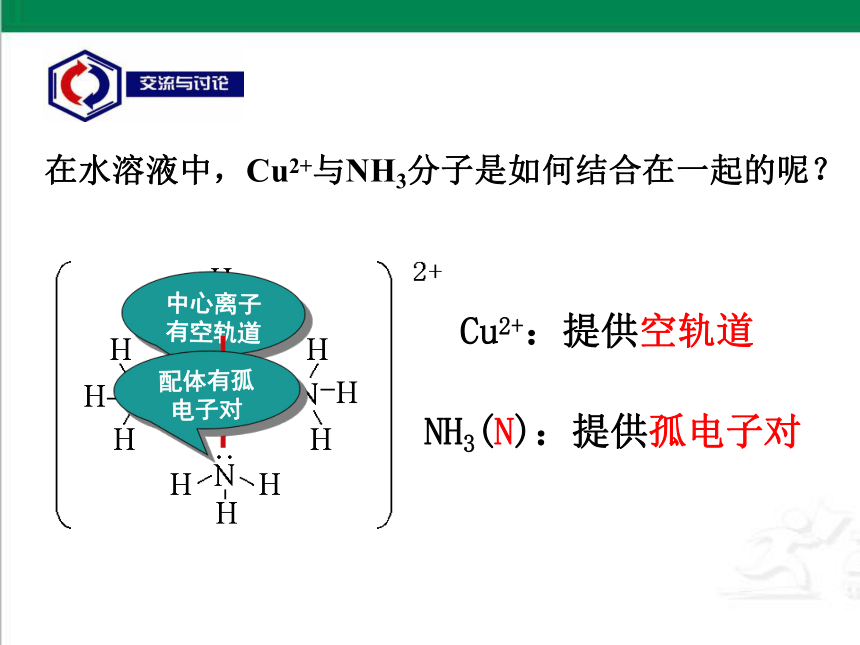
在水溶液中,Cu2+与NH3分子是如何结合在一起的呢?
中心离子
有空轨道
配体有孤电子对
NH3(N):提供孤电子对
Cu2+:提供空轨道
2+
Cu
NH3
H3N
NH3
NH3
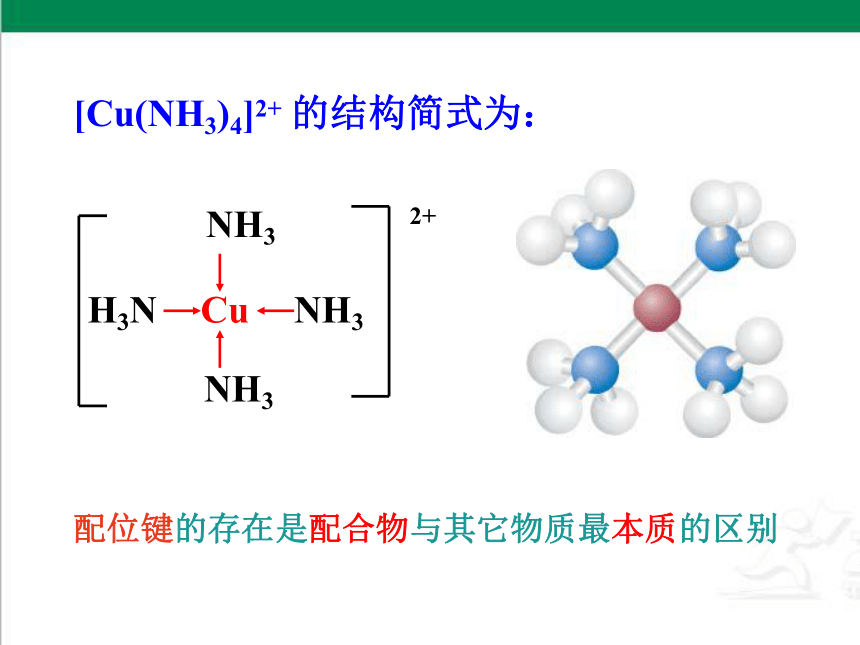
[Cu(NH3)4]2+ 的结构简式为:
配位键的存在是配合物与其它物质最本质的区别
一、配合物的形成
1、 定义
【例】[Cu(NH3)4] SO4、Fe(SCN)3 、Fe(CO)5 、Na3[AlF6]、[Ag(NH3)2]OH
由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物简称配合物。
2、形成条件
(1) 中心原子(或离子)必须存在空轨道。
(2) 配位体具有提供孤电子对的原子。
[ Cu ( N H3 ) 4 ] SO4
中心原子
配位体
配位数
外界离子
内界
外界
配 合 物
硫酸四氨合铜(Ⅱ)
3、组成
内界:用[ ]括起来的部分(由中心原子与配位体通过配位键
形成的复杂而稳定的原子团)。
外界:除内界以外的部分。
Fe(CO)5
Pt(NH3)2Cl2
只有内界,而无外界
配位原子
中心原子:
通常是过渡元素阳离子或原子,如:Fe3+、Fe2+、
Cu2+、Zn2+、Ag+、Ni;
少数主族元素阳离子,如:Al3+;
少数是非金属元素,如:Si、I。
配位原子:
具有孤电子对的原子,如:N、O、F、 Cl、S等。
配位体:
含孤电子对的分子或离子,如:F-、Cl-、 Br-、I-、
OH-、CN-、H2O、NH3、CO等。
在Fe3+、Cu2+、Zn2+、Ag+、H2O、NH3、F-、CN-、CO中,哪些可以作为中心原子?哪些可以作为配位体?
中心原子:Fe3+、Cu2+、Zn2+、Ag+
配位体:H2O、NH3、CO、F-、CN-、Cl-
配位数:
直接与中心原子相连的配位体个数。
一般为2、4、6、8,最常见为4、6。
中心原子(离子) 配位数
Ag+
2
Cu2+
4
Al3+
Fe3+
Fe2+
6
Zn2+
配合物 内界 外界 中心原子(离子) 配位体 配位
数
[Ag(NH3)2]OH
K4[Fe(CN)6]
Na3[AlF6]
Ni(CO)4
[Co(NH3)5Cl]Cl2
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]4-
K+
Fe2+
CN-
6
6
[AlF6]3-
Na+
Al3+
F-
Ni(CO)4
无
Ni
CO
4
[Co(NH3)5Cl]2+
Cl-
Co3+
Cl- NH3
6
(1)配合物整体(包括内界和外界)应显电中性;
外界离子所带电荷总数 = 配位离子的电荷数。
(4) 对于具有内外界的配合物,中心原子和配位体通过配位
键结合,一般内界很难电离;内外界之间以离子键结合,
一般外界在水溶液中完全电离。
[Cu(NH3)4]SO4= [Cu(NH3)4]2++SO42-
(3)配合物的内界不仅可为阳离子、阴离子,还可以是中性分子。
(2)一个中心原子(离子)可同时结合多种配位体。
【注意】
[Ag(NH3)2]OH= [Ag(NH3)2]++OH-
现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将这两种配合物区别开。
【实验方案】
1、称取相同物质的量的两种晶体,分别配成溶液。
2、向两种溶液中加入足量的AgNO3溶液。
3、静置,过滤。
4、洗涤沉淀,干燥。
5、称量。
【结论】所得固体质量多的即为[Co(NH3)6]Cl3,
所得固体质量少的即为[Co(NH3)5Cl]Cl2 。
[Co(NH3)6]Cl3=[Co(NH3)6]3++3Cl-
[Co(NH3)5Cl]Cl2=[Co(NH3)5Cl]2++2Cl-
[Ag(NH3) 2]+
[Zn(NH3) 4] 2+
[Fe(SCN) 6] 3-
[Co(NH3)5H2O] 3+
4、配合物的简单命名(自右向左)
六硫氰酸根合铁(Ⅲ)离子
五氨·一水合钴(Ⅲ)离子
a. 配位离子的命名
配位数→配位体名称→合→中心离子(中心离子化合价)
二氨合银(Ⅰ)离子
四氨合锌(Ⅱ)离子
多种配位体时:阴离子在前,中性分子在后,不同的配位体间用圆点分开
了解
b. 配位阳离子配合物:
某酸(化)→ 配位数→配位体名称→ 合→中心离子(中心离子化合价)
[Cu(NH3)4] SO4
[CoCl2(NH3)3(H2O)]Cl
硫酸四氨合铜(Ⅱ)
氯化二氯·三氨·一水合钴(Ⅲ)
c. 配位阴离子配合物:
配位数→配位体名称→ 合→ 中心离子 (中心离子化合价)→ 酸→某
K3[Fe(CN)6]
K[PtCl3(NH3)]
[Pt(NH3)6][PtCl4]
Na3[AlF6]
六氰合铁(Ⅲ)酸钾
三氯·一氨合铂(Ⅱ)酸钾
四氯合铂(Ⅱ)酸六氨合铂(Ⅱ)
六氟合铝(Ⅲ)酸钠
B
尝试用球棍搭出Pt(NH3)2Cl2的结构模型
5、配合物的异构现象
(2)产生异构现象原因
①含有_ ____或_________ 配位体;
②配位体_____________不同。
两种
两种以上
空间排列方式
(1)定义
配合物化学组成相同,但原子间连接方式或空间
排列方式不同而引起配合物结构性质不同的现象。
(3)分类
(4)异构体的性质
顺、反异构体在颜色、极性、溶解性、活性
等方面都有差异。
相邻
对角
配合物离子的空间构型
[Ag(NH3)2] + [Zn(NH3)4] 2+ [Ni(CN)4] 2- [AlF6] 3-
4
配位数
2
4
6
6、配合物离子的空间构型
配合物离子的空间构型指的是配位体围绕着中心原子排布的几何构型。
配合物的中心原子、配位体的种类和数目的不同,可以形成不同空间构型的配合物。
配位数 空间构型 结构示意图 实例
2 直线形 [Ag(NH3)2]+
[Ag(CN)2]-
4 正四面体 [ZnCl4]2-
[Cd(CN)4]2-
[CoCl4]2-
[Cd(NH3)4]2+
4 平面正方形 [PtCl4]2-
[Ni(CN)4]2-
[Cu(NH3)4]2+
6 八面体 [AlF6]3-
[SiF6]2-
[Fe(CN)6]3-
配合物性质(了解):
具有一定的稳定性,配位键越强,配合物越稳定。过渡金属配合物远比主族金属易形成配合物。
1、检验金属离子、分离物质、定量测定物质的组成。
【实验1】银氨溶液——检验醛基
①配制过程
AgNO3溶液 _____ ____________
②反应现象:先_____________,后_________
③滴加葡萄糖后加热现象:有银镜生成
AgOH
[Ag(NH3)2]OH
产生白色沉淀
沉淀溶解
二、配合物的应用
①过程:含Fe3+的溶液 溶液变为_____
②反应:_________________________________
血红色
Fe3++3SCN- Fe(SCN)3
【实验2】检验Fe3+
2、在生产中的应用:配合物用于染色、电镀、硬水
软化、金属冶炼等领域。
例如,提取Au的原理为
4Au+8CN-+2H2O+O2===4[Au(CN)2]-+4OH-
再用Zn还原成单质金:
Zn+2[Au(CN)2]-===2Au+[Zn(CN)4]2-。
炼金废水中含有CN-,当H+与CN-结合生成HCN,毒性更强,可导致鱼类等水生物死亡,因此不能任意排放。
做助熔剂
2 Al2O3(熔融)==4 Al+3 O2↑
电解
加冰晶石Na3[AlF6]降低熔点
课本P111~113页
(1)配合物在生命体中的作用
(2)药物中的配合物
(3)配合物与生物固氮
Mo
Fe
S
固氮酶中Fe—Mo中心结构示意图
叶绿素结构示意图
3、在尖端研究领域中的应用:生命科学、抗癌药物、催化剂研制、激光材料、超导材料等。
在生命体中、医药、配合物与生物固氮、生产生活等中都有很重要的应用。
血红素(Fe2+ )结构示意图
血红素(Fe2+ )结构示意图
CO中毒原因
人体内血红蛋白是Fe2+卟林配合物, Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+能生成更稳定的配合物。发生CO中毒事故,应首先将病人移至通风处,必要时送医院抢救。
小结:配合物对物质性质的影响与应用
增强
深蓝色
Fe(OH)3
Mg2+
太阳
化学
Fe2+
Zn2+
小结:
一、配合物的形成条件
配体要提供孤对电子
中心原子提供空轨道
二、配合物的结构
中心原子
配位体
配位数
外界离子
内界
外界
1、由配位键形成的离子[Pt(NH3) 6]2+和[PtCl4]2-中,
两个中心离子铂的化合价是( )
A. 都是 + 8 B. 都是 + 6
C. 都是 + 4 D. 都是 + 2
2、配合物[Co(NH3) 4 (H2O) 2](SO4)3的内界是 ,
外界是 ,配位体是 ,配位原子
是 ,中心原子的配位数是 。
D
[Co(NH3) 4 (H2O) 2]6+
SO42-
N和O
6
NH3和H2O
3、配合物PtCl 4 ·2NH3的水溶液不导电,加入硝酸银
溶液也不产沉淀,滴加强碱也无氨气放出,所以它
的化学式是 。
PtCl 4 (NH3) 2
水溶液不导电说明PtCl 4 ·2NH3没有电离出离子,加入AgNO3溶液无沉淀产生,进一步说明溶液中无Cl-;加碱无NH3生成,说明NH3与Pt结合的很牢固,故Pt、 NH3 、Cl-均在内界。
4、0.01 mol氯化铬(CrCl 3 ·6H2O)在水溶液中用过量
的硝酸银溶液处理,产生0.02 mol AgCl沉淀,此氯
化铬最可能是( )
A. [Cr(H2O) 6 ]Cl3
B. [CrCl(H2O) 5 ]Cl2 ·H2O
C .[CrCl2(H2O) 4 ]Cl ·H2O
D .[CrCl3(H2O) 3 ]·3H2O
B
0.01 molCrCl 3 ·6H2O与硝酸银反应,产生0.02 mol AgCl沉淀,说明有2个Cl-在外界
5、下列常见化合物的溶液中,滴入足量氨水最后仍为
澄清溶液的是( )
A. 硫酸镁 B. 氯化铁
C. 硝酸银 D. 氯化铜
CD
D.Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2+ + 2OH- + 4H2O
Mg(OH)2
Fe(OH)3
AgOH
Cu(OH)2
C.AgOH + 2NH3·H2O = [Ag(NH3)2]+ + OH- + 2H2O
6、[Cu(NH3)4]2+中含有____个配位键,______个σ键,N原子的杂化方式为______。请画出该配合物离子的结构示意图,要求用箭头表示出配位键。
答案:4 16 sp3
解析:每个NH3中有3个σ键,每个N原子与Cu2+形成1个配位键(σ键),σ键总数为16。
