苏教版高中化学选择性必修2专题2原子结构与元素性质2.2.2元素的第一电离能和电负性的周期性变化课件(28张)
文档属性
| 名称 | 苏教版高中化学选择性必修2专题2原子结构与元素性质2.2.2元素的第一电离能和电负性的周期性变化课件(28张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 07:51:16 | ||
图片预览




文档简介
(共28张PPT)
元素第一电离能与
电负性的周期性变化
1.解释主族元素第一电离能、电负性变化的一般规律
2.能利用电负性判断周期表中元素性质递变规律
3.能利用电负性推断化学键的类型
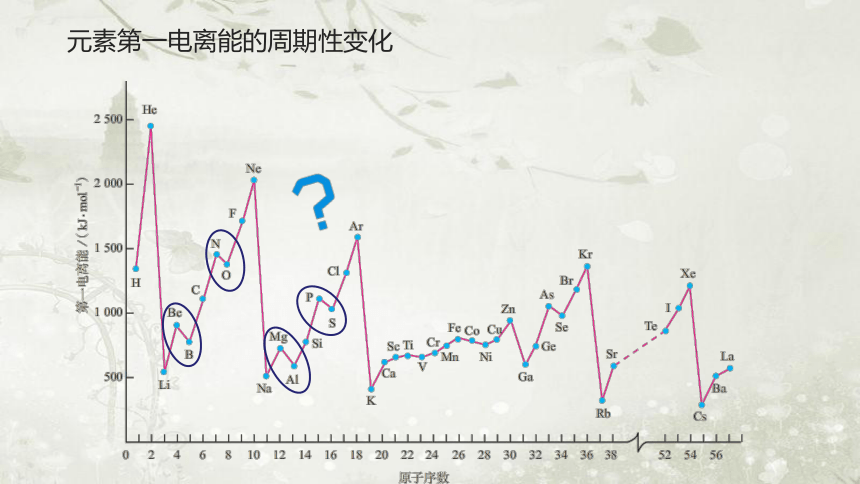
元素第一电离能的周期性变化
1.电离能
气态基态原子或气态基态离子失去一个电子所需要的最小能量。
符号: I 单位: kJ·mol-1
2.意义
可利用电离能数值判断金属元素的原子在气态时失去电子的难易程度。
电离能数值越大,该气态原子越难失去电子。
电离能数值越小,该气态原子越容易失去电子。
元素第一电离能的周期性变化
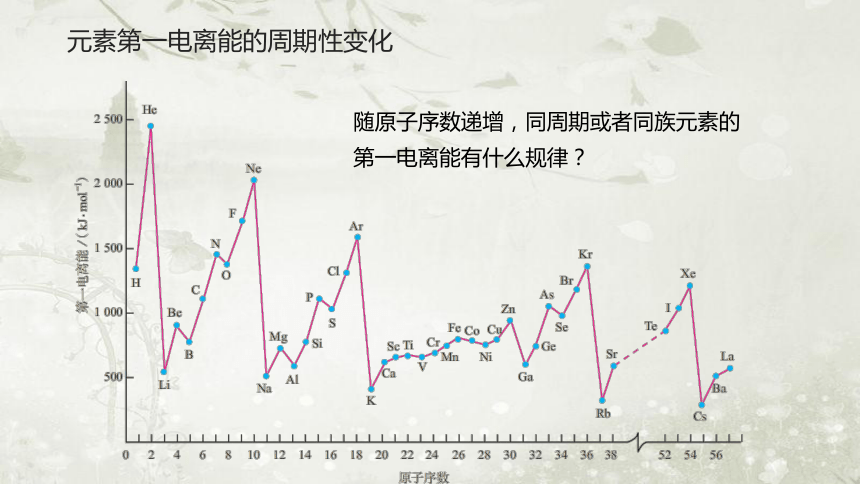
随原子序数递增,同周期或者同族元素的第一电离能有什么规律?
元素第一电离能的周期性变化
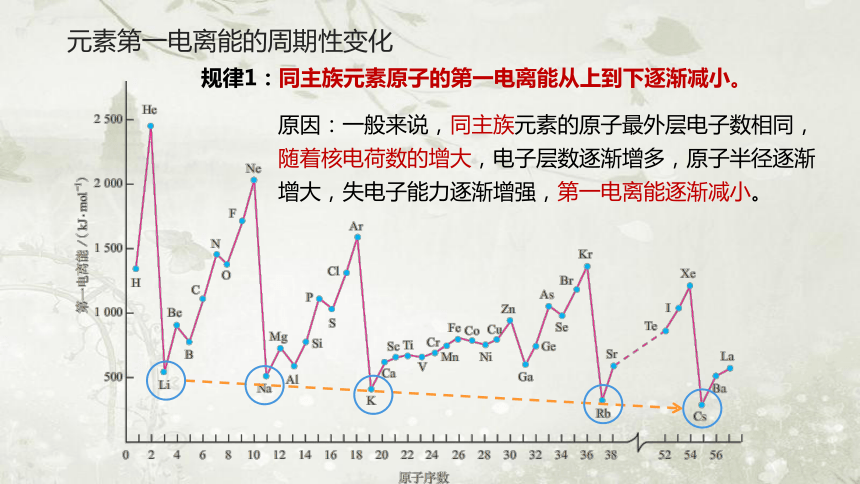
原因:一般来说,同主族元素的原子最外层电子数相同,随着核电荷数的增大,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,第一电离能逐渐减小。
规律1:同主族元素原子的第一电离能从上到下逐渐减小。
元素第一电离能的周期性变化
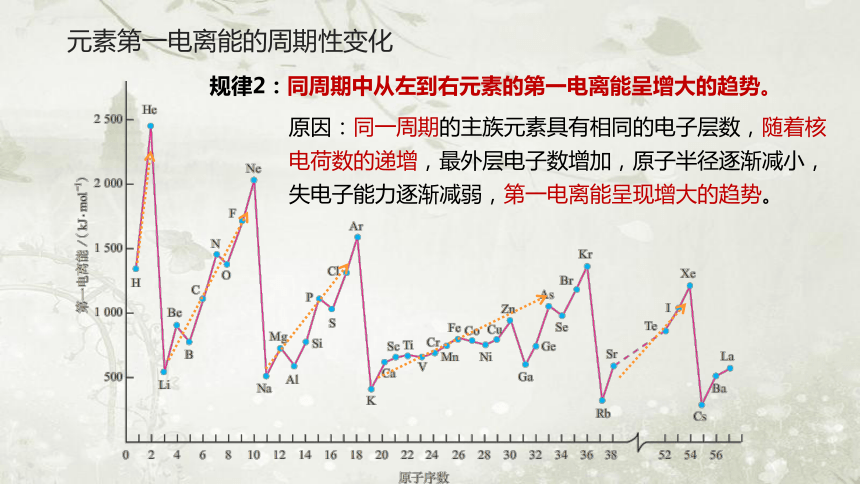
原因:同一周期的主族元素具有相同的电子层数,随着核电荷数的递增,最外层电子数增加,原子半径逐渐减小,失电子能力逐渐减弱,第一电离能呈现增大的趋势。
规律2:同周期中从左到右元素的第一电离能呈增大的趋势。
元素第一电离能的周期性变化
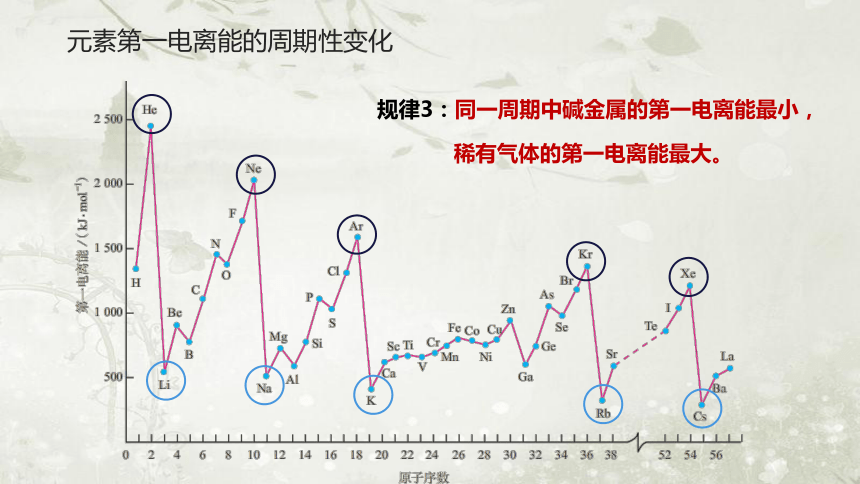
规律3:同一周期中碱金属的第一电离能最小,
稀有气体的第一电离能最大。
元素第一电离能的周期性变化
交流与讨论
请书写出Mg与Al的外围电子排布式,试比较其第一电离能大小
请书写出P与S的外围电子排布式,试比较其第一电离能大小
试总结出元素第一电离能变化的一般规律
Mg :
[Ne]3s2
Al :
[Ne]3s23p1
Mg在2s能级上有两个电子,为全充满的稳定结构,故第一电离能大于Al。
P :
[Ne]3s23p3
S :
[Ne]3s23p4
P在3p能级上有三个电子,为半充满的稳定结构,故第一电离能大于S。
规律4:具有全充满、半充满及全空的电子构型的原子稳定性较高,其第一电离能数值较大。
元素第一电离能的周期性变化
规律1:同主族元素原子的第一电离能从上到下逐渐减小。
规律2:同周期中从左到右元素的第一电离能呈增大的趋势。
规律3:同一周期中碱金属的第一电离能最小,稀有气体的第一电离能最大。
规律4:具有全充满、半充满及全空的电子构型的原子稳定性较高,其第一电离能数值较大。
第三周期元素第一电离能的大小关系为:Na<Al<Mg<Si<S<P<Cl<Ar
第二周期元素第一电离能的大小关系为:Li<B<Be<C<O<N<F<Ne
元素第一电离能的周期性变化
M(g)==M+(g)+e- I1(第一电离能)
M+(g) ==M2+(g)+e- I2(第二电离能)
M2+(g)== M3+ (g)+e- I3(第三电离能)
3.元素的逐级电离能
电离能
I1
I3
I2
铍
原
子
同一原子:I1当相邻逐级电离能突然变大时,说明失去的电子所在电子层发生了变化
元素第一电离能的周期性变化
请试着解释:为什么钠元素的原子容易形成Na+,而不易形成Na2+,
镁元素的原子易形成Mg2+,而不易形成Mg3+?
这些数据与Na、Mg、Al的化合价有什么关系
元素第一电离能的周期性变化
4.电离能的应用
确定元素原子的核外电子排布
判断主族元素的最高正化合价或最外层电子数
判断元素的金属性、非金属性强弱
为什么钠与氯元素以离子键结合形成离子化合物,氢元素与氯元素以共价键结合形成共价化合物?
成键原子吸引电子能力的差异,决定了形成化学键的类型。
为什么氟无正价?
美国化学家鲍林于1932年首先提出了用电负性来衡量元素在化合物中吸引电子的能力。他指定氟的电负性为4.0,并以此为标准来确定其他元素的电负性。
元素电负性的周期性变化
1.电负性
衡量元素在化合物中吸引电子的能力。
电负性越大的原子,对键合电子的吸引力越大。
随原子序数递增,元素的电负性同周期或者同族有什么规律?
元素电负性的周期性变化
同一周期,主族元素的电负性从左到右依次增大,表明其吸引电子的能力逐渐增强,非金属性逐渐增强。
同一主族,元素的电负性从上到下呈现减小的趋势,表明其吸引电子的能力逐渐减弱,金属性逐渐增强。
元素电负性的周期性变化
2.电负性的应用
①判断元素的金属性与非金属性的强弱
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱。
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
元素电负性的周期性变化
2.电负性的应用
②判断共价化合物中元素的化合价的正负
H
C
H
H
H
CH4
-4
+1
显负价
显正价
H
Si
H
H
H
SiH4
+4 -1
显正价
显负价
请指出下列化合物中化合价为正值的元素
CH4 NaH NF3 NH3 SO2 H2S ICl HBr
元素电负性的周期性变化
2.电负性的应用
判断化学键的类型
电负性的差值较大 离子键
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性 0.9
3.0
电负性的差值较小 共价键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性 2.1
2.5
+
H
H
离子键
(相差>1.7)
共价键
(相差<1.7)
但也有特例(如HF)
但也有特例(如NaH)
(1)电负性1.8不能作为划分金属和非金属的绝对标准,部分金属元素的电负性大于1.8。
(2)元素的电负性的值是相对量,没有单位。
(3)不是所有电负性差值大于1.7的元素间都能形成离子键,电负性差值小于1.7的元素间都能形成共价键。如Na、H、F的电负性分别是0.9、2.1、4.0,Na与H的电负性差值为1.2,NaH中存在离子键,H与F的电负性差值为1.9,HF中存在共价键。
电负性应用的局限性
元素电负性的周期性变化
3.对角线规则
有人从元素的电负性值相近解释“对角线”规则:
锂1.0、镁1.2;
铍1.5、铝1.5;
硼2.0、硅1.8。
锂和镁的相似性:
① 在氧气中燃烧生成氧化物,而其他碱金属则生成过氧化物、超氧化物;
② 能直接与氮作用,生成氮化物Li3N、Mg3N2,而其他碱金属不与氮直接反应;③ 氟化物、碳酸盐、磷酸盐都难溶于水,而其他碱金属的相应盐易溶于水等。
铍和铝的相似性:
① 单质在冷的浓硝酸中钝化;
② 氧化物、氢氧化物都有两性;
③ 氯化物都是共价化合物,易汽化,能升华,能溶于有机溶剂等。
硼和硅的相似性:
① 硼和硅的密度分别为2.35 g·cm-3 和2.336 g·cm-3,两者相近;
② 硼和硅的氢化物在常温下都是气体,都能直接被水氧化;
③ 最高价氧化物的水化物都是酸等。
电负性
金属性
应用
金属性/非金属性
元素类型
第一电离能、电负性呈现周期性的递变
非金属性
化学键类型
化合价
第一电离能
应用
确定元素原子的核外电子排布
判断主族元素的最高正化合价或最外层电子数
判断元素的金属性、非金属性强弱
1.下列各元素,最易形成离子化合物的是( )
①第3周期第一电离能最小的元素
②外围电子构型为2s22p6的原子
③2p轨道为半满的元素
④电负性最大的元素
A.①② B.③④ C.②③ D.①④
D
2.下列说法不正确的是( )
A.第ⅠA族元素的电负性从上到下逐渐减小,而第ⅦA族元素的电负性从上到下逐渐增大
B.电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度
C.元素的电负性越大,表示其原子在化合物中吸引电子的能力越强
D.NaH的存在能支持可将氢元素放在第 ⅦA 族的观点
A
3.下列四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5,
则下列有关比较正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>②>①>③
D.最高正化合价:④>③=②>①
A
4.已知X、Y元素同周期,且电负性:X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y可能小于X
C.最高价含氧酸的酸性:X<Y
D.气态氢化物的稳定性:HmY<HnX
C
元素第一电离能与
电负性的周期性变化
1.解释主族元素第一电离能、电负性变化的一般规律
2.能利用电负性判断周期表中元素性质递变规律
3.能利用电负性推断化学键的类型
元素第一电离能的周期性变化
1.电离能
气态基态原子或气态基态离子失去一个电子所需要的最小能量。
符号: I 单位: kJ·mol-1
2.意义
可利用电离能数值判断金属元素的原子在气态时失去电子的难易程度。
电离能数值越大,该气态原子越难失去电子。
电离能数值越小,该气态原子越容易失去电子。
元素第一电离能的周期性变化
随原子序数递增,同周期或者同族元素的第一电离能有什么规律?
元素第一电离能的周期性变化
原因:一般来说,同主族元素的原子最外层电子数相同,随着核电荷数的增大,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,第一电离能逐渐减小。
规律1:同主族元素原子的第一电离能从上到下逐渐减小。
元素第一电离能的周期性变化
原因:同一周期的主族元素具有相同的电子层数,随着核电荷数的递增,最外层电子数增加,原子半径逐渐减小,失电子能力逐渐减弱,第一电离能呈现增大的趋势。
规律2:同周期中从左到右元素的第一电离能呈增大的趋势。
元素第一电离能的周期性变化
规律3:同一周期中碱金属的第一电离能最小,
稀有气体的第一电离能最大。
元素第一电离能的周期性变化
交流与讨论
请书写出Mg与Al的外围电子排布式,试比较其第一电离能大小
请书写出P与S的外围电子排布式,试比较其第一电离能大小
试总结出元素第一电离能变化的一般规律
Mg :
[Ne]3s2
Al :
[Ne]3s23p1
Mg在2s能级上有两个电子,为全充满的稳定结构,故第一电离能大于Al。
P :
[Ne]3s23p3
S :
[Ne]3s23p4
P在3p能级上有三个电子,为半充满的稳定结构,故第一电离能大于S。
规律4:具有全充满、半充满及全空的电子构型的原子稳定性较高,其第一电离能数值较大。
元素第一电离能的周期性变化
规律1:同主族元素原子的第一电离能从上到下逐渐减小。
规律2:同周期中从左到右元素的第一电离能呈增大的趋势。
规律3:同一周期中碱金属的第一电离能最小,稀有气体的第一电离能最大。
规律4:具有全充满、半充满及全空的电子构型的原子稳定性较高,其第一电离能数值较大。
第三周期元素第一电离能的大小关系为:Na<Al<Mg<Si<S<P<Cl<Ar
第二周期元素第一电离能的大小关系为:Li<B<Be<C<O<N<F<Ne
元素第一电离能的周期性变化
M(g)==M+(g)+e- I1(第一电离能)
M+(g) ==M2+(g)+e- I2(第二电离能)
M2+(g)== M3+ (g)+e- I3(第三电离能)
3.元素的逐级电离能
电离能
I1
I3
I2
铍
原
子
同一原子:I1
元素第一电离能的周期性变化
请试着解释:为什么钠元素的原子容易形成Na+,而不易形成Na2+,
镁元素的原子易形成Mg2+,而不易形成Mg3+?
这些数据与Na、Mg、Al的化合价有什么关系
元素第一电离能的周期性变化
4.电离能的应用
确定元素原子的核外电子排布
判断主族元素的最高正化合价或最外层电子数
判断元素的金属性、非金属性强弱
为什么钠与氯元素以离子键结合形成离子化合物,氢元素与氯元素以共价键结合形成共价化合物?
成键原子吸引电子能力的差异,决定了形成化学键的类型。
为什么氟无正价?
美国化学家鲍林于1932年首先提出了用电负性来衡量元素在化合物中吸引电子的能力。他指定氟的电负性为4.0,并以此为标准来确定其他元素的电负性。
元素电负性的周期性变化
1.电负性
衡量元素在化合物中吸引电子的能力。
电负性越大的原子,对键合电子的吸引力越大。
随原子序数递增,元素的电负性同周期或者同族有什么规律?
元素电负性的周期性变化
同一周期,主族元素的电负性从左到右依次增大,表明其吸引电子的能力逐渐增强,非金属性逐渐增强。
同一主族,元素的电负性从上到下呈现减小的趋势,表明其吸引电子的能力逐渐减弱,金属性逐渐增强。
元素电负性的周期性变化
2.电负性的应用
①判断元素的金属性与非金属性的强弱
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱。
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
元素电负性的周期性变化
2.电负性的应用
②判断共价化合物中元素的化合价的正负
H
C
H
H
H
CH4
-4
+1
显负价
显正价
H
Si
H
H
H
SiH4
+4 -1
显正价
显负价
请指出下列化合物中化合价为正值的元素
CH4 NaH NF3 NH3 SO2 H2S ICl HBr
元素电负性的周期性变化
2.电负性的应用
判断化学键的类型
电负性的差值较大 离子键
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性 0.9
3.0
电负性的差值较小 共价键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性 2.1
2.5
+
H
H
离子键
(相差>1.7)
共价键
(相差<1.7)
但也有特例(如HF)
但也有特例(如NaH)
(1)电负性1.8不能作为划分金属和非金属的绝对标准,部分金属元素的电负性大于1.8。
(2)元素的电负性的值是相对量,没有单位。
(3)不是所有电负性差值大于1.7的元素间都能形成离子键,电负性差值小于1.7的元素间都能形成共价键。如Na、H、F的电负性分别是0.9、2.1、4.0,Na与H的电负性差值为1.2,NaH中存在离子键,H与F的电负性差值为1.9,HF中存在共价键。
电负性应用的局限性
元素电负性的周期性变化
3.对角线规则
有人从元素的电负性值相近解释“对角线”规则:
锂1.0、镁1.2;
铍1.5、铝1.5;
硼2.0、硅1.8。
锂和镁的相似性:
① 在氧气中燃烧生成氧化物,而其他碱金属则生成过氧化物、超氧化物;
② 能直接与氮作用,生成氮化物Li3N、Mg3N2,而其他碱金属不与氮直接反应;③ 氟化物、碳酸盐、磷酸盐都难溶于水,而其他碱金属的相应盐易溶于水等。
铍和铝的相似性:
① 单质在冷的浓硝酸中钝化;
② 氧化物、氢氧化物都有两性;
③ 氯化物都是共价化合物,易汽化,能升华,能溶于有机溶剂等。
硼和硅的相似性:
① 硼和硅的密度分别为2.35 g·cm-3 和2.336 g·cm-3,两者相近;
② 硼和硅的氢化物在常温下都是气体,都能直接被水氧化;
③ 最高价氧化物的水化物都是酸等。
电负性
金属性
应用
金属性/非金属性
元素类型
第一电离能、电负性呈现周期性的递变
非金属性
化学键类型
化合价
第一电离能
应用
确定元素原子的核外电子排布
判断主族元素的最高正化合价或最外层电子数
判断元素的金属性、非金属性强弱
1.下列各元素,最易形成离子化合物的是( )
①第3周期第一电离能最小的元素
②外围电子构型为2s22p6的原子
③2p轨道为半满的元素
④电负性最大的元素
A.①② B.③④ C.②③ D.①④
D
2.下列说法不正确的是( )
A.第ⅠA族元素的电负性从上到下逐渐减小,而第ⅦA族元素的电负性从上到下逐渐增大
B.电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度
C.元素的电负性越大,表示其原子在化合物中吸引电子的能力越强
D.NaH的存在能支持可将氢元素放在第 ⅦA 族的观点
A
3.下列四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5,
则下列有关比较正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>②>①>③
D.最高正化合价:④>③=②>①
A
4.已知X、Y元素同周期,且电负性:X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y可能小于X
C.最高价含氧酸的酸性:X<Y
D.气态氢化物的稳定性:HmY<HnX
C
