苏教版高中化学选择性必修2专题3微粒间作用力与物质性质3.4.3晶体性质的比较及类型判断课件(13张)
文档属性
| 名称 | 苏教版高中化学选择性必修2专题3微粒间作用力与物质性质3.4.3晶体性质的比较及类型判断课件(13张) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 08:24:46 | ||
图片预览





文档简介
(共13张PPT)
专题3 微粒间作用力与物质性质
第四单元 分子间作用力 分子晶体
第三课时 晶体性质的比较及类型判断
晶体的共性与个性
金属晶体、离子晶体、共价晶体和分子晶体是最常见的晶体类型。但不论上述晶体颗粒的大小如何,晶体内部结构均是由原子、离子或分子按周期性规律重复排列组成的。因此,在研究这些晶体类型时,我们均可通过研究能够反映晶体结构特征的基本重复单位——晶胞来进行。
晶体具有周期性结构的这一特征,使得不同的晶体具有以下共性:(1)晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等;(2)晶体总能自发地形成多面体外形;(3)晶体都具有确定的熔点。
除具有以上共性外,不同类型的晶体因构成微粒及其相互作用力的不同,常常表现出各自的特性。例如,绝大多数金属晶体是电和热的良导体,延展性好;食盐为离子晶体,质脆,熔融状态下能导电; 金刚石为共价晶体,无色透明、坚硬、质脆,常温下不导电;干冰属于分子晶体,只能在低温下存在。
关注共性与个性的结合 ,是研究各类晶体重要的思想方法。
学科提炼
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结
构 构成微粒 金属阳离子、自由电子 阴、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
可能存在的
其他作用力 无 共价键
无 共价键
决定作用力
强弱的因素 原子半径越小,金属离子所带电荷数越多,金属键就越强 离子半径越小,离子所带电荷数越多,离子键就越强 成键原子半径越小,键长越短,共价键就越强
有氢键时,主要由氢键决定。无氢键时,当组成和结构相似时,由相对分子质量的大小决定
*
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
性
质 熔、沸点 差异较大 高 很高 低
硬 度 差异较大 硬而脆 很大 小
导电性 导电 熔化或溶于水导电 一般不导电,硅是半导体 固体及熔融状态不导电,有的溶于水能导电。
溶解性 难溶(Na等与水反应) 溶解性差异很大 难溶解 相似相溶
举 例 金属、
金属合金
离子化合物 金刚石、Si、SiO2、SiC 硫、干冰、冰、C60、冰醋酸、蔗糖
分子晶体
干冰
冰
共价晶体
金刚石
离子晶体
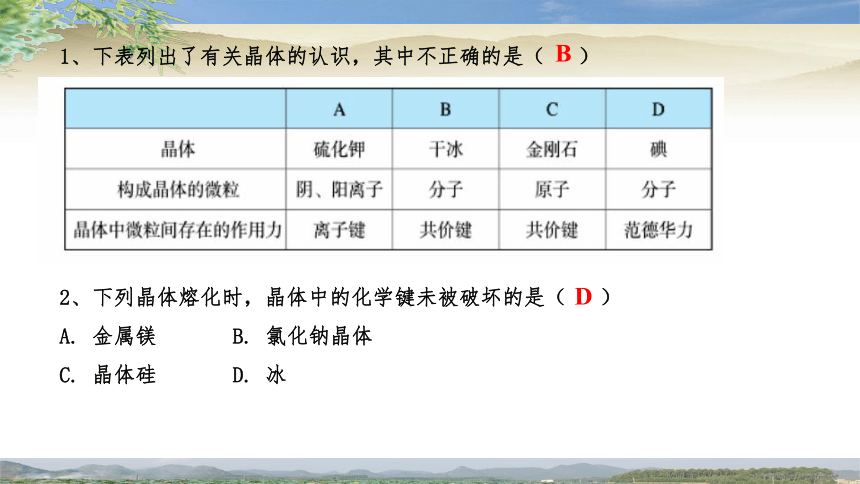
1、下表列出了有关晶体的认识,其中不正确的是( )
B
2、下列晶体熔化时,晶体中的化学键未被破坏的是( )
A. 金属镁 B. 氯化钠晶体
C. 晶体硅 D. 冰
D
3、下列各组物质中,化学键类型与晶体类型均相同的是( )
A. NaCl、NaOH B. SiO2、SO2
C. Na2CO3、KClO3 D. H2O2、Na2O2
C
4、分析下列物质的物理性质,判断其晶体类型。
(1)碳化铝,黄色晶体,熔点2200℃,熔融态不导电:________________。
(2)溴化铝,无色晶体,熔点98 ℃,熔融态不导电:________________。
(3)五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:______。
(4)溴化钾,无色晶体,熔融时或溶于水中都能导电:________________。
共价晶体
分子晶体
分子晶体
离子晶体
判断晶体类型方法:①依据组成晶体的粒子和粒子间的作用力判断;
②依据性质(熔沸点、导电性等)判断。
同种类型晶体熔、沸点的比较
离子晶体 一般的说,离子半径越小,阴、阳离子所带电荷数越多,离子键越强,其熔、沸点越高,如熔点:MgO>MgCl2,NaCl>CsCl
共价晶体 原子半径越小,键长越短,键能越大,晶体的熔、沸点越高,如熔点:金刚石>碳化硅>晶体硅
分子晶体 ①、具有分子间氢键的分子晶体,熔沸点较高,如H2O>H2Te>H2Se>H2S,都有氢键,比较数目的多少;②、组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4;③、组成和结构不相似的分子晶体(相对分子质量接近)分子的极性越大,熔、沸点越高,如CO>N2;④、同分异构体,支链越多,熔、沸点越低。
金属晶体 一般来说,金属阳离子半径越小,离子所带电荷数越多,其金属键越强,金属熔、沸点越高,如熔、沸点:Na1、下列化合物,按其晶体的熔点由高到低排列正确的是( )
A. CsCl、KCl、NaCl B. SiCl4、SiF4、SiH4
C. H2Se、H2S、H2O D. 晶体硅、碳化硅、金刚石
晶体熔沸点高低的比较:首先看物质的状态,一般情况下固体>液体>气体;
二是看物质所属的晶体类型,一般是共价晶体>离子晶体>分子晶体;(3)同种类型晶体的熔、沸点的比较。
;
B
2、Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 ﹣24.12 38.3 155
TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高。
3、一些氧化物的熔点如下表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/°C 1570 2800 23.8 75.5
解释表中氧化物之间熔点差异的原因 。
由于Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O,分子间力(分子量)P4O6>SO2,所以熔点大小顺序是MgO>Li2O>P4O6>SO2;
4、甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是________。
甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多。
晶体的配位数的确定
晶体的配位数是指晶体中一个原子周围与其等距离的最邻近的原子的数目。
1.最密堆积晶体的配位数均为12,如分子晶体中的干冰。
2.金刚石、碳化硅,配位数均为4。
3.金属晶体
4.离子晶体中的配位数是指一个离子周围最近的异电性离子的数目
注意:化学式中的原子个数比等于晶胞中对应原子配位数的反比
1、Ca2+的配位数为: 。
6
2、LaH2晶体中La的配位数为: 。
8
8
专题3 微粒间作用力与物质性质
第四单元 分子间作用力 分子晶体
第三课时 晶体性质的比较及类型判断
晶体的共性与个性
金属晶体、离子晶体、共价晶体和分子晶体是最常见的晶体类型。但不论上述晶体颗粒的大小如何,晶体内部结构均是由原子、离子或分子按周期性规律重复排列组成的。因此,在研究这些晶体类型时,我们均可通过研究能够反映晶体结构特征的基本重复单位——晶胞来进行。
晶体具有周期性结构的这一特征,使得不同的晶体具有以下共性:(1)晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等;(2)晶体总能自发地形成多面体外形;(3)晶体都具有确定的熔点。
除具有以上共性外,不同类型的晶体因构成微粒及其相互作用力的不同,常常表现出各自的特性。例如,绝大多数金属晶体是电和热的良导体,延展性好;食盐为离子晶体,质脆,熔融状态下能导电; 金刚石为共价晶体,无色透明、坚硬、质脆,常温下不导电;干冰属于分子晶体,只能在低温下存在。
关注共性与个性的结合 ,是研究各类晶体重要的思想方法。
学科提炼
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结
构 构成微粒 金属阳离子、自由电子 阴、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
可能存在的
其他作用力 无 共价键
无 共价键
决定作用力
强弱的因素 原子半径越小,金属离子所带电荷数越多,金属键就越强 离子半径越小,离子所带电荷数越多,离子键就越强 成键原子半径越小,键长越短,共价键就越强
有氢键时,主要由氢键决定。无氢键时,当组成和结构相似时,由相对分子质量的大小决定
*
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
性
质 熔、沸点 差异较大 高 很高 低
硬 度 差异较大 硬而脆 很大 小
导电性 导电 熔化或溶于水导电 一般不导电,硅是半导体 固体及熔融状态不导电,有的溶于水能导电。
溶解性 难溶(Na等与水反应) 溶解性差异很大 难溶解 相似相溶
举 例 金属、
金属合金
离子化合物 金刚石、Si、SiO2、SiC 硫、干冰、冰、C60、冰醋酸、蔗糖
分子晶体
干冰
冰
共价晶体
金刚石
离子晶体
1、下表列出了有关晶体的认识,其中不正确的是( )
B
2、下列晶体熔化时,晶体中的化学键未被破坏的是( )
A. 金属镁 B. 氯化钠晶体
C. 晶体硅 D. 冰
D
3、下列各组物质中,化学键类型与晶体类型均相同的是( )
A. NaCl、NaOH B. SiO2、SO2
C. Na2CO3、KClO3 D. H2O2、Na2O2
C
4、分析下列物质的物理性质,判断其晶体类型。
(1)碳化铝,黄色晶体,熔点2200℃,熔融态不导电:________________。
(2)溴化铝,无色晶体,熔点98 ℃,熔融态不导电:________________。
(3)五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:______。
(4)溴化钾,无色晶体,熔融时或溶于水中都能导电:________________。
共价晶体
分子晶体
分子晶体
离子晶体
判断晶体类型方法:①依据组成晶体的粒子和粒子间的作用力判断;
②依据性质(熔沸点、导电性等)判断。
同种类型晶体熔、沸点的比较
离子晶体 一般的说,离子半径越小,阴、阳离子所带电荷数越多,离子键越强,其熔、沸点越高,如熔点:MgO>MgCl2,NaCl>CsCl
共价晶体 原子半径越小,键长越短,键能越大,晶体的熔、沸点越高,如熔点:金刚石>碳化硅>晶体硅
分子晶体 ①、具有分子间氢键的分子晶体,熔沸点较高,如H2O>H2Te>H2Se>H2S,都有氢键,比较数目的多少;②、组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4;③、组成和结构不相似的分子晶体(相对分子质量接近)分子的极性越大,熔、沸点越高,如CO>N2;④、同分异构体,支链越多,熔、沸点越低。
金属晶体 一般来说,金属阳离子半径越小,离子所带电荷数越多,其金属键越强,金属熔、沸点越高,如熔、沸点:Na
A. CsCl、KCl、NaCl B. SiCl4、SiF4、SiH4
C. H2Se、H2S、H2O D. 晶体硅、碳化硅、金刚石
晶体熔沸点高低的比较:首先看物质的状态,一般情况下固体>液体>气体;
二是看物质所属的晶体类型,一般是共价晶体>离子晶体>分子晶体;(3)同种类型晶体的熔、沸点的比较。
;
B
2、Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 ﹣24.12 38.3 155
TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高。
3、一些氧化物的熔点如下表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/°C 1570 2800 23.8 75.5
解释表中氧化物之间熔点差异的原因 。
由于Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O,分子间力(分子量)P4O6>SO2,所以熔点大小顺序是MgO>Li2O>P4O6>SO2;
4、甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是________。
甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多。
晶体的配位数的确定
晶体的配位数是指晶体中一个原子周围与其等距离的最邻近的原子的数目。
1.最密堆积晶体的配位数均为12,如分子晶体中的干冰。
2.金刚石、碳化硅,配位数均为4。
3.金属晶体
4.离子晶体中的配位数是指一个离子周围最近的异电性离子的数目
注意:化学式中的原子个数比等于晶胞中对应原子配位数的反比
1、Ca2+的配位数为: 。
6
2、LaH2晶体中La的配位数为: 。
8
8
