苏教版高中化学选择性必修2专题4分子空间结构与物质性质4.1.3杂化轨道类型和分子空间结构的判断方法课件(34张)
文档属性
| 名称 | 苏教版高中化学选择性必修2专题4分子空间结构与物质性质4.1.3杂化轨道类型和分子空间结构的判断方法课件(34张) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 08:25:52 | ||
图片预览






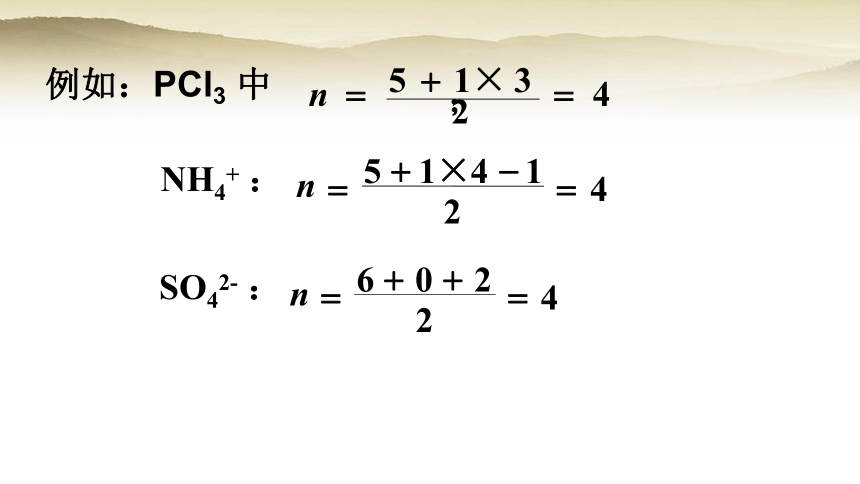
文档简介
(共34张PPT)
专题4 分子空间结构与物质性质
第一单元 分子的空间结构构型
第3课时 杂化轨道类型和分子空间结构的判断
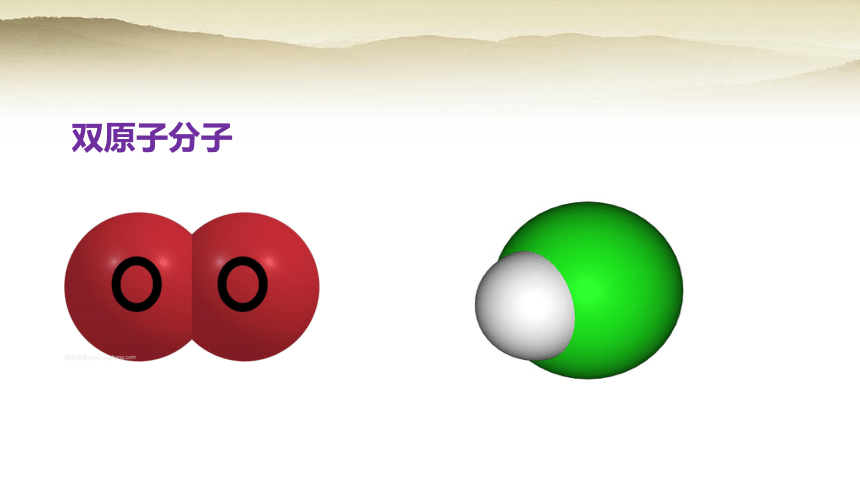
双原子分子
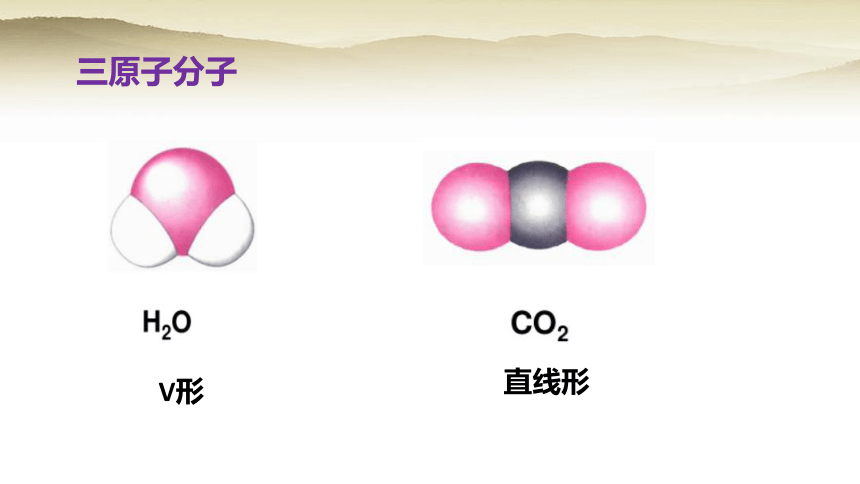
三原子分子
V形
直线形
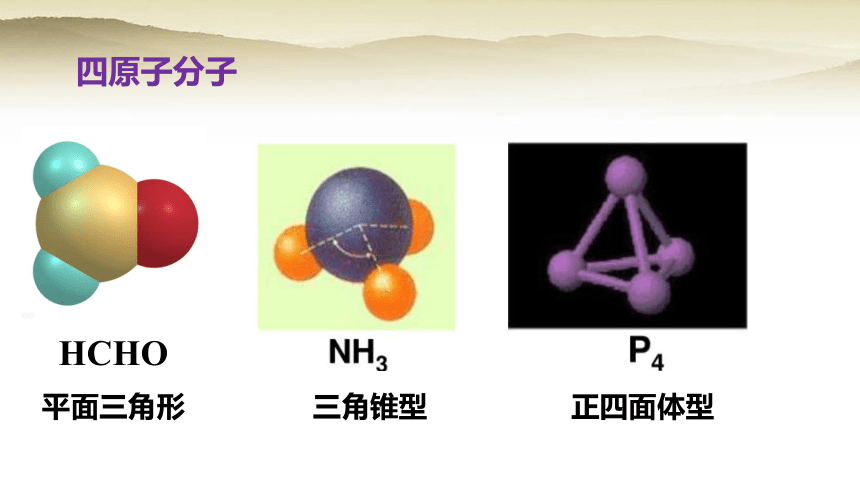
四原子分子
三角锥型
正四面体型
HCHO
平面三角形
五原子分子
正四面体型
分子结构呈现多样性,我们可以通过X射线衍射、波谱等实验手段进行测定,也可以根据相关的理论进行解释或预测。
思考:为什么甲烷是正四面体结构,而不是平面形结构呢?
共价分子的几何外形取决于分子价层电子对数目和类型。分子的价电子对【包括成键电子对(σ键)和孤电子对】由于相互排斥作用,而趋向尽可能远离以减小斥力而采取对称的空间构型,使分子体系能量最低。
一、价层电子对互斥理论(VSEPR)
价电子对数 气球模拟
几何构型 几何构型
实例
2对
3对
4对
直线型
平面三角形
正四面体
BeCl2
BF3
CH4
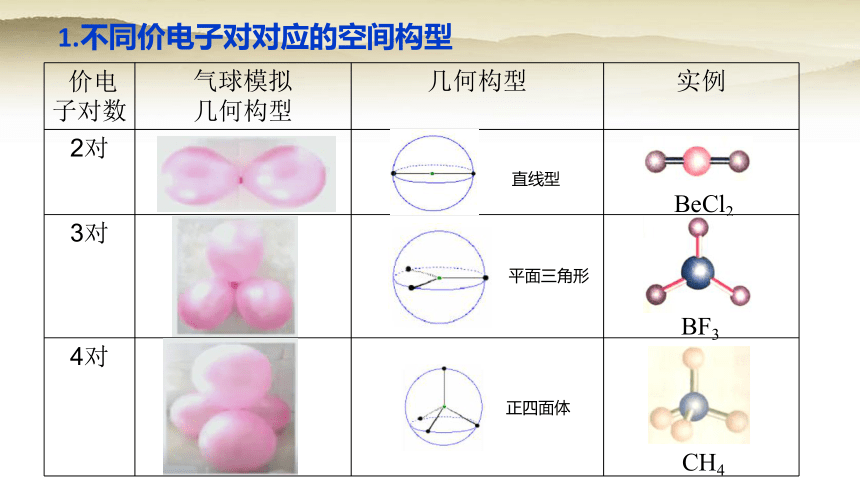
1.不同价电子对对应的空间构型
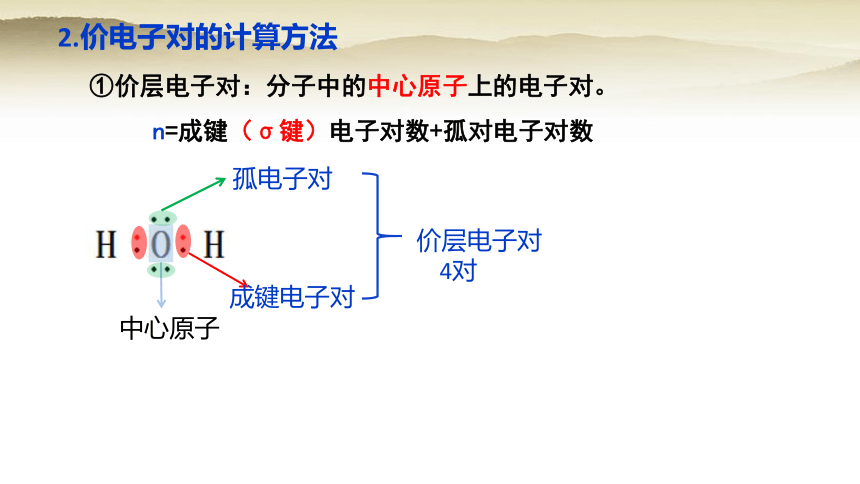
2.价电子对的计算方法
中心原子
孤电子对
成键电子对
价层电子对
4对
①价层电子对:分子中的中心原子上的电子对。
n=成键(σ键)电子对数+孤对电子对数
2对
(σ键)
3(σ键)+1=4对
3对(σ键)
练习:计算下列物质的价层电子对数
n=成键(σ键)电子对数+孤对电子对数
方法:成键电子对数(σ键)=中心原子周围的配位原子个数
②ABm型分子的价电子对数n的确定
注意事项:
(1)对于主族元素,中心原子A价电子数=最外层电子数
(2)对于配位原子B提供价电子对数
H F、 Cl 、 Br 、I O 、 S
1个 1 个 0个
(3)离子的价电子对数计算
=
2
中心原子A的价电子数+配位原子B提供的价电子数×m
n
=
2
中心原子A的价电子数+配位原子B提供的价电子数×m-离子电荷数
n
阳离子:
=
2
中心原子A的价电子数+配位原子B提供的价电子数×m+离子电荷数
n
阴离子:
SO42- :
例如:PCl3 中
;
4
2
3
1×
5
=
+
=
n
NH4+ :
4
2
1
4
1×
5
=
-
+
=
n
4
2
2
0
6
=
+
+
=
n
练习:试计算CH4 、NH3 、H2O价层电子对数,预测它们的空间构型。
CH4 、NH3 、H2O价层电子对数均为4,它们的VSEPR模型均为为正四面体,但是实际上它们的分子模型为
思考:为什么分子模型与VSEPR模型不一致呢?
CH4 NH3 H2O
电子式
价层电子对数
孤电子对数
分子空间模型
键角
0对
1对
2对
正四面体
三角锥型
V形
4对
4对
4对
109°28′
107°18′
104°30′
结论:
1.对于中心原子的价层电子对中若无孤电子对,
则分子的空间构型=VSEPR模型
2.若中心原子的价层电子对中有孤电子对,
则分子的空间构型=VSEPR模型-孤电子对占有的空间
3.孤电子对对成键电子对的排斥作用增强,使得成键电子对之间的键角被“压缩”而减小。
分子空间结构的确定思路
计算中心原子的价电子对数
VSEPR模型
略去孤电子对占有的空间
有孤电子对
无孤电子对
分子空间 = VSEPR模型
结构
分子空间结构
思考:甲烷分子中的C原子的电子排布式是1s22s22p2,理论上只能形成两个共价键,但是甲烷的空间构型是正四面体型,与4个H原子形成4个共价键,怎么解释?
激发
sp3
与4个H原子的1s轨道重叠
在形成分子时,由于原子的相互影响,原子内部几个不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道叫做杂化轨道。
二、杂化轨道理论
杂化轨道理论注意要点:
②杂化只有在形成分子的过程中才会发生,孤立的原子本身并不会杂化。原子形成分子时,通常存在激发、杂化和轨道重叠等过程。
①发生轨道杂化的原子一定是中心原子。
③杂化轨道中的变与不变
⑤杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对。
变:轨道成分、能量、形状、方向
不变:轨道的数量
④杂化轨道有利于成键时轨道的最大重叠。满足最小排斥、最大夹角分布。
杂化类型 sp sp2 sp3
轨道组成 1个ns
1个np 1个ns
2个np 1个ns
3个np
杂化轨道示意图及轨道夹角
分子结构 直线形 平面三角形 正四面体
交流与讨论:
利用价层电子对互斥理论预测BeCl2、BF3的空间结构,并用原子轨道杂化理论解释。
BF3
B:1s22s22p1
BeCl2
Be:1s22s2
学以致用
请用杂化轨道理论分析乙烷、乙烯和乙炔分子的成键情况。
乙烷
C原子均采用sp3杂化,每个C原子的3个sp3轨道与3个H原子的1s轨道重叠成3个C-Hσ键:2个C原子各以1个sp3轨道重叠成一个C-Cσ键。
C原子均采用sp2杂化,每个C原子的2个sp2轨道与2个H原子的1s轨道重叠成2个C-Hσ键:2个C原子各以1个sp2轨道重叠成一个C-Cσ键,2个C原子上各1个未杂化的2p轨道,发生重叠,形成1个π键。
C原子均采用sp杂化,每个C原子的1个sp轨道与1个H原子的1s轨道重叠成1个C-Hσ键:2个C原子各以1个sp轨道重叠成一个C-Cσ键,2个C原子上各2个未杂化的2p轨道,发生重叠,形成2个π键。
①根据分子的空间构型逆推
如:CO2为直线形分子,键角180°,C原子杂化轨道类型为sp
C2H4、C6H6为平面形分子,键角为120°,C原子杂化轨道类型为sp2
CCl4为正四面体形,键角109°28′,C原子杂化轨道类型为sp3
②根据价层电子对互斥理论推导
ABm型复杂分子或离子
计算
中心原子A的价电子对数
杂化轨道类型
对比价电子空间构型
中心原子
价层电子对数 价电子对
几何分布 中心原子
杂化轨道类型
2对 直线型 sp
3对 平面三角形 sp2
4对 正四面体 sp3
③根据中心原子成键类型
在有机物中,
饱和碳原子采取sp3杂化,
连接双键的碳原子采取sp2杂化
连接三键的碳原子采取sp杂化
交流并讨论
根据H2O和NH3的分子构型,判断中心原子的杂化方式,并用杂化轨道理论解释。
价电子对数=4对
VSEPR模型
正四面体
O原子为
sp3类型
O:1s22s22p4
sp3不等性杂化
价电子对数=4对
VSEPR模型
正四面体
N原子为
sp3类型
N:1s22s22p3
sp3不等性杂化
分子结构
价层电子对理论
杂化轨道理论
红外光谱、晶体X射线衍射等实验方法
测定
预测
解释
小 结
三、等电子体
等电子体原理:具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,物理性质相似。
等电子体的许多性质相似、空间构型相似,故可用来预测分子的一些性质和空间构型。
例如:CO2、CNS-、NO2+、N3-
原子数相同
价电子数相同
等电子体
CO2为直线形结构,键角180°,中心原子C原子为sp杂化。
CNS-、NO2+、N3-结构与之相同。
等电子体书写规律
N2
SO2
NH3
O3
NO2-
CN-
CO
C22-
H3O+
PH3
NO+
CO2
CS2
NO2+
N2O
1.同族元素互换
2.相邻元素左右移
3.电子电荷相互换
专题4 分子空间结构与物质性质
第一单元 分子的空间结构构型
第3课时 杂化轨道类型和分子空间结构的判断
双原子分子
三原子分子
V形
直线形
四原子分子
三角锥型
正四面体型
HCHO
平面三角形
五原子分子
正四面体型
分子结构呈现多样性,我们可以通过X射线衍射、波谱等实验手段进行测定,也可以根据相关的理论进行解释或预测。
思考:为什么甲烷是正四面体结构,而不是平面形结构呢?
共价分子的几何外形取决于分子价层电子对数目和类型。分子的价电子对【包括成键电子对(σ键)和孤电子对】由于相互排斥作用,而趋向尽可能远离以减小斥力而采取对称的空间构型,使分子体系能量最低。
一、价层电子对互斥理论(VSEPR)
价电子对数 气球模拟
几何构型 几何构型
实例
2对
3对
4对
直线型
平面三角形
正四面体
BeCl2
BF3
CH4
1.不同价电子对对应的空间构型
2.价电子对的计算方法
中心原子
孤电子对
成键电子对
价层电子对
4对
①价层电子对:分子中的中心原子上的电子对。
n=成键(σ键)电子对数+孤对电子对数
2对
(σ键)
3(σ键)+1=4对
3对(σ键)
练习:计算下列物质的价层电子对数
n=成键(σ键)电子对数+孤对电子对数
方法:成键电子对数(σ键)=中心原子周围的配位原子个数
②ABm型分子的价电子对数n的确定
注意事项:
(1)对于主族元素,中心原子A价电子数=最外层电子数
(2)对于配位原子B提供价电子对数
H F、 Cl 、 Br 、I O 、 S
1个 1 个 0个
(3)离子的价电子对数计算
=
2
中心原子A的价电子数+配位原子B提供的价电子数×m
n
=
2
中心原子A的价电子数+配位原子B提供的价电子数×m-离子电荷数
n
阳离子:
=
2
中心原子A的价电子数+配位原子B提供的价电子数×m+离子电荷数
n
阴离子:
SO42- :
例如:PCl3 中
;
4
2
3
1×
5
=
+
=
n
NH4+ :
4
2
1
4
1×
5
=
-
+
=
n
4
2
2
0
6
=
+
+
=
n
练习:试计算CH4 、NH3 、H2O价层电子对数,预测它们的空间构型。
CH4 、NH3 、H2O价层电子对数均为4,它们的VSEPR模型均为为正四面体,但是实际上它们的分子模型为
思考:为什么分子模型与VSEPR模型不一致呢?
CH4 NH3 H2O
电子式
价层电子对数
孤电子对数
分子空间模型
键角
0对
1对
2对
正四面体
三角锥型
V形
4对
4对
4对
109°28′
107°18′
104°30′
结论:
1.对于中心原子的价层电子对中若无孤电子对,
则分子的空间构型=VSEPR模型
2.若中心原子的价层电子对中有孤电子对,
则分子的空间构型=VSEPR模型-孤电子对占有的空间
3.孤电子对对成键电子对的排斥作用增强,使得成键电子对之间的键角被“压缩”而减小。
分子空间结构的确定思路
计算中心原子的价电子对数
VSEPR模型
略去孤电子对占有的空间
有孤电子对
无孤电子对
分子空间 = VSEPR模型
结构
分子空间结构
思考:甲烷分子中的C原子的电子排布式是1s22s22p2,理论上只能形成两个共价键,但是甲烷的空间构型是正四面体型,与4个H原子形成4个共价键,怎么解释?
激发
sp3
与4个H原子的1s轨道重叠
在形成分子时,由于原子的相互影响,原子内部几个不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道叫做杂化轨道。
二、杂化轨道理论
杂化轨道理论注意要点:
②杂化只有在形成分子的过程中才会发生,孤立的原子本身并不会杂化。原子形成分子时,通常存在激发、杂化和轨道重叠等过程。
①发生轨道杂化的原子一定是中心原子。
③杂化轨道中的变与不变
⑤杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对。
变:轨道成分、能量、形状、方向
不变:轨道的数量
④杂化轨道有利于成键时轨道的最大重叠。满足最小排斥、最大夹角分布。
杂化类型 sp sp2 sp3
轨道组成 1个ns
1个np 1个ns
2个np 1个ns
3个np
杂化轨道示意图及轨道夹角
分子结构 直线形 平面三角形 正四面体
交流与讨论:
利用价层电子对互斥理论预测BeCl2、BF3的空间结构,并用原子轨道杂化理论解释。
BF3
B:1s22s22p1
BeCl2
Be:1s22s2
学以致用
请用杂化轨道理论分析乙烷、乙烯和乙炔分子的成键情况。
乙烷
C原子均采用sp3杂化,每个C原子的3个sp3轨道与3个H原子的1s轨道重叠成3个C-Hσ键:2个C原子各以1个sp3轨道重叠成一个C-Cσ键。
C原子均采用sp2杂化,每个C原子的2个sp2轨道与2个H原子的1s轨道重叠成2个C-Hσ键:2个C原子各以1个sp2轨道重叠成一个C-Cσ键,2个C原子上各1个未杂化的2p轨道,发生重叠,形成1个π键。
C原子均采用sp杂化,每个C原子的1个sp轨道与1个H原子的1s轨道重叠成1个C-Hσ键:2个C原子各以1个sp轨道重叠成一个C-Cσ键,2个C原子上各2个未杂化的2p轨道,发生重叠,形成2个π键。
①根据分子的空间构型逆推
如:CO2为直线形分子,键角180°,C原子杂化轨道类型为sp
C2H4、C6H6为平面形分子,键角为120°,C原子杂化轨道类型为sp2
CCl4为正四面体形,键角109°28′,C原子杂化轨道类型为sp3
②根据价层电子对互斥理论推导
ABm型复杂分子或离子
计算
中心原子A的价电子对数
杂化轨道类型
对比价电子空间构型
中心原子
价层电子对数 价电子对
几何分布 中心原子
杂化轨道类型
2对 直线型 sp
3对 平面三角形 sp2
4对 正四面体 sp3
③根据中心原子成键类型
在有机物中,
饱和碳原子采取sp3杂化,
连接双键的碳原子采取sp2杂化
连接三键的碳原子采取sp杂化
交流并讨论
根据H2O和NH3的分子构型,判断中心原子的杂化方式,并用杂化轨道理论解释。
价电子对数=4对
VSEPR模型
正四面体
O原子为
sp3类型
O:1s22s22p4
sp3不等性杂化
价电子对数=4对
VSEPR模型
正四面体
N原子为
sp3类型
N:1s22s22p3
sp3不等性杂化
分子结构
价层电子对理论
杂化轨道理论
红外光谱、晶体X射线衍射等实验方法
测定
预测
解释
小 结
三、等电子体
等电子体原理:具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,物理性质相似。
等电子体的许多性质相似、空间构型相似,故可用来预测分子的一些性质和空间构型。
例如:CO2、CNS-、NO2+、N3-
原子数相同
价电子数相同
等电子体
CO2为直线形结构,键角180°,中心原子C原子为sp杂化。
CNS-、NO2+、N3-结构与之相同。
等电子体书写规律
N2
SO2
NH3
O3
NO2-
CN-
CO
C22-
H3O+
PH3
NO+
CO2
CS2
NO2+
N2O
1.同族元素互换
2.相邻元素左右移
3.电子电荷相互换
