鲁科版高中化学选择性必修1第1章化学反应与能量转化1.1.3反应焓变的计算课件(15张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第1章化学反应与能量转化1.1.3反应焓变的计算课件(15张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 08:49:54 | ||
图片预览




文档简介
(共15张PPT)
第1章 化学反应与能量转化
第1节 化学反应的热效应
第3课时 反应焓变的计算
思考
目前人们已知的化学反应不计其数,而每一个反应在不同温度下的反应焓变不尽相同。
问题1
是否所有反应的焓变都要通过实验测定?
问题2
如何得到C(s) +O2(g)==CO(g)的焓变?
问题3
能否利用一些已知反应的焓变计算其它反应的焓变?
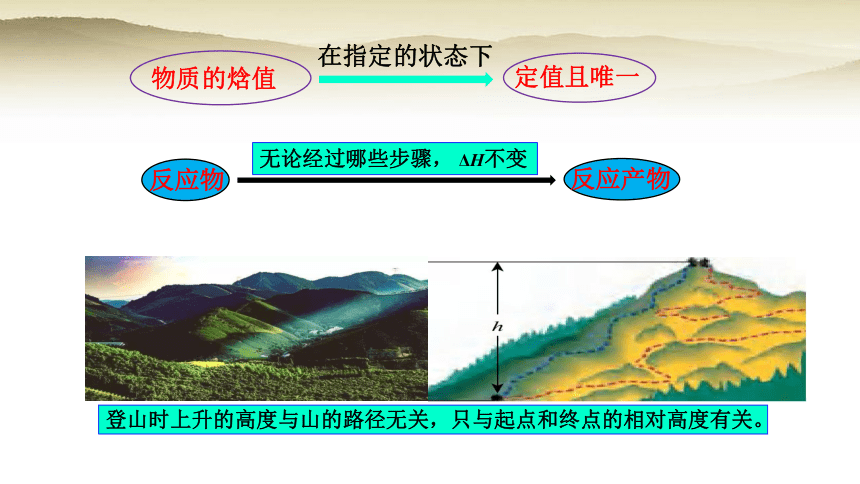
登山时上升的高度与山的路径无关,只与起点和终点的相对高度有关。
物质的焓值
定值且唯一
在指定的状态下
反应物
反应产物
无论经过哪些步骤, ΔH不变
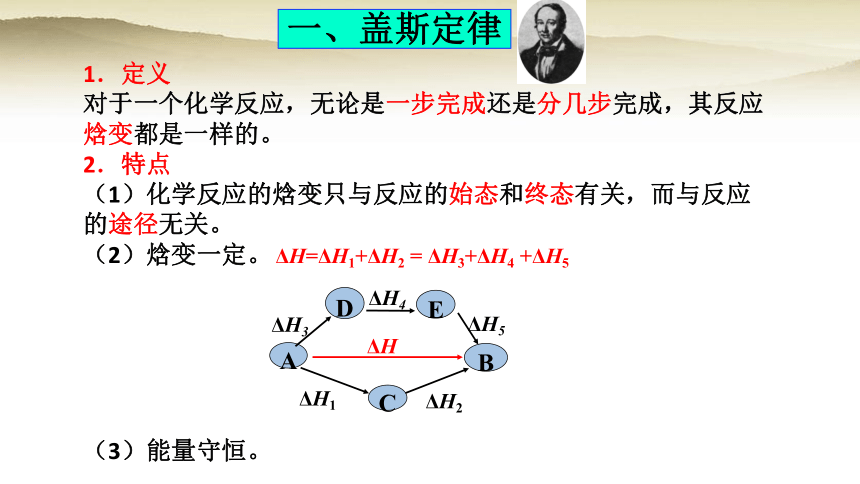
一、盖斯定律
1.定义
对于一个化学反应,无论是一步完成还是分几步完成,其反应
焓变都是一样的。
2.特点
(1)化学反应的焓变只与反应的始态和终态有关,而与反应
的途径无关。
(2)焓变一定。
ΔH
B
A
ΔH1
ΔH2
C
ΔH3
D
E
ΔH4
ΔH5
ΔH=ΔH1+ΔH2 = ΔH3+ΔH4 +ΔH5
(3)能量守恒。
3.意义
对于有些直接测定反应热有困难的反应,可应用盖斯定律,间接地把它们的反应热计算出来。
如:
反应进行的很慢
反应不容易直接发生
反应的产品不纯(有副反应发生)
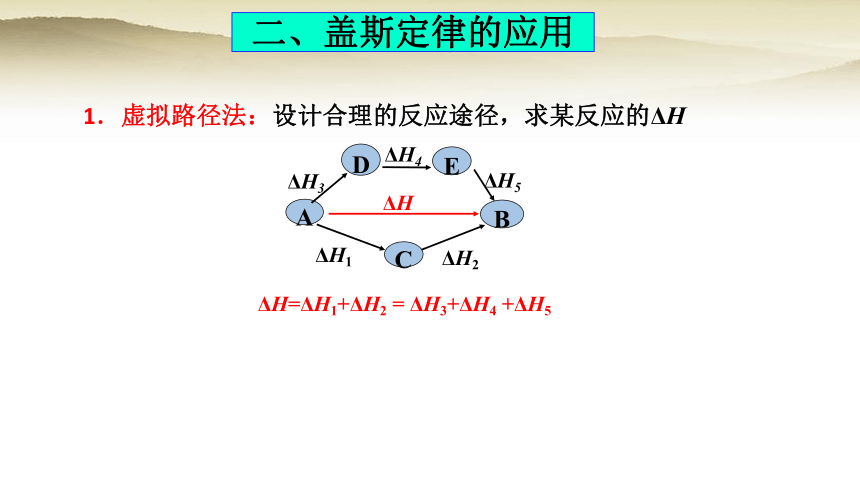
二、盖斯定律的应用
1.虚拟路径法:设计合理的反应途径,求某反应的ΔH
ΔH
B
A
ΔH1
ΔH2
C
ΔH3
D
E
ΔH4
ΔH5
ΔH=ΔH1+ΔH2 = ΔH3+ΔH4 +ΔH5
随堂练习1
CO(g)
C(s)
CO2(g)
ΔH1
ΔH3
ΔH2
∴ ΔH3 = ΔH1 + ΔH2
∴ ΔH1 = ΔH3 - ΔH2
= - 393.5 kJ·mol-1 - (-283.0 kJ·mol-1)
= - 110.5 kJ·mol-1
①C(s) + O2(g) CO(g) ΔH1=
②CO(g)+ O2(g) CO2(g) ΔH2=-283.0 kJ·mol-1
③C(s)+O2(g) CO2(g) ΔH3=-393.5 kJ·mol-1
2.加和法:由已知热化学方程式写目标热化学方程式
1、确定待求得化学反应方程式
2、明确待求方程式中各物质在已知方程式中的位置
3、写出对已知热化学方程式进行变形后的新方程式
4、对变形后的新方程式ΔH加减
随堂练习2
某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g) 2NO2(g) ΔH1= 67.2 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(l) ΔH2= - 534 kJ·mol-1
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2N2H4(g)+ 2NO2(g) 3N2(g)+4H2O(l) ΔH= - 1 135.2 kJ·mol-1
三、焓变的计算方法总结
1、键能: H=反应物的总键能—生成物的总键能
=断裂旧键吸收的能量—形成新键释放的能量
定义:对双原子分子,键能为1mol气态分子离解成气态原子所吸收的能量。对多原子分子,键能为1mol气态分子完全离解成气态原子所吸收的能量分配给结构式中各个共价键的能量。
随堂练习3
答案:C
3、能量: H=生成物的总能量—反应的总能量
4、盖斯定律:
虚拟路径法
加和法
2、活化能: H=正反应的活化能—逆反应的活化能
定义:指化学反应中,由反应物分子到达活化分子所需的最小能量。
如图: H=E1—E2
随堂练习4
A
四、焓变大小比较
随堂检测5
1.已知1 mol白磷(s)转化成1 mol红磷(s),放出18.39 kJ热量,又知:
4P(白,s)+5O2(g)===2P2O5(s) ΔH1
4P(红,s)+5O2(g)===2P2O5(s) ΔH2
则ΔH1和ΔH2的关系正确的是( )
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
C
2. 根据下列热化学方程式可判断ΔH1、ΔH2、ΔH3三者的大小关系是 ( )
2H2(g)+O2(g) 2H2O(l) ΔH1
2H2(g)+O2(g) 2H2O(g) ΔH2
H2(g)+ O2(g) H2O(g) ΔH3
A.ΔH3>ΔH2>ΔH1 B.ΔH1>ΔH2>ΔH3
C.ΔH1=ΔH2>ΔH3 D.ΔH2<ΔH1<ΔH3
A
第1章 化学反应与能量转化
第1节 化学反应的热效应
第3课时 反应焓变的计算
思考
目前人们已知的化学反应不计其数,而每一个反应在不同温度下的反应焓变不尽相同。
问题1
是否所有反应的焓变都要通过实验测定?
问题2
如何得到C(s) +O2(g)==CO(g)的焓变?
问题3
能否利用一些已知反应的焓变计算其它反应的焓变?
登山时上升的高度与山的路径无关,只与起点和终点的相对高度有关。
物质的焓值
定值且唯一
在指定的状态下
反应物
反应产物
无论经过哪些步骤, ΔH不变
一、盖斯定律
1.定义
对于一个化学反应,无论是一步完成还是分几步完成,其反应
焓变都是一样的。
2.特点
(1)化学反应的焓变只与反应的始态和终态有关,而与反应
的途径无关。
(2)焓变一定。
ΔH
B
A
ΔH1
ΔH2
C
ΔH3
D
E
ΔH4
ΔH5
ΔH=ΔH1+ΔH2 = ΔH3+ΔH4 +ΔH5
(3)能量守恒。
3.意义
对于有些直接测定反应热有困难的反应,可应用盖斯定律,间接地把它们的反应热计算出来。
如:
反应进行的很慢
反应不容易直接发生
反应的产品不纯(有副反应发生)
二、盖斯定律的应用
1.虚拟路径法:设计合理的反应途径,求某反应的ΔH
ΔH
B
A
ΔH1
ΔH2
C
ΔH3
D
E
ΔH4
ΔH5
ΔH=ΔH1+ΔH2 = ΔH3+ΔH4 +ΔH5
随堂练习1
CO(g)
C(s)
CO2(g)
ΔH1
ΔH3
ΔH2
∴ ΔH3 = ΔH1 + ΔH2
∴ ΔH1 = ΔH3 - ΔH2
= - 393.5 kJ·mol-1 - (-283.0 kJ·mol-1)
= - 110.5 kJ·mol-1
①C(s) + O2(g) CO(g) ΔH1=
②CO(g)+ O2(g) CO2(g) ΔH2=-283.0 kJ·mol-1
③C(s)+O2(g) CO2(g) ΔH3=-393.5 kJ·mol-1
2.加和法:由已知热化学方程式写目标热化学方程式
1、确定待求得化学反应方程式
2、明确待求方程式中各物质在已知方程式中的位置
3、写出对已知热化学方程式进行变形后的新方程式
4、对变形后的新方程式ΔH加减
随堂练习2
某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g) 2NO2(g) ΔH1= 67.2 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(l) ΔH2= - 534 kJ·mol-1
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2N2H4(g)+ 2NO2(g) 3N2(g)+4H2O(l) ΔH= - 1 135.2 kJ·mol-1
三、焓变的计算方法总结
1、键能: H=反应物的总键能—生成物的总键能
=断裂旧键吸收的能量—形成新键释放的能量
定义:对双原子分子,键能为1mol气态分子离解成气态原子所吸收的能量。对多原子分子,键能为1mol气态分子完全离解成气态原子所吸收的能量分配给结构式中各个共价键的能量。
随堂练习3
答案:C
3、能量: H=生成物的总能量—反应的总能量
4、盖斯定律:
虚拟路径法
加和法
2、活化能: H=正反应的活化能—逆反应的活化能
定义:指化学反应中,由反应物分子到达活化分子所需的最小能量。
如图: H=E1—E2
随堂练习4
A
四、焓变大小比较
随堂检测5
1.已知1 mol白磷(s)转化成1 mol红磷(s),放出18.39 kJ热量,又知:
4P(白,s)+5O2(g)===2P2O5(s) ΔH1
4P(红,s)+5O2(g)===2P2O5(s) ΔH2
则ΔH1和ΔH2的关系正确的是( )
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
C
2. 根据下列热化学方程式可判断ΔH1、ΔH2、ΔH3三者的大小关系是 ( )
2H2(g)+O2(g) 2H2O(l) ΔH1
2H2(g)+O2(g) 2H2O(g) ΔH2
H2(g)+ O2(g) H2O(g) ΔH3
A.ΔH3>ΔH2>ΔH1 B.ΔH1>ΔH2>ΔH3
C.ΔH1=ΔH2>ΔH3 D.ΔH2<ΔH1<ΔH3
A
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
