鲁科版高中化学选择性必修1第2章化学反应的方向、限度与速率2.2.3温度、浓度对化学平衡的影响课件(11张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第2章化学反应的方向、限度与速率2.2.3温度、浓度对化学平衡的影响课件(11张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 750.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 09:04:21 | ||
图片预览


文档简介
(共11张PPT)
第2节 化学反应的限度
第3课时 温度、浓度对化学平衡的影响
第2章 化学反应的方向、限度与速率
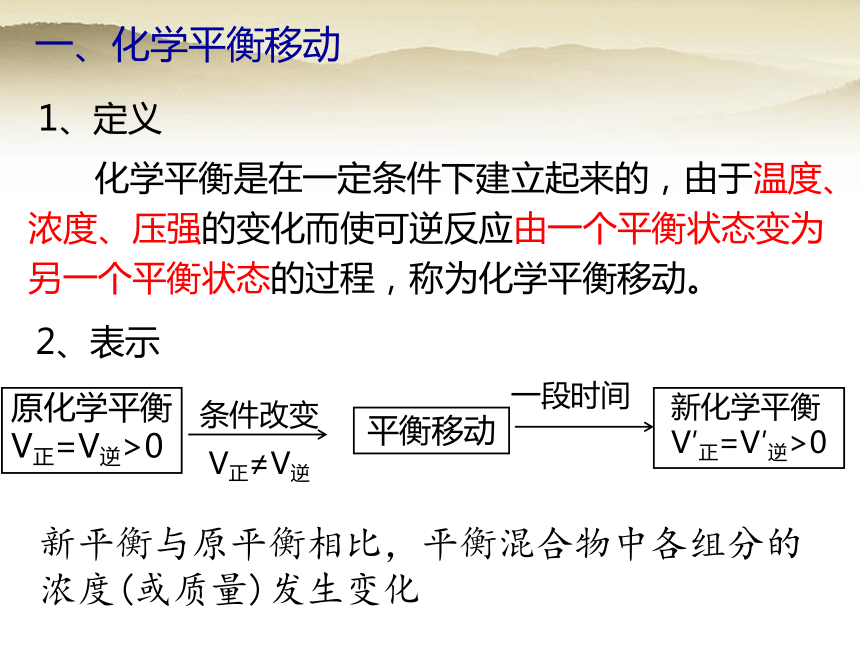
一、化学平衡移动
1、定义
2、表示
原化学平衡
V正=V逆>0
条件改变
V正≠V逆
平衡移动
新化学平衡
V′正=V′逆>0
一段时间
化学平衡是在一定条件下建立起来的,由于温度、浓度、压强的变化而使可逆反应由一个平衡状态变为另一个平衡状态的过程,称为化学平衡移动。
新平衡与原平衡相比,平衡混合物中各组分的浓度(或质量)发生变化
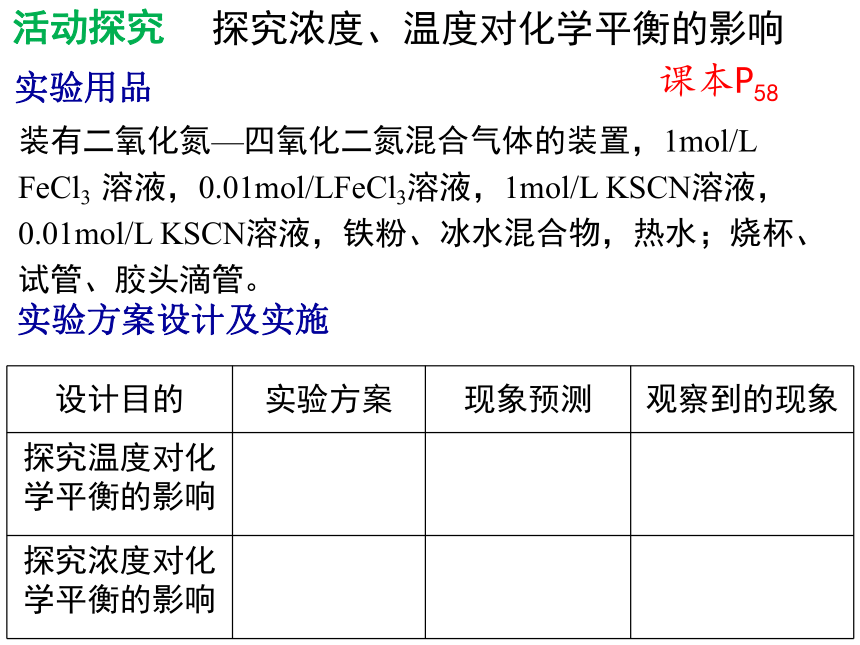
探究浓度、温度对化学平衡的影响
实验用品
装有二氧化氮—四氧化二氮混合气体的装置,1mol/L FeCl3 溶液,0.01mol/LFeCl3溶液,1mol/L KSCN溶液,0.01mol/L KSCN溶液,铁粉、冰水混合物,热水;烧杯、试管、胶头滴管。
实验方案设计及实施
设计目的 实验方案 现象预测 观察到的现象
探究温度对化学平衡的影响
探究浓度对化学平衡的影响
活动探究
课本P58
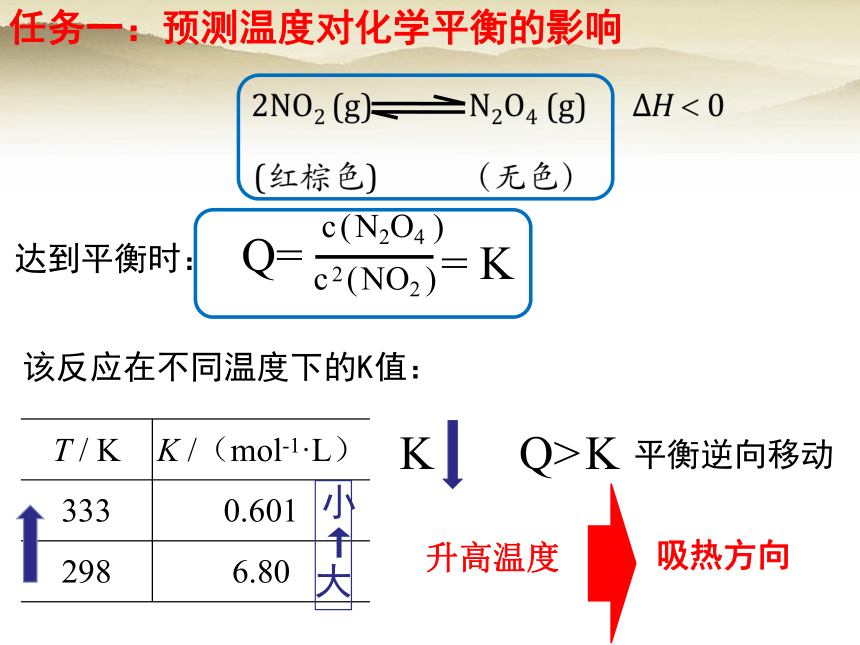
任务一:预测温度对化学平衡的影响
该反应在不同温度下的K值:
T / K K /(mol-1·L)
333 0.601
298 6.80
c(N2O4 )
c2(NO2 )
Q=
= K
达到平衡时:
K
Q>
K
平衡逆向移动
升高温度
吸热方向
小↑
大
冷水
热水
任务二:实验验证温度对化学平衡的影响
2NO2 (g) N2O4(g)
红棕色
无色
实验
现象 浸到冰水中时混合物颜色_____,浸到热水中时混合物颜色_____
变浅
变深
小结:
温度对化学平衡的影响
反应焓变 ΔH 温度变化 平衡常数K 移动方向
ΔH >0
(吸热反应) 温度升高 变大 吸热方向(正向)
温度降低 变小 放热方向(逆向)
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
KSCN溶液
FeCl3+KSCN溶液
实验原理
实验 实验1 实验2
实验现象
实验结论
FeCl3+KSCN溶液
与实验1相比溶液红色均加深
增大反应物的浓度,平衡正向移动
溶液显红色
Fe3++3SCN- Fe(SCN)3 (红色)
FeCl3溶液
FeCl3+KSCN溶液
任务三:预测浓度对化学平衡的影响
mA(g)+nB(g) pC(g)+qD (g)
cp(C) cq(D)
cm(A) cn(B)
Q=
= K
小结:
浓度对化学平衡的影响
c(反应物) ↓
或c(生成物)↑
Q>K
平衡逆向移动
c(反应物)↑
或c(生成物)↓
Q平衡正向移动
课堂小结
一定条件下,对任意可逆反应:
mA(g)+nB(g) pC(g)+qD (g)
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
增大反应物浓度,平衡正向移动;
减小反应物浓度平衡逆向移动。
1、以下几个反应,在一定条件下达到平衡时升高温度,平衡向什么方向移动,平衡常数K如何变化?如果降低温度呢?
课堂练习
2、关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动
BD
第2节 化学反应的限度
第3课时 温度、浓度对化学平衡的影响
第2章 化学反应的方向、限度与速率
一、化学平衡移动
1、定义
2、表示
原化学平衡
V正=V逆>0
条件改变
V正≠V逆
平衡移动
新化学平衡
V′正=V′逆>0
一段时间
化学平衡是在一定条件下建立起来的,由于温度、浓度、压强的变化而使可逆反应由一个平衡状态变为另一个平衡状态的过程,称为化学平衡移动。
新平衡与原平衡相比,平衡混合物中各组分的浓度(或质量)发生变化
探究浓度、温度对化学平衡的影响
实验用品
装有二氧化氮—四氧化二氮混合气体的装置,1mol/L FeCl3 溶液,0.01mol/LFeCl3溶液,1mol/L KSCN溶液,0.01mol/L KSCN溶液,铁粉、冰水混合物,热水;烧杯、试管、胶头滴管。
实验方案设计及实施
设计目的 实验方案 现象预测 观察到的现象
探究温度对化学平衡的影响
探究浓度对化学平衡的影响
活动探究
课本P58
任务一:预测温度对化学平衡的影响
该反应在不同温度下的K值:
T / K K /(mol-1·L)
333 0.601
298 6.80
c(N2O4 )
c2(NO2 )
Q=
= K
达到平衡时:
K
Q>
K
平衡逆向移动
升高温度
吸热方向
小↑
大
冷水
热水
任务二:实验验证温度对化学平衡的影响
2NO2 (g) N2O4(g)
红棕色
无色
实验
现象 浸到冰水中时混合物颜色_____,浸到热水中时混合物颜色_____
变浅
变深
小结:
温度对化学平衡的影响
反应焓变 ΔH 温度变化 平衡常数K 移动方向
ΔH >0
(吸热反应) 温度升高 变大 吸热方向(正向)
温度降低 变小 放热方向(逆向)
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
KSCN溶液
FeCl3+KSCN溶液
实验原理
实验 实验1 实验2
实验现象
实验结论
FeCl3+KSCN溶液
与实验1相比溶液红色均加深
增大反应物的浓度,平衡正向移动
溶液显红色
Fe3++3SCN- Fe(SCN)3 (红色)
FeCl3溶液
FeCl3+KSCN溶液
任务三:预测浓度对化学平衡的影响
mA(g)+nB(g) pC(g)+qD (g)
cp(C) cq(D)
cm(A) cn(B)
Q=
= K
小结:
浓度对化学平衡的影响
c(反应物) ↓
或c(生成物)↑
Q>K
平衡逆向移动
c(反应物)↑
或c(生成物)↓
Q
课堂小结
一定条件下,对任意可逆反应:
mA(g)+nB(g) pC(g)+qD (g)
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
增大反应物浓度,平衡正向移动;
减小反应物浓度平衡逆向移动。
1、以下几个反应,在一定条件下达到平衡时升高温度,平衡向什么方向移动,平衡常数K如何变化?如果降低温度呢?
课堂练习
2、关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动
BD
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
