鲁科版高中化学选择性必修1第2章化学反应的方向、限度与速率2.2.4压强对化学平衡的影响课件(11张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第2章化学反应的方向、限度与速率2.2.4压强对化学平衡的影响课件(11张) |  | |
| 格式 | ppt | ||
| 文件大小 | 636.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 09:10:16 | ||
图片预览




文档简介
(共11张PPT)
第2章 化学反应的方向、限度与速率
第2节 化学反应的限度
第4课时 压强对化学平衡的影响
1、压强的影响
[思考]
(1)压强对化学平衡的影响与参加化学反应的_______________有关;
(2)实际上压强的改变是通过引起_________的变化而影响化学平衡的,否则,是无效的。
气态物质的系数
浓 度
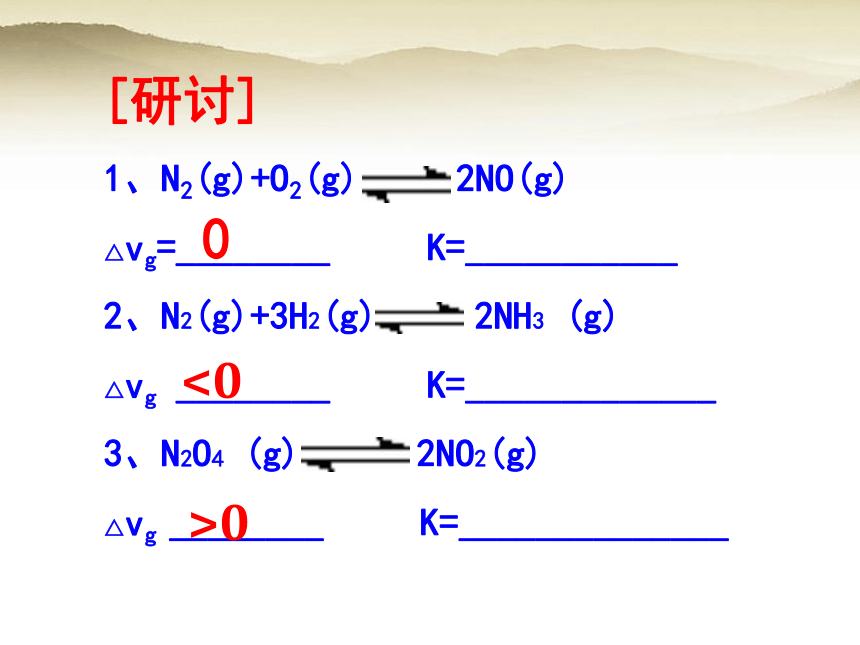
[研讨]
1、N2(g)+O2(g) 2NO(g)
△vg=________ K=___________
2、N2(g)+3H2(g) 2NH3 (g)
△vg ________ K=_____________
3、N2O4 (g) 2NO2(g)
△vg ________ K=______________
0
<0
>0
N2(g)+3 H2 (g) 2NH3(g)
He
压强增大,
各物质浓度不变,
化学平衡不移动,
此压强增大,对平衡无影响
理论分析
2、压强增大,浓度增大,平衡仍不移动
一定条件下,可逆反应:
Δvg=0
H2 (g)+ I2(g) 2HI(g)
当 V→1/2V ,P → 2P;
[2c(HI)]
[2c (H2)]
[2c (I2)]
2
Q=
Q=
[c(HI)]
[c (H2)]
[c (I2)]
2
= K
Δvg=0
Q = K, 压强增大,平衡不移动
3、压强对化学平衡的影响
理论分析
一定条件下,可逆反应:
N2(g)+3 H2 (g) 2NH3(g)
Q
c 2(NH3)
c (N2)
c (H2)
3
= K
[2c(NH3)]
[2c (N2)]
[2c (H2)]
3
2
Q=
c 2(NH3)
c (N2)
c (H2)
3
2
2
2
2
3
Q=
Q < K
压强增大时,该平衡向气体系数小的方向移动
Δvg<0
Δvg<0
当 V→1/2V ,P → 2P;
理论分析
压强对化学平衡的影响
一定条件下,可逆反应:
Δvg>0
N2O(g) 2NO2(g)
当 V→2V ,P → 1/2P;
[1/2c(NO2)]
1/2[c (N2O)]
2
Q=
1/4[c(NO2)]
1/2[c (N2O)]
2
Q=
Q < K
Δvg>0
压强减小时,此反应向气体系数大的方向移动
总结
压强对化学平衡的影响
m+n = p+q 改变P,平衡不移动
m+n p+q
P↑ :平衡向气态物质系数减小的方向移动
P↓ :平衡向气态物质系数增大的方向移动
改变条件 平衡移动方向 α(H2) c(H2) K
升高温度
恒温恒容,c(NH3) 增大
恒温恒容,c(H2) 增大
恒恒温容,c(H2) 减小
压缩体积(V↓P↑)
扩大体积(V↑P↓)
恒温恒容,再充2mol He气
恒温恒压,再充2mol He气
加催化剂
3H2 (g) +N2 (g) 2NH3 (g) H<0,将1molN2和3molH2充入一密闭容器中,一段时间后,体系达到平衡,改变平衡体系中的条件,判断以下量的变化:
←
↓
↓
↓
←
↓
↑
—
→
↓
↑
—
←
↓
—
→
↑
↑
↑
—
←
↓
↓
—
—
—
—
—
←
↓
↓
—
—
—
—
—
1、将NO2装入带活塞的密闭容器中,当反应
2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
C
课堂练习
2、在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
C
第2章 化学反应的方向、限度与速率
第2节 化学反应的限度
第4课时 压强对化学平衡的影响
1、压强的影响
[思考]
(1)压强对化学平衡的影响与参加化学反应的_______________有关;
(2)实际上压强的改变是通过引起_________的变化而影响化学平衡的,否则,是无效的。
气态物质的系数
浓 度
[研讨]
1、N2(g)+O2(g) 2NO(g)
△vg=________ K=___________
2、N2(g)+3H2(g) 2NH3 (g)
△vg ________ K=_____________
3、N2O4 (g) 2NO2(g)
△vg ________ K=______________
0
<0
>0
N2(g)+3 H2 (g) 2NH3(g)
He
压强增大,
各物质浓度不变,
化学平衡不移动,
此压强增大,对平衡无影响
理论分析
2、压强增大,浓度增大,平衡仍不移动
一定条件下,可逆反应:
Δvg=0
H2 (g)+ I2(g) 2HI(g)
当 V→1/2V ,P → 2P;
[2c(HI)]
[2c (H2)]
[2c (I2)]
2
Q=
Q=
[c(HI)]
[c (H2)]
[c (I2)]
2
= K
Δvg=0
Q = K, 压强增大,平衡不移动
3、压强对化学平衡的影响
理论分析
一定条件下,可逆反应:
N2(g)+3 H2 (g) 2NH3(g)
Q
c 2(NH3)
c (N2)
c (H2)
3
= K
[2c(NH3)]
[2c (N2)]
[2c (H2)]
3
2
Q=
c 2(NH3)
c (N2)
c (H2)
3
2
2
2
2
3
Q=
Q < K
压强增大时,该平衡向气体系数小的方向移动
Δvg<0
Δvg<0
当 V→1/2V ,P → 2P;
理论分析
压强对化学平衡的影响
一定条件下,可逆反应:
Δvg>0
N2O(g) 2NO2(g)
当 V→2V ,P → 1/2P;
[1/2c(NO2)]
1/2[c (N2O)]
2
Q=
1/4[c(NO2)]
1/2[c (N2O)]
2
Q=
Q < K
Δvg>0
压强减小时,此反应向气体系数大的方向移动
总结
压强对化学平衡的影响
m+n = p+q 改变P,平衡不移动
m+n p+q
P↑ :平衡向气态物质系数减小的方向移动
P↓ :平衡向气态物质系数增大的方向移动
改变条件 平衡移动方向 α(H2) c(H2) K
升高温度
恒温恒容,c(NH3) 增大
恒温恒容,c(H2) 增大
恒恒温容,c(H2) 减小
压缩体积(V↓P↑)
扩大体积(V↑P↓)
恒温恒容,再充2mol He气
恒温恒压,再充2mol He气
加催化剂
3H2 (g) +N2 (g) 2NH3 (g) H<0,将1molN2和3molH2充入一密闭容器中,一段时间后,体系达到平衡,改变平衡体系中的条件,判断以下量的变化:
←
↓
↓
↓
←
↓
↑
—
→
↓
↑
—
←
↓
—
→
↑
↑
↑
—
←
↓
↓
—
—
—
—
—
←
↓
↓
—
—
—
—
—
1、将NO2装入带活塞的密闭容器中,当反应
2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
C
课堂练习
2、在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
C
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
