鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.1.2.溶液的酸碱性与pH课件(17张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.1.2.溶液的酸碱性与pH课件(17张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
第1节 水与水溶液
第2课时 溶液的酸碱性与pH
人体体液的pH范围
尿液检查报告单
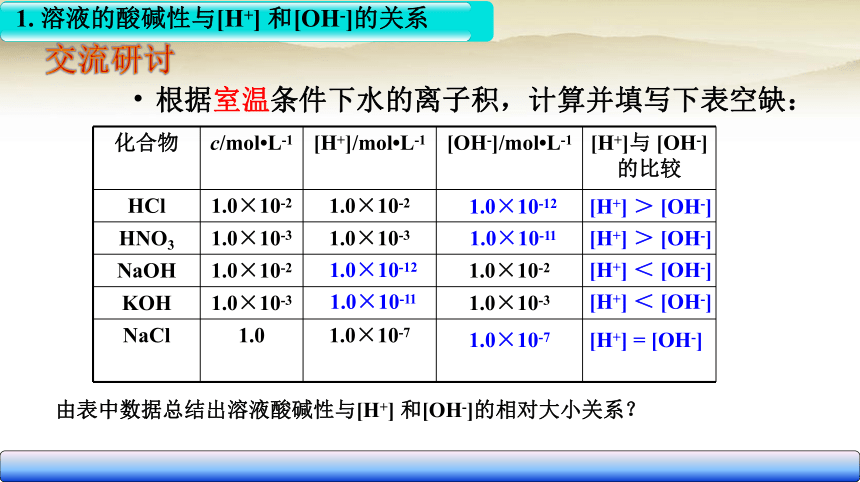
化合物 c/mol L-1 [H+]/mol L-1 [OH-]/mol L-1
[H+]与 [OH-]的比较
HCl 1.0×10-2 1.0×10-2
HNO3 1.0×10-3 1.0×10-3
NaOH 1.0×10-2 1.0×10-2
KOH 1.0×10-3 1.0×10-3
NaCl 1.0 1.0×10-7
由表中数据总结出溶液酸碱性与[H+] 和[OH-]的相对大小关系?
1. 溶液的酸碱性与[H+] 和[OH-]的关系
1.0×10-12
1.0×10-11
1.0×10-12
1.0×10-11
1.0×10-7
[H+] > [OH-]
[H+] > [OH-]
[H+] < [OH-]
[H+] < [OH-]
[H+] = [OH-]
根据室温条件下水的离子积,计算并填写下表空缺:
[H+]=[OH-],溶液呈中性
[H+]>[OH-],溶液呈酸性,且[H+]越大酸性越强
[H+]<[OH-],溶液呈碱性,且[OH-]越大碱性越强
利用[H+] 和[OH-]的相对大小关系判断溶液的酸碱性
pH是[H+]的负对数。
(1)意义:
pH
(3)表达式:
pH= -lg[H+]
(4) pH只适用于[H+]≤1 mol·L-1或[OH-]≤1 mol·L-1的电解质溶液,即pH的取值范围为0~14,当[H+]或[OH-]≥1 mol·L-1时,直接用[H+]或[OH-]表示溶液的酸碱性。
(2)定义:
用pH表示溶液的酸碱性
2. 溶液的酸碱性与pH的关系
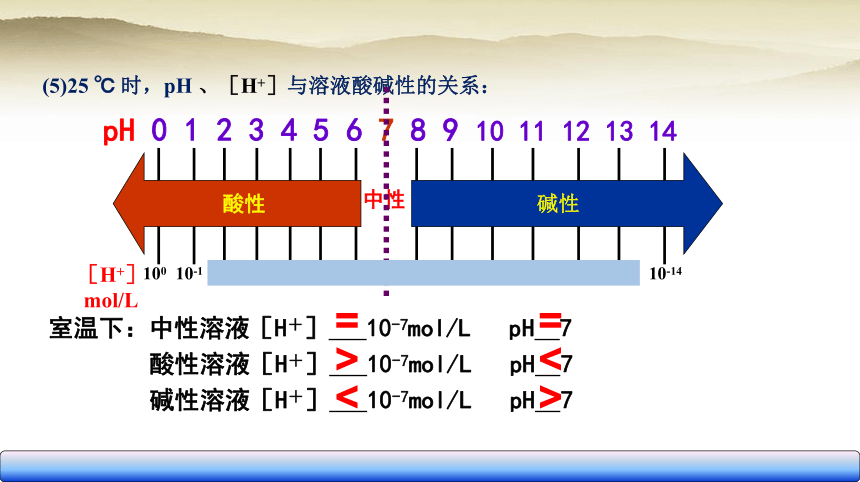
(5)25 ℃ 时,pH 、[H+]与溶液酸碱性的关系:
pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
中性
[H+]
mol/L
100
10-1
10-2
10-3
10-5
10-4
10-6
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
碱性
酸性
室温下:中性溶液[H+] 10-7mol/L pH 7
酸性溶液[H+] 10-7mol/L pH 7
碱性溶液[H+] 10-7mol/L pH 7
>
>
<
<
=
=
思考讨论:
1:已知100℃时,KW=10-12 mol2·L-2,该温度下某溶液的[H+]=1×10-7mol/L,则该溶液呈____性
2:当溶液中[H+]>10-7时,一定是酸性溶液吗?
碱
不一定
判断溶液酸碱性:
只看 [H+]与[OH-]的相对大小
正误判断
1、一定条件下 pH值越大,溶液的酸性越强。
2、pH值等于6的溶液,一定是一个酸溶液。
3、在室温下,pH=0的溶液酸性最强,pH=14的溶液碱性最强。
4、pH值有可能等于负值。
溶液酸碱性
的判断 [H+] 和[OH-]的相对大小 [H+] 的范围 pH的范围
中性溶液 [H+]=[OH-] [H+]=10-7mol/L pH=7
酸性溶液 [H+]>[OH-], [H+]>10-7mol/L
pH<7
碱性溶液 [H+]<[OH-], [H+]<10-7mol/L
pH>7
小结
只适用于25 ℃
适用于任意温度
(定性判断溶液的酸碱性)
(1) 酸碱指示剂
酸碱指示剂的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
3.1~4.4
8.2~10.0
5.0~8.0
3. 溶液酸碱性的测定方法
思考:
使酚酞呈无色的溶液,一定是酸性?
不一定。可能是酸性,也可能是碱性,或中性
(2)利用pH试纸测定
能否直接用手撕下pH试纸?
1
能否直接把pH试纸伸到待测液中?
2
是否要先湿润pH试纸后,再将待测液滴到pH试纸上?
3
能否用广泛pH试纸测出pH=7.1来?
4
(粗略测定)
(2)利用pH试纸测定(粗略测定)
用镊子取一小块试纸,放在表面皿或玻璃片上,用洁净的玻璃棒蘸取待测液,点于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,
读出pH。
pH试纸的使用方法
广泛pH试纸的范围是1~14,读数是整数
(2)利用pH试纸测定(粗略测定)
1,如用湿润的pH试纸检验待测液,对该溶液pH值的测定:
A、一定有影响 B、偏大 C、偏小 D、不确定
思考:
√
2,能否用pH试纸测定氯水的pH?
不能。
注意:1,pH试纸不能润湿
2,不能用pH试纸测强氧化性溶液的pH
(3)利用pH计测定(精确测定,精确到小数点后两位)
溶液
酸碱性
[H+] 和[OH-]
相对大小 [H+] 的范围 pH的
范围
中性溶液 [H+]=[OH-] [H+]=10-7mol/L pH=7
酸性溶液 [H+]>[OH-], [H+]>10-7mol/L pH<7
碱性溶液 [H+]<[OH-], [H+]<10-7mol/L
pH>7
[H+] 越大酸性越强,pH越小酸性越强
酸碱指示剂 定性判断溶液的酸碱性
pH试纸 粗略测定
广泛pH试纸的范围1~14
注意pH试纸的使用方法
pH计 精确测定
小结
适用于
任意温度
只适用于
25 ℃
题目解析
课堂练习
利用pH值和[H+]判断酸碱性时要考虑温度,只有在25℃时,pH=7和[H+]=1×10-7mol·L-1的溶液呈中性。
C
1、
第1节 水与水溶液
第2课时 溶液的酸碱性与pH
人体体液的pH范围
尿液检查报告单
化合物 c/mol L-1 [H+]/mol L-1 [OH-]/mol L-1
[H+]与 [OH-]的比较
HCl 1.0×10-2 1.0×10-2
HNO3 1.0×10-3 1.0×10-3
NaOH 1.0×10-2 1.0×10-2
KOH 1.0×10-3 1.0×10-3
NaCl 1.0 1.0×10-7
由表中数据总结出溶液酸碱性与[H+] 和[OH-]的相对大小关系?
1. 溶液的酸碱性与[H+] 和[OH-]的关系
1.0×10-12
1.0×10-11
1.0×10-12
1.0×10-11
1.0×10-7
[H+] > [OH-]
[H+] > [OH-]
[H+] < [OH-]
[H+] < [OH-]
[H+] = [OH-]
根据室温条件下水的离子积,计算并填写下表空缺:
[H+]=[OH-],溶液呈中性
[H+]>[OH-],溶液呈酸性,且[H+]越大酸性越强
[H+]<[OH-],溶液呈碱性,且[OH-]越大碱性越强
利用[H+] 和[OH-]的相对大小关系判断溶液的酸碱性
pH是[H+]的负对数。
(1)意义:
pH
(3)表达式:
pH= -lg[H+]
(4) pH只适用于[H+]≤1 mol·L-1或[OH-]≤1 mol·L-1的电解质溶液,即pH的取值范围为0~14,当[H+]或[OH-]≥1 mol·L-1时,直接用[H+]或[OH-]表示溶液的酸碱性。
(2)定义:
用pH表示溶液的酸碱性
2. 溶液的酸碱性与pH的关系
(5)25 ℃ 时,pH 、[H+]与溶液酸碱性的关系:
pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
中性
[H+]
mol/L
100
10-1
10-2
10-3
10-5
10-4
10-6
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
碱性
酸性
室温下:中性溶液[H+] 10-7mol/L pH 7
酸性溶液[H+] 10-7mol/L pH 7
碱性溶液[H+] 10-7mol/L pH 7
>
>
<
<
=
=
思考讨论:
1:已知100℃时,KW=10-12 mol2·L-2,该温度下某溶液的[H+]=1×10-7mol/L,则该溶液呈____性
2:当溶液中[H+]>10-7时,一定是酸性溶液吗?
碱
不一定
判断溶液酸碱性:
只看 [H+]与[OH-]的相对大小
正误判断
1、一定条件下 pH值越大,溶液的酸性越强。
2、pH值等于6的溶液,一定是一个酸溶液。
3、在室温下,pH=0的溶液酸性最强,pH=14的溶液碱性最强。
4、pH值有可能等于负值。
溶液酸碱性
的判断 [H+] 和[OH-]的相对大小 [H+] 的范围 pH的范围
中性溶液 [H+]=[OH-] [H+]=10-7mol/L pH=7
酸性溶液 [H+]>[OH-], [H+]>10-7mol/L
pH<7
碱性溶液 [H+]<[OH-], [H+]<10-7mol/L
pH>7
小结
只适用于25 ℃
适用于任意温度
(定性判断溶液的酸碱性)
(1) 酸碱指示剂
酸碱指示剂的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
3.1~4.4
8.2~10.0
5.0~8.0
3. 溶液酸碱性的测定方法
思考:
使酚酞呈无色的溶液,一定是酸性?
不一定。可能是酸性,也可能是碱性,或中性
(2)利用pH试纸测定
能否直接用手撕下pH试纸?
1
能否直接把pH试纸伸到待测液中?
2
是否要先湿润pH试纸后,再将待测液滴到pH试纸上?
3
能否用广泛pH试纸测出pH=7.1来?
4
(粗略测定)
(2)利用pH试纸测定(粗略测定)
用镊子取一小块试纸,放在表面皿或玻璃片上,用洁净的玻璃棒蘸取待测液,点于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,
读出pH。
pH试纸的使用方法
广泛pH试纸的范围是1~14,读数是整数
(2)利用pH试纸测定(粗略测定)
1,如用湿润的pH试纸检验待测液,对该溶液pH值的测定:
A、一定有影响 B、偏大 C、偏小 D、不确定
思考:
√
2,能否用pH试纸测定氯水的pH?
不能。
注意:1,pH试纸不能润湿
2,不能用pH试纸测强氧化性溶液的pH
(3)利用pH计测定(精确测定,精确到小数点后两位)
溶液
酸碱性
[H+] 和[OH-]
相对大小 [H+] 的范围 pH的
范围
中性溶液 [H+]=[OH-] [H+]=10-7mol/L pH=7
酸性溶液 [H+]>[OH-], [H+]>10-7mol/L pH<7
碱性溶液 [H+]<[OH-], [H+]<10-7mol/L
pH>7
[H+] 越大酸性越强,pH越小酸性越强
酸碱指示剂 定性判断溶液的酸碱性
pH试纸 粗略测定
广泛pH试纸的范围1~14
注意pH试纸的使用方法
pH计 精确测定
小结
适用于
任意温度
只适用于
25 ℃
题目解析
课堂练习
利用pH值和[H+]判断酸碱性时要考虑温度,只有在25℃时,pH=7和[H+]=1×10-7mol·L-1的溶液呈中性。
C
1、
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
