鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.1.1水的电离电解质在水溶液中的存在形态课件(15张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.1.1水的电离电解质在水溶液中的存在形态课件(15张) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 09:17:14 | ||
图片预览




文档简介
(共15张PPT)
第3章 物质在水溶液中的行为
第1节 水与水溶液
第1课时 水的电离 电解质在水溶液中的存在形式
联想·质疑
电解质溶液(如盐酸、CH3COOH溶液等)能够导电。那么,纯水能导电吗?为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。你认为实验结果会是怎样的?
纯水能够导电吗?
实验数据证明纯水实际上有微弱的导电性。
μS/cm
纯水能导电
纯水导电性弱
存在自由
移动的离子
自由移动的离子的浓度很低
极少量H2O
H+
纯水具有微弱的导电性说明了什么?
H+、OH-
电离
水是一种极弱的电解质,纯水中存在着电离平衡。
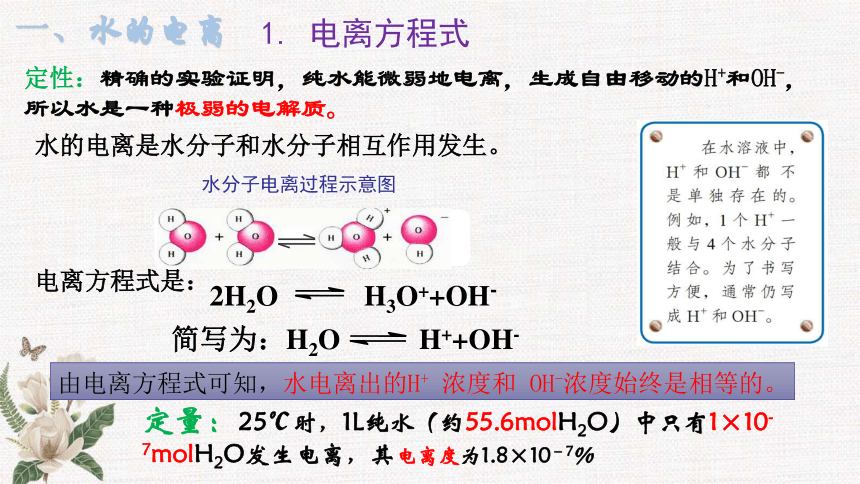
定性:精确的实验证明,纯水能微弱地电离,生成自由移动的H+和OH-,所以水是一种极弱的电解质。
水的电离是水分子和水分子相互作用发生。
电离方程式是:
定量:25℃时,1L纯水(约55.6molH2O)中只有1×10-7molH2O发生电离,其电离度为1.8×10-7%
2H2O H3O++OH-
简写为:H2O H++OH-
水分子电离过程示意图
1. 电离方程式
由电离方程式可知,水电离出的H+ 浓度和 OH-浓度始终是相等的。
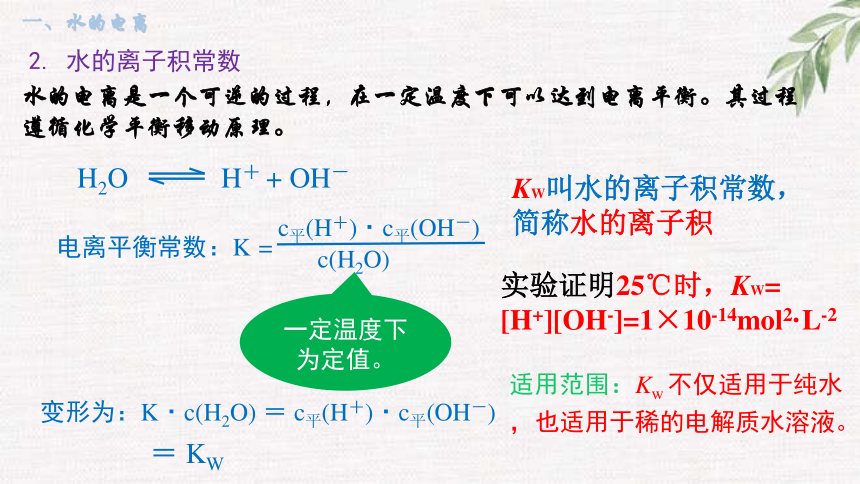
水的电离是一个可逆的过程,在一定温度下可以达到电离平衡。其过程遵循化学平衡移动原理。
实验证明25℃时,KW= [H+][OH-]=1×10-14mol2·L-2
KW叫水的离子积常数,简称水的离子积
2. 水的离子积常数
H2O H+ + OH-
变形为:K·c(H2O) = c平(H+)·c平(OH-)
电离平衡常数:K =
c平(H+)·c平(OH-)
c(H2O)
= KW
一定温度下为定值。
t/℃ K W /mol2·L-2
25 1.0×10-14
55 7.3×10-14
80 2.5×10-13
100 5.5×10-13
不同温度下水的离子积常数
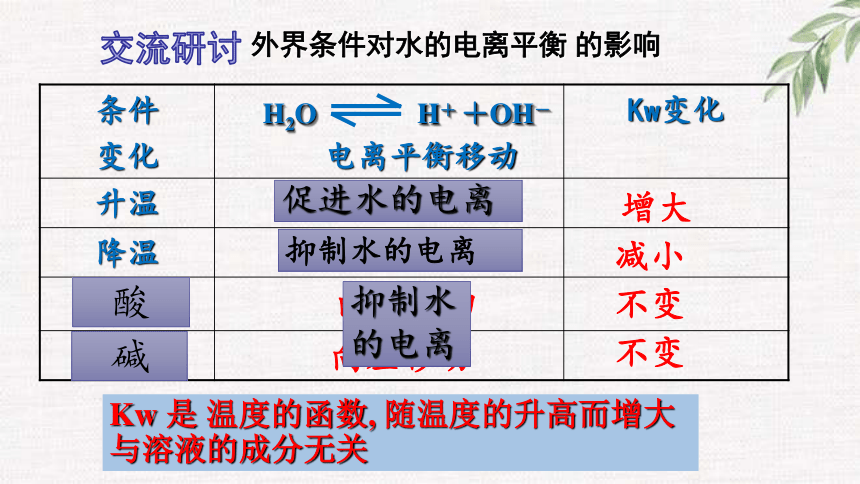
分析上表数据可得出怎样的结论?
根据平衡移动原理分析影响水的电离平衡的因素有哪些?
1 .在水中 H+,OH-,H2O共存
2.水的电离是吸热过程
H2O H+ + OH- △H>0
条件
变化
电离平衡移动 Kw变化
升温
降温
加H2SO4
加NaOH
向右移动
向左移动
向左移动
向左移动
外界条件对水的电离平衡 的影响
H2O H+ +OH-
增大
减小
不变
不变
Kw 是 温度的函数, 随温度的升高而增大 与溶液的成分无关
抑制水的电离
促进水的电离
抑制水
的电离
酸
碱
等体积的溶液浓度(mol/L) 电解质溶液 灯泡亮度 导电能力
0.5 HCl
0.5 NaOH
0.5 NaCl
0.5 CH3COOH
强
强
强
弱
亮
亮
亮
暗
1.以上水溶液导电能力有何不同?溶液导电能力取决于什么?
溶液导电能力取决于自由移动离子浓度大小和离子所带电荷
2.氯化氢、醋酸等电解质在溶于水时发生了哪些变化?它们最终的存在形式如何?
1.强电解质:在稀的水溶液里能完全电离的电解
包括强酸、强碱、大部分盐
存在形态:水合离子。
2.弱电解质:在稀的水溶液里部分电离的电解质。
包括弱酸、弱碱、水、少数盐、两性氢氧化物 存在形态:水合分子(主要)和水合离子。
强电解质的电离过程是不可逆的,电离方程式用“=”,如:HCl=H++Cl- 、 NaCl=Na++Cl-
弱电解质的电离过程是可逆的,电离方程式用“ ”,如:HAc H++Ac- 、NH3.H2O NH4++OH-
HCl和CH3COOH电离情况比较
电解质溶液中,不论是离子还是分子,都不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在
3.溶剂化作用:溶质分子或离子与溶剂相互吸引的作用
完全电离
H+
Cl-
HCl
存在电离平衡
H+
CH3COOH
CH3COOH
水与水溶液
水的电离
中的存在形态
电解质在水溶液
Kw 适用于纯水和稀的电解质水溶液。
水的电离过程:
水的离子积:
H2O H+ + OH-
Kw = c平(H+)·c平(OH-)
吸热
Kw 只受温度影响
升温,Kw 增大
强电解质:完全电离
包括:强酸、强碱和大部分盐。
弱电解质:部分电离
包括:弱酸、弱碱和水等。
HCl H+ + Cl-
CH3COOH CH3COO- + H+
1.下列说法正确的是( )
A、HCl溶液中无OH-
B、NaOH溶液中无H+
C、NaCl溶液中既无OH-也无H+
D、常温下,任何物质的水溶液中都有H+和OH-,
且Kw=c平(H+)·c平(OH-)=10-14
D
D
2.25 ℃时,水的电离达到平衡:H2O H++OH-。下列叙述错误的是( )
A.向水中通入氨气,平衡逆向移动,c(OH-)增大
B.向水中加入少量稀硫酸,c(H+)增大,Kw不变
C.将水加热,平衡正向移动,Kw变大
D.升高温度,平衡正向移动,c(H+)增大,pH不变
3、下列事实不能证明CH3COOH是弱酸的是 ( )
A.CH3COOH溶液能使石蕊溶液变红
B.0.1 mol·L-1 CH3COOH溶液中H+浓度为0.001 mol·L-1
C.物质的量浓度相同的CH3COOH溶液的导电能力比盐酸的弱
D.0.01 mol·L-1 CH3COOH溶液中有两种分子存在
A
故溶液中既有未电离的CH3COOH和H2O,也有电离产生的
CH3COO- 、H+和OH- 。
CH3COOH CH3COO- + H+
H2O H+ + OH-
4、某温度下的水溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1。x与y的关系如图所示:
(1)该温度下水的离子积为 (填具体数值);该温度 (填“高于”“低于”或“等于”)常温。
(2)该温度下0.01 mol·L-1 NaOH溶液的pH为 。
10-12
高于
10
8
第3章 物质在水溶液中的行为
第1节 水与水溶液
第1课时 水的电离 电解质在水溶液中的存在形式
联想·质疑
电解质溶液(如盐酸、CH3COOH溶液等)能够导电。那么,纯水能导电吗?为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。你认为实验结果会是怎样的?
纯水能够导电吗?
实验数据证明纯水实际上有微弱的导电性。
μS/cm
纯水能导电
纯水导电性弱
存在自由
移动的离子
自由移动的离子的浓度很低
极少量H2O
H+
纯水具有微弱的导电性说明了什么?
H+、OH-
电离
水是一种极弱的电解质,纯水中存在着电离平衡。
定性:精确的实验证明,纯水能微弱地电离,生成自由移动的H+和OH-,所以水是一种极弱的电解质。
水的电离是水分子和水分子相互作用发生。
电离方程式是:
定量:25℃时,1L纯水(约55.6molH2O)中只有1×10-7molH2O发生电离,其电离度为1.8×10-7%
2H2O H3O++OH-
简写为:H2O H++OH-
水分子电离过程示意图
1. 电离方程式
由电离方程式可知,水电离出的H+ 浓度和 OH-浓度始终是相等的。
水的电离是一个可逆的过程,在一定温度下可以达到电离平衡。其过程遵循化学平衡移动原理。
实验证明25℃时,KW= [H+][OH-]=1×10-14mol2·L-2
KW叫水的离子积常数,简称水的离子积
2. 水的离子积常数
H2O H+ + OH-
变形为:K·c(H2O) = c平(H+)·c平(OH-)
电离平衡常数:K =
c平(H+)·c平(OH-)
c(H2O)
= KW
一定温度下为定值。
t/℃ K W /mol2·L-2
25 1.0×10-14
55 7.3×10-14
80 2.5×10-13
100 5.5×10-13
不同温度下水的离子积常数
分析上表数据可得出怎样的结论?
根据平衡移动原理分析影响水的电离平衡的因素有哪些?
1 .在水中 H+,OH-,H2O共存
2.水的电离是吸热过程
H2O H+ + OH- △H>0
条件
变化
电离平衡移动 Kw变化
升温
降温
加H2SO4
加NaOH
向右移动
向左移动
向左移动
向左移动
外界条件对水的电离平衡 的影响
H2O H+ +OH-
增大
减小
不变
不变
Kw 是 温度的函数, 随温度的升高而增大 与溶液的成分无关
抑制水的电离
促进水的电离
抑制水
的电离
酸
碱
等体积的溶液浓度(mol/L) 电解质溶液 灯泡亮度 导电能力
0.5 HCl
0.5 NaOH
0.5 NaCl
0.5 CH3COOH
强
强
强
弱
亮
亮
亮
暗
1.以上水溶液导电能力有何不同?溶液导电能力取决于什么?
溶液导电能力取决于自由移动离子浓度大小和离子所带电荷
2.氯化氢、醋酸等电解质在溶于水时发生了哪些变化?它们最终的存在形式如何?
1.强电解质:在稀的水溶液里能完全电离的电解
包括强酸、强碱、大部分盐
存在形态:水合离子。
2.弱电解质:在稀的水溶液里部分电离的电解质。
包括弱酸、弱碱、水、少数盐、两性氢氧化物 存在形态:水合分子(主要)和水合离子。
强电解质的电离过程是不可逆的,电离方程式用“=”,如:HCl=H++Cl- 、 NaCl=Na++Cl-
弱电解质的电离过程是可逆的,电离方程式用“ ”,如:HAc H++Ac- 、NH3.H2O NH4++OH-
HCl和CH3COOH电离情况比较
电解质溶液中,不论是离子还是分子,都不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在
3.溶剂化作用:溶质分子或离子与溶剂相互吸引的作用
完全电离
H+
Cl-
HCl
存在电离平衡
H+
CH3COOH
CH3COOH
水与水溶液
水的电离
中的存在形态
电解质在水溶液
Kw 适用于纯水和稀的电解质水溶液。
水的电离过程:
水的离子积:
H2O H+ + OH-
Kw = c平(H+)·c平(OH-)
吸热
Kw 只受温度影响
升温,Kw 增大
强电解质:完全电离
包括:强酸、强碱和大部分盐。
弱电解质:部分电离
包括:弱酸、弱碱和水等。
HCl H+ + Cl-
CH3COOH CH3COO- + H+
1.下列说法正确的是( )
A、HCl溶液中无OH-
B、NaOH溶液中无H+
C、NaCl溶液中既无OH-也无H+
D、常温下,任何物质的水溶液中都有H+和OH-,
且Kw=c平(H+)·c平(OH-)=10-14
D
D
2.25 ℃时,水的电离达到平衡:H2O H++OH-。下列叙述错误的是( )
A.向水中通入氨气,平衡逆向移动,c(OH-)增大
B.向水中加入少量稀硫酸,c(H+)增大,Kw不变
C.将水加热,平衡正向移动,Kw变大
D.升高温度,平衡正向移动,c(H+)增大,pH不变
3、下列事实不能证明CH3COOH是弱酸的是 ( )
A.CH3COOH溶液能使石蕊溶液变红
B.0.1 mol·L-1 CH3COOH溶液中H+浓度为0.001 mol·L-1
C.物质的量浓度相同的CH3COOH溶液的导电能力比盐酸的弱
D.0.01 mol·L-1 CH3COOH溶液中有两种分子存在
A
故溶液中既有未电离的CH3COOH和H2O,也有电离产生的
CH3COO- 、H+和OH- 。
CH3COOH CH3COO- + H+
H2O H+ + OH-
4、某温度下的水溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1。x与y的关系如图所示:
(1)该温度下水的离子积为 (填具体数值);该温度 (填“高于”“低于”或“等于”)常温。
(2)该温度下0.01 mol·L-1 NaOH溶液的pH为 。
10-12
高于
10
8
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
