鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.2.1弱电解质的电离平衡课件(43张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.2.1弱电解质的电离平衡课件(43张) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 09:21:50 | ||
图片预览








文档简介
(共43张PPT)
第2节 弱电解质的电离 盐类水解
CH3COOH CH3COO - + H+
NH3. H2O NH4+ + OH-
NaHCO3 = Na+ + HCO3-
在稀的水溶液中能完全电离的电解质
溶于水时部分电离的电解质
CH3COOH CH3COO - + H+
NH3. H2O NH4+ +OH-
结合CH3COOH或NH3. H2O电离方程式,根据平衡移动原理,分析电离平衡状态是如何建立的?电离平衡的特征有哪些?
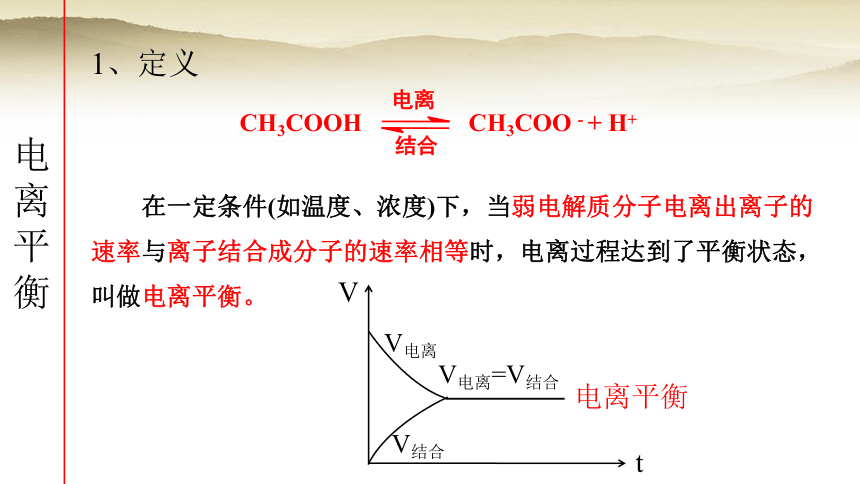
1、定义
电离平衡
在一定条件(如温度、浓度)下,当弱电解质分子电离出离子的速率与离子结合成分子的速率相等时,电离过程达到了平衡状态,叫做电离平衡。
CH3COOH CH3COO - + H+
电离
结合
t
V
V电离=V结合
电离平衡
V结合
V电离
V电离 = V结合 > 0
2、特征
电离平衡
电离平衡是动态平衡,服从化学平衡的一般规律
研究对象是弱电解质的电离
动态平衡
平衡时,各微粒的浓度保持恒定,溶液中既有离子,也有分子
外界条件改变时,平衡会发生移动
电离平衡常数
1、定义
2、符号
弱酸的电离平衡常数:Ka
弱碱的电离平衡常数:Kb
电离平衡常数
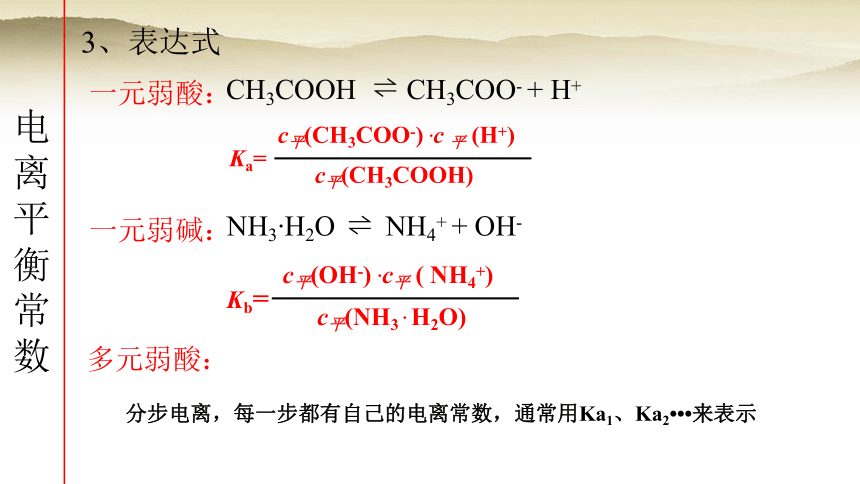
3、表达式
一元弱酸:
一元弱碱:
多元弱酸:
CH3COOH CH3COO- + H+
NH3 H2O NH4+ + OH-
Ka=
c平(CH3COO-) .c 平 (H+)
c平(CH3COOH)
Kb=
c平(OH-) .c平 ( NH4+)
c平(NH3 . H2O)
分步电离,每一步都有自己的电离常数,通常用Ka1、Ka2 来表示
H3PO4 H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42- H+ + PO43-
Ka1=7.1×10-3mlol . L-1
Ka2=6.2×10-8mlol . L-1
Ka3=4.5×10-13mlol . L-1
(1)多元弱酸的各级电离常数逐渐减小
(2)其水溶液中的H+主要是由第一步电离产生的
4、意义
表示弱电解质的电离能力(自身决定)
一定温度下,K值越大,弱电解质的电离程度越大,酸(或碱)性越强
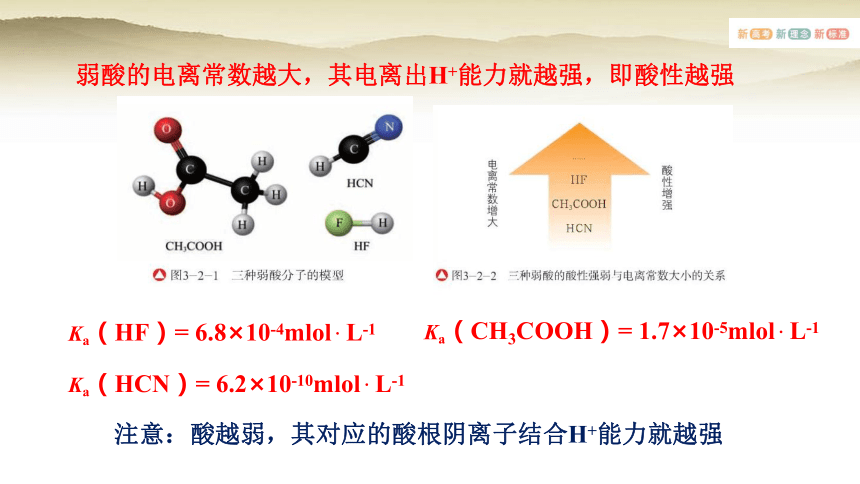
弱酸的电离常数越大,其电离出H+能力就越强,即酸性越强
Ka(HCN)= 6.2×10-10mlol . L-1
Ka(CH3COOH)= 1.7×10-5mlol . L-1
Ka(HF)= 6.8×10-4mlol . L-1
注意:酸越弱,其对应的酸根阴离子结合H+能力就越强
电离平衡常数
同一弱电解质,电离常数K的大小只与温度有关
5、影响因素
温度升高,电离常数增大(电离吸热)
①电离平衡常数只与温度有关,与浓度无关,且升高温度K值增大
②相同条件下,K值越大,表示该弱电解质越易电离,对应的酸(或碱)越强
③多元弱酸是分步电离,逐级减小且一般相差很大,Ka1 Ka2,故溶液中的c(H+) 主要由第一步电离程度决定
④多元弱碱的电离比较复杂,一般看作是一步电离
电离平衡常数的特点
在相同温度下,三种弱酸的电离常数(mol·L-1)如下:HF(6.8×10-4)、CH3COOH(1.7×10-5)、HClO(4.7×10-8)。则三种酸的酸性最强的是( )
A.HF B.CH3COOH
C.HClO D.无法确定
A K(HF)>K(CH3COOH)>K(HClO),故酸性:HF>CH3COOH>HClO。
电离平衡常数
6、应用
相同条件下,K值越大,电离程度越大,酸(或碱)性越强
判断弱酸(弱碱)的相对强弱
电离平衡常数
判断电离平衡的移动方向
例:一定浓度的CH3COOH溶液,平衡后加水稀释一倍,平衡移动方向?
QKa= ————————
c平(H+)c平(CH3COO-)
c平(CH3COOH)
Q= ———————————— = 0.5Ka
0.5c平(H+) ·0.5c平(CH3COO-)
0.5c平(CH3COOH)
电离平衡常数
判断反应能否进行
如:根据表格中的电离常数可判断出H2CO3、HClO、HCO3-的酸性强弱顺序为H2CO3>HClO>HCO3-
因此,向Na2CO3溶液中加入次氯酸,会生成NaHCO3和NaClO,而不会生成H2CO3
先依据电离常数K判断出酸的相对强弱,再利用强酸制弱酸的反应原理,判断反应能否进行以及反应产物。
由表格中的电离常数判断可以发生的反应是( )
A.NaClO+NaHCO3=HClO+Na2CO3
B.2HClO+Na2CO3=2NaClO+CO2↑+H2O
C.2NaClO+CO2+H2O=2HClO+Na2CO3
D.NaClO+CO2+H2O=HClO+NaHCO3
化学式 电离常数
HClO K=3×10-8 mol/L
H2CO3 Ka1=4.4×10-7 mol·L
Ka2=4.7×10-11 mol·L
课堂练习
D
“强酸制弱酸”离子反应的思维模型,根据Ka判断能否发生
H2CO3>HClO>HCO3-
判断溶液中微粒浓度比值的变化情况
电离平衡常数
弱酸(如HA)溶液中,存在的粒子有:H+、OH-、A-、HA
弱酸或弱碱加水稀释时,溶液中不一定所有离子浓度都减小
弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数的百分率 称为电离度,用α表示。
相同温度下,等浓度的弱酸,电离度越大则电离常数越大,酸性越强
越稀越电离
越热越电离
追根寻源
如何计算CH3COOH溶液中的c平(H+)和c平(OH-)
在CH3COOH溶液中同时存在水的电离平衡和醋酸的电离平衡,其中醋酸的电离能力远强于水的电离能力。醋酸电离出较多的H+,促使水的电离平衡向H+和OH-结合成水分的方向移动,抑制了水的电离。因此,CH3COOH溶液中绝大多数的H+由醋酸电离产生,由水电离产生的H+极少;当然,溶液中还存在极少量由水电离产生的OH-。
CH3COOH CH3COO - + H+
H2O OH- + H+
多
少
平衡逆向移动,水的电离被抑制
C水(OH-)
C酸(H+)
C水(H+)
C平(H+) = C酸(H+) + C水(H+) ≈ C酸(H+)
C平(OH-) = C水(OH-)
25℃时,醋酸的Ka=1.7×10-5 mol·L-1,求0.10 mol·L-1的醋酸溶液中c平(H+)、 c平(OH-)?
解析:结合三段式,利用电离常数的表达式计算
CH3COOH CH3COO- + H+
起(mol/L)
转(mol/L)
平(mol/L)
解:设发生电离的CH3COOH的浓度为x
Ka= =
c平(CH3COO-)·c平(H+)
c平(CH3COOH)
x2
0.1- x
≈
x2
0.1
x =1.3 ⅹ10-3
0.1 0 0
x x x
0.1-x x x
c平(H+)
c平(OH-)
注:
1.浓度必须是平衡时的浓度;
2.电离常数不仅可比较弱电解质的电离能力,还可定量判断电离平衡的移动
电离平衡常数(K)、电离度(α)与c(H+)的关系
HA H++A-
起始: c 0 0
变化: cα cα cα
平衡: c-cα cα cα
依照化学平衡计算中“列三行”(或“列两行”)的方法,通过起始浓度、消耗浓度、平衡浓度,结合Ka(Kb)、α(电离度)等条件进行电离平衡的有关计算。
以一元弱酸为例,酸的起始浓度为c
≈c
0.3 mol·L-1 醋酸溶液中 c平(H+)是0.1 mol·L-1醋酸溶液中 c平(H+)的三倍吗?
分析:设0.3 mol·L-1的醋酸溶液的电离度为α1 ,
0.1 mol·L-1的醋酸溶液的电离度为α2 , 则α1< α2
< 3
———— = ———— = ———
c平(H+)1
c平(H+)2
0.1α2
0.3α1
c1α1
c2α2
c平(H+)1 = c1α1 c平(H+)2 = c2α2
在0.3 mol·L-1溶液中 c平(H+)1 = 0.3α1 mol·L-1;
在0.1 mol·L-1溶液中 c平(H+)2 = 0.1α2 mol·L-1
不会
4.2×10-4mol·L-1
纯醋酸加水过程中c(H+)的变化
在向纯醋酸中加水前,醋酸分子尚未电离,c(H+)=0。加水后,醋酸开始电离,随水的加入,电离平衡逐渐向生成CH3COO-和H+的方向移动,在此过程中V(溶液)和n(H+)都逐渐增大。n(H+)从0开始当加水至醋酸浓度非常小时,溶液中的c(H+)又非常接近于水电离出的c(H+)。c(H+)变化的全过程是:小(0)→大→小{接近于水电离出的c(H+)}。c(H+)变化过程可用图像近似地表示出来(如图)。
相关链接
提示:开始加水时,电离平衡向右移动,H+数目增多, c(H+)增大;离子浓度增大到最大后再加水稀释,电离
平衡仍向右移动,H+数目增多,电离程度增大,但c平(H+)减小,溶液导电能力减弱。
根据化学平衡影响因素,分析温度、浓度等外界条件对电离平衡的影响?
CH3COOH CH3COO- + H+ △H>0
越稀越电离
越热越电离
条件改变 平衡
移动 电离
程度 n(H+) c(H+) c(Ac-) c(HAc) 导电
能力
升温
通HCl
加CH3COONa(s)
加NaOH(s)
加水
加CH3COOH
c(OH-)
电离平衡向右移动,电离程度(转换率)不一定增大,c分子不一定减小,c离子不一定增大
例:一定浓度的CH3COOH溶液,平衡后再加入CH3COOH溶液使其浓度增大一倍,平衡移动方向?电离度?
Ka= ————————
c平(H+)c平(CH3COO-)
c平(CH3COOH)
α = ——————————————
c平(CH3COO-)
c平(CH3COOH )+c平(CH3COO-)
醋酸浓度增大,平衡时氢离子的浓度必然增大,故电离度降低
Ka
c平(H+)
α = ———————
c平(CH3COO-)
c平(CH3COOH )
=
Q= ——————————— = 0.5Ka
c平(H+) ·c平(CH3COO-)
2c平(CH3COOH)
Q影响因素 平衡移动方向 电离程度
内因
外因
右移
增大
右移
增大
右移
减小
左移
减小
右移
增大
(电解质越弱,电离程度越小)
物质本身的性质
电离平衡的影响因素
温度(升高温度)
浓度 加水
加弱电解质
同离子效应
离子反应效应
同离子效应:加入同弱电解质电离产生的离子相同的离子,逆向移动(抑制电离)
离子反应效应:加入能与弱电解质电离产生的离子反应的物质,正向移动(促进电离)
越稀越电离
越热越电离
OH- NH3·H2O NH3
正反应方向
减小
增大
正反应方向
固体溶解,溶液中有刺激性气味的气体放出
逆反应方
【学以致用】
(1)在0.1 mol/L的CH3COOH溶液中,要促进醋酸电离且使H+浓度增大,应采取的措施是( )
A.升温 B.加水 C.加入NaOH溶液 D.加入稀盐酸
A
提示:要促进CH3COOH电离即平衡向右移动,pH增大即c平(H+)减小,因此采取的措施应是c平(H+)减小引起的平衡右移。故加水稀释、加入Na2CO3固体、加入NaOH、加入Zn等活泼金属,都能促进醋酸电离,且使溶液pH增大。
(2)要促进CH3COOH的电离并使溶液pH增大,可采取哪些措施?
强弱电解质
区别
酸或碱溶液稀释后pH的变化(同V,同pH)
强酸、弱酸稀释相同倍数时,强酸pH变化大
强碱、弱碱稀释相同倍数时,强碱pH变化大
强弱电解质
区别
酸或碱溶液稀释后pH的变化示意图(同V,同c)
盐酸、醋酸稀释相同倍数时,pH盐酸NaOH、氨水稀释相同倍数时,pHNaOH>pH 氨水
稀释倍数
pH
7
稀释倍数
pH
7
盐酸
醋酸
NaOH
氨水
(1)在相同浓度、相同温度下,与强电解质做导电性对比实验,导电性弱的为弱电解质。
(2)浓度与pH的关系。如0.1 mol·L-1 CH3COOH溶液,其 pH>1,则可证明CH3COOH是弱电解质。
(3)稀释前后pH与稀释倍数的关系。例如,将pH=2的酸溶液稀释至原体积的1 000倍,若pH小于5,则证明该酸为弱酸;若pH为5,则证明该酸为强酸
弱电解质的判断方法
(4)利用实验证明存在电离平衡。如醋酸溶液中滴入紫色石蕊溶液变红,再加CH3COONa固体,颜色变浅,证明CH3COOH是弱电解质。
(5)在相同浓度、相同温度下,比较与金属反应的速率的快慢。如将锌粒投入等浓度的盐酸和醋酸溶液中,起始速率前者比后者快。
同c、V
C(H+) pH 中和碱的能力 与足量Na反应产生H2的量 与Zn反应的初始速率 由H2O电离出的c(H+)
盐酸
醋酸
例:1L 1mol/L的盐酸、醋酸
大
小
小
大
相同
相同
大
小
小
大
一元强酸、一元弱酸的比较
同pH、V
C(H+) c(酸) 中和碱的能力 与足量Na反应产生H2的量 与Zn反应的初始速率 由H2O电离出的c(H+)
盐酸
醋酸
相同
小
大
小
大
少
多
相同
相同
例:体积为1L,pH=1盐酸、醋酸
(1)弱电解质的电离是微弱的,在溶液中主要以弱电解质分子的形式存在。
(2)电离平衡发生正向移动,弱电解质的电离程度不一定增大,如醋酸溶液中加冰醋酸。
(3)多元弱酸分步电离,电离常数逐渐减小,上一步电离产生的H+对下一步的电离起到抑制作用。
(4)弱电解质溶液加水稀释,电离程度增大,但是弱电解质电离出的离子浓度却不是增大,而是减小的。
【特别警示】
下列实验事实不能证明醋酸是弱电解质的是( )
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.在相同条件下,醋酸溶液的导电性比盐酸的弱
课堂练习
A
课堂练习
2、在0.1 mol/LCH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
A.加入水时,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol/LHCl溶液,溶液中[H+]减小
D.加入少量CH3COONa固体,平衡正向移动
B
A.①②③ B.①③⑤
C.①③⑥ D.②④⑥
3、现有0.1 mol/L氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是 ( )
①电离程度增大 ②[NH3·H2O]增大 ③NH4+ 数目增多
④[OH-]增大 ⑤导电性增强
课堂练习
C
课堂练习
D
4、已知0.1 mol/L的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+,要使溶液中 值增大,可以采取的措施是 ( )
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸
④加水 ⑤加少量醋酸钠固体
A.①② B.②③⑤
C.③④⑤ D.②④
第2节 弱电解质的电离 盐类水解
CH3COOH CH3COO - + H+
NH3. H2O NH4+ + OH-
NaHCO3 = Na+ + HCO3-
在稀的水溶液中能完全电离的电解质
溶于水时部分电离的电解质
CH3COOH CH3COO - + H+
NH3. H2O NH4+ +OH-
结合CH3COOH或NH3. H2O电离方程式,根据平衡移动原理,分析电离平衡状态是如何建立的?电离平衡的特征有哪些?
1、定义
电离平衡
在一定条件(如温度、浓度)下,当弱电解质分子电离出离子的速率与离子结合成分子的速率相等时,电离过程达到了平衡状态,叫做电离平衡。
CH3COOH CH3COO - + H+
电离
结合
t
V
V电离=V结合
电离平衡
V结合
V电离
V电离 = V结合 > 0
2、特征
电离平衡
电离平衡是动态平衡,服从化学平衡的一般规律
研究对象是弱电解质的电离
动态平衡
平衡时,各微粒的浓度保持恒定,溶液中既有离子,也有分子
外界条件改变时,平衡会发生移动
电离平衡常数
1、定义
2、符号
弱酸的电离平衡常数:Ka
弱碱的电离平衡常数:Kb
电离平衡常数
3、表达式
一元弱酸:
一元弱碱:
多元弱酸:
CH3COOH CH3COO- + H+
NH3 H2O NH4+ + OH-
Ka=
c平(CH3COO-) .c 平 (H+)
c平(CH3COOH)
Kb=
c平(OH-) .c平 ( NH4+)
c平(NH3 . H2O)
分步电离,每一步都有自己的电离常数,通常用Ka1、Ka2 来表示
H3PO4 H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42- H+ + PO43-
Ka1=7.1×10-3mlol . L-1
Ka2=6.2×10-8mlol . L-1
Ka3=4.5×10-13mlol . L-1
(1)多元弱酸的各级电离常数逐渐减小
(2)其水溶液中的H+主要是由第一步电离产生的
4、意义
表示弱电解质的电离能力(自身决定)
一定温度下,K值越大,弱电解质的电离程度越大,酸(或碱)性越强
弱酸的电离常数越大,其电离出H+能力就越强,即酸性越强
Ka(HCN)= 6.2×10-10mlol . L-1
Ka(CH3COOH)= 1.7×10-5mlol . L-1
Ka(HF)= 6.8×10-4mlol . L-1
注意:酸越弱,其对应的酸根阴离子结合H+能力就越强
电离平衡常数
同一弱电解质,电离常数K的大小只与温度有关
5、影响因素
温度升高,电离常数增大(电离吸热)
①电离平衡常数只与温度有关,与浓度无关,且升高温度K值增大
②相同条件下,K值越大,表示该弱电解质越易电离,对应的酸(或碱)越强
③多元弱酸是分步电离,逐级减小且一般相差很大,Ka1 Ka2,故溶液中的c(H+) 主要由第一步电离程度决定
④多元弱碱的电离比较复杂,一般看作是一步电离
电离平衡常数的特点
在相同温度下,三种弱酸的电离常数(mol·L-1)如下:HF(6.8×10-4)、CH3COOH(1.7×10-5)、HClO(4.7×10-8)。则三种酸的酸性最强的是( )
A.HF B.CH3COOH
C.HClO D.无法确定
A K(HF)>K(CH3COOH)>K(HClO),故酸性:HF>CH3COOH>HClO。
电离平衡常数
6、应用
相同条件下,K值越大,电离程度越大,酸(或碱)性越强
判断弱酸(弱碱)的相对强弱
电离平衡常数
判断电离平衡的移动方向
例:一定浓度的CH3COOH溶液,平衡后加水稀释一倍,平衡移动方向?
Q
c平(H+)c平(CH3COO-)
c平(CH3COOH)
Q= ———————————— = 0.5Ka
0.5c平(H+) ·0.5c平(CH3COO-)
0.5c平(CH3COOH)
电离平衡常数
判断反应能否进行
如:根据表格中的电离常数可判断出H2CO3、HClO、HCO3-的酸性强弱顺序为H2CO3>HClO>HCO3-
因此,向Na2CO3溶液中加入次氯酸,会生成NaHCO3和NaClO,而不会生成H2CO3
先依据电离常数K判断出酸的相对强弱,再利用强酸制弱酸的反应原理,判断反应能否进行以及反应产物。
由表格中的电离常数判断可以发生的反应是( )
A.NaClO+NaHCO3=HClO+Na2CO3
B.2HClO+Na2CO3=2NaClO+CO2↑+H2O
C.2NaClO+CO2+H2O=2HClO+Na2CO3
D.NaClO+CO2+H2O=HClO+NaHCO3
化学式 电离常数
HClO K=3×10-8 mol/L
H2CO3 Ka1=4.4×10-7 mol·L
Ka2=4.7×10-11 mol·L
课堂练习
D
“强酸制弱酸”离子反应的思维模型,根据Ka判断能否发生
H2CO3>HClO>HCO3-
判断溶液中微粒浓度比值的变化情况
电离平衡常数
弱酸(如HA)溶液中,存在的粒子有:H+、OH-、A-、HA
弱酸或弱碱加水稀释时,溶液中不一定所有离子浓度都减小
弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数的百分率 称为电离度,用α表示。
相同温度下,等浓度的弱酸,电离度越大则电离常数越大,酸性越强
越稀越电离
越热越电离
追根寻源
如何计算CH3COOH溶液中的c平(H+)和c平(OH-)
在CH3COOH溶液中同时存在水的电离平衡和醋酸的电离平衡,其中醋酸的电离能力远强于水的电离能力。醋酸电离出较多的H+,促使水的电离平衡向H+和OH-结合成水分的方向移动,抑制了水的电离。因此,CH3COOH溶液中绝大多数的H+由醋酸电离产生,由水电离产生的H+极少;当然,溶液中还存在极少量由水电离产生的OH-。
CH3COOH CH3COO - + H+
H2O OH- + H+
多
少
平衡逆向移动,水的电离被抑制
C水(OH-)
C酸(H+)
C水(H+)
C平(H+) = C酸(H+) + C水(H+) ≈ C酸(H+)
C平(OH-) = C水(OH-)
25℃时,醋酸的Ka=1.7×10-5 mol·L-1,求0.10 mol·L-1的醋酸溶液中c平(H+)、 c平(OH-)?
解析:结合三段式,利用电离常数的表达式计算
CH3COOH CH3COO- + H+
起(mol/L)
转(mol/L)
平(mol/L)
解:设发生电离的CH3COOH的浓度为x
Ka= =
c平(CH3COO-)·c平(H+)
c平(CH3COOH)
x2
0.1- x
≈
x2
0.1
x =1.3 ⅹ10-3
0.1 0 0
x x x
0.1-x x x
c平(H+)
c平(OH-)
注:
1.浓度必须是平衡时的浓度;
2.电离常数不仅可比较弱电解质的电离能力,还可定量判断电离平衡的移动
电离平衡常数(K)、电离度(α)与c(H+)的关系
HA H++A-
起始: c 0 0
变化: cα cα cα
平衡: c-cα cα cα
依照化学平衡计算中“列三行”(或“列两行”)的方法,通过起始浓度、消耗浓度、平衡浓度,结合Ka(Kb)、α(电离度)等条件进行电离平衡的有关计算。
以一元弱酸为例,酸的起始浓度为c
≈c
0.3 mol·L-1 醋酸溶液中 c平(H+)是0.1 mol·L-1醋酸溶液中 c平(H+)的三倍吗?
分析:设0.3 mol·L-1的醋酸溶液的电离度为α1 ,
0.1 mol·L-1的醋酸溶液的电离度为α2 , 则α1< α2
< 3
———— = ———— = ———
c平(H+)1
c平(H+)2
0.1α2
0.3α1
c1α1
c2α2
c平(H+)1 = c1α1 c平(H+)2 = c2α2
在0.3 mol·L-1溶液中 c平(H+)1 = 0.3α1 mol·L-1;
在0.1 mol·L-1溶液中 c平(H+)2 = 0.1α2 mol·L-1
不会
4.2×10-4mol·L-1
纯醋酸加水过程中c(H+)的变化
在向纯醋酸中加水前,醋酸分子尚未电离,c(H+)=0。加水后,醋酸开始电离,随水的加入,电离平衡逐渐向生成CH3COO-和H+的方向移动,在此过程中V(溶液)和n(H+)都逐渐增大。n(H+)从0开始当加水至醋酸浓度非常小时,溶液中的c(H+)又非常接近于水电离出的c(H+)。c(H+)变化的全过程是:小(0)→大→小{接近于水电离出的c(H+)}。c(H+)变化过程可用图像近似地表示出来(如图)。
相关链接
提示:开始加水时,电离平衡向右移动,H+数目增多, c(H+)增大;离子浓度增大到最大后再加水稀释,电离
平衡仍向右移动,H+数目增多,电离程度增大,但c平(H+)减小,溶液导电能力减弱。
根据化学平衡影响因素,分析温度、浓度等外界条件对电离平衡的影响?
CH3COOH CH3COO- + H+ △H>0
越稀越电离
越热越电离
条件改变 平衡
移动 电离
程度 n(H+) c(H+) c(Ac-) c(HAc) 导电
能力
升温
通HCl
加CH3COONa(s)
加NaOH(s)
加水
加CH3COOH
c(OH-)
电离平衡向右移动,电离程度(转换率)不一定增大,c分子不一定减小,c离子不一定增大
例:一定浓度的CH3COOH溶液,平衡后再加入CH3COOH溶液使其浓度增大一倍,平衡移动方向?电离度?
Ka= ————————
c平(H+)c平(CH3COO-)
c平(CH3COOH)
α = ——————————————
c平(CH3COO-)
c平(CH3COOH )+c平(CH3COO-)
醋酸浓度增大,平衡时氢离子的浓度必然增大,故电离度降低
Ka
c平(H+)
α = ———————
c平(CH3COO-)
c平(CH3COOH )
=
Q= ——————————— = 0.5Ka
c平(H+) ·c平(CH3COO-)
2c平(CH3COOH)
Q
内因
外因
右移
增大
右移
增大
右移
减小
左移
减小
右移
增大
(电解质越弱,电离程度越小)
物质本身的性质
电离平衡的影响因素
温度(升高温度)
浓度 加水
加弱电解质
同离子效应
离子反应效应
同离子效应:加入同弱电解质电离产生的离子相同的离子,逆向移动(抑制电离)
离子反应效应:加入能与弱电解质电离产生的离子反应的物质,正向移动(促进电离)
越稀越电离
越热越电离
OH- NH3·H2O NH3
正反应方向
减小
增大
正反应方向
固体溶解,溶液中有刺激性气味的气体放出
逆反应方
【学以致用】
(1)在0.1 mol/L的CH3COOH溶液中,要促进醋酸电离且使H+浓度增大,应采取的措施是( )
A.升温 B.加水 C.加入NaOH溶液 D.加入稀盐酸
A
提示:要促进CH3COOH电离即平衡向右移动,pH增大即c平(H+)减小,因此采取的措施应是c平(H+)减小引起的平衡右移。故加水稀释、加入Na2CO3固体、加入NaOH、加入Zn等活泼金属,都能促进醋酸电离,且使溶液pH增大。
(2)要促进CH3COOH的电离并使溶液pH增大,可采取哪些措施?
强弱电解质
区别
酸或碱溶液稀释后pH的变化(同V,同pH)
强酸、弱酸稀释相同倍数时,强酸pH变化大
强碱、弱碱稀释相同倍数时,强碱pH变化大
强弱电解质
区别
酸或碱溶液稀释后pH的变化示意图(同V,同c)
盐酸、醋酸稀释相同倍数时,pH盐酸
稀释倍数
pH
7
稀释倍数
pH
7
盐酸
醋酸
NaOH
氨水
(1)在相同浓度、相同温度下,与强电解质做导电性对比实验,导电性弱的为弱电解质。
(2)浓度与pH的关系。如0.1 mol·L-1 CH3COOH溶液,其 pH>1,则可证明CH3COOH是弱电解质。
(3)稀释前后pH与稀释倍数的关系。例如,将pH=2的酸溶液稀释至原体积的1 000倍,若pH小于5,则证明该酸为弱酸;若pH为5,则证明该酸为强酸
弱电解质的判断方法
(4)利用实验证明存在电离平衡。如醋酸溶液中滴入紫色石蕊溶液变红,再加CH3COONa固体,颜色变浅,证明CH3COOH是弱电解质。
(5)在相同浓度、相同温度下,比较与金属反应的速率的快慢。如将锌粒投入等浓度的盐酸和醋酸溶液中,起始速率前者比后者快。
同c、V
C(H+) pH 中和碱的能力 与足量Na反应产生H2的量 与Zn反应的初始速率 由H2O电离出的c(H+)
盐酸
醋酸
例:1L 1mol/L的盐酸、醋酸
大
小
小
大
相同
相同
大
小
小
大
一元强酸、一元弱酸的比较
同pH、V
C(H+) c(酸) 中和碱的能力 与足量Na反应产生H2的量 与Zn反应的初始速率 由H2O电离出的c(H+)
盐酸
醋酸
相同
小
大
小
大
少
多
相同
相同
例:体积为1L,pH=1盐酸、醋酸
(1)弱电解质的电离是微弱的,在溶液中主要以弱电解质分子的形式存在。
(2)电离平衡发生正向移动,弱电解质的电离程度不一定增大,如醋酸溶液中加冰醋酸。
(3)多元弱酸分步电离,电离常数逐渐减小,上一步电离产生的H+对下一步的电离起到抑制作用。
(4)弱电解质溶液加水稀释,电离程度增大,但是弱电解质电离出的离子浓度却不是增大,而是减小的。
【特别警示】
下列实验事实不能证明醋酸是弱电解质的是( )
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.在相同条件下,醋酸溶液的导电性比盐酸的弱
课堂练习
A
课堂练习
2、在0.1 mol/LCH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
A.加入水时,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol/LHCl溶液,溶液中[H+]减小
D.加入少量CH3COONa固体,平衡正向移动
B
A.①②③ B.①③⑤
C.①③⑥ D.②④⑥
3、现有0.1 mol/L氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是 ( )
①电离程度增大 ②[NH3·H2O]增大 ③NH4+ 数目增多
④[OH-]增大 ⑤导电性增强
课堂练习
C
课堂练习
D
4、已知0.1 mol/L的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+,要使溶液中 值增大,可以采取的措施是 ( )
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸
④加水 ⑤加少量醋酸钠固体
A.①② B.②③⑤
C.③④⑤ D.②④
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
