鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.3.2沉淀溶解平衡的应用课件(18张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.3.2沉淀溶解平衡的应用课件(18张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 09:23:10 | ||
图片预览






文档简介
(共18张PPT)
沉淀溶解
平衡的应用
沉淀的生成
沉淀的转化
沉淀的溶解
Q > Ksp
Q < Ksp
第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
沉淀的溶解
为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”
BaSO4(s) Ba2+ + SO42- BaCO3(s) Ba2+ + CO32-
+
2H+
CO2+H2O
c(Ba2+)增大导致人体中毒。
不能用BaCO3作“钡餐”。
SO42-是强酸酸根,不与H+结合,胃酸中的H+对BaSO4的溶解平衡没有影响,Ba2+浓度保持在安全浓度范围内,因此用BaSO4 作“钡餐”。
Q =c(Ba2+)c(CO32-)↓< Ksp
沉淀的溶解
如: CaCO3 、FeS、Al(OH)3、 Mg(OH)2、 Cu(OH)2等
① 酸溶解法:
沉淀溶解的方法
③盐溶液溶解法:
②配位溶解法:
如——AgCl溶于氨水
AgCl + 2NH3·H2O = [Ag(NH3)2]+ + Cl- + 2H2O
如:Mg(OH)2溶于NH4Cl溶液
Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3·H2O
Mg(OH)2(s)??Mg2+(aq)+2OH-(aq)
NH4++OH-==NH3·H2O,c(OH-)减小,
Q沉淀的生成
思考:如果误食可溶性钡盐,造成钡中毒,应尽快用___________给患者洗胃?
c(Ba2+)
Ksp(BaSO4)
c(SO42—)
=
1.1×10-10
0.35
=
= 3.1 10-10 mol/L
已知:Ksp(BaSO4)=1.1×10-10 mol2·L-2
可充分将Ba2+转化为BaSO4沉淀。
计算:5.0%的Na2SO4溶液(c≈0.35mol/L)能否使钡离子浓度降到10-5 mol/L以下?
Na2SO4溶液
沉淀的转化
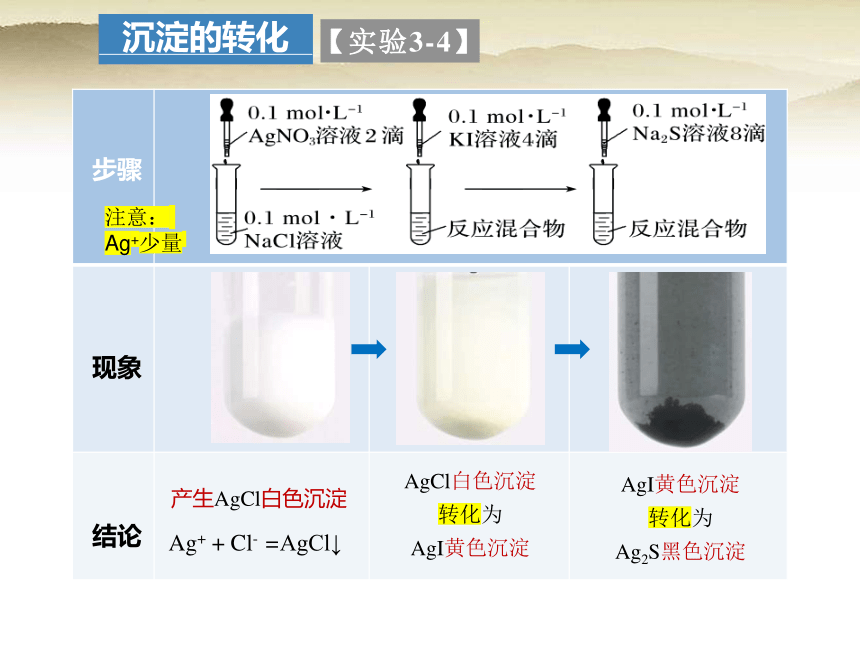
【实验3-4】
步骤
现象
产生AgCl白色沉淀
AgCl白色沉淀
转化为
AgI黄色沉淀
AgI黄色沉淀
转化为
Ag2S黑色沉淀
Ag+ + Cl- = AgCl↓
结论
注意:
Ag+少量
AgCl(s) Ag+(aq) + Cl-(aq)
AgI(s) Ag+(aq) + I-(aq)
Na2S = S2- + 2Na+
KI = I- + K+
AgI
+
Ag2S
+
溶解度/g: 1.5×10-4 2.1×10-7 1.3×10-16
沉淀转化方向:AgCl (白)→ AgI (黄)→ Ag2S(黑)
实质:
沉淀溶解平衡的移动
沉淀转化的定性分析
通常,一种沉淀可以转化为更难溶的沉淀;两种难溶物的溶解能力差别越大,这种转化的趋势就越大。
Q(AgI)>Ksp(AgI)
Q(AgCl)<Ksp(AgCl)
Q(Ag2S)>Ksp(Ag2S)
Q(AgI)<Ksp(AgI)
判断正误:
1. 向AgCl沉淀中加入KI溶液,沉淀颜色转变成黄色沉淀,是由于Ksp(AgI)<Ksp(AgCl)
√
2. 向盛有2 mL 0.1 mol·L-1 AgNO3溶液 的试管中滴加2滴0.1 mol·L-1 NaCl溶液,产生白色沉淀;振荡后再滴加4滴 0.1 mol·L-1 KI溶液,生成黄色沉淀。因此Ksp(AgI)<Ksp(AgCl)
×
Ag+ + I- = AgI↓
溶液中有大量Ag+
Ksp(AgCl)=1.8×10-10 mol2 L-2 ,Ksp(AgI)=8.3×10-17mol2·L-2
沉淀转化的定量分析
平衡常数K
c(Cl—)
c(I —)
=
c(Ag+)
c(Ag+)
Ksp(AgCl)
Ksp(AgI)
=
= 4.6 107
组成类型相同的难溶电解质,Ksp较大的难溶电解质容易转化为Ksp较小的难溶电解质。
> 105
AgCl Ag+ + Cl-
I-
AgI
+
c(Ag+)≈10-5mol L-1
满足Q>Ksp
c(I—)近似>10-12 mol L-1
Ksp相差不大的难溶电解质,Ksp较小的难溶电解质在一定条件下(满足Q>Ksp)可以转化为Ksp较大的难溶电解质。
Ksp(BaSO4)=1.1×10-10 mol2·L-2,Ksp(BaCO3)=2.5×10-9 mol2·L-2
平衡常数K
c(SO42—)
c(CO32 —)
=
c(Ba2+)
c(Ba2+)
Ksp(BaSO4)
Ksp(BaCO3)
=
= 4.4 10—2
10—5 ~ 105
沉淀转化的定量分析
BaSO4 Ba2+ + SO42—
CO32 —
BaCO3
+
c(Ba2+)≈10-5 mol L-1
满足Q>Ksp
c(CO32—)近似>10-4 mol L-1
Ksp(AgCl)=1.8×10-10 mol2 L-2 ,Ksp(AgI)=8.3×10-17mol2·L-2
平衡常数K
c(I—)
c(Cl —)
=
c(Ag+)
c(Ag+)
Ksp(AgI)
Ksp(AgCl)
=
< 10-5
AgI Ag+ + I-
Cl-
AgCl
+
c(Ag+)≈10-8 mol L-1
满足Q>Ksp
c(Cl—)近似>102 mol L-1
Ksp相差很大的难溶电解质,Ksp较小的难溶电解质很难转化为Ksp较大的难溶电解质。
很难实现
如何除去工业废水中的Cu2+、Hg2+、Pb2+等重金属离子呢?
Ksp[Cu(OH)2]=2.2×10-20mol3·L-3
Ksp(CuS)=1.3×10-36mol2·L-2
要使生成沉淀的反应能够发生;
沉淀反应完成后,剩余离子的浓度尽量小。
【思考与讨论】
常利用生成沉淀来分离或除去某些离子。
你选择将重金属离子转化为什么沉淀 为什么
(2) 如何使沉淀反应完成后,溶液中剩余离子的浓度能够尽量小
增大所用沉淀剂的浓度
硫化物,
生成的CuS、HgS等极难溶,使废水中Cu2+、Hg2+浓度很低
Ksp(HgS)=6.4×10-53mol2·L-2
Ksp(PbS)=3.4×10-28mol2·L-2
① 直接沉淀法:以Na2S、H2S做沉淀剂
Cu2+ + S2- = CuS↓黑色 Hg2+ + S2- = HgS↓
Cu2+ + H2S = CuS↓ + 2H+
如何除去工业废水中的Cu2+、Hg2+、Pb2+等重金属离子呢?
② 沉淀转化法:以FeS(s)、MnS(s)等难溶物作沉淀剂
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+(aq)
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+(aq)
FeS(s) + Hg2+(aq) = HgS(s) + Fe2+(aq)
Ksp(FeS)=6.3×10-18mol2·L-2
Ksp(MnS)=2.5×10-13mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2
Ksp(HgS)=6.4×10-53mol2·L-2
Ksp(PbS)=3.4×10-28mol2·L-2
思考:哪种方法好?
水垢的生成与去除
水垢含有Mg(OH)2、CaCO3、CaSO4等
1)水垢的生成 :
硬水中含有Ca(HCO3)2、Mg(HCO3)2、CaSO4等盐
CaCO3
Mg(OH)2
MgCO3
Ksp(MgCO3)=6.8×10-6 mol2·L-2
Ksp(Mg(OH)2)=5.6×10-12 mol3·L-3
Ca(HCO3)2===CaCO3↓+H2O+CO2↑
Mg(HCO3)2===MgCO3↓+H2O+CO2↑
△
△
Mg(OH)2比MgCO3更难溶
c(Mg2+)≈10-3 mol·L-1
c(Mg2+)≈10-4 mol·L-1
CO32—水解产生OH—
MgCO3+H2O====Mg(OH)2+CO2↑
△
水垢的生成与去除
水垢含有Mg(OH)2、CaCO3、CaSO4等
1)水垢的去除 :
Mg(OH)2+ 2CH3COOH = (CH3COO)2Mg + 2H2O
CaCO3 + 2CH3COOH= (CH3COO)2Ca + H2O + CO2↑
稀盐酸能除去CaSO4吗?
【思考】
用Na2CO3溶液浸泡一段时间
再辅以“酸洗”
沉淀转化: CaSO4 → CaCO3
4)氟化物
预防龋齿:
牙齿表面釉质层主要成分——难溶羟基磷灰石
氟离子与羟基磷灰石反应,生成溶解度更小的氟磷灰石
Ca5(PO4)3(OH)
3)自然界中
矿物的转化:
原生
铜的硫化物
CuSO4溶液
铜蓝(CuS)
沉淀溶解
平衡的应用
沉淀的生成
沉淀的转化
沉淀的溶解
调节pH法
加沉淀剂法
① 酸溶解法
③盐溶液溶解法
②配位溶解法
实质:
沉淀溶解平衡的移动
规律:
溶解度小的沉淀转化为溶解度更小的沉淀
容易实现。
如何除去CuSO4溶液中含有少量的Fe3+杂质?
氢氧化物 沉淀开始时的pH值
(0.1mol/L) 沉淀完全时的pH值
(10-5 mol/L)
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
信息:由于Cu2+和Fe3+的水解,溶液的pH≈1。
要求:不引入杂质
加过量CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3
思路:调节溶液的pH值在[2.81~4.67) 。
Q≥Ksp[Fe(OH)3],Fe3+完全沉淀
Q<Ksp[Cu(OH)2],Cu2+不沉淀
Fe3++3H2O Fe(OH)3+ 3H+
如何除去CuSO4中混有少量Fe2+杂质?
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值 (<10-5 mol/L)
Fe(OH)2 6.34 8.34
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
氧化剂:H2O2,氧气 【若CuCl2(aq)(含Fe2+),可选Cl2】
要求:不引入杂质
CuSO4(aq)
(含Fe2+)
调节溶液pH
[2.81~4.67)
Fe(OH)3↓
(过滤除去)
CuSO4(aq)
(含Fe3+)
氧化剂
调节pH:加过量CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3
沉淀溶解
平衡的应用
沉淀的生成
沉淀的转化
沉淀的溶解
Q > Ksp
Q < Ksp
第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
沉淀的溶解
为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”
BaSO4(s) Ba2+ + SO42- BaCO3(s) Ba2+ + CO32-
+
2H+
CO2+H2O
c(Ba2+)增大导致人体中毒。
不能用BaCO3作“钡餐”。
SO42-是强酸酸根,不与H+结合,胃酸中的H+对BaSO4的溶解平衡没有影响,Ba2+浓度保持在安全浓度范围内,因此用BaSO4 作“钡餐”。
Q =c(Ba2+)c(CO32-)↓< Ksp
沉淀的溶解
如: CaCO3 、FeS、Al(OH)3、 Mg(OH)2、 Cu(OH)2等
① 酸溶解法:
沉淀溶解的方法
③盐溶液溶解法:
②配位溶解法:
如——AgCl溶于氨水
AgCl + 2NH3·H2O = [Ag(NH3)2]+ + Cl- + 2H2O
如:Mg(OH)2溶于NH4Cl溶液
Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3·H2O
Mg(OH)2(s)??Mg2+(aq)+2OH-(aq)
NH4++OH-==NH3·H2O,c(OH-)减小,
Q
思考:如果误食可溶性钡盐,造成钡中毒,应尽快用___________给患者洗胃?
c(Ba2+)
Ksp(BaSO4)
c(SO42—)
=
1.1×10-10
0.35
=
= 3.1 10-10 mol/L
已知:Ksp(BaSO4)=1.1×10-10 mol2·L-2
可充分将Ba2+转化为BaSO4沉淀。
计算:5.0%的Na2SO4溶液(c≈0.35mol/L)能否使钡离子浓度降到10-5 mol/L以下?
Na2SO4溶液
沉淀的转化
【实验3-4】
步骤
现象
产生AgCl白色沉淀
AgCl白色沉淀
转化为
AgI黄色沉淀
AgI黄色沉淀
转化为
Ag2S黑色沉淀
Ag+ + Cl- = AgCl↓
结论
注意:
Ag+少量
AgCl(s) Ag+(aq) + Cl-(aq)
AgI(s) Ag+(aq) + I-(aq)
Na2S = S2- + 2Na+
KI = I- + K+
AgI
+
Ag2S
+
溶解度/g: 1.5×10-4 2.1×10-7 1.3×10-16
沉淀转化方向:AgCl (白)→ AgI (黄)→ Ag2S(黑)
实质:
沉淀溶解平衡的移动
沉淀转化的定性分析
通常,一种沉淀可以转化为更难溶的沉淀;两种难溶物的溶解能力差别越大,这种转化的趋势就越大。
Q(AgI)>Ksp(AgI)
Q(AgCl)<Ksp(AgCl)
Q(Ag2S)>Ksp(Ag2S)
Q(AgI)<Ksp(AgI)
判断正误:
1. 向AgCl沉淀中加入KI溶液,沉淀颜色转变成黄色沉淀,是由于Ksp(AgI)<Ksp(AgCl)
√
2. 向盛有2 mL 0.1 mol·L-1 AgNO3溶液 的试管中滴加2滴0.1 mol·L-1 NaCl溶液,产生白色沉淀;振荡后再滴加4滴 0.1 mol·L-1 KI溶液,生成黄色沉淀。因此Ksp(AgI)<Ksp(AgCl)
×
Ag+ + I- = AgI↓
溶液中有大量Ag+
Ksp(AgCl)=1.8×10-10 mol2 L-2 ,Ksp(AgI)=8.3×10-17mol2·L-2
沉淀转化的定量分析
平衡常数K
c(Cl—)
c(I —)
=
c(Ag+)
c(Ag+)
Ksp(AgCl)
Ksp(AgI)
=
= 4.6 107
组成类型相同的难溶电解质,Ksp较大的难溶电解质容易转化为Ksp较小的难溶电解质。
> 105
AgCl Ag+ + Cl-
I-
AgI
+
c(Ag+)≈10-5mol L-1
满足Q>Ksp
c(I—)近似>10-12 mol L-1
Ksp相差不大的难溶电解质,Ksp较小的难溶电解质在一定条件下(满足Q>Ksp)可以转化为Ksp较大的难溶电解质。
Ksp(BaSO4)=1.1×10-10 mol2·L-2,Ksp(BaCO3)=2.5×10-9 mol2·L-2
平衡常数K
c(SO42—)
c(CO32 —)
=
c(Ba2+)
c(Ba2+)
Ksp(BaSO4)
Ksp(BaCO3)
=
= 4.4 10—2
10—5 ~ 105
沉淀转化的定量分析
BaSO4 Ba2+ + SO42—
CO32 —
BaCO3
+
c(Ba2+)≈10-5 mol L-1
满足Q>Ksp
c(CO32—)近似>10-4 mol L-1
Ksp(AgCl)=1.8×10-10 mol2 L-2 ,Ksp(AgI)=8.3×10-17mol2·L-2
平衡常数K
c(I—)
c(Cl —)
=
c(Ag+)
c(Ag+)
Ksp(AgI)
Ksp(AgCl)
=
< 10-5
AgI Ag+ + I-
Cl-
AgCl
+
c(Ag+)≈10-8 mol L-1
满足Q>Ksp
c(Cl—)近似>102 mol L-1
Ksp相差很大的难溶电解质,Ksp较小的难溶电解质很难转化为Ksp较大的难溶电解质。
很难实现
如何除去工业废水中的Cu2+、Hg2+、Pb2+等重金属离子呢?
Ksp[Cu(OH)2]=2.2×10-20mol3·L-3
Ksp(CuS)=1.3×10-36mol2·L-2
要使生成沉淀的反应能够发生;
沉淀反应完成后,剩余离子的浓度尽量小。
【思考与讨论】
常利用生成沉淀来分离或除去某些离子。
你选择将重金属离子转化为什么沉淀 为什么
(2) 如何使沉淀反应完成后,溶液中剩余离子的浓度能够尽量小
增大所用沉淀剂的浓度
硫化物,
生成的CuS、HgS等极难溶,使废水中Cu2+、Hg2+浓度很低
Ksp(HgS)=6.4×10-53mol2·L-2
Ksp(PbS)=3.4×10-28mol2·L-2
① 直接沉淀法:以Na2S、H2S做沉淀剂
Cu2+ + S2- = CuS↓黑色 Hg2+ + S2- = HgS↓
Cu2+ + H2S = CuS↓ + 2H+
如何除去工业废水中的Cu2+、Hg2+、Pb2+等重金属离子呢?
② 沉淀转化法:以FeS(s)、MnS(s)等难溶物作沉淀剂
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+(aq)
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+(aq)
FeS(s) + Hg2+(aq) = HgS(s) + Fe2+(aq)
Ksp(FeS)=6.3×10-18mol2·L-2
Ksp(MnS)=2.5×10-13mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2
Ksp(HgS)=6.4×10-53mol2·L-2
Ksp(PbS)=3.4×10-28mol2·L-2
思考:哪种方法好?
水垢的生成与去除
水垢含有Mg(OH)2、CaCO3、CaSO4等
1)水垢的生成 :
硬水中含有Ca(HCO3)2、Mg(HCO3)2、CaSO4等盐
CaCO3
Mg(OH)2
MgCO3
Ksp(MgCO3)=6.8×10-6 mol2·L-2
Ksp(Mg(OH)2)=5.6×10-12 mol3·L-3
Ca(HCO3)2===CaCO3↓+H2O+CO2↑
Mg(HCO3)2===MgCO3↓+H2O+CO2↑
△
△
Mg(OH)2比MgCO3更难溶
c(Mg2+)≈10-3 mol·L-1
c(Mg2+)≈10-4 mol·L-1
CO32—水解产生OH—
MgCO3+H2O====Mg(OH)2+CO2↑
△
水垢的生成与去除
水垢含有Mg(OH)2、CaCO3、CaSO4等
1)水垢的去除 :
Mg(OH)2+ 2CH3COOH = (CH3COO)2Mg + 2H2O
CaCO3 + 2CH3COOH= (CH3COO)2Ca + H2O + CO2↑
稀盐酸能除去CaSO4吗?
【思考】
用Na2CO3溶液浸泡一段时间
再辅以“酸洗”
沉淀转化: CaSO4 → CaCO3
4)氟化物
预防龋齿:
牙齿表面釉质层主要成分——难溶羟基磷灰石
氟离子与羟基磷灰石反应,生成溶解度更小的氟磷灰石
Ca5(PO4)3(OH)
3)自然界中
矿物的转化:
原生
铜的硫化物
CuSO4溶液
铜蓝(CuS)
沉淀溶解
平衡的应用
沉淀的生成
沉淀的转化
沉淀的溶解
调节pH法
加沉淀剂法
① 酸溶解法
③盐溶液溶解法
②配位溶解法
实质:
沉淀溶解平衡的移动
规律:
溶解度小的沉淀转化为溶解度更小的沉淀
容易实现。
如何除去CuSO4溶液中含有少量的Fe3+杂质?
氢氧化物 沉淀开始时的pH值
(0.1mol/L) 沉淀完全时的pH值
(10-5 mol/L)
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
信息:由于Cu2+和Fe3+的水解,溶液的pH≈1。
要求:不引入杂质
加过量CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3
思路:调节溶液的pH值在[2.81~4.67) 。
Q≥Ksp[Fe(OH)3],Fe3+完全沉淀
Q<Ksp[Cu(OH)2],Cu2+不沉淀
Fe3++3H2O Fe(OH)3+ 3H+
如何除去CuSO4中混有少量Fe2+杂质?
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值 (<10-5 mol/L)
Fe(OH)2 6.34 8.34
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
氧化剂:H2O2,氧气 【若CuCl2(aq)(含Fe2+),可选Cl2】
要求:不引入杂质
CuSO4(aq)
(含Fe2+)
调节溶液pH
[2.81~4.67)
Fe(OH)3↓
(过滤除去)
CuSO4(aq)
(含Fe3+)
氧化剂
调节pH:加过量CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
